氯沙坦逆转心室重构的作用及机制
2016-11-26于杜娟
于 敏 于杜娟
(北华大学附属医院心内科,吉林 吉林 132011)
氯沙坦逆转心室重构的作用及机制
于 敏 于杜娟1
(北华大学附属医院心内科,吉林 吉林 132011)
目的 研究氯沙坦对心室重构的逆转作用及分子信号转导机制。方法 异丙肾上腺素(Iso)诱导心室重构(VR)模型,观察氯沙坦对VR影响;通过HE染色、Masson特染、透射电镜、免疫组织化学染色和Western印迹方法观察氯沙坦对心肌形态学和转化生长因子(TGF)-β1及磷酸化蛋白激酶Cα(p-PKCα)表达的影响。结果 Iso能显著升高心脏重量(HW)/体重(BW)、VMI、左室舒张末期内径(LVDd)、左室收缩末期内径(LVDs)、右室舒张末期左室后壁厚度(LVPWd)、左室收缩末期右室后壁厚度(LVPWs)、心肌纤维直径(MFD),氯沙坦通过降低上述各指标对抗Iso诱导的VR;Iso能升高尾动脉血压,降低心室功能指标射血分数(EF) 和短轴缩短速率(FS);氯沙坦能降低尾动脉血压,提高EF和FS水平,从而减轻VR。结论 Iso通过提高p-PKCα和TGF-β1的表达诱导VR,氯沙坦通过抑制p-PKCα和TGF-β1的表达逆转VR。
心室重构;氯沙坦;磷酸化蛋白酶C;转化生长因子-β1
心室重构(VR)的主要病理学改变包括心肌细胞的反应性变化和心肌间质细胞的纤维化两部分,抑制肾素血管紧张素醛固酮系统(RAAS)有助于VR的逆转〔1〕。转化生长因子(TGF)-β1是细胞生长和分化的调控因子,由心肌细胞在压力超负荷刺激下所产生并与膜受体结合,激活第二信使如蛋白激酶C(PKC)、丝裂酶原激活的蛋白激酶(MAPK)等促进细胞生长信息的传递,诱导RNA和蛋白质合成,从而导致心肌肥厚〔2,3〕。PKC是体内广泛存在的一大类苏/丝氨酸激酶家族〔4〕,过度激活的PKC可导致心肌肥厚的发生〔5〕。
1 材料与方法
1.1 VR模型制备 Wistar大鼠随机分成对照组,模型组,氯沙坦低、中、高(5.0、10.0和20.0 mg/kg)三个剂量组。参照Rona等〔6〕方法,使用背部皮下注射异丙肾上腺素(Iso)10 d进行造模。各给药组第二日开始灌胃给药,连续14 d,造模和给药间隔时间4 h以上。对照组背部皮下注射等量生理盐水,模型组和对照组均用等容积蒸馏水灌胃,末次给药后禁食24 h,于第15天处死动物。
1.2 多普勒超声心动图评价VR大鼠心脏功能 药物干预14 d后,使用多普勒超声心动图对大鼠心脏功能进行评估。形态学指标包括左室舒张末期内径(LVDd)及收缩末期内径(LVDs),左室舒张末期左室后壁厚度(LVPWd)、左室收缩末期左室后壁厚度(LVPWs)。收缩功能指标包括射血分数(EF)、短轴缩短率(FS)。
1.3 VR指标检测 大鼠称重处死,取出心脏,留取干净心室,剔除其余组织,电子天平称取心脏重量(HW)、心室重量(VW)、左室重量(LVW),心室/体重指数=心重(mg)/体重(g)。
1.4 心室组织形态学检测 取左室近心尖1/2处心肌下部组织,10%甲醛固定,石蜡包埋,切片,分别行HE染色、Masson胶原纤维特异性染色、醋酸铀染色。光镜下观察心肌组织病理学变化;10×40倍下测量大鼠心肌纤维直径(MFD);电镜下检测心肌组织超微结构。
1.5 免疫印迹检测磷酸化PKCα(p-PKCα)蛋白表达 提取心肌组织总蛋白,考马斯亮蓝法进行定量。使用Western印迹方法检测p-PKCα蛋白表达。
1.6 免疫组织化学染色法检测左室TGF-β1蛋白表达 给药结束时于左心室赤道面横切,甲醛固定,石蜡包埋切片,切片厚度4 μm,Envision法检测大鼠心脏组织TGF-β1(1∶100)表达。阳性反应呈棕黄色细密颗粒,阴性对照用PBS取代一抗染色为阴性。应用全自动图像分析仪,在每组随机选择4~6个高倍视野自动计数100个左右的细胞,用Media Cybernetics公司的Image-ProPlus 5.0图像分析软件分析各组TGF-β1在心肌组织中表达的平均光密度值。单位面积阳性表达积分光密度=积分光密度/视野面积×100%。TGF-β1阳性反应为黄色至棕黄色颗粒,定位于胞核、近细胞核及细胞质处。
1.7 统计学分析 使用SPSS19.0软件,组间比较采用t检验,采用直线相关分析评估两组数据相关性。
2 结 果
2.1 氯沙坦可减轻Iso诱导大鼠VR病理学改变 对照组心肌肌纤维完整,排列整齐,染色均匀一致(图1A);Iso模型组心肌肌纤维断裂、缺损,排列紊乱,心肌内膜下见大片坏死灶,局限或广泛呈片状分布,严重者相融合,心室壁全层均被累及,坏死处心肌成纤维细胞增生明显(图1B);氯沙坦干预组心肌肌纤维损伤较Iso模型组明显减轻,呈片状(图1C,1D)或点状(图1E),心肌内膜下多见(图1F)。
2.2 氯沙坦可减轻Iso诱导大鼠VR胶原纤维增生 模型组心肌坏死灶内纤维增生明显,胶原纤维明显增加;氯沙坦治疗组胶原纤维受到不同程度抑制。见图2。
2.3 氯沙坦可减轻Iso诱导大鼠VR超微结构的损伤 电镜下醋酸铀染色可见:对照组心肌细胞结构正常,核仁清晰,肌膜及细胞器完整,闰盘、Z线清楚,无胶原纤维增生;模型组心肌细胞结构破坏严重,核仁不清楚,肌丝排列紊乱,闰盘及Z线显示不清,线粒体肿胀,嵴消失、断裂,内质网肿胀,部分心肌细胞核染色质呈早期凋亡形态改变,胶原纤维大量增生呈片状;氯沙坦组较模型组有明显改善,心肌细胞结构大致正常,闰盘清楚,细胞变性程度较轻,间质略水肿,肌浆网略有扩张,未见明显坏死,胶原纤维偶见点状增生,胶原增生明显受抑,见图3。
2.4 氯沙坦可减轻Iso诱导的VR大鼠心室增大 与对照组比较,模型组LVDd,LVDs,LVPWd,LVPWs明显增加(P<0.05或P<0.01);与模型组比较,氯沙坦各剂量组上述指标不同程度降低(P<0.01)。见表1。
2.5 氯沙坦可改善Iso诱导的VR大鼠心室功能 与对照组比较,模型组MFD及尾动脉压(CBP)明显增加,EF和FS明显下降;氯沙坦三个剂量组均能降低MFD和CBP,提高EF和FS水平(P<0.05,P<0.01),见表1。
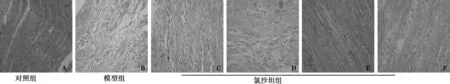
图1 HE染色检测氯沙坦对Iso诱导大鼠心肌细胞的影响(×400)

图2 Masson特殊染色检测氯沙坦对Iso诱导大鼠心肌细胞的影响

图3 电子电镜检测氯沙坦对Iso诱导大鼠心肌细胞的影响
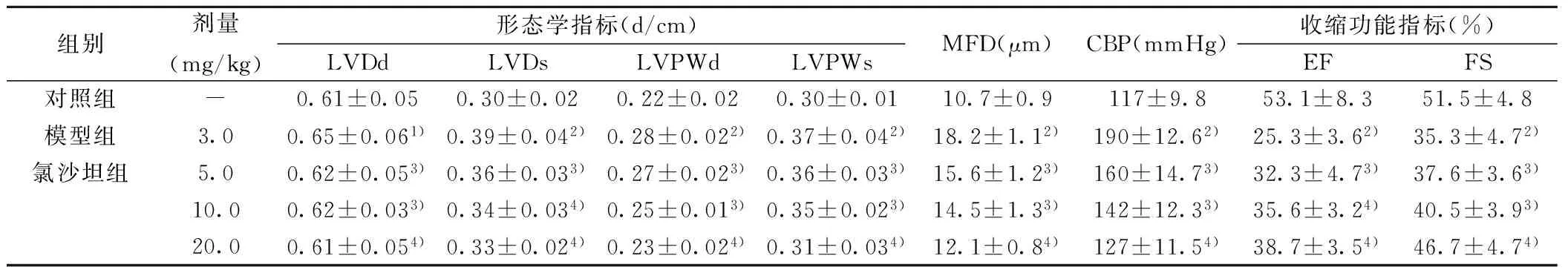
组别剂量(mg/kg)形态学指标(d/cm)LVDdLVDsLVPWdLVPWsMFD(μm)CBP(mmHg)收缩功能指标(%)EFFS对照组-0.61±0.050.30±0.020.22±0.020.30±0.0110.7±0.9117±9.853.1±8.351.5±4.8模型组3.00.65±0.061)0.39±0.042)0.28±0.022)0.37±0.042)18.2±1.12)190±12.62)25.3±3.62)35.3±4.72)氯沙坦组5.00.62±0.053)0.36±0.033)0.27±0.023)0.36±0.033)15.6±1.23)160±14.73)32.3±4.73)37.6±3.63)10.00.62±0.033)0.34±0.034)0.25±0.013)0.35±0.023)14.5±1.33)142±12.33)35.6±3.24)40.5±3.93)20.00.61±0.054)0.33±0.024)0.23±0.024)0.31±0.034)12.1±0.84)127±11.54)38.7±3.54)46.7±4.74)
与对照组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01;下表同
2.6 氯沙坦可降低Iso诱导的大鼠HW/BW、LVI 与对照组比较,模型组HW/BW、LVI含量明显升高(P<0.05或P<0.01),氯沙坦三个剂量组均能降低HW/BW,LVI水平(P<0.05,P<0.01)。见表2。
2.7 氯沙坦可降低Iso诱导VR中TGF-β1表达 对照组TGF-β1表达量(69.12±19.98)很少;模型组TGF-β1阳性深棕色染色细胞数明显增多(166.89±32.65)(P<0.01),主要分布于胞质中,说明Iso能促进TGF-β1表达;氯沙坦组三个剂量组不同程度地抑制了TGF-β1表达(高、中、低剂量组分别为68.76±23.69、79.90±18.21、101.86±34.38,P<0.05,P<0.01)。见图4。
2.8 氯沙坦可降低Iso诱导VR中p-PKCα表达 与对照组比较(设为1),模型组p-PKCα表达(6.73)明显升高(P<0.001),氯沙坦高、中、低三个剂量组均能降低VR心肌组织中p-PKCα表达(分别为1.83、2.58、5.07,P<0.05,P<0.01)。见图5。
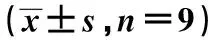
表2 氯沙坦对VR大鼠HW/BW、LVI的影响

图4 氯沙坦对Iso诱导VR 中TGF-β1表达的影响

图5 Western印迹检测氯沙坦对Iso诱导VR 中p-PKCα表达的影响
3 讨 论
VR是心脏对各种刺激所产生的反应性增生,主要表现为心肌细胞增大和心脏重量增加,左室重构是心血管疾病的独立危险因素,最终导致心力衰竭甚至猝死。VR包括心肌细胞肥大和心肌间质增殖及心肌细胞外基质(ECM)重建等。心肌纤维化可引起心室重构,包括实质重构和间质重构;前者表现为心肌细胞出现病理性肥大、变性、坏死等改变;后者表现为心肌间质纤维化及ECM胶原网的含量和组成等改变〔7〕。大剂量Iso可引起部分心肌细胞出现变性与坏死、心肌(细胞)肥大、胶原纤维增生等光镜及电镜超微结构改变,与缺血性心肌坏死类似〔8〕,可以用于诱导心肌缺血坏死动物模型。氯沙坦各剂量组治疗后,其超微结构明显改善,提示氯沙坦可以逆转VR引起的心肌超微结构损害,与国内学者的研究结果相似〔9〕。
VR的重要组成部分是心肌间质中基质胶原的增加以及胶原类型、组分和相互连接的改变,为导致心室舒张功能障碍的主要原因〔10〕,HW/BW目前已被用来作为观察VR的重要指标〔11〕。使用Iso后大鼠心肌出现明显的间质纤维化。Masson染色显示应用Iso造模后,心肌间质和血管周围有大量胶原纤维沉积,证实Iso能造成胶原沉积和心肌肥厚引起VR,氯沙坦能减轻心肌肥厚,抑制心肌间质细胞胶原含量的增加而改善VR,与文献报道一致〔12〕。
在VR分子机制的研究中,信号转导途径已成为近年来关注的焦点和研究热点,PKC信号转导通路的激活在心肌肥厚引起的VR中起重要作用〔13〕;PKCα可以介导心肌细胞肥厚,包括蛋白质合成增加、蛋白/DNA比率升高、细胞表面积增大等。TGF-β1是VR发生中的关键因子,通过上调Ⅰ、Ⅲ型胶原合成〔14〕,调节组织修复〔15〕,调节ECM蛋白〔16〕并抑制胶原酶的释放等促进VR生成。本研究发现,Iso可引起p-PKCα活性升高进而促进TGF-β1的表达,导致心肌肥厚、心肌胶原纤维沉积、ECM增多发生VR〔17〕;氯沙坦可抑制p-PKCα信号转导,减少TGF-β1生成,减轻VR。
1 魏红山,李定国,陆汉明.心室重构的发生与药物逆转——血管紧张素Ⅱ受体拮抗剂和ACEI应用研究进展〔J〕.心血管病学进展,2000;21(6):330-3.
2 Kim S,Ohta K,Hamaguchi A,etal.AngiotensionⅡinduces cardiac phynotypic modulation and remodeling in vivo in rats〔J〕.Hypertension,1995;25(6):1252-9.
3 Gibbons GH,Pratt RE,Dzau VJ,etal.Vascular smooth muscle cell hyperophy vs.hyperplasia autocrine transforming growth factor β1 expression determines growth response to angiotensinⅡ〔J〕.J Clin Invest,1992;90(2):456-61.
4 Mochly Rosen D,Gordon AS.Anchoring proteins for protein kinase C:a means for isozyme selectivity〔J〕.FASEB J,1998;12(1):35-42.
5 何 华,高玖鸣,王 文.PKCε在心肌肥厚中的作用地位〔J〕.高血压杂志,2006;14(7):145-6.
6 Rona G,Chappel CI,Balazs T,etal.An infact-like myocardial lesion and other toxic manifestations produced by isoproterenol in the rat〔J〕.Arch Pathol Lab Med,1995;67(4):443-55.
7 Doering CW,Jalil JE,Janicki,JS,etal.Collagen netwok remodelling and diastolic stiffness of the rat left ventricle with presssure overload hypertrophy〔J〕.Cardiovasc Res,1988;22(10):686-95.
8 符民桂,王晓红,姜志胜,等.环孢素A对儿茶酚胺诱导的大鼠心肌肥大的作用〔J〕.中华心血管病杂志,2001;29(1):41.
9 梁子敬,钟敏然.依那普利拉对再灌注心肌超微结构的影响〔J〕.广西医学,1997;18(2):123-4.
10 孙敬春,培 莉.心肌细胞外基质重塑及其影响因素〔J〕.高血压杂志,2003;11(3):200-3.
11 Takizawa T,Gu M,Chobanian AV,etal.Effect of nitric oxide on DNA replication induced by angiotensin Ⅱ in rat cardiac fibroblasts〔J〕.Hypertension,1997;30(5):1035-40.
12 Takemoto Y.Increased JNK,AP-1 and NF-kappa B DNA-binding activities〔J〕.Acta Physiol Sinica,1999;31(11):2017-30.
13 刘丽娜,李法琦.心肌肥厚相关信号通路的研究进展〔J〕.重庆医学,2010;39(20):805-8.
14 Eghali M,Tomek R,Sukhatme UP,etal.Differential factors of transforming growth factor-β1 and phorbol myristate acetate on cardiac fibroblasts:regulation of fibrillar collaga mRNA and expression of early transcription factors〔J〕.Circ Res,1991;69(2):483-90.
15 Brand T,Schueider MD.The TGF-β superfamily in myocardium:ligands,receptor,translation,and function〔J〕.J Mol Cell Cardiol,1995;27(1):5-18.
16 Yu G,Liang X,Xie X,etal.Apoptosis,myocardial fibrosis and angiotension Ⅱ in the left ventricle hypertensive rats treated with fosinopril or losartan〔J〕.Chin Med J(Engl),2002;115(9):1287-91.
17 阮颖新,刘素雁,李春媚,等.p38MAPK通路参与肾间质纤维化的实验研究〔J〕.临床泌尿外科杂志,2007;22(1):63-6.
〔2016-05-17修回〕
(编辑 郭 菁)
吉林市科委资助课题(201437026)
于杜娟(1980-),女,主治医师,博士,主要从事信号通路的相关研究。
于 敏(1968-),女,博士,副主任医师,主要从事心肌病的临床研究。
R542.2
A
1005-9202(2016)20-4982-04;
10.3969/j.issn.1005-9202.2016.20.018
1 吉林大学中日联谊医院
