基于体外化疗药物敏感试验制定中晚期肝母细胞瘤患儿化疗方案的疗效对照研究
2016-11-26张伟令黄东生胡慧敏张芮仙
李 静 张伟令 黄东生 胡慧敏 张 谊 文 圆 韩 涛 张芮仙 李 凡
·论著·
基于体外化疗药物敏感试验制定中晚期肝母细胞瘤患儿化疗方案的疗效对照研究
李 静 张伟令 黄东生 胡慧敏 张 谊 文 圆 韩 涛 张芮仙 李 凡
目的 评估根据体外化疗药物敏感试验-三磷酸腺苷肿瘤化疗药物敏感试验 (ATP-TCA)制定的Ⅲ和Ⅳ期肝母细胞瘤(HB)化疗方案的疗效。方法 纳入2013年6月至2016年6月在北京同仁医院儿科行术后化疗的Ⅲ和Ⅳ期HB患儿,以是否行ATP-TCA分为ATP-TCA组和对照组。ATP-TCA组检测伊立替康(CPT-11)、顺铂(DDP)、长春地辛(VDS)、环磷酰胺(CTX)、吡柔比星(THP)、依托泊苷(VP-16)、紫杉醇(PTX)、5-氟尿嘧啶( 5-FU)的体外敏感性,并根据药敏结果制定精准化疗方案。评估2组病死率和生存率等指标。结果 ATP-TCA组纳入38例,2例肿瘤标本细胞数少放弃培养,2例患儿共行2次手术,均进行药敏试验,对照组纳入40例。①ATP-TCA组各种化疗药物的敏感+中度敏感率分别为DDP 32例(84.2%)、CPT-11和VD各30例(78.9%)、CTX和5-FU各29例 (76.3%)、THP 22例 (57.9%)、VP-16 18例 (47.3%)、PTX 16例(42.1%)。②ATP-TCA组病死率为36.1%(13/36),对照组为50%(20/40),差异有统计学意义(P=0.048),Ⅲ期病死率ATP-TCA组为15.4%(2/13),对照组为28.5%(4/14),差异无统计学意义(P=0.077); Ⅳ期病死率ATP-TCA组47.8%(11/23),对照组为61.5%(16/26),差异有统计学意义(P=0.005)。③生存曲线分析显示, Ⅲ期预期3年生存率ATP-TCA组和对照组分别为75%和55%,Ⅳ期预期3年生存率ATP-TCA组和对照组分别为分别为50%和35%。结论 ATP-TCA可评估化疗药物的敏感性,基于此制定的个体化化疗方案可能可以提高HB Ⅳ期患儿的生存。
体外化疗药物敏感实验; 肝母细胞瘤; 精准治疗
肝母细胞瘤(HB)是儿童期最为常见的原发性肝脏恶性肿瘤,多药化疗及手术是治疗HB的主要手段。国际上各肿瘤协作组报道[1,2],标危的HB预后较好,对化疗的反应也较好,高危的HB多药联合化疗疗效仍不太理想,尤其是多于4个肝区侵犯、远处转移等病例的疗效欠佳。国际儿童肝脏肿瘤战略协会(SIOPEL)报道,PRETEXTⅠ、Ⅱ、Ⅲ期肿瘤预后较好[3],而PRETEXT Ⅳ期肿瘤、AFP<100 μg·L-1和有其他转移性疾病等因素者预后较差[4]。高危HB的5年无事件生存率(EFS)仅为28%~46%,予改良化疗方案后3年EFS也仅提高至56%~68%[5]。术后残留、复发和多药耐药严重影响了治疗效果。近年来,通过肿瘤体外药物敏感性试验指导个体化疗已越来越受到重视,三磷酸腺苷生物荧光法(ATP-TCA)技术快速、简便,已被广泛应用于多种成人恶性肿瘤研究,但应用于儿童恶性实体瘤国内未见报道。
1 方法
1.1 研究设计 PRETEXT Ⅲ和Ⅳ期HB病例基于术中患儿家长是否愿意行ATP- TCA药敏检测,分为ATP-TCA组和对照组,根据两组分别选择的相应化疗方案,比较两组预后及生存率。
1.2 HB诊断和分型标准 HB的诊断均依据肿瘤组织的病理学检查结果;肿瘤分期参照儿童肿瘤协会(COG)术后分期:Ⅰ期,手术完全切除,切缘无肿瘤残留;Ⅱ期,手术完全切除,切缘见显微镜下肿瘤残留;Ⅲ期,手术完全切除肿瘤/或无法切除肿瘤,有大体肿瘤残留/或伴有局部淋巴结转移;Ⅳ期,肿瘤完全切除或不完全切除,伴有远处转移。
1.3 ATP-TCA组纳入标准 ①2013 年6 月至2016年 6 月在北京同仁医院(我院)儿科、符合HB病理诊断的、行化疗并随访的HB术后病例;②HB术后符合PRETEXTⅢ期和Ⅳ期标准;③患儿家长同意在术中行ATP-TCA检测。
1.4 ATP-TCA组剔除标准 ①肿瘤细胞较少,不能完成ATP-TCA检测;②标本污染致检测结果准确性受影响。
1.5 对照组纳入标准 同ATP-TCA组纳入标准①和②,HB术后符合PRETEXTⅢ期和Ⅳ期分期病例数与ATP-TCA组匹配,且家长不同意在术中行ATP-TCA检测。
1.6 HB手术 本文HB患儿均在外院(首都医科大学附属北京儿童医院或首都儿科研究所附属儿童医院)外科行肿瘤切除,手术尽可能做到最完整切除。
1.6 药敏试验方法[6~8]
1.6.1 试验药物 采用8种化疗药物,包括顺铂(DDP,齐鲁制药有限公司)、伊立替康体内代谢产物(CPT-11,大连美仑生物技术有限公司)、长春地辛(VDS,杭州民生药业有限公司)、环磷酰胺(CTX,Research Chemical Inc)、5-氟尿嘧啶(5-FU,天津金耀氨基酸有限公司)、吡柔比星(THP,深圳万乐药业有限公司)、紫杉醇(PTX,北京协和药厂)和依托泊苷(VP-16,齐鲁制药有限公司)。
1.6.2 仪器和试剂 微孔板式化学发光检测仪OrionII购自德国Berthold公司;ATP 生物荧光肿瘤药物敏感性检测试剂盒购自湖州海创生物科技有限公司。ATP-TCA试剂盒包括完全分析培养基(CAM),肿瘤组织消化酶(胶原酶、透明质酸酶和DNA酶),ATP抑制剂,ATP提取液和荧光素-荧光素酶,96孔细胞培养板和检测板等,均购自北京金紫晶生物医药技术有限公司。
1.6.3 标本采集 ATP-TCA组患儿由我院派专人负责从外院取HB术中切除的新鲜肿瘤组织标本,2 h内送至我院行药敏试验。
1.6.4 药敏试验方法 按照试剂盒说明书进行,由首都医科大学附属北京世纪坛医院病理科进行。步骤简述如下:①剥离新鲜肿瘤标本表面的结缔组织、纤维和脂肪后,将标本剪碎成 1 mm3的碎块,加入组织消化酶(胰酶、胶原酶)消化 2~3 h,将消化后细胞悬液通过细胞筛网,洗涤细胞后即得到单细胞悬液。②取化疗药物和完全分析培养液,于96孔培养板倍比稀释成6个梯度药物浓度:200%、100%、50%、25%、12.5%,6.25%,同时设置M0对照(无药),M1(ATP最大抑制),在不同药物种类、同一药物不同药物质量浓度梯度下培养 5~7 d。③利用生物荧光原理测定 ATP 水平。④分析各药物不同浓度抑制率,绘制抑制曲线,计算药物抑制半数癌细胞生长时的血浆峰值浓度百分比 (IC50)和抑制90%癌细胞生长时的血浆峰值浓度百分比(IC90),评估药物的敏感度。
1.6.5 药敏试验结果判断 肿瘤对化疗药敏分为4个等级,敏感:IC50≤25% 检测药物浓度(TDC)且IC90≤100% TDC;中度敏感: IC50≤25% TDC且IC90>100%;轻度敏感: IC50>25% TDC或敏感度指数 <600;耐药:IC90>100% TDC 且 IC50>25% TDC且敏感度指数>600。
1.7 化疗方案 对照组化疗方案根据中国儿童肝母细胞瘤专家共识及我科经验制定的治疗方案,采用“5-FU+DDP+THP+VDS”及“DDP+THP+CTX”方案交替;ATP-TCA组则根据药敏检测结果选择敏感或中度敏感的药物组合方案。
1.8 随访 HB术后化疗患儿按要求定期来我院随访AFP、腹部CT或MRI,存在远处转移患儿同时监测转移灶情况;对于不能来我院复查的患儿采用电话随访。
1.9 观察指标 ①病死率;②绘制生存曲线,评估3年预期生存率;③完全缓解(CR):手术及接受化疗后病情稳定, AFP下降至正常,影像学检查未发现肿瘤或肿瘤消失“所有症状体征消失”维持时间至少4周;部分缓解(PR):肿瘤缩少≥50%,AFP下降达到手术前50%至少4周;进展(PD):有新病变出现或原有病变估计增大≥25%并且 AFP持续升高;总病情缓解率(ORR):CR和PR之和占可评估病例的比例;总体生存率:从接受治疗至死亡或末次随访的人数的比例。
1.10 统计学方法 采用SPSS 19.0软件行统计学分析,计数资料以百分比或率表示,率的比较采用χ2检验,P<0. 05 为差异有统计学意义。Kaplan-Meier 法计算患儿3年生存率并绘制生存曲线。
2 结果
2.1 一般情况 ATP-TCA组纳入38例,2例肿瘤标本细胞数少放弃培养,36例完成38例次药敏试验,男23例,女13例;就诊年龄3个月至5岁1个月,中位就诊年龄为2.0岁;Ⅲ期13例,Ⅳ期23例。对照组40例,男25例,就诊年龄4个月至5岁6个月,中位就诊年龄1.8岁;Ⅲ期14例,Ⅳ期26例。两组性别构成、年龄和分期差异无统计学意义。
2.2 体外ATP-TCA结果 ATP-TCA组按38例次统计8种化疗药物的敏感性,敏感+中度敏感率分别为DDP 32 例(84.2%),CPT-11 30例(78.9%),VDS 30例(78.9%),CTX 29例(76.3%),5-FU 29例( 76.3%),THP 22例(57.9%),VP-16 18例( 47.3% ),PTX 16例(42.1%)。
2.3 化疗方案 ATP-TCA组根据敏感性结果的化疗方案为:5-FU+VDS+THP+DDP 10例,DDP+THP+CTX 12例,CPT-11+DDP+CTX+VDS 5例,CPT-11+DDP+CTX+THP 4例,DDP+VP-16+CTX 3例,PTX+卡铂2例。
2.4 预后分析 截止2016年6月30日, Ⅲ期病死率ATP-TCA组为15.4%(2/13),对照组为28.5%(4/14),差异无统计学意义(P=0.077);Ⅳ期病死率ATP-TCA组47.8%(11/23),对照组为61.5%(16/26),差异有统计学意义(P=0.005)。
生存曲线分析显示, Ⅲ期预期3年生存率ATP-TCA组和与对照组分别为75%和55%(图1),Ⅳ期预期3年生存率ATP-TCA组和与对照组分别为50%和35%。Ⅲ期和Ⅳ期预期3年生存率ATP-TCA组较对照组有提高。表1显示,Ⅲ期和Ⅳ期3年CR和PR率ATP-TCA组略高于对照组。
表1 ATP-TCA组与对照组患儿Ⅲ期和Ⅳ期随访结局指标[n(%)]
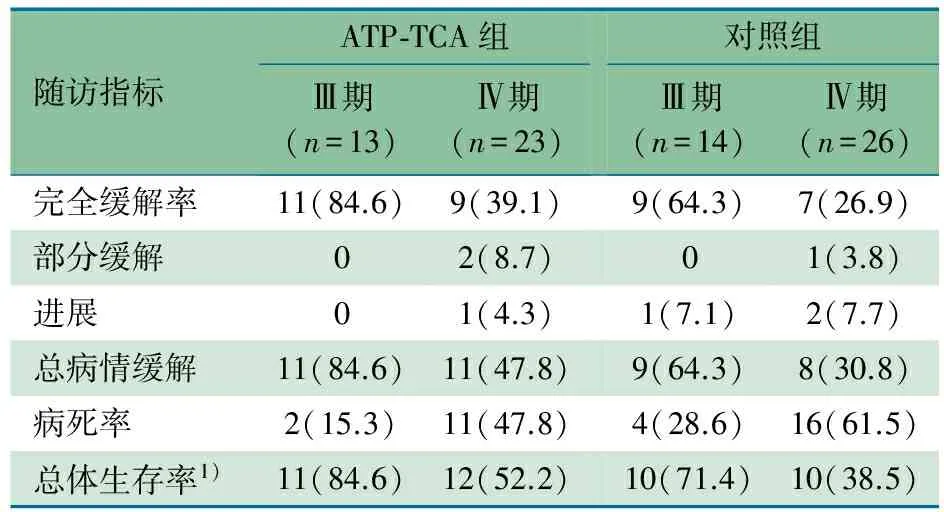
随访指标ATP⁃TCA组Ⅲ期(n=13)Ⅳ期(n=23)对照组Ⅲ期(n=14)Ⅳ期(n=26)完全缓解率11(84.6)9(39.1)9(64.3)7(26.9)部分缓解02(8.7)01(3.8)进展01(4.3)1(7.1)2(7.7)总病情缓解11(84.6)11(47.8)9(64.3)8(30.8)病死率2(15.3)11(47.8)4(28.6)16(61.5)总体生存率1)11(84.6)12(52.2)10(71.4)10(38.5)
注 1)指至死亡或本次随访时点
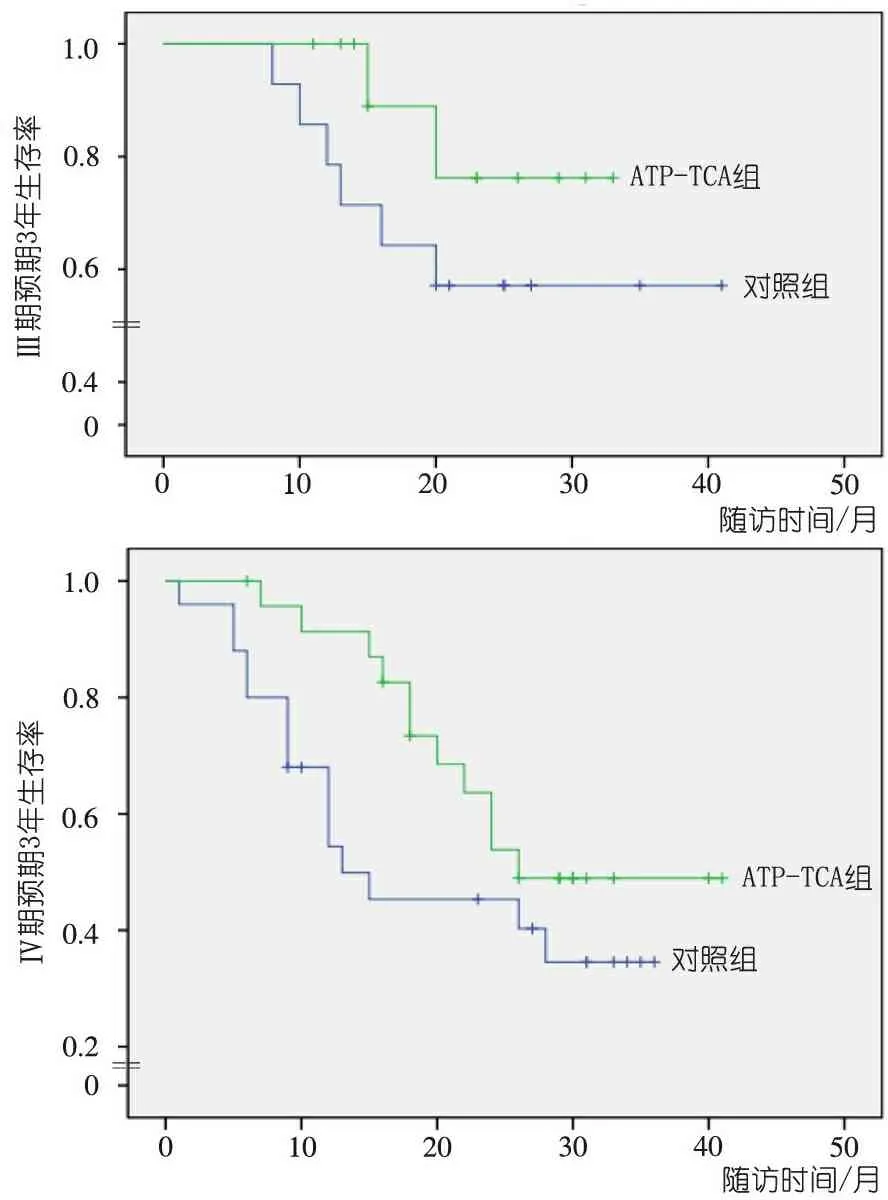
图1 ATP-TCA组与对照组生存率比较
3 讨论
儿童HB目前已成为继神经母细胞瘤和肾母细胞瘤之后的腹腔内常见实体肿瘤,全球发病率为(0.005~0.015)/万[10]。化疗及手术是治疗HB的主要手段。本研究试验单药敏感性显示:DDP对肝母细胞瘤的抑制作用优于其他药物,达84.2%,略高于既往张语桐等报道的78.6%的有效率[11]。含有DDP的术前化疗方案出现后,HB患者生存率大为提高。SDP报道使用DDP+THP方案进行术前化疗可使总体生存率由单纯手术时代的20%提高至75%~80%,术后复发率30%降至3%~4%[12]。但改良化疗方案后高危HB的3年无事件生存率也仅提高到56%~68%[5]。我院曾对近10年收治的30/103例随访3年以上的Ⅲ和Ⅳ期HB患儿行预后评估,其中Ⅲ期12例,CR 10例(83%),Ⅳ期18例,CR 8例(44%),5年总体生存率为58%[13]。因此对于高危的HB,虽应用多药联合化疗,疗效及总体预后仍不理想。肿瘤的异质性及多态性决定肿瘤耐药的普遍存在,经验化疗药物针对性不强且易产生耐药性,不能达到很好的治疗效果。近年来,以抗肿瘤药物精准治疗为目的的抗肿瘤药敏试验受到重视,许多体外试验方法在指导临床化疗及选择合适的化疗方案,或在评估现有化疗方案疗效, 或在抗肿瘤药物的筛选和预测患儿生存期以及肿瘤基础研究等方面均有重要意义。
目前临床开展药敏检测常用的方法有克隆形成实验、肾包膜下移植法、差别染色细胞毒检测、 MTT比色法等,这些方法在不同程度上均存在不足[14~16]。而ATP 体外药敏试验的原理是细胞内 ATP 与荧光素酶复合物作用产生可测定荧光 ,检测ATP 量可反映活细胞数[17],可检测出不同药物及同种药物不同剂量作用后的差别。ATP 水平与活细胞数量呈正相关 , 故通过测定其水平可反映生物体的增殖活性。Moon等[18]根据ATP-TCA体外检测结果将34例无法手术的非小细胞肺癌患者分为铂类敏感组(20例)及耐药组(14例),敏感组患者临床有效率明显较耐药组高(61.1%vs21.4%,P=0.036)。治疗后16.9月的随访结果表明,敏感组无进展生存期较耐药组延长(4.7月vs2.3月,P=0.06);研究结束时敏感组15例均存活,耐药组总生存期仅为8.1个月。Jinushi等[19]的研究表明,ATP-TCA在69例胃肠道肿瘤患者的化疗中显著提高了治疗效果,延长了患者的生存期。Inoue等[20]将ATP-TCA应用于浅表性膀胱癌患者膀胱内灌注化疗,药敏试验指导治疗的ATP-TCA组(32例)5年未复发率为80.9%,而经验化疗对照组仅为39.4%(P<0.001),且术后2年后ATP-TCA组才出现复发。提示ATP -TCA筛选化疗药物及提供患者预后有较好的应用价值。
本研究对36例Ⅲ和Ⅳ期HB患儿行ATP-TCA药物敏感性检测,并根据药敏结果重新组合方案,药物的选择尽量为敏感及中度敏感药物,并避开耐药药物制定个体化化疗的方案;同期40例以经验方案进行化疗的患儿作为对照组。两组预后分析结果显示, 预期3年生存率ATP-TCA组较对照组有提高,Ⅳ期病死率差异有统计学意义(P<0.05)。推测个体化疗指导方案对提高体内残余的癌细胞治疗有一定的作用,使HB患儿的病情得到延缓。因观察时间较短,且样本量较小,需进一步延长观察时间并扩大样本量。另外,根据药敏结果制定的化疗方案,与目前国内外常采用的化疗方案基本一致,但同时药敏结果也提示部分患儿对这些方案不敏感,反而一些较少应用的药物效果较好,因此,药敏试验指导下的化疗方案的制定可为每名患儿更好地选择适合的方案,并减少化疗的不良反应,改善预后、提高生存率提供可能。
本研究ATP-TCA组2例为2次手术,2次均行药物敏感性检测,前后2次敏感性检测存在一定差异,第2次检测结果显示,肿瘤细胞对第1次敏感的药物产生耐药,即肿瘤细胞早期治疗有效,治疗过程中发生耐药导致后期治疗无效并最终导致死亡。因此建议对化疗效果差的患儿需多次行药物敏感性检测,及时发现药敏变化,以调整化疗方案及巩固化疗疗效。
[1]Katzenstein HM, London WB, Douglass EC, et al.Treatment of unresectable and metastatic hepatoblastoma:A pediatric oncology group phase II study. J Clin Oncol,2002,20(16):3438-3444
[2]Fuchs J,Rydzynski J,vonSchweinitz D,et al.Pretreatment prognostic factors and treatment results in children with hepatoblastoma:A report from the german cooperative pediatric liver tumor study HB94. Cancer,2002,95(1):172-182
[3]Aronson DC,Schnater JM,Staalman CR,et al. Predictive power of predictive value of the pretreatment extent of disease system in hepatoblastoma:results from the international society of pediatric oncology liver tumor study group SIOPEL-1 study. ClinOncol,2005,23(6):1245-1252
[4]Meyers RL,Rowland JR,Krailo M,et al. Predictive power of pretreatment prognostic factors in hepatoblastoma:a report of the Children's Oncology Group. Pediatr Blood Cancer,2009,53(6):1016-1022
[5]Zsiros J,Maibach R,Shafford E,et al.Successful treatment of childhood high-risk hepatoblastoma with dose-intensive multiagent chemotherapy and surgery:Final results of the SIOPEL-3HR study.JClin Oncol,2009,28(15):2584-2590
[6]Sevin BU,Peng Z,Perras J,et al.Application of ATP billuminescence assay in human tumor chemosensitivitytesting.Gynecol Oncol,1988,31(1):191-204
[7]Andreotti PE,CreeI A,Kurbancher CM,et al.Chemosensitivity testing of human tumors using a microplate adenosine triphlsphate luminescence assay:clinical correlation for cisplatin resistance of ovarian carcinoma.Cancer Res,1995,55(22):5276-5282
[8]Kurbacher CM,Mallmann P,Kurbacher JA,et al.In vitro activity of titanocenedichloride versus cisplatin and doxorubicin in primary and recurrent epithelial ovarian cancer.Anticancer Res,1994,14(5A):1961-1965
[9]陈凯,蒋慧,奚政君,等.单中心2009 至2011 年住院患儿中实体肿瘤状况分析.中国循证儿科杂志,2013,8(1):60-63
[10]Ang JP,Heath JA,Donath S,et al. Treatment outcomes for hepatoblastoma:An institution's experience over two decades. PediatrSurgInt,2007,23(2):103-109
[11]Zhang YT,Feng LH,Zhong XD,el al.Single-agent cisplatin treatment of children with high.risk hepatoblastoma J.J Pediatr Hematol Oncol,2014,36(4):271-275
[12]Meyers RL, Rowland JR, Krailo M, et al. Predictive power of pretreatment prognostic factors in children with hepatoblastoma: a report from the children's oncology group. Pediatr Blood Cancer, 2009, 53(6) : 1016-1022
[13]易优,张谊,张伟令,等.晚期儿童肝母细胞瘤的预后分析.中国小儿血液与肿瘤杂志,2014 ,12 (19) :303-307
[14]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays. Immunol Methods,1983,55(1-2) :65-67
[15]Yanaue H,Tanimura H,Tsunoda T,et al.Chemosenstitivity testing with highly purified fresh human tumour cells with the MTT colorimetric assay.Eur J Cancer,1991,27(10) :1258-1262
[16]Sevin BU, Perras JP, Averette HE, et al .Chemosensitivity testing in ovarian cancer. Cancer, 1993, 71 (4) : 1613-1620
[17]Fruehauf JP.In vitro assay - assisted treatment selection for women with breast or ovarian cancer. EndocrRelat Cancer,2002, 9(3) : 171-182
[18]Moon YW,Choi SH,Kim YT,et al. Adenosine triphosphate-based chemotherapy response assay(ATP-CRA)-guided platinum-based 2-drug chemotherapy for unresectablenonsmall-cell lung cancer. Cancer,2007,109(9):1829-1835
[19]Jinushi K, Hirabayashi N, Kirihara Y, et al. Clinical studies of in vitro chemosensitivity test evaluated by ATP assay of gastrointestinal cancer. Gan to Kagaku Ryoho Cancer & Chemotherapy,1990, 17(11):2235-2239
[20]Inoue K, Kasahara K, Inoue Y, et al. The efficacy of ATP sensitivity assay on intravesical prophylactic instillation for superficial bladder cancer. Nippon Hinyōkika Gakkai Zasshi the Japanese Journal of Urology, 1996, 87(12):1281-1288
(本文编辑:丁俊杰)
Establishment of precisionchemotherapy for intermediate and advanced stage hepatoblastoma based on tumor chemosensitive assay in vitro
LI Jing, ZHANG Wei-ling, HUANG Dong-sheng, HU Hui-min, ZHANG Yi, WEN Yuan, HAN Tao, ZHANG Rui-xian, LI Fan
(Beijing Tongren Hospital affiliated to Capital Medical University, Beijing 100176, China)
HUANG Dong-sheng,E-mail: hds5180@sina.com
Objective To evaluate the effectiveness of chemo-therapeutic drugs for Ⅲ and Ⅳ HB patients, constituded by in vitro adenosine triphosphate tumor chemosensitive assay(ATP-TCA) system.MethodsⅢ and Ⅳ patients who received postoperative chemotherapy were selected in our department from June 2013 to June 2016, and divided into ATP-TCA group and control group according to if they had received ATP-TCA. ATP-TCA system was applied to test efficacies of Irinotecan(CPT-11), cisplatin (DDP),vindesine (VDS), cyclophosphamide(CTX),pirarubicin(THP),etoposide (VP-16), paclitaxel (PTX)and 5-fluorouracil (5-FU), then the patients received precision chemotherapy according to ATP-TCA.ResultsThe ATP-TCA group had 38 samples,2 of them quit the group because of fewer cells .2 of them had two surgeries and had two assay results. The control group had 40 samples. In the 38 samples,the sensitive rates were 84.2%to DDP, 78.9% to CPT-11, 78.9% to VDS,77.8% to CTX, 76.3% to 5-FU, 57.9% to THP, 47.3% to VP-16, 42.1% to PTX,respectively. In stage Ⅲ patients, no significant differences were found in mortality between ATP-TCA group and control group (15.4%vs28.5%,P=0.077. In stage Ⅳpatients, significant differences were found in mortality between ATP-TCA group and control group(47.8%vs61.5%,P=0.005). In clinical trail,at the research end-point, significant differences were found in mortality between ATP-TCA group and control group(36.1% vs 50%,P=0.048.ConclusionThe highest sensitivity drug was DDP. In ATP-TCA group, three-year survival rate was higher than control group, ATP-TCA system might be useful in evaluating the efficacy of drugs on HB samlpes, and in planning ivdividualized chemotherapy regimen for HB samples,and in planning individualized chemotherapy regimen for HB patients. ATP-TCA-guided chemotherapy might prolong survival time of HB patients.
Tumor chemosensitive assay in vitro; Hepatoblastoma; Precision chemotherapy
首都医科大学附属北京同仁医院 北京,100176
黄东生,E-mail: hds5180@sina.com
10.3969/j.issn.1673-5501.2016.05.009
2016-06-10
2016-09-15)
