第48届国际化学奥林匹克试题(续)
2016-11-24江万权朱平平王颖霞
江万权 朱平平 王颖霞 裴 坚,*
(1中国科学技术大学化学与材料科学学院,合肥230026;2北京大学化学与分子工程学院,北京100871)
·竞赛园地·
第48届国际化学奥林匹克试题(续)
江万权1朱平平1王颖霞2裴坚2,*
(1中国科学技术大学化学与材料科学学院,合肥230026;2北京大学化学与分子工程学院,北京100871)
www.dxhx.pku.edu.cn
第4题 总分的8%
动力学研究在水处理中的应用
工业废物是导致水污染的主要原因,实验室开展的动力学研究为废液处理提供支持。作为工业用溶剂和副产物的1,4-二氧杂环已烷,俗称二氧六环(C4H8O2),是一种严重污染水体的有机物。它可以被氧化剂如过二硫酸根、臭氧或者过氧化氢等氧化成为无害的化学物质。
在温度T=303.15 K,以AgNO3为催化剂、过二硫酸钾(K2S2O8)为氧化剂,进行二氧六环氧化的动力学研究,得到如下数据。通过测定未反应的过二硫酸根监控反应过程。研究中所用AgNO3的浓度为1.00×10-3mmol·dm-3。
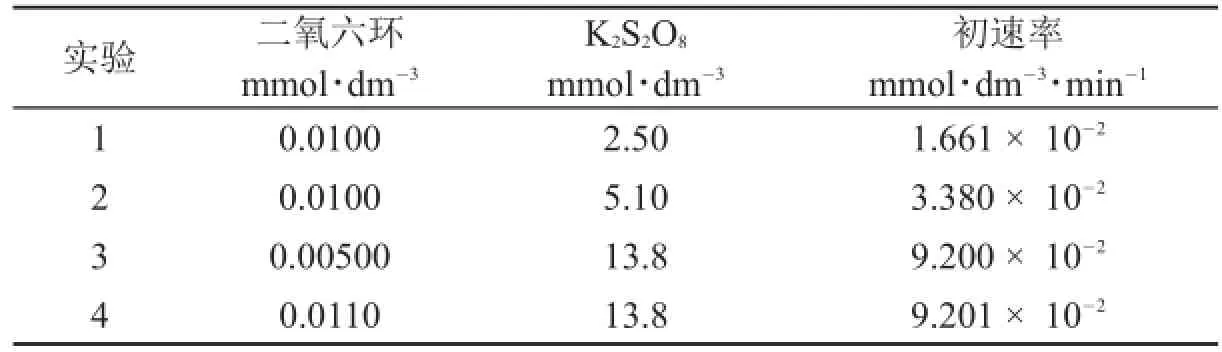
实验1234二氧六环mmol·dm-30.0100 0.0100 0.00500 0.0110 K2S2O8mmol·dm-32.50 5.10 13.8 13.8初速率mmol·dm-3·min-11.661×10-23.380×10-29.200×10-29.201×10-2
许多国家饮用水中二氧六环的最高许可值设定为0.35 μg·dm-3。
某一水样,二氧六环起始浓度为40.00 μg·dm-3。假设氧化l mol二氧六环需消耗l mol过二硫酸根。研究中所用AgNO3的浓度为1.00×10-3mmol·dm-3。
4.1.1计算要使水样中的二氧六环浓度达到许可值,氧化反应过程需要进行多长时间(单位:分钟),温度为303.15 K,K2S2O8的起始浓度为5.0×10-6mol·dm-3。假定上述实验得到的速率关系在这些条件下依然有效。
对于过二硫酸根氧化二氧六环的反应,业有不同的机理。Misra和Ghosh(1963)给出的机理如下:
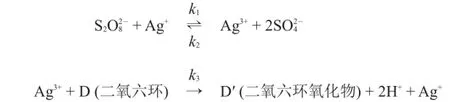
4.1.2假设Ag(III)处于稳态,导出二氧六环氧化过程的速率方程。
4.1.3如下说法哪个或哪些是正确的?
A)在二氧六环浓度非常高时,根据4.1.2所给机理得到的速率方程和4.1.1中的实验数据相符合。
B)在二氧六环浓度非常低时,根据4.1.2所给机理得到的速率方程和4.1.1中的实验数据相符合。
C)在二氧六环浓度非常高时,表观反应速率常数的单位为dm3·mol-1·s-1。
D)在二氧六环浓度非常低时,表观反应速率常数的单位为dm3·mol-1·s-1。
药物的降解——动力学纵览
动力学研究对确定药物保质期至关重要。一些化学反应会影响药物的保质期,这些反应的速率依赖于反应条件如pH、温度、湿度。
赖氨酸的乙酰水杨酸盐(LAS)是一种有镇痛和消炎作用的处方药,商品名称为Aspegic。LAS水解生成赖氨酸水杨酸盐和乙酸。
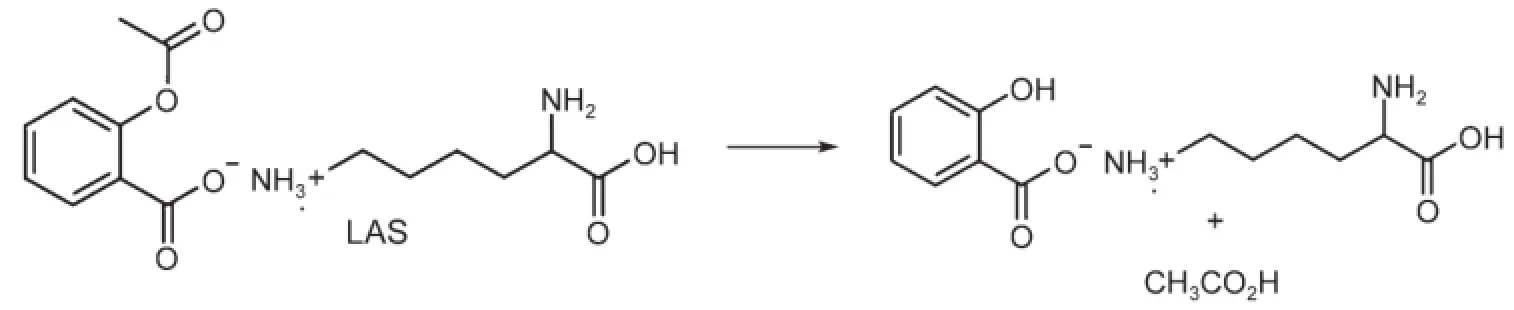
LAS水解有三种途径:(a)酸催化,(b)非催化以及(c)碱催化。
如果以[LAS]表示“t”时刻LAS的浓度,水解反应的总速率可以写为:
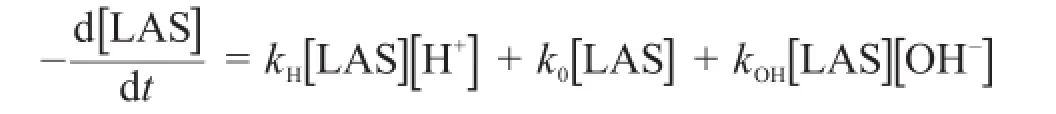
这里,kH、k0和kOH分别为酸催化、非催化和碱催化水解途径的速率常数。总反应速率可以定义为:
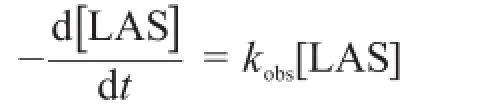
4.2.1写出含kH、k0、kOH和[H+]的kobs表达式。
在298.15 K、不同pH(从0.50到13.0)条件下进行LAS的水解反应。LAS的起始浓度非常低,可以认为在反应过程中pH不变。
下图给出LAS水解随pH的变化关系。

4.2.2下面哪个或哪些说法正确?
A)在pH=12时,kobs≌k0。
B)在pH=5.0时,kobs≌k0。
C)随pH从0.50变为1.0,反应速率增大。
D)随pH从10变为12,反应速率增大。
4.2.3利用上图和下表的数据,计算kH、k0和kOH。必须给出单位。

pH log(kobs/min-1)1.300-3.886 5.300-4.000 12.180-1.726
乙酰水杨酸,俗称阿司匹林,是一种常用来退热、止痛和消炎的药物。与LAS类似,阿司匹林的水解随pH变化也有多种途径。在333.15 K温度下,阿司匹林水解与pH的关系如下:
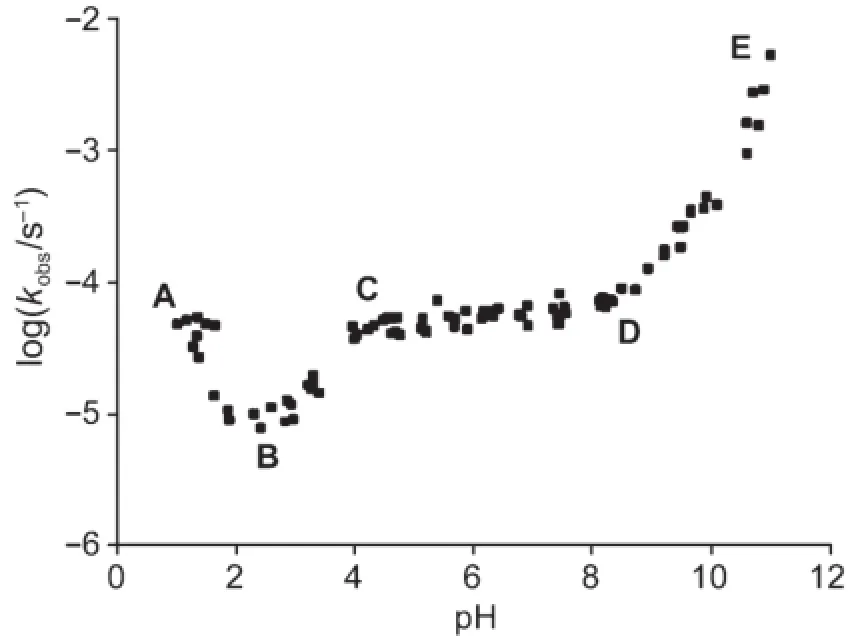
下面给出阿司匹林水解的可能反应。随pH不同,会有一个或者多个反应占主导地位。
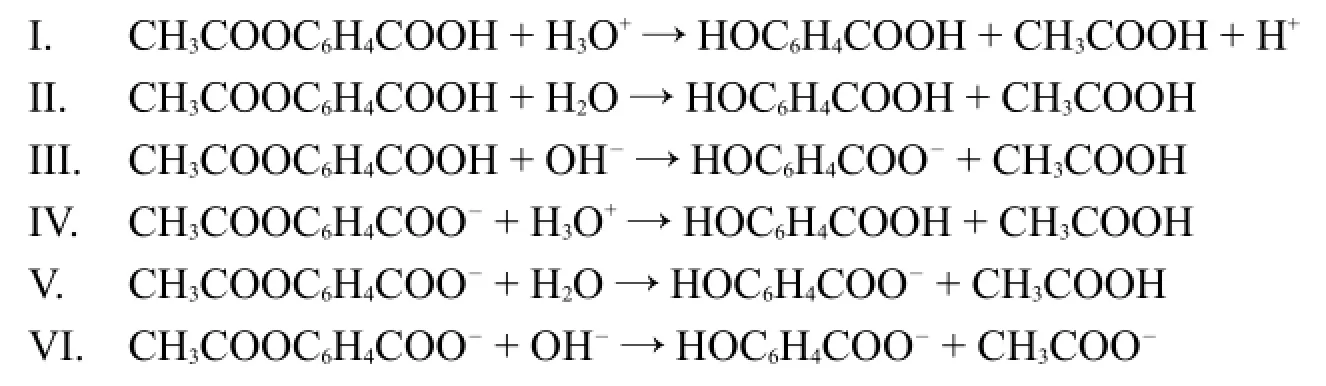
4.3.1利用上面的pH和速率关系曲线和以上所给的反应,指出下面的说法中哪个或哪些是正确的。(在温度为333.15 K时,阿司匹林pKa=3.57)
a)在C-D区间,反应IV占主导。
b)在C-D区间,反应V占主导。
c)在D-E区间,反应VI占主导。
d)在A-B区间,反应II占主导。
研究表明,阿司匹林水解的速率常数对pH关系曲线在某一特定pH总是存在一个极小值。在290.15 K温度下,测得反应I、II和III的速率常数如下:
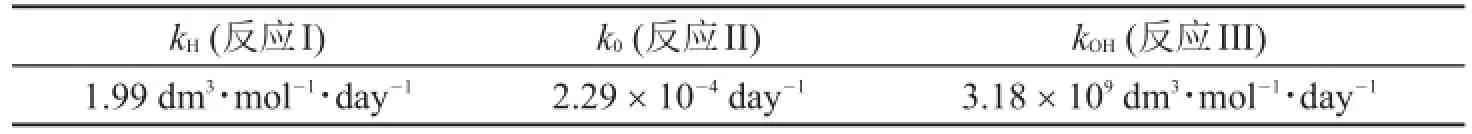
kH(反应I)1.99 dm3·mol-1·day-1k0(反应II)2.29×10-4day-1kOH(反应III)3.18×109dm3·mol-1·day-1
290.15K,水的离子积取1.0×10-14。
4.3.2假设只发生反应I、反应II和反应III,计算速率常数最小处的pH值。
第5题 总分的8%
早在5500年前,古埃及人就知道如何合成蓝色颜料,今天我们把这种颜料称为“埃及蓝”。之后约2000年,在古代的中国,另外一种如今被称作“中国蓝”的蓝色颜料被广泛使用。这两种颜料结构相似,但元素组成不同。
古代制备这两种颜料的方法在现代的实验室中很容易重复。
涉及到物质的量的关系,假设本题目中的所有化合物均为纯净物且产物可定量得到。
要制备埃及蓝,将10.0 g矿物A与21.7 g SiO2和9.05 g矿物B在800-900°C加热足够长的时间,释放出16.7 dm3由两种物质组成的混合气体(体积在温度850°C,1.013×105Pa下测得),得到34.0 g颜料,没有其他产物。将以上混合气体冷却,其中一种组分发生凝聚。进一步冷却至0°C,气体体积减至3.04dm3。
5.1.1计算加热A和B及SiO2而产生的混合气体的质量。
5.1.2定量确定气体混合物的组成。
当10.0 g矿物A和21.7 g SiO2在B不存在的条件下共热,释放出8.34 dm3气体(体积在温度850°C和1.013×105Pa下测得)。矿物A仅含一种金属。
5.1.3计算矿物B的摩尔质量并确定B的化学式。提示:这是一种不含结晶水且不溶于水的离子固体。
要制得中国蓝,需称取17.8 g矿物C替代矿物B(矿物A和SiO2的质量保持与制备埃及蓝相同),且反应在更高的温度下进行。除了目标颜料,反应还产生与制备埃及蓝时相同种类、相同质量的气体。
5.1.4确定矿物C的化学式。
5.1.5确定埃及蓝和中国蓝的化学式。
5.1.6确定矿物A的化学式。
某些中国蓝样品分析结果显示其中含有痕量硫。这就意味着合成这些样品时采用的是另一种不同于C的矿物。
5.2.1写出一种替代C的矿物的化学式。
5.2.2如果采用这种矿物而不是C合成中国蓝,反应温度是否可以降低?
假如在制备中国蓝的过程中,二氧化硅的量比前述过程所用的要少,将会得到一种紫色的颜料:中国紫。中国紫被特别用于兵马俑的着色。
5.3写出在制备中国紫的条件下可以形成的二元化合物的化学式,此化合物也是颜色发生变化之根源。
第6题 总分的7%
尽管目前还没有治疗老年痴呆症的方法,但是科学家们已经发展了一些治疗神经组织退化性疾病的药物。在这些乙酰胆碱酯酶抑制剂中,药物加兰他敏1就是其中一个。这个分子可以从格鲁吉亚当地植物高加索雪莲中分离得到,但是必须通过人工大量合成才能满足临床治疗的需求。人工大量制备加兰他敏的合成路线如下所示。

关于此合成的说明:
1H NMR图谱表明化合物A中苯环上2个氢处在芳环的对位;
在水相中,化合物C易分解,不能分离得到;但是很快能被NaBH4还原为化合物D。
6.1.1画出化合物A、B、C、D、F以及G的结构简式;除了最后一步L-selectride的还原反应外,其他反应均不是立体选择性的。因此,在你的答题中不需要考虑立体化学。
6.1.2给出将化合物D转化为E的试剂X的化学式。
通过拆分获得的目标化合物的旋光度为-400(°)·cm2·g-1,但是在相同条件下测量,其对映体纯化合物的旋光度为-415(°)·cm2·g-1。你可以假定其光活性不纯只归因于另一个对映体。
其中一种表示光活性纯度的方法是对映体过量(ee)值,此值指的是在只由一对对映体组成的混合体系中一个化合物对其对映体的过量的数值。例如,在一个70%R和30%S组成的混合体系中,其ee值为40%。
6.2.1人工制备经拆分后的这个化合物的对映体过量ee值为多少?
用于最后的立体选择性还原的L-selectride是一个商业化试剂。
6.2.2确定(-)-1化合物标识为(α,β,γ)的立体中心R或S构型。
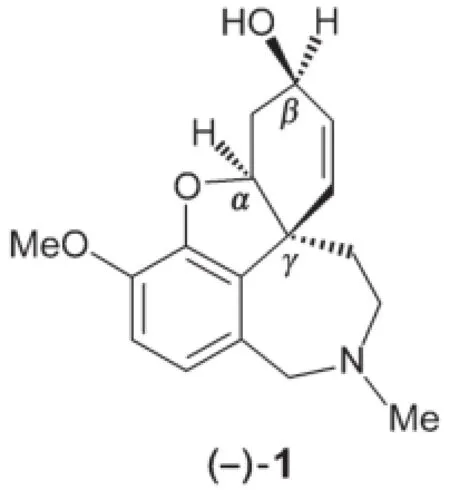
6.2.3给出一个与L-selectride一样能将H转化为1的试剂的化学式。无需考虑立体选择性。另一条生产加兰他敏的替代性合成路线中最后一步构建了化合物中的七元环。
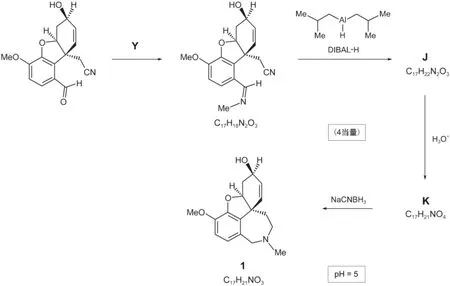
6.3.1给出进行第一步反应的化合物Y的化学式。
6.3.2画出化合物J和K的结构简式。
第7题 总分的8%
这个问题主要讨论dolasetron mesylate Z的合成(结构式如下图所示),这个市售药物的名称为Anzemet,主要用于治疗手术后的恶心和呕吐。
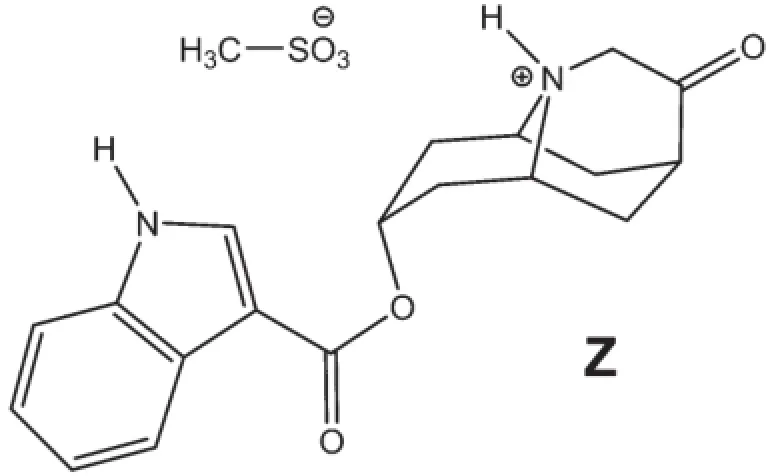
其起始的合成路线如下图所示。

第一步合成了环状化合物A,其分子中只含C、H以及O原子。化合物G是非手性的,可以直接通过化合物D的臭氧化反应后再经还原后处理得到,也可以通过在OsO4氧化后的立体异构体产物E1和E2再转化得到,还可以由过酸氧化后的立体异构体产物F1和F2再转化得到。
7.1依据所给的质量百分数确定化合物G的经验式。
7.2画出A、B、C、D、E1、E2、F1、F2和G的结构简式。
化合物G用于下一步的合成,在缓冲溶液中G转化为H(是由两个非手性的非对映异构体组成的混合物)。化合物H被NaBH4还原生成醇I(是由4个非手性的非对映异构体组成的混合物)。I在酸性条件下与四氢吡喃反应生成J(是由更多非对映异构体组成的混合物)。然后,J先经叔丁醇钾处理,接着再在盐酸水溶液中回流,在弱碱性条件下进行后处理,分离得到K,K由一对非对映异构体组成,K1为主产物,K2为次要产物。两者可以分离。K1用于最后的合成。
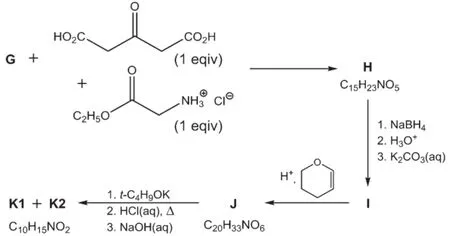
7.3.1画出化合物H、I和J的结构简式。此处不需要将形成的所有非对映异构体都一一列出。
7.3.2画出非对映异构体K1和K2的结构简式。
在最后的合成中,L与M反应生成中间体N,N接着与K1反应后,分离得到中性胺化合物,再经CH3SO3H质子化反应得到最终药物Z。
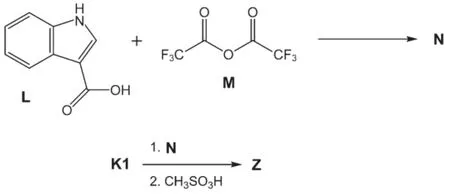
7.4画出化合物N的结构简式。
第8题 总分的7%
一个不常见的、但与生理活性相关的糖类似物可以以D-葡萄糖为原料经以下合成路线制备。D-葡萄糖的丙酮溶液加入一滴浓酸加热后生成二缩酮化合物A。A接着可以选择性水解转化为B。

8.1给出答题纸中选择题的答案。
化合物B与NaIO4反应生成C。C接着与NaCN水溶液反应,再经10%NaOH水溶液加热处理得到由两个非对映异构体组成的混合物D1和D2。这两个化合物可以通过柱色谱分离。
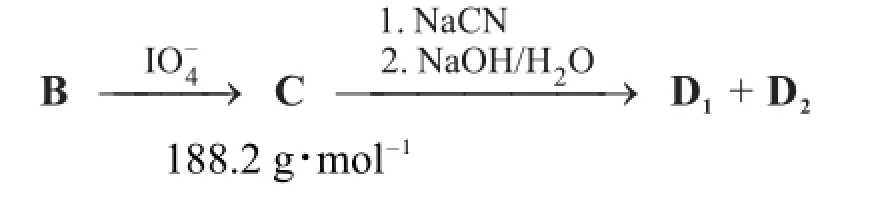
D1被LiAlH4还原后,接着在1 M HCl水溶液中加热生成糖F,F是目前自然界中含量最高的多糖水解产物。
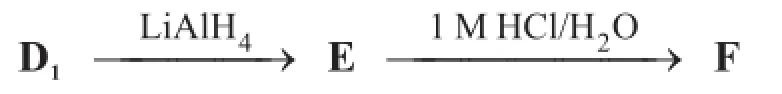
8.2.1画出化合物C、D1、D2、E以及F的立体结构简式,在这些结构简式中须带有立体化学信息。F中需表示为以稳定的六元环为骨架的异构体。用波浪线表示与绝对立体构型不能确定的手性碳原子相连接的其中一根单键。
8.2.2给出答题纸中选择题的答案。
D2经HCl中和后,接着在甲苯中加热失水形成化合物G,这是一个在无水溶剂中稳定的三环结构。在1 M HCl溶液中加热回流,G可以转化为H(C6H10O7),这是一个含六元环的天然糖类衍生物。H是肝素的构建骨架,肝素是在我们人体中产生的抗凝血多糖化合物。

8.3.1画出包含立体化学信息的化合物G的立体结构简式。
画出含有以稳定的六元环为骨架的H的立体结构简式。用波浪线表示与绝对立体构型不能确定的手性碳原子相连接的一根单键。
8.3.2给出答题纸中选择题的答案。
8.3.3给出答题纸中选择题的答案。
10.3866/PKU.DXHX201609001
,Email:jianpei@pku.edu.cn
