活度系数法测定A2B型难溶盐的溶度积——以Ag2SO4为例
2016-11-24朱金华饶秋华宋玉苏周子龙
李 瑜 朱金华 饶秋华 宋玉苏 周子龙 郑 炀
(海军工程大学理学院,武汉430033)
·化学实验·
活度系数法测定A2B型难溶盐的溶度积——以Ag2SO4为例
李瑜*朱金华饶秋华宋玉苏周子龙郑炀
(海军工程大学理学院,武汉430033)
实验假设水溶液中Ag+和的浓度非常低时,其活度无论处于同一体系还是在不同体系均相同。依此设计原电池,使该原电池的电池反应为,采用补偿法测量一定温度下此原电池中AgNO3溶液浓度和K2SO4溶液浓度发生变化时的电池电动势E。依据能斯特方程和Debye-Huckel极限公式,推导出原电池标准电动势E⊖与电解质的平均活度系数Y±及溶液浓度的关系,用外推法作图得到此电池反应的标准电动势E⊖。由平衡常数与原电池标准电动势的关系,得到Ag2SO4的溶度积Ksp(Ag2SO4)。
活度系数法;原电池;溶度积常数
www.dxhx.pku.edu.cn
溶度积是判断一定温度下难溶盐在水中形成沉淀和沉淀溶解倾向大小的一个重要常数[1]。难溶盐的溶度积常数是一个重要的数值,它是研究难溶盐沉淀的生成和溶解等问题一个重要依据,因此难溶盐溶度积的测定有重要意义。国内外普通化学和无机化学实验教材中,难溶盐溶度积的测定是必不可少的实验内容之一。常用测量溶度积的方法有离子交换法[2,3]、电位滴定法[4,5]、分光光度法[6,7]和电导率法[8,9]等,上述列举的溶度积测量方法都是比较传统和经典的方法,每种方法各有其优点,但又存在不足,有的实验方法操作难度较大,有的耗费时间过长,有的需要的实验条件苛刻且对环境造成较大污染。本文在作者前期采用活度系数法测定AB型难溶盐(以AgCl为研究对象)溶度积的研究基础上[10],对此方法进行进一步研究,以Ag2SO4为研究对象,尝试采用活度系数法测定A2B型难溶盐的溶度积,实验结果表明活度系数法能够用于测量A2B型难溶盐的溶度积。
1 活度系数法实验原理

式(1)中α(Ag+)为银离子的活度,为硫酸根的活度。假设水溶液中Ag+和的浓度非常低时,其活度无论处于同一体系还是在不同体系均相同,即在原电池中,使正极K2SO4溶液浓度与负极AgNO3溶液浓度之比为1:2,即b(K2SO4)=2b(AgNO3),则可假设这两种溶液中的和Ag+源自于难溶盐Ag2SO4的水解。若Ag2SO4水解的浓度为b(Ag2SO4),则有,γ+、γ-分别为正负离子的活度系数,b⊖=1 mol·kg-1,银离子的活度α(Ag+)=γ+2b(Ag2SO4)/b⊖,硫酸根离子活度,γ±为离子的平均活度系数,则式(1)可化为:
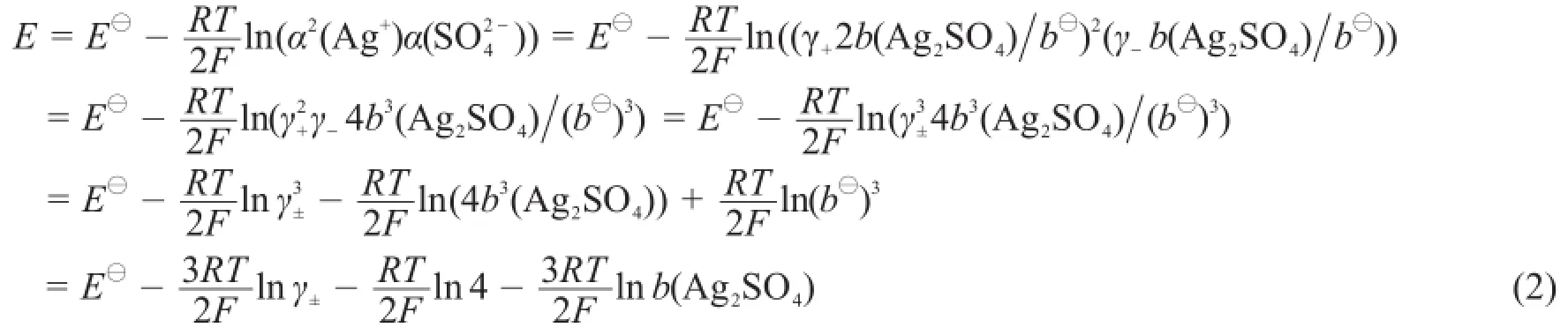
以H2O为溶剂,稀溶液在一定浓度范围内(溶质浓度在0.01-0.001 mol·kg-1之间),电解质溶液服从Debye-Huckel极限定律[11],溶液中正负离子平均活度系数γ±与离子强度I及正负离子所带电荷数z+、z-满足公式:

其中I为离子强度,对于A2B型电解质Ag2SO4,z+=1,z-=-2,

将式(4)代入式(3)中,得:

将式(5)代入式(2)中可得:
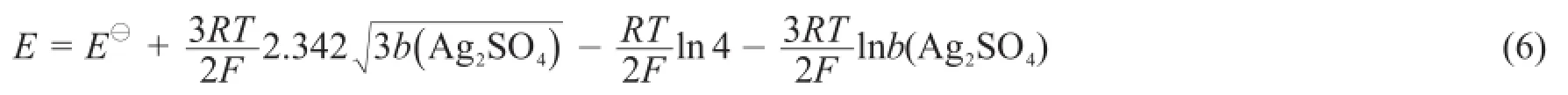
将式(6)改写为:
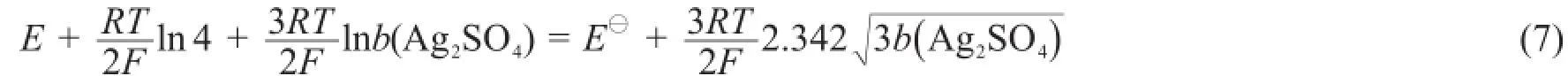
2 实验
2.1实验仪器及药品
弦线式电位差计(杭州大华仪器制造有限公司)、电桥电位差计实验板(实验室自制)、饱和标准电池(BC7型,常州儒林电子仪器厂)、多盘十进电阻器(ZX21型,金坛市儒林电子仪器厂)、双路直流稳压电源(自制)、银棒(实验室提供);硝酸银(分析纯,国药集团化学试剂有限公司)、硫酸钾(分析纯,天津市北联精细化学品开发有限公司)、KNO3盐桥(自制)。
2.2配制溶液
根据实验要求,从高到低依次配制0.10000、0.01000、0.00500、0.00250、0.00100、0.00050、0.00010、0.00005、0.00001 mol·L-1共9个浓度的硫酸钾溶液和9个对应浓度的硝酸银溶液:0.20000、0.02000、0.0100、0.00500、0.00200、0.00010、0.00020、0.00010、0.00002 mol·L-1。硝酸银溶液见光易分解,在实验前将配制好的硝酸银溶液用锡箔纸包裹。
2.3连接测量电路
本实验中原电池的电动势采用补偿法测量。按照实验电路(图1)[12]连接好测量电路;取一定浓度的K2SO4溶液30 mL倒入50 mL烧杯中,将对应浓度的AgNO3溶液30 mL倒入另一个用遮光纸包裹好的50 mL烧杯中,用连有导线的锯齿夹将打磨光洁的银棒夹好并分别放入两个烧杯中,形成原电池的两个电极;用硝酸钾盐桥将两电极连接起来,形成原电池;将原电池接入测量电路,完成原电池及测量体系的构建过程。连接好的实物如图2所示。
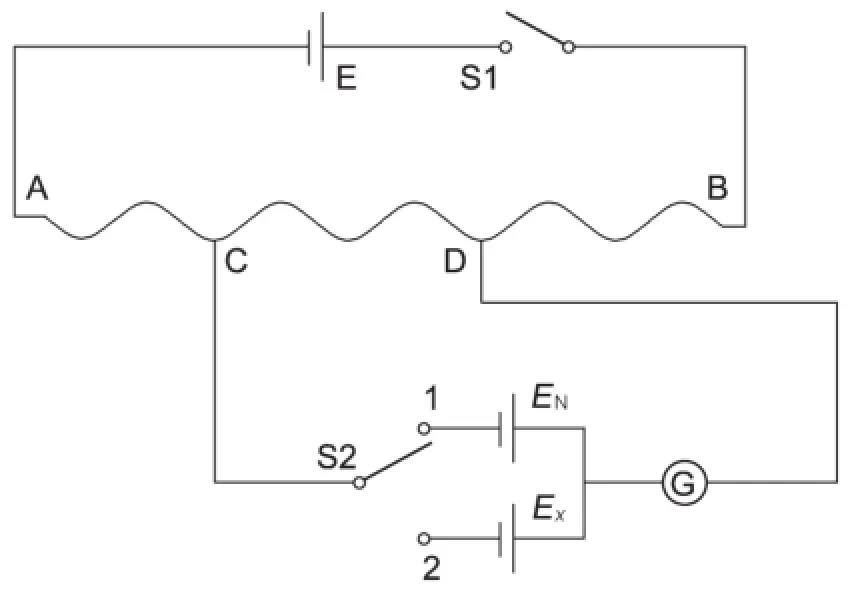
图1 补偿法测量电动势的原理图

图2 补偿法测量原电池电动势的实物连接图
2.4测量
在不改变工作回路的情况下,将滑动变阻器接入电路中的电阻调至最大。将开关拨向测量档,调节弦式电阻拨片的位置(测量前用万用表粗略测量原电池的电动势,估计拨片接头的位置),使检流计中无电流通过;慢慢将滑动电阻器减小至零,微调活动触头,保证检流计指针无偏转,记下此时电阻丝的长度,计算出未知电动势Ex。将此过程重复3次,做好数据记录。改变原电池两个电极烧杯中AgNO3和K2SO4溶液的浓度,测量电池电动势。
3 结果与讨论
3.1实验数据
实验记录的数据如表1所示,b为Ag2SO4的浓度,L0为弦式电阻丝测定标准电池所占分压电阻丝的长度,Lx为三次测量得到电阻丝长度的平均值,EN为标准电池的电动势,Ex为计算得到的电池电动势。
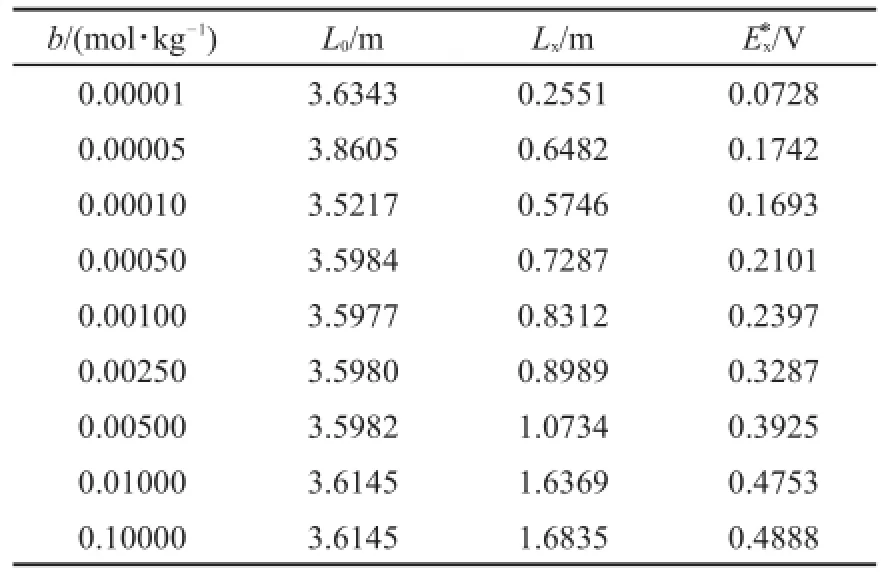
表1 实验记录数据(实验温度为14.5°C)
3.2实验数据分析
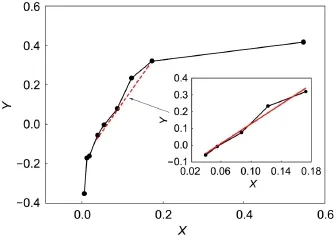
图3 不同浓度下Y与X的对应关系
实验结果如图3所示,依据本实验活度系数法理论依据——Debye-Huckel定律,溶质浓度在0.01-0.001 mol·kg-1之间Y与X应呈线性关系;从图中可看出,在此浓度范围内,Y与X呈线性关系(如图3中虚线所示),对此处于线性关系的5点进行多项式线性拟合(见图3内插图)得到线性关系式:Y=2.8954 X-0.1623,相关系数为0.9888。由活度系数法原理可知,此时可以求得在T=287.65 K时,此电池的标准电动势E⊖=-0.1623 V。本实验的目的是测定A2B型难溶盐Ag2SO4的溶度积常数Ksp(Ag2SO4),因此只需将实际测得的E⊖代入公式lnKsp=RTE⊖/zF,即可求得Ksp(Ag2SO4)。Ksp(Ag2SO4)的理论值[12,13]为1.20×10-5,依此理论值计算原电池电动势,实验测量的相对误差为:
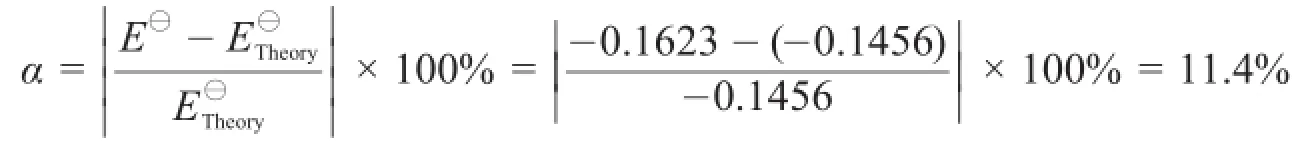
因此与理论值相比,本实验测定原电池电动势的相对误差α为11.4%。
本实验测量得到的Ag2SO4的溶度积常数为:
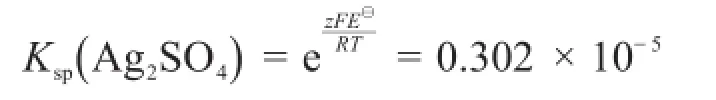
尽管实验结果与理论值相差较大,综合考虑本实验的影响因素非常多,作者认为,实验结果验证了本实验设计方法的正确性。
3.3误差分析
实验得到的Ag2SO4的溶度积值与理论值相差较大,综合分析导致实验结果存在较大偏差的原因如下:
1)数据处理误差:实验测量直接得到的数据是原电池的电动势,需要结合热力学和电化学的知识来计算溶度积,在此过程中要进行幂指数运算,不可避免会将误差放大。
2)仪器误差:实验所使用的仪器如弦线式电位差计、电子分析天平等的测量精度都达到了可控范围内的理想值,但还是有部分仪器因为老化降低了测量精度以及出厂时存在的固有误差等原因导致最后的实验结果与理论值存在差距。另外,本实验使用的KNO3盐桥在经历一次测量后,盐桥中的组成会发生微小变化,不能还原到初始状态,可能会对实验体系产生影响,对实验结果造成误差。实验设计原电池电极各导线之间的连接会产生接触电压,也会对实验结果产生影响。
3)操作误差:实验过程中实验人员的理论基础和操作水平以及对仪器使用的熟练程度都会给实验精度带来一定影响。比如,在制备一定浓度梯度的K2SO4或AgNO3溶液时,稀释过程中在容器壁上残留的K2SO4或AgNO3溶液,会降低实验测量数据的精度;另外,读数是本实验的一个重要环节,实验人员对各种玻璃仪器以及弦线式电位差计的读数都可能存在一定问题,比如读数视线不水平,估读出现主观误差等。除此之外,对实验过程中各种仪器试剂的准备处理可能做得不够,比如为了节省实验时间,在更换不同浓度的溶液进行实验时,对玻璃仪器的清洗不够彻底等,这些因素均会造成较大实验误差。
4)环境因素:实验过程中环境因素也会对实验的测量精度造成影响。本实验在测量不同原电池电极溶液浓度对应的电动势时,使用的方法是依次减小原电池电极溶液浓度,而随着原电池电极溶液浓度的不断降低,存在的不确定因素也就越来越多,这些因素对测定结果的影响也就越大。如配制溶液时所使用蒸馏水中的杂质离子、空气中的CO2会溶于溶液中,或者其他杂质等。另外,本实验使用了AgNO3,虽然在前期准备时对保存AgNO3溶液的容量瓶进行了包裹锡箔纸的处理,但在溶液的配制过程中以及取出溶液使用时都可能因为溶液见光导致部分AgNO3分解,也会对实验结果造成不良影响,降低实验数据的精确度。
4 结语
本论文研究采用活度系数法测定A2B型难溶盐Ag2SO4的溶度积。此方法假设水溶液中电解质浓度非常低时电解质电离出各离子的活度无论处于同一体系还是在不同体系中均相等,以此为基础设计的原电池,采用补偿法测量原电池的电动势,后依据化学热力学的知识,计算出Ag2SO4的溶度积。实验数据验证了本文提出的实验原理的正确性。分析整个实验过程可知,该实验设计原理简单,实验过程循序渐进、环环相扣;虽本实验结果的精度相对较低,但对误差分析中指出的部分进行改进后,可作为大学物理化学实验课程开设的一个综合设计性实验,以深化学生对原电池、溶度积、化学平衡等知识点的理解。
[1]秦剑.辽宁师专学报(自然科学版),2009,11(2),97.
[2]张卫,李梅,陈虹锦,马荔,谢少艾.实验室研究与探索,2014,33(12),163.
[3]陈莲英.化学工程与装备,2008,10(10),123.
[4]刘晓晖,黎源,黄德音.感光科学与光化学,2001,4(2),34.
[5]王国荣,袁万钟.大连理工大学学报,2008,48(6),800.
[6]龚正君,张新申,蒋晓萍,陈国和,肖新峰.皮革科学与工程,2004,14(5),38.
[7]黄方志,沈玉华,谢安建,叶桂生,胡乃梁.大学化学,2007,22(5),36.
[8]胡应喜.石油化工高等学校学报,1995,8(1),19.
[9]王美霞,江英志,马秀兰.广东化工,2013,40(2),107.
[10]李瑜,饶秋华,朱金华,宋玉苏.实验室科学,2016,19(3),34.
[11]傅玉普.物理化学简明教程.第3版.大连:大连理工大学出版社,2014.
[12]傅献彩,沈文霞,姚天扬,侯文华.物理化学.北京:高等教育出版社,2006.
[13]曲保中,朱炳林,周伟红.大学化学.北京:科学出版社,2012.
Solubility Product Determination of A2B Type Insoluble Salts by the Activity Coefficient Method:Taking Ag2SO4as an Example
LI Yu*ZHU Jin-HuaRAO Qiu-HuaSONG Yu-SuZHOU Zi-LongZHENG Yang
(College of Science,Naval University of Engineering,Wuhan 430033,P.R.China)
Taking the assumption that activity of silver ion and sulfate ion of very low concentration is constant in any aqueous solution,the primary cell was designed for the cell reaction of Ag2SO4(s)→2Ag+(aq)+(aq).The compensation method was used to obtain the electromotive force of the primary cell when the concentrations of AgNO3and K2SO4changed.The relationship between electromotive force and the mean activity coefficients of electrolytes as well as the solution concentration was deduced according to the Nernst equation and the limit Debye-Huckel formula.Standard electromotive forceE⊖was obtained by extrapolation.Finally,the solubility product of silver sulfate was calculated through the relationship between equilibrium constant and electromotive force of the primary cell.
The activity coefficient method;Primary cell;Solubility product
G64;O646.23
10.3866/PKU.DXHX201601035
,Email:55491983@qq.com
海军工程大学教学研究项目(2015JB-06,NUE2013224)
