GDF11对ApoE-/-糖尿病小鼠内皮依赖性血管舒张功能的作用
2016-11-24梅稳向光大卢俊颜李欢向林董靖
梅稳 向光大 卢俊颜 李欢 向林 董靖
基础研究
·论著·
GDF11对ApoE-/-糖尿病小鼠内皮依赖性血管舒张功能的作用
梅稳 向光大 卢俊颜 李欢 向林 董靖
目的研究生长分化因子11(GDF11)对载脂蛋白 E 基因敲除(ApoE-/-)糖尿病小鼠胸主动脉内皮依赖性血管舒张功能的影响,探讨其可能的机制。方法40只4周龄健康雄性ApoE-/-小鼠按随机数字法选择10只作为正常对照组(NC组),以正常饲料喂养,其余30只以高脂饲料喂养4周后,连续5 d腹腔注射链脲佐菌素(50 mg/kg)制备2型糖尿病模型。将造模成功小鼠共20只按随机数字法分为GDF11组(0.1 mg·kg-1·d-1腹腔注射,n=10)和糖尿病对照组(T2DM组,等量磷酸盐缓冲液腹腔注射,n=10)。干预4周后,检测各组空腹血糖、空腹胰岛素、HbA1c、GDF11浓度,并计算稳态模型评估-胰岛素敏感性指数(HOMA-ISI);测定各组小鼠离体胸主动脉条的张力反应及主动脉一氧化氮含量,Western印迹检测主动脉内皮型一氧化氮合酶(eNOS)、磷酸化eNOS(P-eNOS)、Smad2/3、磷酸化Smad2/3(P-Smad2/3)水平。结果与NC组相比,T2DM组空腹血糖、空腹胰岛素、HbA1c水平升高,GDF11浓度及HOMA-ISI降低,乙酰胆碱引起的内皮依赖性舒张反应降低;与T2DM组相比,GDF11组上述指标均有改善(F=70.923~675.430,P均<0.01)。而硝普钠诱导的内皮非依赖性舒张反应各组间差异无统计学意义(P>0.05)。与NC组相比,T2DM组血管中一氧化氮含量、P-eNOS水平、磷酸化Smad2/3水平下降,GDF11组上述指标均有显著升高(F=40.120~148.060,P均<0.01)。结论GDF11通过促进一氧化氮生成,激活Smad2/3信号通路,改善ApoE-/-糖尿病小鼠内皮依赖性血管舒张功能。
生长分化因子11;2型糖尿病;内皮依赖性血管舒张;一氧化氮
2型糖尿病(T2DM)与动脉粥样硬化(AS)关系密切,表现在患者出现AS的时间早、程度重、预后差。糖尿病能引起内皮功能紊乱,而内皮依赖性舒张功能紊乱是发生AS的一个早期标志,也是糖尿病多种血管并发症的病理基础[1]。生长分化因子11(GDF11),又名骨形态发生蛋白11,属于转化生长因子-β超家族成员之一。GDF11是一种在早期胚胎发育过程中起重要作用的蛋白,对多种器官发育起调控作用[2-4]。最近的研究发现,GDF11可以恢复衰老小鼠的神经干细胞再生和分化潜能,增加老年小鼠大脑血管腔体积和血流量,这种作用是通过直接促进内皮细胞增殖实现的[5]。本研究使用高脂饮食联合小剂量链脲佐菌素(STZ)腹腔注射诱导T2DM小鼠模型,并用GDF11进行干预,观察其对小鼠血管内皮依赖性舒张功能、一氧化氮浓度的影响,探讨GDF11的作用机制。
1 材料和方法
1.1 实验材料与试剂 高脂饲料购于北京华阜康公司。重组人GDF11(Pepro Tech公司)、STZ及去甲肾上腺素(Sigma公司)、血糖仪及试纸(强生公司)、胰岛素放射免疫检测试剂盒、HbA1c、GDF11 ELISA检测试剂盒(伊莱瑞特生物科技有限公司)、一氧化氮检测试剂盒(南京凯基)、氯化乙酰胆碱(上海阿拉丁公司)、一抗[单克隆兔抗人内皮型一氧化氮合酶(eNOS)、磷酸化eNOS(P-eNOS)、Smad2/3、磷酸化Smad2/3(P-Smad2/3)抗体]、二抗[单克隆山羊抗兔抗体(辣根过氧化物酶标记),美国CST公司)]、BL-420S生物信号采集系统、JH-2型张力换能器及HV-4恒温灌流系统均购买于成都泰盟公司。
1.2 实验方法
1.2.1 T2DM小鼠模型的建立 40只4周龄的SPF级雄性载脂蛋白E基因敲除(ApoE-/-)小鼠[批号为SCXK(京)2014-0004],按照随机数字法选择10只作为正常对照组(NC组),予以普通饲料喂养。其余30只准备造模,予以高脂饲料喂养。4周后准备造模小鼠禁食12 h,连续5 d腹腔注射STZ(50 mg/kg)进行T2DM造模,NC组仅腹腔注射等体积柠檬酸-柠檬酸钠缓冲液。注射1周后测腹腔葡萄糖耐量试验,以空腹血糖≥7.0 mmol/L和(或)餐后2 h血糖≥11.1 mmol/L为T2DM小鼠成模标准,共造模成功20只。
1.2.2 动物分组及干预 将造模成功的20只小鼠按照随机数字法分为糖尿病对照组(T2DM组,n=10)和GDF11组(n=10),GDF11组根据小鼠体重每天给予0.1 mg·kg-1·d-1的GDF11,连续4周腹腔注射[5]。NC组和T2DM组每天予以等量的磷酸盐缓冲液腹腔注射。
1.2.3 各组小鼠体重、空腹血糖、空腹胰岛素、HbA1c和GDF11浓度的测定 记录各组小鼠第4,10,14周时的体重。14周实验结束时,尾部取血测血糖,腹腔注射1%戊巴比妥钠60 mg/kg麻醉小鼠,皮肤消毒后开腹,下腔静脉采血,离心后取血清,ELISA检测胰岛素、HbA1c和GDF11浓度。计算稳态模型评估-胰岛素敏感性指数(HOMA-ISI)=1/(空腹血糖×空腹胰岛素)。
1.2.4 离体胸主动脉内皮舒张功能测定 每组取其中5只采过血的小鼠,迅速开胸,剪除肺脏组织,在体式显微镜下移除主动脉血管鞘及周围结缔组织,每只小鼠取出4段胸主动脉环,每段长约4 mm,将血管环悬于挂钩,置于37℃持续通95%O2+5%CO2混合气体的Krebs液中。在含Krebs液的恒温灌流槽中,下方以钢钩固定于槽底,上方通过JH-2张力换能器连接BL-420S生物信号采集系统记录张力变化。调整基础静息张力0.5 g,平衡1 h。血管环张力平衡后,向浴槽中加入终浓度为10-6mol/L的苯肾上腺素收缩主动脉环,待其收缩张力达到平顶后,依次加入终浓度分别为1×10-9,1×10-8,1×10-7,1×10-6,1×10-5,1×10-4mol/L的乙酰胆碱诱导血管舒张,同步记录每一浓度下主动脉环张力的变化,取4个环的平均张力,各浓度的内皮依赖性舒张反应为[(最大张力-各浓度点张力)/(最大张力-基础值)]×100%。冲洗血管重新平衡至基础张力,换用浓度为10-9~10-4mol/L的硝普钠测定血管内皮非依赖性舒张功能。
1.2.5 主动脉一氧化氮含量、eNOS、P-eNOS、Smad2/3、P-Smad2/3表达水平检测 每组剩余5只采过血的小鼠,取其主动脉的一半,加入1∶10冷生理盐水,匀浆后离心,取上清液,按一氧化氮检测试剂盒步骤测定。另外一半主动脉于液氮中冻存备测Western印迹。测定时,主动脉匀浆,测蛋白浓度后,各样本取50 μg蛋白上样于12%的PAGE胶电泳,电泳后转膜于 0.2 μm的硝酸纤维素膜,室温摇床封闭2 h,然后用相应特异性一抗[抗eNOS、P-eNOS(Ser1177)、Smad2/3、P-Smad2/3抗体]和辣根过氧化物酶标记的二抗处理,最后用增强的化学发光剂染色、显影。
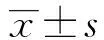
2 结果
2.1 各组体重、空腹血糖、空腹胰岛素和HbA1c的
比较 10周时,T2DM组体重低于NC组(F=4.635,P<0.05);14周时T2DM组和GDF11组体重低于NC组,但各组体重差异无统计学意义(P>0.05)。与NC组相比,GDF11组、T2DM组空腹血糖、空腹胰岛素、HbA1c均显著升高,HOMA-ISI显著下降(P均<0.01)。与T2DM组相比,GDF11组空腹血糖、空腹胰岛素、HbA1c均降低,HOMA-ISI上升(P均<0.01),见图1,表1。
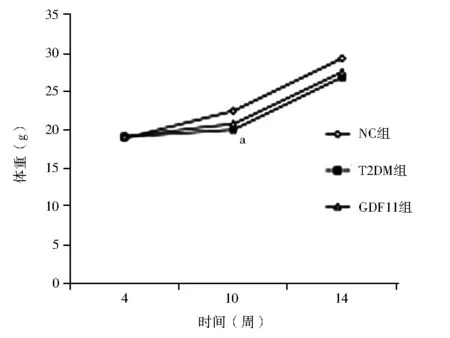
注:NC组:对照组;T2DM组:糖尿病对照组;GDF11组:GDF11干预组;GDF11:生长分化因子11;与NC组相比,aP<0.01图1 3组小鼠不同时间点体重的比较
2.2 各组GDF11浓度的比较 T2DM组血清GDF11浓度低于NC组,GDF11组血清GDF11浓度高于T2DM组,但仍低于NC组[NC组:(220.71±6.83) ng/L;T2DM组:(147.46±4.92) ng/L;GDF11组:(206.47±7.03) ng/L,F=675.430,P<0.01]。
2.3 GDF11对乙酰胆碱诱导的主动脉内皮依赖性舒张功能的影响 与NC组相比,T2DM组小鼠胸主动脉对乙酰胆碱诱导的内皮依赖性舒张反应显著下降[(92.32±2.17)%vs. 60.03±3.07)%,乙酰胆碱:10-4mmol/L,F=590.380,P<0.01],而对硝普钠诱导的内皮非依赖性舒张功能,差异无统计学意义;
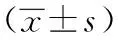
表1 3组小鼠14周时空腹血糖、空腹胰岛素、HbA1c和HOMA-ISI的比较
注:NC组:对照组;T2DM组:糖尿病对照组;GDF11组:GDF11干预组;GDF11:生长分化因子11;与NC组相比,aP<0.01,与T2DM组相比,bP<0.01;FPG:空腹血糖;FINS:空腹胰岛素;HOMA-ISI:稳态模型评估-胰岛素敏感性指数
与T2DM组相比,GDF11组上述指标得到改善[(80.85±3.26)%vs.(60.03±3.07)%,乙酰胆碱:10-4mmol/L,F=179.240,P<0.01],对硝普钠诱导的舒张反应差异仍无统计学意义[(93.31±4.13)%vs.(89.23±3.83)%vs.(90.59±3.27)%,硝普钠:10-4mmol/L,F=1.365,P>0.05],见图2。
2.4 各组小鼠主动脉一氧化氮含量和Western印迹结果 与NC组相比,T2DM组、GDF11组离体主动脉一氧化氮含量显著下降[NC组:(118.31±7.21) μmol/mg;T2DM组:(68.31±5.17) μmol/mg;GDF11组:(95.07±4.02) μmol/mg,P<0.01];与T2DM组相比,GDF11组一氧化氮含量显著升高(F=148.060,P<0.01)。Western印迹结果显示,与NC组相比,T2DM组P-eNOS/eNOS水平显著降低(P<0.01),而GDF11组P-eNOS/eNOS水平显著高于T2DM组,但低于NC组(F=40.123,P<0.01),见图3。与NC组和T2DM组相比,GDF11组P-Smad2/Smad2、P-Smad3/Smad3水平显著升高(P<0.01),而T2DM组P-Smad2/Smad2、P-Smad3/Smad3水平又显著低于NC组(F=48.472,50.957,P均<0.01),见图4。
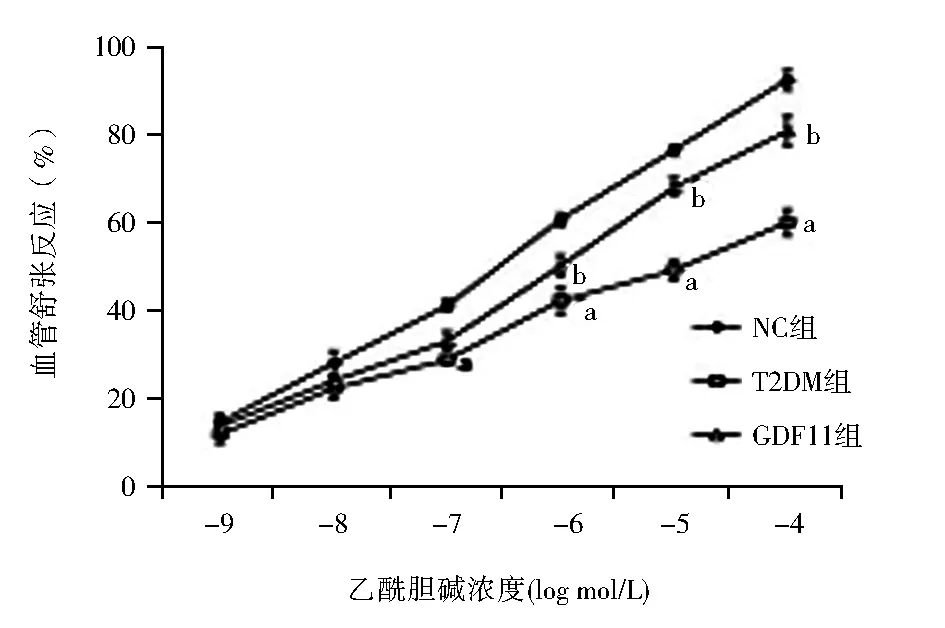
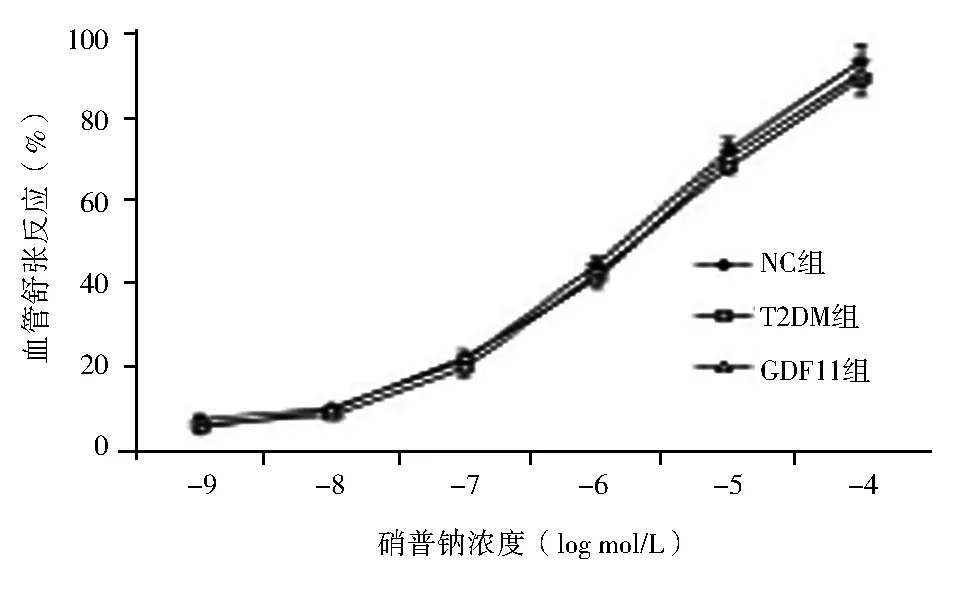
注:NC组:对照组;T2DM组:糖尿病对照组;GDF11组:GDF11干预组;GDF11:生长分化因子11;Ach:乙酰胆碱;SNP:硝普钠;与NC组相比,aP<0.05;与T2DM组相比,bP<0.05图2 3组小鼠主动脉对不同浓度Ach和SNP介导的血管舒张反应
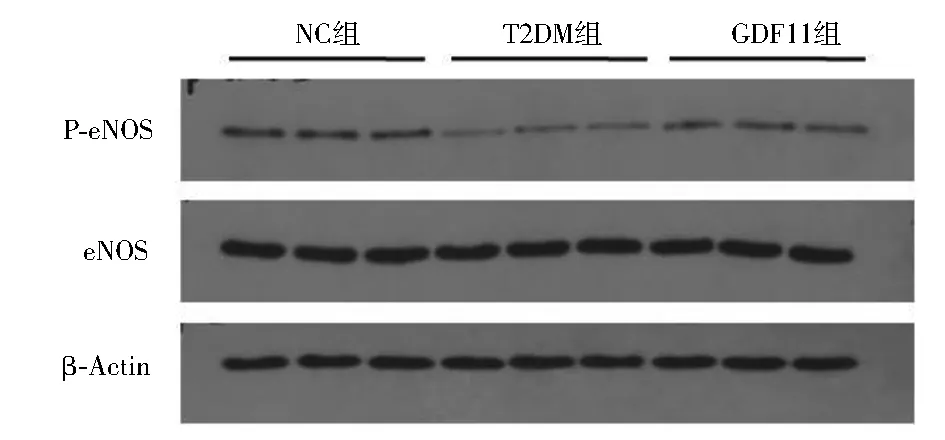
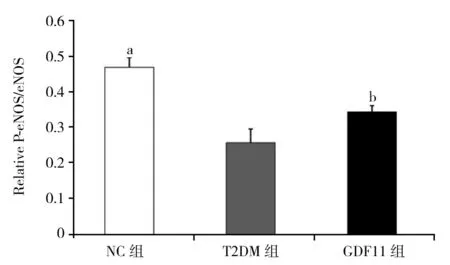
注:NC组:对照组;T2DM组:糖尿病对照组;GDF11组:GDF11干预组;GDF11:生长分化因子11;eNOS:内皮型一氧化氮合酶;P-eNOS:磷酸化内皮型一氧化氮合酶;与T2DM组、GDF11组相比,aP<0.01;与T2DM组相比,bP<0.01图3 GDF11对主动脉eNOS蛋白表达的影响
3 讨论
本研究提示,通过高脂饮食联合小剂量STZ进行T2DM造模,可以观察到T2DM组空腹血糖、空腹胰岛素和HbA1c水平较NC组明显上升,HOMA-ISI明显下降,提示胰岛素抵抗明显。胰岛素抵抗是糖尿病患者发生AS的独立危险因素。胰岛素抵抗可引起“糖毒性”、“脂毒性”及血管内皮功能障碍,加速AS进展[6]。研究观察到GDF11干预ApoE-/-糖尿病小鼠后,不仅空腹血糖、胰岛素和HbA1c较T2DM组有不同程度的下降,HOMA-ISI也有所改善,显示GDF11可以改善T2DM小鼠糖代谢水平,减轻胰岛素抵抗。因此,减轻胰岛素抵抗可能是GDF11改善血管内皮功能障碍的机制之一。
血管内皮功能障碍是包括AS在内的多种心血管疾病的早期病理生理改变[7]。通过测定以内皮依赖性舒张功能为代表的内皮功能,可早期预测疾病发生的风险及预后。同时它也可以用来评估药物是否具有心血管保护作用。本研究中,各组间非内皮依赖性舒张功能无明显区别,说明血管对乙酰胆碱引起舒张反应的差异是由内皮功能不同引起的。T2DM组内皮依赖性舒张功能下降,GDF11组内皮依赖性舒张功能得到改善,说明GDF11保护了血管内皮,即具有潜在的心血管保护作用。
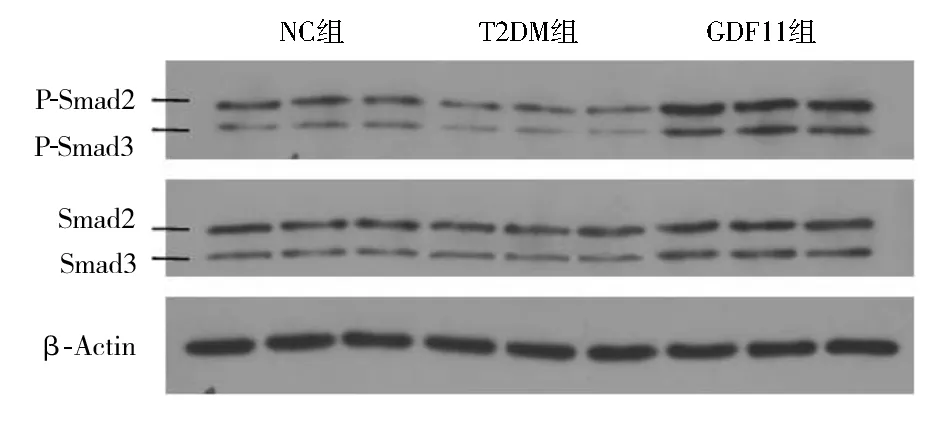
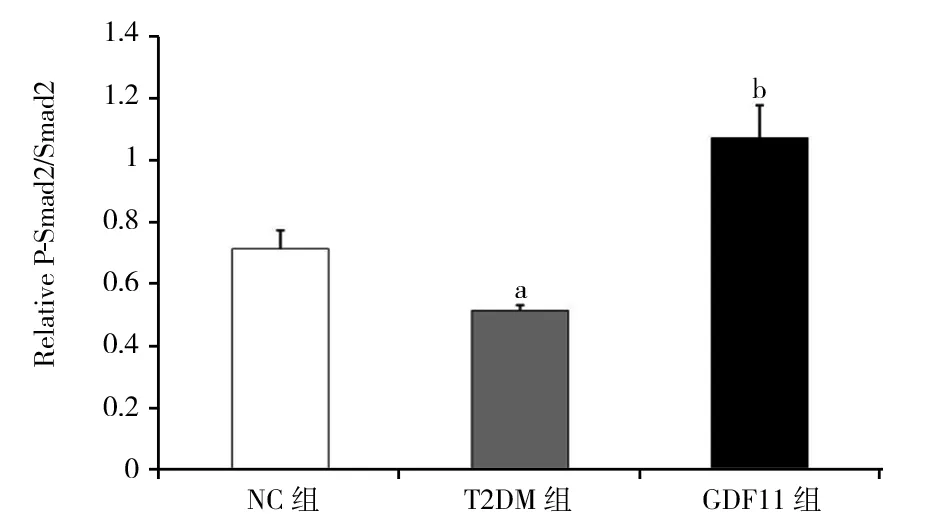
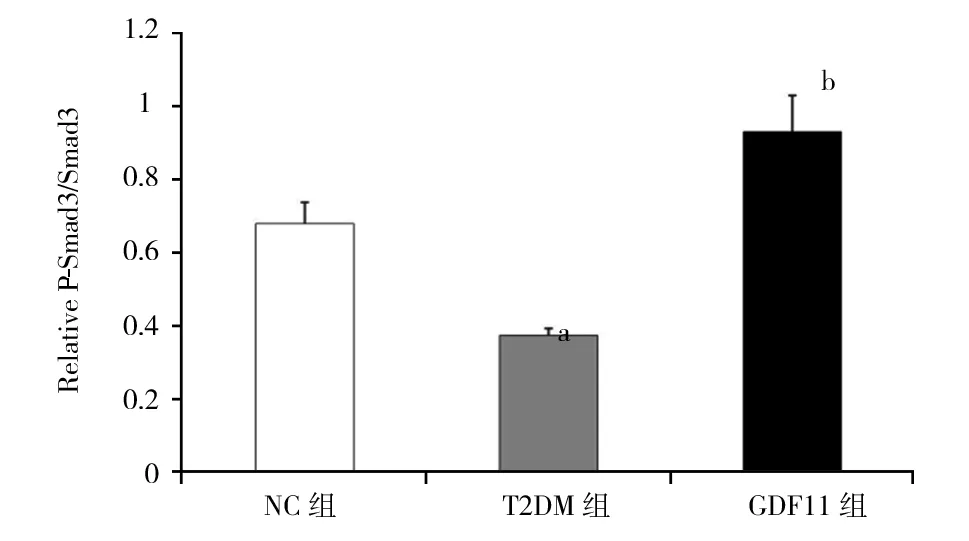
注:NC组:对照组;T2DM组:糖尿病对照组;GDF11组:GDF11干预组;GDF11:生长分化因子11;与NC组相比,aP<0.01;与NC组和T2DM组相比,bP<0.01图4 GDF11对主动脉Smad2/3蛋白表达的影响
在体内,调节内皮依赖性舒张功能的重要介质是一氧化氮,它是以左旋精氨酸为底物,由eNOS催化合成的[8]。eNOS主要在动、静脉内皮细胞表达,多种化学物质和病理生理刺激如乙酰胆碱、血管内皮生长因子、血糖、血脂等,参与调节eNOS的活性,从而影响一氧化氮的产生。一氧化氮对血管的正常功能起重要作用,调节内皮细胞的舒张、增殖、衰老和凋亡,还具有防止AS的作用[9-10]。本研究中,T2DM组的主动脉P-eNOS/eNOS下降,一氧化氮含量降低是导致其内皮功能障碍的主要原因。体内给予重组GDF11蛋白后,上调了eNOS的活性、增加了一氧化氮的产生,进一步证实了GDF11对糖尿病血管并发症的保护作用。
GDF11实现多种生物学功能的基础是先与胞膜上活动素ⅡA和ⅡB型受体结合,再磷酸化Ⅰ型受体ALK5,形成配体受体复合物作用于胞浆内的Smad2/3蛋白,活化的Smad2/3蛋白与通用型Smad4结合形成复合物,转移至细胞核,调节基因的转录、翻译和表达[11-12]。最近的研究指出,衰老小鼠血清GDF11水平下降,它能增加小鼠大脑血管体积和分支数,体外实验发现GDF11能够促进大脑毛细血管内皮细胞增殖,并且这种作用是通过磷酸化Smad2/3通路实现的[5,13]。此外,一个8.9年的随访研究发现,在稳定性冠心病患者中,血清GDF11水平低的患者发生心血管事件(如心肌梗死、卒中、心力衰竭入院、死亡)的风险高,说明GDF11对冠心病患者具有一定的保护作用[14-15]。本研究采用高脂饮食联合STZ制备T2DM模型,发现造模后,血清GDF11水平下降。T2DM小鼠外源性补充GDF11后,主动脉磷酸化Smad2、磷酸化Smad3水平升高,说明激活了血管内皮的Smad2/3通路,Smad2/3蛋白与Smad4蛋白结合转移至细胞核,调节多种基因包括eNOS基因的表达,从而保护了血管内皮。
综上所述,本研究证实GDF11可改善ApoE-/-糖尿病小鼠的内皮依赖性舒张功能,其机制是减轻胰岛素抵抗、上调eNOS活性、增加一氧化氮浓度和激活Smad通路。但GDF11蛋白对多种心血管疾病的具体作用和相关机制还需进一步研究。
[1] Molnar J, Yu S, Mzhavia N,et al. Diabetes induces endothelial dysfunction but does not increase neointimal formation in high-fat diet fed C57BL/6J mice[J].Circ Res,2005,96(11):1178-1184.
[2] Nakashima M, Toyono T, Akamine A,et al. Expression of growth/differentiation factor 11, a new member of the BMP/TGFbeta superfamily during mouse embryogenesis[J].Mech Dev,1999,80(2):185-189.
[3] McPherron AC, Lawler AM, Lee SJ. Regulation of anterior/posterior patterning of the axial skeleton by growth/differentiation factor 11[J].Nat Genet,1999,22(3):260-264.
[4] Esquela AF, Lee SJ. Regulation of metanephric kidney development by growth/differentiation factor 11[J].Dev Biol,2003,257(2):356-370.
[5] Katsimpardi L, Litterman NK, Schein PA,et al. Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors[J].Science,2014,344(6184):630-634. DOI: 10.1126/science.1251141.
[6] Bansilal S, Farkouh ME, Fuster V. Role of insulin resistance and hyperglycemia in the development of atherosclerosis[J].Am J Cardiol,2007,99(4A):6B-14B.
[7] Verma S, Buchanan MR, Anderson TJ. Endothelial function testing as a biomarker of vascular disease[J].Circulation,2003,108(17):2054-2059.
[8] Palmer RM, Ashton DS, Moncada S. Vascular endothelial cells synthesize nitric oxide from L-arginine[J].Nature,1988,333(6174):664-666.
[9] Moncada S, Palmer RM, Higgs EA. Nitric oxide: physiology, pathophysiology, and pharmacology[J].Pharmacol Rev,1991,43(2):109-142.
[10] Oemar BS, Tschudi MR, Godoy N,et al. Reduced endothelial nitric oxide synthase expression and production in human atherosclerosis[J].Circulation,1998,97(25):2494-2498.
[11] Oh SP, Yeo CY, Lee Y, et al. Activin type ⅡA and ⅡB receptors mediate Gdf11 signaling in axial vertebral patterning[J].Genes Dev,2002,16(21):2749-2754.
[12] Andersson O, Reissmann E, Ibáez CF. Growth differentiation factor 11 signals through the transforming growth factor-beta receptor ALK5 to regionalize the anterior-posterior axis[J].EMBO Rep,2006,7(8):831-837.
[13] Loffredo FS, Steinhauser ML, Jay SM,et al. Growth differentiation factor 11 is a circulating factor that reverses age-related cardiac hypertrophy[J].Cell,2013,153(4):828-839.DOI: 10.1016/j.cell.2013.04.015.
[14] Heidecker B, Olson K, Beatty A. Low levels of growth differentiation factor 11 and high levels of its inhibitor follistatin-like 3 are associated with adverse cardiovascular outcomes in humans[J]. J Am Coll Cardiol,2015,65(10S):A999.
[15] Olson KA, Beatty AL, Heidecker B,et al. Association of growth differentiation factor 11/8, putative anti-ageing factor, with cardiovascular outcomes and overall mortality in humans: analysis of the Heart and Soul and HUNT3 cohorts[J].Eur Heart J, 2015,36(48):3426-3434. DOI: 10.1093/eurheartj/ehv385.
EffectsofGDF11onendothelium-dependentvasodiationfunctionofaortainApoE-/-diabeticmice
MeiWen*,XiangGuangda,LuJunyan,LiHuan,XiangLin,DongJing.
*WuhanClinicalInstituteAffiliatedtoSouthernMedicalUniversity,Guangzhou510515,China
Correspondingauthor:XiangGuangda,Email:Guangda64@hotmail.com
ObjectiveTo explore the effects of growth differentiation factor 11 (GDF11) on endothelium-dependent vasodilation function of aorta in apolipoprotein E-Null (ApoE-/-) diabetic mice and to investigate the mechanisms.MethodsTen of the 40 healthy male ApoE-/-mice at 4-week age were selected as normal control group according to random number method and
basic diet, whereas the other 30 mice were fed with high-fat diet for 4 weeks and then treated with streptozotocin intraperitoneal injection (50 mg/kg) for 5 days to induce type 2 diabetes mellitus (T2DM). Diabetes was successfully induced in twenty mice which were then randomly divided into GDF11 group (0.1 mg·kg-1·d-1intraperitoneal injection,n=10) and T2DM control group (T2DM group, equivalent phosphate buffered saline,n=10) according to random number method. After 4 weeks of intervention, fasting plasma glucose, fasting plasma insulin, HbA1c and serum GDF11 were measured respectively. Homeostasis model assessment-insulin sensitive index (HOMA-ISI) was calculated. The relaxation response and nitric oxide levels were detected in isolated aorta of mice. Acetylcholine (Ach)-induced endothelium-dependent vasodilation and sodium nitroprusside (SNP) -induced endothelium-independent vasodilation were measured in aortas for estimating endothelial function. Endothelial nitric oxide synthase (eNOS), phosphorylated eNOS (P-eNOS) and Smad2/3, phosphorylated Smad2/3 (P-Smad2/3) were measured by Western blotting in isolated aorta of mice.ResultsCompared with NC group, fasting plasma glucose, fasting plasma insulin, and HbA1c were significantly increased, meanwhile HOMA-ISI, serum GDF11 concentration and Ach-dependent relaxation response were significantly reduced in T2DM group; compared with T2DM group, all markers mentioned above were improved in GDF11 group (F=70.923-675.430, allP<0.01); whereas the SNP-independent relaxation were not different among three groups (P>0.05). Compared with NC group, nitric oxide, P-eNOS, P-Smad2/3 were significantly decreased in T2DM group, but indexes mentioned above were all increased in GDF11 group (F=40.120-148.060, allP<0.01).ConclusionGDF11 improves endothelium-dependent vasodilation function in ApoE-/-diabetic mice by enhancing nitric oxide synthesis and Smad2/3 signaling pathways.
Growth differentiation factor 11;Type 2 diabetes mellitus; Endothelium-dependent vasodilation; Nitric oxide
国家自然科学基金资助项目(81370896)
10.3760/cma.j.issn.1673-4157.2016.02.007
510515 广州,南方医科大学附属武汉临床学院(梅稳,向光大,卢俊颜,李欢);430070 武汉,广州
军区武汉总医院内分泌科(向光大,向林,董靖)
向光大,Email: Guangda64@hotmail.com
FundprogramNational Natural Science Foundation of China (81370896)
2016-08-22)
