人参皂甙Rb1通过Rho/Rho激酶通路影响低氧诱导大鼠肺动脉平滑肌细胞增殖及SERT和5-HT1BR表达*
2016-11-24戴一洳叶玉柱林琪琪陈顺利林丽娜
林 碧, 张 琼, 戴一洳, 叶玉柱, 林琪琪, 陈顺利, 林丽娜
(温州医科大学附属第一医院,浙江 温州 325000)
人参皂甙Rb1通过Rho/Rho激酶通路影响低氧诱导大鼠肺动脉平滑肌细胞增殖及SERT和5-HT1BR表达*
林 碧, 张 琼, 戴一洳, 叶玉柱, 林琪琪, 陈顺利, 林丽娜△
(温州医科大学附属第一医院,浙江 温州 325000)
目的: 观察人参皂甙Rb1对低氧性大鼠肺动脉平滑肌细胞(PASMCs)5-羟色胺转运体(SERT)和5-羟色胺1B受体(5-HT1BR)表达及细胞增殖的影响,并探讨Rho/Rho激酶通路在其中的作用。方法: 分离并培养健康雄性SD大鼠PASMCs,随机分为常氧组(normal组)、低氧组(hypoxia组)以及低氧加50、100和200 mg/L人参皂甙Rb1组(HR50、HR100和HR200组),采用CCK-8、BrdU结合流式细胞术、Western blot及RT-PCR等方法,观察大鼠PASMCs的增殖程度以及SERT和5-HT1BR的mRNA和蛋白表达变化;另取PASMCs分为normal组、hypoxia组、HR200组和低氧加Y-27632组(HY组),检测Rho激酶(ROCK1)mRNA表达和肌球蛋白磷酸酶目标亚单位1(MYPT1)磷酸化水平。 结果: 与normal组比较,hypoxia组PASMCs增殖明显(P<0.01);与hypoxia组比较,人参皂甙Rb1可明显抑制 PASMCs的增殖(P<0.01),并浓度依赖性抑制SERT和5-HT1BR的mRNA与蛋白表达(P<0.05);HR200组可明显抑制ROCK1的mRNA表达和MYPT1磷酸化水平(P<0.01),与HY组相比较,差异无统计学显著性。结论: 低氧能诱导大鼠PASMCs增殖,上调SERT和5-HT1BR表达;人参皂甙Rb1能浓度依赖性抑制这种作用,其机制可能与抑制Rho/Rho激酶通路表达有关。
人参皂甙Rb1; 低氧; 肺动脉高压; 5-羟色胺转运体; 5-羟色胺1B受体; Rho激酶
肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)病理性增殖导致的肺血管重建是低氧性肺动脉高压(hypoxic pulmonary hypertension, HPH)的重要发展环节[1]。PASMCs表面的5-羟色胺转运体(serotonin transporter,SERT)和5-羟色胺1B受体(5-hydroxytryptamine 1B receptor,5-HT1BR)可通过直接转运或受体结合的方式,与促有丝分裂因子5-羟色胺(5-hydroxytryptamine,5-HT)相结合,从而激活不同的信号通路促进细胞增殖,而Rho/Rho激酶信号通路在近年来引起了人们的广泛关注[2-3]。人参皂甙Rb1(ginsenoside Rb1)能显著抑制大鼠颈动脉和胸主动脉平滑肌的增生及炎症反应[4-5]。并通过抑制ERK1/2通路缓解肺动脉高压的进展[6]。但是它对低氧性肺动脉平滑肌细胞表面的SERT、5-HT1BR以及Rho激酶的表达是否有影响尚无研究。本实验通过人参皂甙Rb1对低氧环境下PASMCs的干预,探索SERT、5-HT1BR以及Rho/Rho激酶信号通路对低氧肺动脉高压中肺血管重建的作用及机制,为人参皂甙Rb1在肺动脉高压的预防和治疗方面提供新理论。
材 料 和 方 法
1 动物和主要试剂
SPF级健康雄性SD大鼠15 只,体重180~220 g,购于温州医科大学实验动物中心。
高糖 DMEM 培养基、胎牛血清、胰酶和青-链霉素(Gibco);台盼蓝和胶原酶I(Sigma);人参皂甙Rb1(上海同田生物);FastQuant RT Kit(北京天根生化);Cell Counting Kit-8试剂盒(Dojindo);APC-BrdU细胞增殖试剂盒(南京凯基生物);BCA 蛋白定量试剂盒(Thermo);TRIzol试剂盒(Invitrogen);α-平滑肌肌动蛋白 (α-smooth muscle actin, α-SMA)小鼠单克隆抗体、FITC标记的羊抗小鼠IgG、辣根过氧化物酶标记的兔抗山羊II抗IgG和辣根过氧化物酶标记的山羊抗小鼠 II 抗IgG(Abcam);SERT小鼠抗大鼠单克隆抗体IgG和5-HT1BR 山羊抗大鼠多克隆抗体IgG(Santa Cruz);肌球蛋白磷酸酶目标亚单位1(myosin phosphatase target subunit 1,MYPT1)和磷酸化MYPT1(p-MYPT1)兔抗大鼠多克隆抗体IgG(Cell Signaling Technology)。引物由上海捷瑞生物工程有限公司设计合成。
2 主要方法
2.1 细胞分离、培养 大鼠经10%水合氯醛腹腔注射麻醉后处死,解剖显微镜直视下取2~4 级肺动脉,去内外膜剪成5 mm×5 mm大小的组织块,用0.2%胶原酶Ⅰ消化30 min,离心并转移到培养瓶内,加入含20%胎牛血清的DMEM培养液,置于37 ℃、5% CO2培养箱中静置培养。当PASMCs生长至培养瓶80%~90%时,用胰蛋白酶消化细胞进行传代培养,取第4~6代的细胞用于实验。
2.2 细胞鉴定 倒置相差显微镜观察PASMCs形态并摄片,激光共聚焦免疫荧光染色法鉴定细胞,采用α-SMA单克隆抗体(稀释度1∶100),4 ℃过夜后滴加FITC标记羊抗小鼠(稀释度1∶200)孵育。滴加DAPI核染液(1 mg/L),室温避光3~5 min,在激光共聚焦显微镜下以同一视野不同激发波长观察摄片,其中FITC的激发波长488 nm,发射光峰值630 nm;DAPI的激发波长488 nm,发射光峰值358 nm。
2.3 分组与处理 取第4~6代生长良好的对数生长期 PASMCs,胰酶消化至细胞悬液,按5×108/L 的密度接种于10 cm培养皿中,加入含 10%胎牛血清的 DMEM高糖培养基,置于 37 ℃、5% CO2普通培养箱中进行培养,待融合成单层细胞时(约80%铺满)换成无血清培养基饥饿培养24 h,使细胞同步化。进行随机分组。第1部分实验分为 常氧组(normal组: 37 ℃、21% O2、5% CO2)、低氧组(hypoxia组:37 ℃、3% O2、5% CO2)和低氧加人参皂甙Rb1(50 mg/L、100 mg/L和200 mg/L)组(HR50、HR100和HR200组),孵育24 h;第2部分实验分为常氧组(normal组: 37 ℃、21% O2、5%CO2)、低氧组(hypoxia组:37 ℃、3% O2、5% CO2)、低氧加人参皂甙Rb1 200 mg/L组(HR组)和低氧加Y-27632 10 μmol/L组(HY组)。
2.4 CCK-8法检测细胞活力 PASMCs 以5×107/L接种于96孔板,培养至铺满孔底面积80%~90%,PBS清洗后加DMEM同步化24 h;根据实验设计进行分组干预,每组设置6孔,并设空白组,培养24 h。取出96孔板,PBS清洗各组细胞,分别按每孔培养基总体积的10% 加入CCK-8试剂,在酶联免疫检测仪450 nm波长下检测各孔的吸光度(A)值。
2.5 BrdU-APC法检测细胞增殖程度 各组细胞中加入BrdU至终浓度为30 μmol/L,孵育30 min,吸去培养基,PBS清洗,胰酶消化10 min,按照APC-BrdU细胞增殖检测试剂盒说明书步骤,进行细胞收集、固定、通透、DNA变性及BrdU标记,上流式细胞仪检测(488 nm激发波长,520 nm发射波长)。
2.6 半定量RT-PCR法检测PASMCs SERT、5-HT1BR和ROCK1的mRNA表达 各组细胞用TRIzol一步法抽提总RNA,按照逆转录试剂盒说明书步骤,合成cDNA,测A260值。用PCR扩增目的片段。SERT的上游引物序列为5’-CCA CCT TCC CAT ACA TTG TCC TC -3’,下游引物序列为5’-TCT ACC CAC ACC CCT GTC TCC A-3’,PCR产物为130 bp;扩增条件为: 95 ℃ 5 min;94 ℃ 1 min, 64.7 ℃ 30 s, 72 ℃ 1 min, 72 ℃ 10 min,共35个循环。5-HT1BR的上游引物序列为5’-GCC CAG TTG ATA ACA GAC TCT CCA G -3’,下游引物序列为5’-GAG ACT CGC ACT TTG ACT TGG TTC-3’, PCR产物为125 bp; ROCK1的上游引物序列为5’-TTA TGA AGT AGT AAA GGT AAT CGG C-3’,下游引物序列为5’-AGG TAT TCC AAC TGC TGT ATC-3’, PCR产物为 490 bp;扩增条件为: 94 ℃ 2 min;94 ℃ 30 s, 54.7 ℃ 1 min, 72 ℃ 2 min, 72 ℃ 2 min,共35个循环;β-actin的上游引物序列为5’-CGT TGA CAT CCG TAA AGA C-3’,下游引物序列为5’-TGG AAG GTG GAC AGT GAG-3’, PCR产物为201 bp;扩增条件为: 94 ℃ 2 min;94 ℃ 30 s, 63.0 ℃ 1 min, 72 ℃ 2 min, 72 ℃ 5 min,共30个循环。PCR扩增产物经1.5%琼脂糖凝胶电泳(含溴化乙锭 0.5 g/L),在UV-800凝胶成像分析系统紫外灯下观察结果并拍摄,以目的条带平均灰度值与β-actin的平均灰度值比值来表示目的mRNA表达的相对强度。
2.7 Western blot法检测PASMCs SERT、5-HT1BR和ROCK1的蛋白含量 加入细胞裂解液100 μL,冰上裂解30~50 min,12 000 r/min,4 ℃ 离心20 min,取上清液以BCA法测定蛋白浓度。用10% SDS-PAGE分离蛋白,再经湿转(300 mA,70 min)至PVDF膜上,5%脱脂奶粉封闭1 h。加入小鼠抗大鼠SERT(1∶500)、山羊抗大鼠5-HT1BR(1∶500)、兔抗大鼠p-MYPT1(1∶500)、兔抗大鼠MYPT1(1∶500)和兔抗大鼠GAPDH(1∶1 000),4℃孵育过夜。兔抗山羊 II 抗(1∶10 000)、山羊抗小鼠 II 抗(1∶15 000)和山羊抗兔II抗(1∶10 000)孵育1 h,TBST清洗3次,每次10 min。ECL化学发光法覆盖条带,全自动曝光机曝光。Quantity One凝胶软件分析系统测定各目的条带的平均灰度值,以SERT和5-HT1BR与GAPDH的灰度值比值表示相对含量。p-MYPT1/MYPT1表示MYPT1的活性。
3 统计学处理
应用 SPSS 17.0软件进行统计学分析。计量资料进行正态性检验,数据以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析(one-way ANOVA),方差齐则采用Bonferroni校正的t检验进行两两比较,方差不齐者采用Dunnett’s检验。以P<0.05 为差异有统计学意义。
结 果
1 激光共聚焦免疫荧光法鉴定PASMCs
原代PASMCs培养48~72 h后,可在Olympus倒置相差显微镜下观察到细胞呈长梭形或三角形生长,大小不一,重叠交织排铺。培养至5~7 d,培养皿内细胞密度低处呈网格状,密度高处呈栅栏状,呈现出平滑肌细胞特有的“峰 -谷”状生长,见图1。培养至第4~6代的PASMCs经α-SMA单克隆抗体孵育、FITC标记的 II抗染色、DAPI细胞核复染后,在激光共聚焦显微镜下观察,98%的PASMCs表达阳性。FITC标记的α-SMA呈现绿色荧光,以纤维细丝状排列;DAPI染色的细胞核呈卵圆形,发蓝色荧光,见图2。

Figure 1.Primary culture of rat PASMCs (×100).
图1 大鼠原代培养肺动脉平滑肌细胞
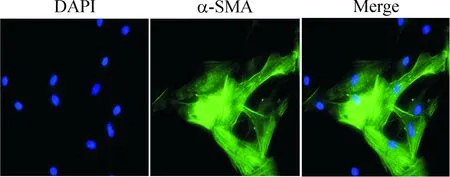
Figure 2.Immunofluorescence identification of rat PASMCs [α-smooth muscle actin (α-SMA) immunofluorescence staining, ×400)].
图2 大鼠肺动脉平滑肌细胞α-平滑肌肌动蛋白免疫荧光染色
2 不同浓度人参皂甙Rb1对低氧PASMCs活力的影响
CCK-8法结果显示,与normal组比较,hypoxia组细胞活力明显增加(P<0.01)。HR50组、HR100组和HR200组呈浓度依赖性抑制PASMCs的细胞活力,其对低氧PASMCs的抑制率分别为13.2%、19.0%和24.2%,且HR200组与HR50组比较差异有统计学显著性(P<0.05)。Y-27632组对低氧PASMCs的抑制率为27.0%,见图3。
3 各组PAMSCs BrdU阳性细胞数的变化
通过流式细胞术检测,各组细胞均可检测到BrdU阳性细胞。相比normal组,hypoxia组BrdU阳性细胞比例明显增高(P<0.01)。HR50组、HR100组、HR200组和HY组的BrdU阳性细胞比例依次降低,且HR200组与HR50组比较差异有统计学显著性(P<0.05),见图4。
4 各组PASMCs SERT、5-HT1BR和ROCK1 mRNA的表达变化
与normal组比较,hypoxia组的SERT、5-HT1BR和ROCK1 mRNA表达均升高(P<0.01);与hypoxia组比较,HR组的SERT和5-HT1BR mRNA表达均明显下调 (P<0.01);且与HR50组比较,HR100和HR200组的SERT 和5-HT1BR mRNA表达均显著降低(P<0.01)。HR200组的ROCK1 mRNA表达比hypoxia组明显下降,但与HY组相比差异无统计学显著性,见图5。

Figure 3.The changes of cell viability in all groups. Mean±SD.n=6.**P<0.01vsnormal group;##P<0.01vshypoxia group;△P<0.05vsHR50 group.
图3 各组细胞活力的比较

Figure 4.The changes of BrdU positive cells in all groups. Mean±SD.n=4.**P<0.01vsnormal group;##P<0.01vshypoxia group;△P<0.05vsHR50 group.
图4 各组BrdU阳性细胞比例的比较
5 各组PASMCs SERT和5-HT1BR蛋白表达及MYPT1磷酸化水平的变化
与normal组比较,hypoxia组的SERT和5-HT1BR 蛋白表达量明显升高(P<0.05)。与hypoxia组比较,HR组的SERT和5-HT1BR 蛋白表达均明显下调 (P<0.01);与HR50组比较,HR100组和HR200组的SERT和5-HT1BR蛋白表达均显著降低(P<0.01)。HR200组的MYPT1磷酸化水平比hypoxia组明显下降,但与HY组相比差异无统计学显著性,见图6。
讨 论
缺氧性血管收缩和肺血管结构重建是肺动脉高压形成的重要因素,而由肺动脉平滑肌细胞增殖、迁移以及细胞外基质异常沉积是肺血管结构重构的基础,也是肺动脉高压形成的中心环节。在低氧环境,血小板对具有血管活性和促有丝分裂作用的5-HT释放增加,并且5-HT的再摄取和被单胺氧化酶(monoamine oxidase,MAO)降解的过程受到抑制。PASMCs表面的SERT和5-HT1BR与5-HT相结合,诱发细胞内一系列相关信号转导机制,调节PASMCs的增殖和收缩,参与肺动脉高压的形成。缺氧可使低氧诱导因子-1、c-Jun和c-Fos表达大量增加,并与SERT基因启动序列的2个激活蛋白-1位点相结合而介导SERT的表达[7],继而活化蛋白酪氨酸激酶使核苷酸交换因子转移到细胞膜,Ras蛋白转化为活性形式Ras-GTP后激活下游信号促进细胞增殖[8]。低氧刺激下PASMCs的5-HT1BR表达增加且受体密度也明显增高[9],可能通过G蛋白偶联抑制腺苷酸环化酶活性使cAMP生成减少,诱发DNA合成和细胞增殖[10]。
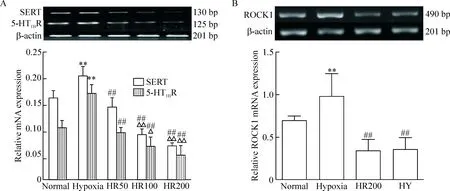
Figure 5.The changes of SERT, 5-HT1BR and ROCK1 mRNA expression in the PASMCs with different treatments. Mean±SD.n=6.**P<0.01vsnormal group;##P<0.01vshypoxia group;△P<0.05,△△P<0.01vsHR50 group.
图5 各组PASMCs SERT、5-HT1BR和ROCK1 mRNA的表达

Figure 6.The changes of SERT, 5-HT1BR and p-MYPT1 protein levels in the PASMCs with different treatments. Mean±SD.n=6.*P<0.05vsnormal group;##P<0.01vshypoxia group;△△P<0.01vsHR50 group.
图6 各组PASMCs SERT、5-HT1BR和p-MYPT1蛋白水平的比较
本实验显示,PASMCs在低氧培养24 h后迅速增殖,SERT和5-HT1BR的mRNA及蛋白表达也均较常氧组明显增加,经不同浓度人参皂甙Rb1处理后,无论是细胞增殖情况还是SERT和5-HT1BR的mRNA及蛋白表达水平均呈浓度依赖性下调,其中以200 mg/L浓度抑制效果最佳。这说明人参皂甙Rb1可能通过抑制SERT和5-HT1BR的表达,缓解PASMCs的增殖。人参皂甙Rb1是人参、三七等传统中药的主要药理活性成分,对心血管系统、免疫系统等方面有良好的保护作用,同时也是一类重要的植物雌激素,它可通过特异性与雌激素受体-β结合发挥抗血管平滑肌细胞增殖和抗炎的作用[5]。研究表明,卵巢切除的恒河猴经雌激素干预后,SERT mRNA在中缝核的表达水平明显下降[11],雌二醇处理后的大鼠海马区SERT的结合位点显著降低[12]。Hiroi等[13]也发现,雌激素可选择性降低大鼠中缝背核区域5-HT1BR的mRNA表达。
人参皂甙Rb1抑制SERT和5-HT1BR表达及PASMCs增殖,从而改善HPH的机制尚不清楚。近年来研究表明,Rho/Rho激酶信号通路在HPV发展中起到重要作用。RhoA是Ras单体GTP酶超家族的一员,在外界信号刺激下,RhoA由失活的GDP 结合状态转化为活化的GTP 结合状态, 并将信号传递给下游效应分子Rho激酶(ROCK)。活化的ROCK通过磷酸化肌球蛋白轻链磷酸酶(myosin light chain phosphatase,MLCP)的亚单位MYPT1,抑制MLCP活性从而增强肌球蛋白轻链(MLC)的磷酸化。胞浆磷酸化MLC水平上升,引起细胞肌动蛋白微丝骨架聚合状态改变,影响细胞的移动、黏附、增殖、基因表达等。因此MYPT1磷酸化水平代表了ROCK的活化程度。而ROCK特异性抑制剂Y-27632可增加停留在G0/G1期的血管平滑肌细胞的相对百分数[14],降低低氧诱导的右室肥厚,逆转血管重建[15]。本实验结果显示低氧明显诱导了ROCK1的mRNA表达,MYPT1磷酸化水平相应上升,同时PASMCs增殖明显。应用200mg/L的人参皂甙Rb1干预后,无论是ROCK1 mRNA还是p-MYPT1水平均显著下降,并有效抑制了大鼠PASMCs的增殖,且抑制程度与Y-27632比较,差异没有统计学显著性。说明Rho/Rho激酶信号通路在低氧诱导的大鼠PASMCs增殖中发挥重要作用,而人参皂甙Rb1减轻大鼠PASMCs增殖,很有可能与抑制Rho/Rho激酶信号通路有关。Oka等[16]发现无论处于短时还是长期缺氧状态,大鼠肺组织p-MYPT1水平均上升。缺氧环境中大鼠PASMCs的MLC磷酸化水平持续升高,且与Rho激酶活化有关[17]。PAH患者的肺组织、血小板、PASMCs的RhoA/ROCK活性亦明显上升,ROCK能通过调节细胞周期蛋白的表达或活性,调节细胞周期,促进细胞增殖[18]。
通过本实验,发现人参皂甙Rb1可降低低氧性大鼠PASMCs SERT和5-HT1BR的mRNA和蛋白表达,进而降低Rho/Rho激酶关键蛋白MYPT1的磷酸化水平,从而抑制肺动脉平滑肌细胞的增殖。但从Rho激酶活化到抑制细胞增殖过程中是否还存在其它重要信号蛋白,仍需深入研究。
[1] Wang YX, Wang J, Wang C, et al. Functional expression of transient receptor potential vanilloid-related channels in chronically hypoxic human pulmonary arterial smooth muscle cells[J]. J Membrane Biol, 2008, 223(3):151-159.
[2] Liu Y, Suzuki YJ, Day RM, et al. Rho kinase-induced nuclear translocation of ERK1/ERK2 in smooth muscle cell mitogenesis caused by serotonin[J]. Circ Res, 2004, 95(6):579-586.
[3] Satoh K, Fukumoto Y, Shimokawa H. Rho-kinase: important new therapeutic target in cardiovascular diseases[J]. Am J Physiol Heart Circ Physiol, 2011, 301(2):H287-H296.
[4] Zhang S, Deng J, Gao Y, et al. Ginsenoside Rb 1 inhibits the carotid neointimal hyperplasia induced by balloon injury in rats via suppressing the phenotype modulation of vascular smooth muscle cells[J]. Eur J Pharmacol, 2012, 685(1):126-132.
[5] Li QY, Chen L, Fu WH, et al. Ginsenoside Rb1 inhibits proliferation and inflammatory responses in rat aortic smooth muscle cells[J]. J Agric Food Chem, 2011, 59(11):6312-6318.
[6] 宋张娟, 唐兰兰, 黎关龙, 等. 三七皂苷单体Rb1在低氧高二氧化碳肺动脉收缩中的保护作用及机制[J]. 中国中西医结合杂志, 2012, 32(10):1380-1384.
[7] Bengel D, Heils A, Petri S, et al. Gene structure and 5′-flanking regulatory region of the murine serotonin transporter[J]. Mol Brain Res, 1997, 44(2):286-292.
[8] 汤娜娜, 刘先胜, 徐永健, 等. 活性氧和ERK1/2信号通路在缺氧大鼠肺动脉平滑肌细胞增殖和凋亡中的作用[J]. 中国病理生理杂志, 2009, 25(1):36-41.
[9] 王佳兴, 康发宽, 肖 军, 等. 低氧性肺动脉高压大鼠肺内5-HT1B受体的分布和表达变化[J]. 中国病理生理杂志, 2010, 26(8):1579-1583.
[10]葛付超, 高 芬. 5-羟色胺/5-羟色胺转运体在低氧性肺动脉高压形成中的作用[J]. 现代临床医学, 2011, 37(3):163-165.
[11]Bethea CL, Mirkes SJ, Su A, et al. Effects of oral estrogen, raloxifene and arzoxifene on gene expression in serotonin neurons of macaques[J]. Psychoneuroendocrinology, 2002, 27(4):431-445.
[12]Mendelson SD, McKittrick CR, McEwen BS. Autoradiographic analyses of the effects of estradiol benzoate on [3H] paroxetine binding in the cerebral cortex and dorsal hippocampus of gonadectomized male and female rats[J]. Brain Res, 1993, 601(1-2):299-302.
[13]Hiroi R, Neumaier JF. Estrogen decreases 5-HT1Bautoreceptor mRNA in selective subregion of rat dorsal raphe nucleus: inverse association between gene expression and anxiety behavior in the open field[J]. Neuroscience, 2009, 158(2):456-464.
[14]Chen XY, Dun JN, Miao QF, et al. Fasudil hydrochloride hydrate, a Rho-kinase inhibitor, suppresses 5-hydroxy-tryptamine-induced pulmonary artery smooth muscle cell proliferation via JNK and ERK1/2 pathway[J]. Pharmacology, 2009, 83(2):67-79.
[15]Xu EZ, Kantores C, Ivanovska J, et al. Rescue treatment with a Rho-kinase inhibitor normalizes right ventricular function and reverses remodeling in juvenile rats with chronic pulmonary hypertension[J]. Am J Physiol Heart Circ Physiol, 2010, 299(6):H1854-H1864.
[16]Oka M, Homma N, Taraseviciene-Stewart L, et al. Rho kinase-mediated vasoconstriction is important in severe occlusive pulmonary arterial hypertension in rats[J]. Circ Res, 2007, 100(6):923-929.
[17]Wang Z, Jin N, Ganguli S, et al. Rho-kinase activation is involved in hypoxia-induced pulmonary vasoconstriction[J]. Am J Respir Cell Mol Biol, 2001, 25(5):628-635.
[18]Guilluy C, Eddahibi S, Agard C, et al. RhoA and Rho kinase activation in human pulmonary hypertension: role of 5-HT signaling[J]. Ame J Respir Crit Care Med, 2009, 179(12):1151-1158.
(责任编辑: 林白霜, 罗 森)
Effect of ginsenoside Rb1 on proliferation and serotonin transporter and 5-HT1BR expression in hypoxia-induced rat pulmonary artery smooth muscle cells via Rho/Rho-kinase pathway
LIN Bi, ZHANG Qiong, DAI Yi-ru, YE Yu-zhu, LIN Qi-qi, CHEN Shun-li, LIN Li-na
(TheFirstAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China.E-mail:wzlinlina@163.com)
AIM: To observe the effect of ginsenoside Rb1 on the proliferation and the expression of serotonin transporter (SERT), 5-hydroxytryptamine 1B receptor (5-HT1BR) in rat pulmonary artery smooth muscle cells (PASMCs) under hypoxia condition and the relationship with Rho/Rho-kinase signal pathway. METHODS: PASMCs were isolated from the adult male SD rats and primarily cultured. The subcultured cells from the 4th generation to the 6th generation were harvested and divided into normal group, and hypoxia group, different concentrations of Rb1 incubation groups treated with 50, 100 and 200 mg/L ginsenoside Rb1 under hypoxia (HR50, HR100 and HR200 groups, respectively). The viability of the PASMCs was measured by CCK-8 assay. BrdU positive cells were determined using flow cytometry. The expression of serotonin transporter and 5-HT1BR at mRNA and protein levels was detected by RT-PCR and Western blot, respectively. The PASMCs were randomly divided into normal group, hypoxia group, HR200 group and hypoxia+Y-27632 incubation group (HY group). The mRNA expression of Rho-kinase and phosphorylated myosin phosphatase target subunit 1 (p-MYPT1) protein level were investigated by RT-PCR and Western blot, respectively. RESULTS: Compared with normal group, the proliferation of PASMCs in hypoxia group was significantly increased (P<0.01). The cell viability and the expression of SERT and 5-HT1BR at mRNA and protein levels in all different concentrations of Rb1 groups were obviously decreased compared with hypoxia group (P<0.05). The mRNA expression of Rho-kinase and protein level of p-MYPT1 were markedly decreased in HR200 group, and no significant difference compared with HY group was observed (P<0.01). CONCLUSION: Treatment with ginsenoside Rb1 might prevent hypoxia-induced proliferation of PASMCs and over-expression of SERT and 5-HT1BR through inhibiting the Rho/Rho-kinase pathway.
Ginsenoside Rb1; Hypoxia; Pulmonary hypertension; Serotonin transporter; 5-hydroxytryptamine 1B receptor; Rho-kinase
1000- 4718(2016)10- 1848- 06
2016- 05- 30
2016- 08- 18
浙江省中医药科技计划重点项目(No. 2008ZA017)
△通讯作者 Tel: 0577-55579097; E-mail: wzlinlina@163.com
R363.2
A
10.3969/j.issn.1000- 4718.2016.10.018
杂志网址: http://www.cjpp.net
