维拉帕米逆转乳头状甲状腺癌对多柔比星抗性中的L-Ca2+/calpain信号转导机制*
2016-11-24汪军兵丁向东郑媛媛梁莹莹李光明江明亮
汪军兵, 丁向东, 郑媛媛, 梁莹莹, 王 浩, 李光明, 江明亮, 董 军△
(1广州市番禺区中心医院,广东 广州 511400; 2广州金域医学检验中心有限公司,广东 广州 510330; 3暨南大学医学院,广东 广州 510632)
维拉帕米逆转乳头状甲状腺癌对多柔比星抗性中的L-Ca2+/calpain信号转导机制*
汪军兵1, 2▲, 丁向东2▲, 郑媛媛3, 梁莹莹1, 王 浩1, 李光明3, 江明亮3, 董 军3△
(1广州市番禺区中心医院,广东 广州 511400;2广州金域医学检验中心有限公司,广东 广州 510330;3暨南大学医学院,广东 广州 510632)
目的: 探讨维拉帕米逆转乳头状甲状腺癌对多柔比星抗性的L型钙离子通道/钙蛋白酶(L-Ca2+/calpain)信号转导通路机制。方法: 以培养2 d的人乳头状甲状腺癌TPC-1细胞为实验对象,首先以CCK-8分析法测定细胞存活率对维拉帕米和多柔比星进行配伍试验,确定合适的药物作用浓度及时间。然后将细胞分为空白对照组、多柔比星组、维拉帕米组和多柔比星+维拉帕米组。以全细胞膜片钳技术记录TPC-1细胞的L-Ca2+通道电流,以Western blot法测定蛋白calpain 1及LC3的表达水平。结果: 多柔比星组、维拉帕米组与空白对照组相比,L-Ca2+通道电流密度减小(P<0.05);多柔比星+维拉帕米组与多柔比星组相比,L-Ca2+通道电流密度减小(P<0.01)。多柔比星组、维拉帕米组与空白对照组相比,calpain 1蛋白表达减弱(P<0.05);多柔比星+维拉帕米组与多柔比星组相比,calpain 1蛋白表达减弱(P<0.05)。多柔比星组和维拉帕米组与空白对照组相比,LC3蛋白表达增强(P<0.05);多柔比星+维拉帕米组与多柔比星组相比,LC3蛋白表达增强(P<0.01)。结论: TPC-1细胞抗多柔比星可能与其自噬活性增强有关;维拉帕米能进一步增强细胞自噬活性,致自噬性细胞死亡,从而对抗TPC-1细胞对多柔比星的抗性,其机制可能与自噬的L-Ca2+/calpain 1信号转导通路有关。
自噬; 抗性; L型钙离子通道; 钙蛋白酶; 乳头状甲状腺癌
全世界范围内,甲状腺癌在过去的几十年间呈持续增长态势,乳头状甲状腺癌(papillary thyroid carcinoma,PTC)是最常见的甲状腺恶性肿瘤,占甲状腺恶性肿瘤的85%~90%[1]。PTC生物学行为表现为易转移、易复发,约有20%~50%的PTC患者早期即发生颈部淋巴结转移,14%的PTC患者复发[2]。对于进展型PTC转移及复发的患者,目前手术及放疗难以根治,因此找到一个好的根治方法的任务就显得尤为迫切。
进展型PTC通常在放疗后使用多柔比星进行化疗,不幸的是,PTC对多柔比星的化疗高度抵抗[3-4]。文献显示PTC对多柔比星抗性的产生与PTC自噬保护作用有关,自噬过度激活所致的自噬性死亡可能是PTC治疗的一个有效途径[5]。
细胞有多条自噬通路,L型钙离子通道(L-type calcium channel, L-Ca2+)/钙蛋白酶(calpain)通路是其中一条重要途径,它对自噬起负调节作用[6]。维拉帕米是临床常用的L型Ca2+通道阻断剂,具有降血压的作用。有文献报道,维拉帕米可增强自噬活性[7-8]。我们猜想能否通过使用维拉帕米来进一步增强多柔比星作用的PTC细胞的自噬活性,使PTC出现自噬性死亡,从而消除PTC对多柔比星的抗性,提高PTC患者的治愈率。为验证此假设,本实验以人PTC细胞株TPC-1为研究对象,探讨PTC对多柔比星产生抗性的通路机制,并探讨维拉帕米是否能逆转这种抗性及其机制,为PTC术后化疗中多柔比星与维拉帕米联合应用提供理论依据。
材 料 和 方 法
1 主要试剂
多柔比星及维拉帕米购自Sigma;血清购自四季青生物有限公司;胰酶购自Gibco;RPMI-1640培养液购自HyClone;抗LC3、calpain 1及GAPDH抗体购自Abcam;TPC-1细胞购自广州吉妮欧生物科技有限公司。膜片钳电极外液组成(mmol/L): NaCl 120, CsCl 5, TEA-Cl 10, BaCl210, HEPES 10, MgCl21, TTX 0.0005;膜片钳电极内液组成(mmol/L):CsCl 120, MgCl22, Na2ATP 5, HEPES 10, Glucose 11, EGTA 11。
2 方法
2.1 细胞培养和实验分组 TPC-1细胞生长于RPMI-1640 细胞培养液中,介质中加入10%胎牛血清和1%青、链霉素,用细胞培养瓶及细胞培养板培养。培养细胞置于37 ℃、5% CO2培养箱中,每天换液1次,待单层培养细胞生长汇合以后,用0.25%胰蛋白酶消化,传代培养。传代培养后,在倒置显微镜下观察,当细胞即将汇合时开始加药。本实验分为空白对照组、多柔比星组、维拉帕米组和多柔比星+维拉帕米组。
2.2 CCK-8法测定TPC-1细胞存活率 取对数生长期细胞, 经胰酶消化分散记数后, 稀释到4×108/L,接种于96孔培养板中, 每孔180 μL。培养至单层细胞即将汇合时加药。各孔终体积为200 μL,体积不足者以相应培养基补足。每一组设6个平行孔,根据实验需要加不同浓度药物并培养不同时间后 , 弃去培养液; 每孔加入CCK-8试剂(临用前以PBS 配成0.5 g/L)100 μL , 培养箱内继续培养,足够实验时间后,于30 min内在Bio-Rad 3350型酶标仪上读取490 nm处的吸光度(A)值。不加药只含CCK-8试剂孔细胞的吸光度值减去空白孔的吸光度值作为基本对照 , 实验孔吸光度值减去空白孔吸光度值与之相比得到各自的细胞存活率。公式为:
细胞存活率(%)=(实验孔A值-空白孔A值)/(只含CCK-8对照孔A值-空白孔A值)×100%。
2.3 全细胞膜片钳记录TPC-1细胞的L型钙离子通道电流 玻璃毛坯经P97微电极拉制仪经3步法拉制成尖端直径为2~3 μm的电极,冲灌电极内液。换上电极外液,将皿置于倒置显微镜载物台上,20倍物镜找到胞体光亮饱满的TPC-1细胞,安装好冲灌玻璃微电极并在电压钳模式下用微操纵器引导玻璃微电极靠近细胞。将微电极尖端调整至胞体正上方,然后在持续正压的同时让电极尖端缓慢靠近细胞,待电极尖端接触细胞表面时,轻轻给予电极内负压,形成高阻封接(1 GΩ),此时形成贴附式膜片,正确补偿电容,再给予负压吸破电极尖端的细胞膜,补偿电容电流和串联电阻,形成全细胞膜片钳,稳定3~5 min进行记录。电流信号经Ag/AgCl电极引导,数据经Digtal 1320A转换器记录。记录时,将高阻封接的细胞电位钳制在-50 mV持续300 ms,阶跃10 mV的10个去极化电压钳制记录L型Ca2﹢通道电流-电压曲线。实验中钳制电压和电路电阻随时被检测,只有基线、钳制电压和电路电阻稳定的数据才被纳入分析数据。
2.4 Western blot法测定calpain 1及LC3的蛋白表达 收集总蛋白,按说明书步骤提取总蛋白,用BCA法蛋白定量,蛋白样品上样进行SDS-PAGE后转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗膜后,分别加入抗 calpain 1、LC3和GAPDH抗体,抗体用含5%BSA稀释,相应浓度均为1∶1 000,4 ℃孵育过夜。TBST洗膜后,加入HRP标记的II抗,37 ℃孵育1 h。TBST洗膜后,ECL发光试剂检测蛋白印迹条带,光密度扫描胶片,Image-Pro Plus 6.0软件分析结果。以LC3-Ⅱ的灰度值与内参照GAPDH灰度值的比值来表示蛋白LC3的表达活性。
3 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,组间均数比较采用完全随机设计单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 CCK-8法测定TPC-1细胞的细胞存活率
1.1 进行药物配伍实验,确定药物的合适实验浓度及时间 以CCK-8测定TPC-1细胞的存活率,使用96孔板,每组设6个平行孔,对应孔取平均值。首先以不同浓度(0.25 μmol/L、0.5 μmol/L、0.75 μmol/L、1 μmol/L、2 μmol/L)的多柔比星分别作用于TPC-1细胞不同时间(2 h、6 h、12 h、24 h)。发现与对照组相比,低浓度短时间的多柔比星对TPC-1细胞的存活率无多大影响,随着药物作用时间延长和药物浓度加大,细胞存活率逐渐下降,在2 h、6 h、12 h、24 h这4个时点均出现细胞存活率先减弱后增强现象,对应2 h、6 h、12 h的细胞存活率最低点的多柔比星的浓度分别为1 μmol/L、0.75 μmol/L、0.5 μmol/L。前述实验说明TPC-1细胞对多柔比星具有抗性。然后,我们以不同浓度(1 μmol/L、2 μmol/L、3 μmol/L、7 μmol/L、8 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L)的维拉帕米作用于TPC-1细胞24 h,发现TPC-1细胞的细胞存活率从3 μmol/L开始下降,浓度越高下降幅度越大,这说明高浓度的维拉帕米对细胞有损害作用。综合前面的实验结果,我们选定药物作用时间为24 h,多柔比星的作用浓度为1 μmol/L,维拉帕米的作用浓度为3 μmol/L。
1.2 观察维拉帕米能否逆转TPC-1细胞对多柔比星的抗性 作用时间与药物浓度同上,实验分为空白对照组、多柔比星组、维拉帕米组和多柔比星组+维拉帕米组。各组的细胞存活率分别为(100.0±0.0)%、(89.1±4.7)%、(99.0±5.2)%和(52.3±2.6)%。多柔比星+维拉帕米组与多柔比星组相比较,差异有统计学显著性(P<0.05)。这说明维拉帕米能有效对抗TPC-1细胞对多柔比星的抗性,见图1。

Figure 1.The viability of the TPC-1 cells in different groups at 24 h. Mean±SD.n=6.*P<0.05vsdoxorubicin group.
图1 24 h后不同分组TPC-1细胞存活率的变化
2 维拉帕米对加入多柔比星后TPC-1细胞L型钙离子通道电流峰值的影响
由电压步阶产生的内向L型钙离子通道电流在加药24 h后被记录,从-50 mV~+40 mV的电压步阶产生的L型Ca2+通道电流在空白对照组、多柔比星组、维拉帕米组和多柔比星+维拉帕米组经膜电容标化后峰值电流密度(pA/pF)分别为-20.76±0.98、-15.18±0.74、-4.58±0.22和-3.61±0.17;多柔比星组与空白对照组比较,差异有统计学显著性(P<0.05),说明多柔比星可使TPC-1细胞的L型钙离子通道电流减弱;维拉帕米组与空白对照组相比较,差异有统计学显著性(P<0.01),说明维拉帕米可有效地阻断TPC-1细胞的L型钙离子通道电流;多柔比星+维拉帕米组与多柔比星组相比较,差异有统计学显著性(P<0.01),说明维拉帕米可有效地阻断受多柔比星作用的TPC-1细胞的L型钙离子通道电流,见图2。
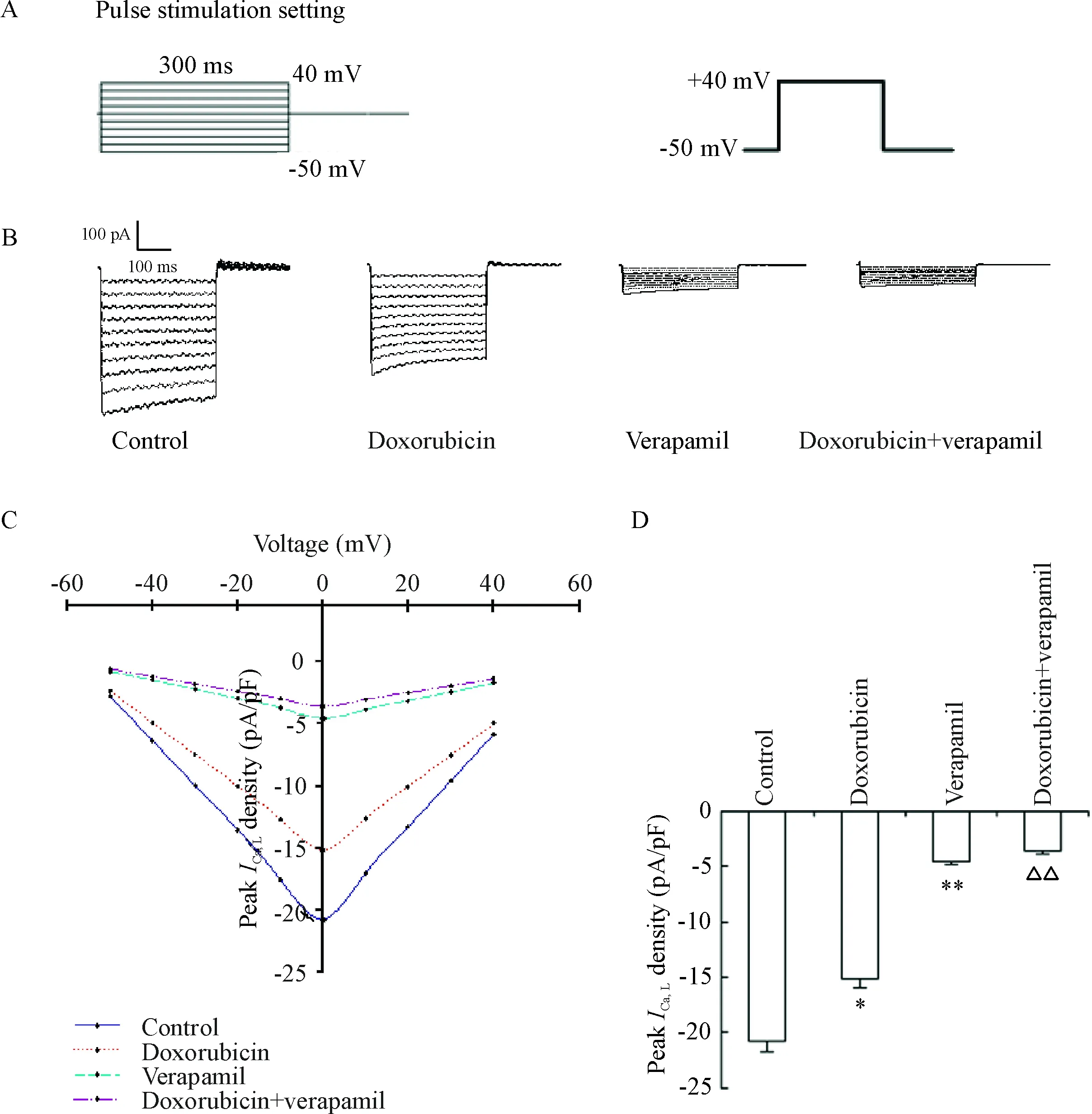
Figure 2.The effect of verapamil on peak L-type calcium channel current (ICa, L) in TPC-1 cells treated with doxorubicin. A: voltage steps of L-type calcium channel; B: average peak current amplitude in different groups; C: I-V curves of peak current density in different groups; D: the quantitative analysis of peak current density in different groups. Mean±SD.n=8.*P<0.05,**P<0.01vscontrol group;△△P<0.01vsdoxorubicin group.
图2 维拉帕米对加入多柔比星后TPC-1细胞L型钙离子通道电流峰值的影响
3 不同分组中TPC-1细胞calpain 1蛋白表达的Western blot实验分析
与空白对照组相比较,多柔比星组calpain 1的蛋白表达减弱(P<0.05),维拉帕米组calpain 1的蛋白表达减弱(P<0.05);与多柔比星组相比较,多柔比星+维拉帕米组calpain 1的蛋白表达减弱(P<0.05),见图3。
4 不同分组中TPC-1细胞LC3蛋白表达活性的Western blot实验分析
与空白对照组相比较,多柔比星组LC3的蛋白表达活性增强(P<0.05),维拉帕米组LC3的蛋白表达增强(P<0.05);与多柔比星组相比较,多柔比星+维拉帕米组LC3的蛋白表达增强(P<0.01),见图4。
讨 论
自噬,又称Ⅱ型程序性细胞死亡,是细胞内某些胞质成分通过一系列严格调控的途径,最后被溶酶体内蛋白酶降解,释放出大分子物质再循环的过程。自噬具有双重功能:当自噬在对不同形式的细胞应激作出反应时自噬可被快速上调,这种快速的自噬诱导可以通过清除细胞内受损的细胞器及毒性代谢分子,并通过产生维持细胞重要功能所必需的细胞内构件的方式以利于细胞的生存[9],但自噬的持续过度性激活也可导致细胞最终发生自噬性细胞死亡[10]。
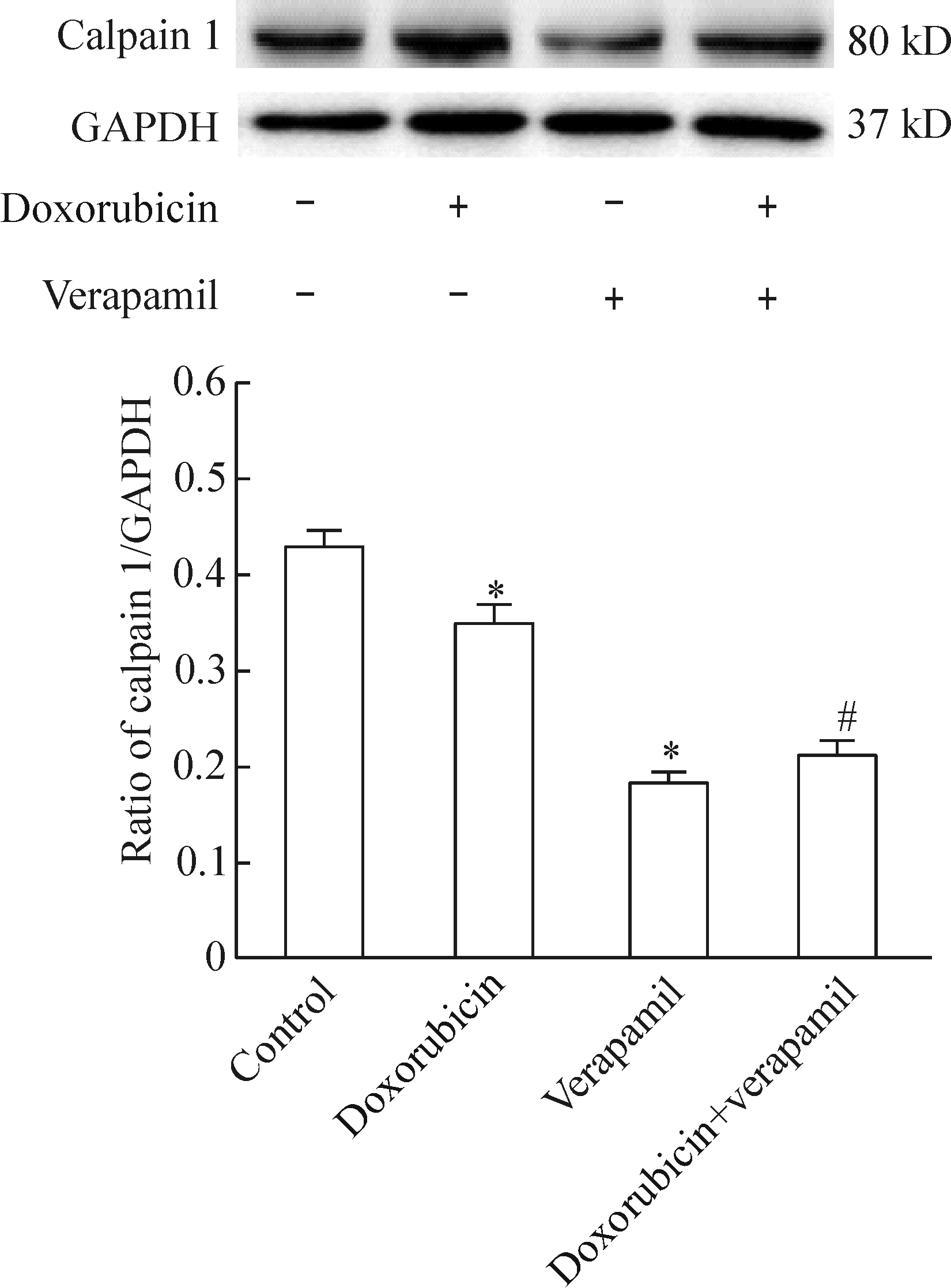
Figure 3.Western blot analysis of calpain 1 protein expression in the TPC-1 cells with different treatments after 24 h. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsdoxorubicin group.
图3 24 h后不同分组中TPC-1细胞calpain 1蛋白表达的Western blot实验分析
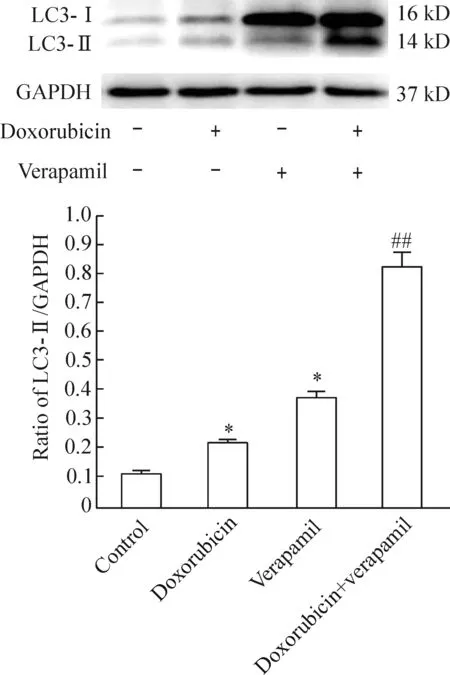
Figure 4.Western blot analysis of autophagy-related protein LC3 expression in the TPC-1 cells with different treatments after 24 h. Mean±SD.n=3.*P<0.05vscontrol group;##P<0.01vsdoxorubicin group.
图4 24 h后不同分组中TPC-1细胞自噬相关蛋白LC3表达活性的Western blot实验分析
自噬的信号转导通路包括哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)及非mTOR信号转导通路[9],后者主要指L-Ca2+/calpain信号转导通路。Calpain是L型钙依赖性的半胱氨酸蛋白酶,又可分为μ-calpain和m-calpain,二者均由1个80 kD左右的大片段及1个28 kD的小片段组成,对应的80 kD大片段分别称为calpain 1和calpain 2,μ-calpain是L-Ca2+/calpain信号转导通路中起作用的主要蛋白酶[11]。Calpain可以特异性水解多种酶及蛋白。作为非mTOR依赖信号通路的主要调节因子,calpain可结合由细胞膜L型钙离子通道进入的及三磷酸肌醇(inositol 1,4,5-trisphosphate,IP3)诱导内质网内释放的Ca2+,进而通过刺激型G蛋白的α亚单位(Gsα)通路激活环磷酸腺苷而抑制自噬[12];故L-Ca2+/calpain信号转导通路对自噬起负调节作用。
自噬相关蛋白LC3是哺乳动物细胞中酵母自噬蛋白ATG8的同源物,定位于前自噬泡和自噬泡膜表面,是细胞自噬泡膜的通用标志物[13]。细胞中新合成的LC3蛋白经过加工,成为胞浆可溶性LC3-I,后者经泛素样加工修饰过程,与自噬泡膜表面的磷脂酰乙醇胺结合,称为LC3-II。LC3-II含量的多少在某种程度上反映了细胞的自噬活性。
本实验通过CCK-8实验测定TPC-1细胞的存活率,发现TPC-1细胞对多柔比星的抗性与药物浓度及药物作用时间有关, 与文献报道的相一致[14-15]。同时,也发现当TPC-1细胞对多柔比星耐受时,加入不对细胞造成损害浓度的维拉帕米后导致TPC-1细胞的存活率降低,即能有效地对抗TPC-1细胞对多柔比星的抗性。
本实验发现多柔比星组与空白对照组相比,TPC-1细胞的L型钙离子通道电流减弱,calpain 1的蛋白表达亦减弱,而LC3的自噬活性增强,结合CCK-8实验中TPC-1细胞对多柔比星耐受这个结果,可以认为TPC-1细胞对多柔比星的抗性与其自噬活性增强有关,且可能有L-Ca2+/calpain信号转导通路的参与。同时,我们推测当TPC-1细胞处在多柔比星这种毒性药物的作用下,细胞受损,但经过一段时间的适应,TPC-1细胞通过自噬活性的增强来保护自己,维持生存,从而产生了对多柔比星的抗性。
有文献报道维拉帕米本身就有增强自噬的作用[7-8]。本实验中,维拉帕米与空白对照组相比,TPC-1细胞的L型钙离子通道电流大幅降低,calpain 1的蛋白表达减弱,而LC3的蛋白表达增强,结合CCK-8实验中TPC-1细胞的存活率未见明显下降这个结果,可以得出维拉帕米可增强自噬,且可能有L-Ca2+/calpain 1信号转导通路参与的结论。这种自噬的增强未对细胞造成明显损害。
另外,多柔比星+维拉帕米组与多柔比星组相比, TPC-1细胞的L型钙离子通道电流大幅降低,calpain 1的蛋白表达减弱,而LC3的自噬活性增强,结合CCK-8实验中TPC-1细胞存活率明显降低这个结果,可以得出结论,维拉帕米对抗TPC-1细胞对多柔比星的抗性与自噬的进一步增强有关,可能有L-Ca2+/calpain 1信号转导通路的参与。我们推测,由于多柔比星与维拉帕米均能通过L-Ca2+/calpain 1信号转导通路增强自噬,导致自噬活性过度增强,TPC-1细胞出现了自噬性死亡,故细胞存活率明显下降。
本实验不但找到了TPC-1细胞对多柔比星产生抗性的原因及机制,还发现了维拉帕米对抗这种抗性的原因及机制。另外,本实验组还收集了PTC患者切下的大体标本,与周围正常组织比较,发现了蛋白LC3及calpain 1表达的变化,不过将另文发表。这些结论可为PTC术后化疗多柔比星与维拉帕米联合应用提供理论依据。
[1] Kondo T, Ezzat S, Asa SL. Pathogenetic mechanisms in thyroid follicular-cell neoplasia[J]. Nat Rev Cancer, 2006, 6(4):292-306.
[2] Cooper DS, Doherty GM, Haugen BR, et al. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2006, 16(2):109-142.
[3] Matuszczyk A, Petersenn S, Bockisch A, et al. Chemotherapy with doxorubicin in progressive medullary and thyroid carcinoma of the follicular epithelium[J]. Horm Metab Res, 2008, 40(3):210-213.
[4] 王 焕, 李小毛, 刘穗玲, 等. RAD001 通过诱导自噬提高人子宫内膜癌细胞对紫杉醇的敏感性[J]. 中国病理生理杂志, 2013, 29(11):1966-1971.
[5] Lin CI, Whang EE, Abramson MA, et al. Autophagy: a new target for advanced papillary thyroid cancer therapy[J]. Surgery, 2009, 146(6):1208-1214.
[6] Yousefi S, Perozzo R, Schmid I, et al. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J]. Nat Cell Biol, 2006, 8(10):1124-1132.
[7] Salabei JK, Balakumaran A, Frey JC, et al. Verapamil stereoisomers induce antiproliferative effects in vascular smooth muscle cells via autophagy[J]. Toxicol Appl Pharmacol, 2012, 262(3):265-272.
[8] Park HW, Lee JH. Calcium channel blockers as potential therapeutics for obesity-associated autophagy defects and fatty liver pathologies[J]. Autophagy, 2014, 10(12):2385-2386.
[9] Levine B, Yuan J. Autophagy in cell death: an innocent convict?[J]. J Clin Invest, 2005, 115(10):2679-2688.
[10]Shi R, Weng J, Zhao L, et al. Excessive autophagy contributes to neuron death in cerebral ischemia[J]. CNS Neurosci Ther, 2012, 18(3):250-260.
[11]Goll DE, Thompson VF, Li H, et al. The calpain system[J]. Physiol Rev, 2003, 83(3):731-801.
[12]Gao X, Zhang Y, Arrazola P, et al. Tsc tumour suppressor proteins antagonize amino-acid-TOR signalling[J]. Nat Cell Biol, 2002, 4(9):699-704.
[13]Asanuma K, Tanida I, Shirato I, et al. MAP-LC3, a promising autophagosomal marker, is processed during the differentiation and recovery of podocytes from PAN nephrosis[J]. FASEB J, 2003, 17(9):1165-1167.
[14]Pan YZ, Wang X, Bai H, et al. Autophagy in drug resistance of the multiple myeloma cell line RPMI8226 to doxorubicin[J]. Genet Mol Res, 2015, 14(2):5621-5629.
[15]卢 娜, 白瑞樱, 魏林郁, 等. 胞外高浓度ATP诱导SH-SY5Y细胞的自噬和凋亡[J]. 中国病理生理杂志, 2014, 30(8):1388-1393.
(责任编辑: 林白霜, 罗 森)
杂志网址: http://www.cjpp.net
[文章编号] 1000- 4718(2016)10- 1788- 11
Mechanism of L-Ca2+/calpain signal transduction in verapamil inversing resistance of papillary thyroid carcinoma to doxorubicin
WANG Jun-bing1, 2, DING Xiang-dong2, ZHENG Yuan-yuan3, LIANG Ying-ying1, WANG Hao1, LI Guang-ming3, JIANG Ming-liang3, DONG Jun3
(1PanyuCentralHospital,Guangzhou511400,China;2LimitedCorporationofGuangzhouJinyuMedicalExaminationCenter,Guangzhou510330,China;3SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:dongjunbox@163.com)
AIM: To investigate the mechanism of L-type calcium channel (L-Ca2+)/calpain signal transduction pathway in verapamil inversing resistance of papillary thyroid carcinoma to doxorubicin. METHODS: Human papillary thyroid carcinoma TPC-1 cells were cultured for 2 d. For determining the appropriate concentrations and treatment time of verapamil and doxorubicin, a compatibility test was conducted to detect the cell viability by CCK-8 assay. The cells were divided into control group, doxorubicin group, verapamil group and doxorubicin+verapamil group. The techniques of whole-cell patch-clamp was used to record L-Ca2+currents. The protein expression levels of calpain 1 and LC3 were detected by Western blot. RESULTS: Compared with control group, the density of L-Ca2+current decreased in doxorubicin group and verapamil group (P<0.05). Compared with verapamil group, the density of L-Ca2+current decreased in doxorubicin+verapamil group (P<0.01). Compared with control group, the expression of calpain 1 decreased in doxorubicin group and verapamil group (P<0.05). Compared with doxorubicin group, the expression of calpain 1 decreased in doxorubicin+verapamil group (P<0.05). Compared with control group, the expression of LC3 increased in doxorubicin group and verapamil group (P<0.05). Compared with doxorubicin group, the expression of LC3 increased in doxorubicin+verapamil group (P<0.01). CONCLUSION: The drug resistance of TPC-1 cells to doxorubicin may be related to the increase in autophagic activity. Verapamil further increases autophagic activity of TPC-1 cells, resulting in autophagic death and inversing the resistance of TPC-1 cells to doxorubicin. The mechanism may be involved in L-Ca2+/calpain 1 signal transduction pathway of autophagy.
Autophagy; Resistance; L-type calcium channel; Calpain; Papillary thyroid carcinoma
1000- 4718(2016)10- 1782- 06
2016- 06- 27
2016- 09- 07
国家自然科学基金资助项目(No. 81171134; No. 81471235);广东省自然科学基金资助项目(No. 2014A030313360); 广州市医药卫生科技计划资助项目(No. 20141A011111); 广州市番禺区科技计划资助项目(No. 2014-203-26); 高等学校学科创新引智计划(No. B14036)
△通讯作者 Tel: 020-85228289; E-mail: dongjunbox@163.com
▲并列第1作者
R363.1
A
10.3969/j.issn.1000- 4718.2016.10.009
杂志网址: http://www.cjpp.net
