Caveolin-1在高盐饮食损伤糖尿病大鼠血管中的作用*
2016-11-24刘若海吴文俊金芃芃余立群
刘若海, 王 颖, 吴文俊, 金芃芃, 余立群, 曹 红, 李 旭△
(1温州医科大学附属第二医院麻醉科, 浙江 温州 325027; 温州医科大学 2仁济学院生理学教研室, 3附属第一医院内分泌科, 浙江 温州 325035)
Caveolin-1在高盐饮食损伤糖尿病大鼠血管中的作用*
刘若海1, 王 颖2, 吴文俊3, 金芃芃2, 余立群2, 曹 红2, 李 旭2△
(1温州医科大学附属第二医院麻醉科, 浙江 温州 325027; 温州医科大学2仁济学院生理学教研室,3附属第一医院内分泌科, 浙江 温州 325035)
目的: 观察1型糖尿病(DM)大鼠给予高盐饮食后内皮细胞功能障碍的可能机制。方法:SD大鼠(150~180 g)60只,腹腔注射链唑霉素(70 mg/kg),3 d后空腹血糖≥16.7 mmol/L为1型DM大鼠。正常大鼠和DM大鼠分别给予正常饮食和高盐饮食(8% NaCl)6周。检测肠系膜动脉舒张功能,Western blot技术检测血管中Akt、内皮型一氧化氮合酶(eNOS)、caveolin-1(Cav-1)等蛋白的水平。结果:高盐饮食DM大鼠收缩压显著高于DM组,其肠系膜动脉乙酰胆碱和胰岛素的舒张作用显著下降(P<0.01)。Akt、p-eNOS和NO水平均显著低于DM组(P<0.01),Cav-1显著增高(P<0.01)。结论:1型糖尿病大鼠高盐饮食血管功能障碍可能与抑制内皮细胞Akt激活及增强Cav-1表达导致的eNOS活性下降有关。
高盐饮食; 糖尿病; Caveolin-1; 内皮型一氧化氮合酶; 肠系膜动脉
糖尿病(diabetes mellitus,DM)合并高血压患者与单纯高血压患者或单纯的糖尿病患者相比,其心血管并发症风险[1]和血管进行性损伤[2]显著增加,已成为全球性的主要健康问题。因此,阐明糖尿病状态下对高血压易感性增加的机制是降低糖尿病患者高血压发病率及死亡率的关键。流行病学研究已明确高盐饮食会导致血压升高并增加日后患心脏病和中风的风险,但高盐饮食导致的内皮功能损害,使糖尿病患者更易伴发高血压的机制仍不清楚。窖蛋白(caveolin)/脂质筏是膜特殊的微结构,是多分子信号传递的区域。细胞内多种信号分子是通过与窖蛋白1(caveolin-1,Cav-1)的相互作用完成信号转导过程。有研究提示,Cav-1是连接胰岛素抵抗和高血压发病之间重要的信号分子[3],本研究将从Cav-1和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)之间的相互作用探讨糖尿病状态下高盐饮食引发高血压的易感性及其信号机制,期望为临床更有效治疗糖尿病罹患高血压患者提供新的实验依据。
材 料 和 方 法
1 动物
雄性SD大鼠(150~180 g),由温州医科大学实验动物中心提供。动物生产许可证号为SCXK(浙)2015-0001。
2 主要试剂
Insulin、eNOS、p-eNOS抗体、IP试剂盒均购于CST;Cav-1抗体购于BD;β-tubulin购于南通碧云天生物技术研究所。
3 主要方法
3.1 动物模型的制备和分组 腹腔注射链唑霉素(streptozotocin,STZ) 70 mg/kg,3 d后空腹血糖≥16.7 mmol/L为1型糖尿病大鼠。正常大鼠给予正常饮食作为对照(control,CON)组,给予高盐饮食为HS组;糖尿病大鼠给予正常饮食为糖尿病模型组(即DM组),给予高盐饮食6周,即DM+HS组。每周测血压和空腹血糖。
3.2 肠系膜动脉环舒张功能检测 待用的PSS缓冲液(mmol/L: NaCl 118、KCl 4.7、MgSO41.2、KH2PO41.2、NaHCO325、glucose 11和CaCl21.8),预先放入37 ℃恒温浴槽加热;小血管张力测定仪PowerLab Chart System (Danish Myo Technology)浴槽中加入5 mL 预热的PSS液,并持续通以5% CO2及95% O2的混合气,保持水温37 ℃;在显微镜下,使用2根直径为40 μm的不锈钢丝分别穿过血管,固定,将血管全部没入PSS液中,平衡时间为60 min。氯化钾溶液KPSS(mmol/L: NaCl 64.7、KCl 58.9、MgSO41.2、KH2PO41.2、NaHCO325、glucose 11和CaCl21.8)预收缩1次检查肠系膜动脉环的活力。加入10-5mol/L的苯肾上腺素(phenylephrine,PE)预收缩,待血管收缩反应达平台稳定后,加入不同浓度(10-10~10-6mol/L)的乙酰胆碱(acetylcholine,ACh)或胰岛素(insulin),观察血管的内皮依赖性舒张反应。

3.4 Western blot法检测蛋白 提取血管总蛋白,取等量的蛋白用10%聚丙烯酰胺凝胶电泳后,转至PVDF膜上,5%脱脂奶粉封闭液室温轻摇1 h,将PVDF膜分别与Ⅰ抗eNOS(1∶1 000)、p-eNOS(1∶1 000)、Cav-1(1∶1 000)和β-tubulin(1∶1 000) 4 ℃孵育过夜。HRP标记的山羊抗兔Ⅱ抗(1∶10 000)或者山羊抗小鼠Ⅱ抗(1∶10 000)(北京天德悦生物科技公司)按比例稀释,室温孵育PVDF膜1 h,ECL发光检测液发光,用凝胶成像系统检测相对表达强度。
4 统计学处理
实验数据均以均数±标准差(mean±SD)表示,采用GraphPad Prism 5.0 统计程序进行统计学分析。多组间比较采用单因素方差分析(one-way ANOVA),各组均数间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 高盐饮食6周后收缩压和舒张压
饮食6周后测各组的血压,DM+HS组血压明显升高,SBP和DBP显著高于CON组和DM组(P<0.01),见表1。结果提示高盐饮食可引起血压增高,在糖尿病的基础上高盐饮食,可促进高血压的进一步发展。
表1 高糖高盐对大鼠收缩压和舒张压的影响
Table 1.Systolic blood pressure (SBP) and diastolic blood pressure (DBP) in rats (mmHg. Mean±SD.n=8)
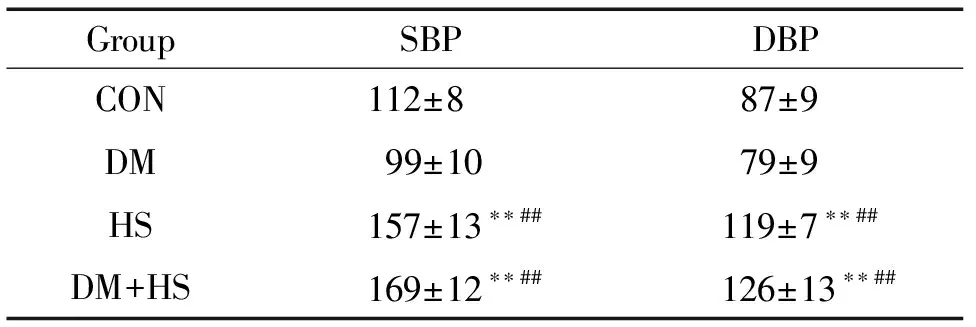
GroupSBPDBPCON112±887±9DM99±1079±9HS157±13∗∗##119±7∗∗##DM+HS169±12∗∗##126±13∗∗##
**P<0.01vsCON;##P<0.01vsDM.
2 外周阻力血管收缩舒张功能
6周时,DM组和HS组ACh和胰岛素引起的内皮依赖性舒张作用进一步降低,硝普钠(sodium nitroprusside,SNP)的血管舒张作用仍未见明显下降,表明高血糖和高盐饮食都损伤血管内皮细胞,导致血管舒张能力下降。但DM+HS组ACh和胰岛素引起的内皮依赖性舒张作用进一步减退(P<0.01),而且SNP对血管的直接舒张作用也明显低于其它组(P<0.01),提示糖尿病加高盐饮食不仅损害了血管内皮细胞,而且还损伤到血管平滑肌的舒张功能,见图1。
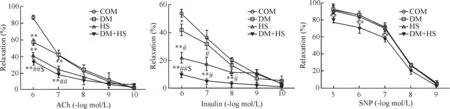
Figure 1.Impairment of ACh-induced, insulin-induced, and SNP-induced vasodilatation in small mesenteric arteries. Mean±SD.n=8.**P<0.01vsCON;#P<0.05,##P<0.01vsDM;$P<0.05vsHS.
图1 高糖高盐对乙酰胆碱、胰岛素和SNP诱导肠系膜动脉环舒张功能的影响
3 主动脉管壁形态学的变化
高盐饮食6周主动脉的HE染色。DM和DM+HS组的主动脉管壁厚度(内膜+中膜)显著低于CON组(P<0.01),也显著低于HS组(P<0.01),而DM+HS组肠系膜动脉的厚度显著低于其它组。DM+HS组的主动脉中膜血管平滑肌排列紊乱,中层平滑肌增生异常,内膜破坏相对严重。该结果显示糖尿病状态下HS不仅损伤血管内膜,也导致血管平滑肌形态上发生损伤,对肠系膜动脉的损伤要比主动脉的的损伤更为显著,见图2。

Figure 2.Representative images of hematoxylin-eosin (HE) staining of aorta at 6 weeks. Mean±SD.n=3.**P<0.01vsCON;##P<0.01vsDM.
图2 HE染色观察主动脉管壁的形态学变化
4 血浆NO水平的变化
为观察糖尿病大鼠高盐饮食后血管内皮功能受损是否与NO的产生增多或者破坏增多有关,我们检测了血浆NOX的浓度。高盐饮食6周,DM组和HS组的NO水平与对照组比较均下降(P<0.01);DM+HS组的NO水平与对照组比较下降更明显(P<0.01),也明显低于HS组和DM组(P<0.05)。这提示糖尿病高盐饮食后,血管舒张能力急剧下降与NO生成减少密切相关。
5 高盐饮食信号机制蛋白水平的研究
6周时,DM组和HS组的p-eNOS均显著降低,Cav-1均升高。但是DM+HS组p-Akt和p-eNOS最低,Cav-1最高,提示高血糖和高盐饮食均损害了Akt/eNOS/NO通路从而加剧内皮舒张功能障碍。而DM+HS组p-eNOS水平要比HS组低,提示Akt活性的改变并不是导致eNOS活性下降的唯一原因,需要进一步研究Cav-1在血管舒张功能的作用,见图3。

Figure 3.The protein levels of vascular Cav-1, eNOS, p-eNOS, Akt and p-Akt at 6 weeks determined by Western blot analysis. Mean±SD.n=5.*P<0.05,**P<0.01vsCON;#P<0.05,##P<0.01vsDM;$$P<0.01vsHS.
图3 Western blot法检测Cav-1、eNOS、p-eNOS、Akt和p-Akt的蛋白水平
讨 论
血压受到神经、激素的调节和血管、肾脏等相互的作用。高盐饮食、血管炎症、氧化应激等可导致血管功能障碍[4]。临床研究显示高血糖症导致血管内皮进行性损害是高血压发生发展的主要危险因素,也是血管功能障碍的第一步[5]。ACh可通过激活内皮毒蕈碱样受体作用于血管舒张因子NO,从而舒张血管,本实验发现,DM组和HS组肠系膜动脉对ACh的舒张反应减弱,而DM+HS组肠系膜动脉对ACh的舒张反应比前2组更弱,表明糖尿病加高盐饮食对血管内皮损伤更为严重。高盐饮食促进胰岛素信号传导并引起胰岛素抵抗[6]。我们实验组以前的研究显示幼年自发性高血压大鼠具有胰岛素抵抗,内皮依赖的胰岛素血管舒张作用下降[7]。本实验研究显示在高血糖症时增加盐的摄入量会降低血管内皮细胞对ACh和胰岛素刺激的舒张作用,肠系膜动脉对SNP的舒张反应下降表明损伤了平滑肌细胞对NO的反应。盐敏感性高血压大鼠损伤了胰岛素引起的舒张作用和Akt/eNOS磷酸化,降低了胰岛素的敏感性[8]。
DM+HS组大鼠的肠系膜动脉胰岛素内皮依赖的血管舒张作用明显低于其它组,这与以往的研究一致。DM+HS组肠系膜动脉对SNP的舒张作用明显低于其它组,并观察到血管壁的厚度变薄,血管平滑肌排列紊乱、增生异常导致平滑肌细胞受损,可能导致血管对NO的反应下降。有文献报道,敲除Cav-1可能会导致血管舒张和增加血管壁的紊乱,引起血管重塑[9]。因此,从实验的血管形态学显示糖尿病伴高盐饮食比单独糖尿病组和单独高盐饮食组的血管内皮和平滑肌损害更为严重,高盐饮食加剧了糖尿病组的内皮依赖和非内皮依赖的血管舒张功能障碍并促进高血压的发生发展。
大量的研究认为Akt/eNOS通路在胰岛素信号转导中起非常重要的作用。有研究显示糖尿病相关的血管内皮功能障碍与内皮细胞的胰岛素信号Akt/eNOS减弱有关[10-11]。高血压盐敏感性大鼠也显示胰岛素诱导的血管舒张损害和Akt/eNOS磷酸化的减弱[8]。然而在糖尿病伴高盐饮食中,对eNOS磷酸化水平的影响很少有研究。本实验的结果显示DM+HS组的Akt/eNOS磷酸化水平下降,NO生成减少,提示高盐饮食可能是损害了Akt/eNOS/NO通路从而加剧内皮功能的障碍。在盐敏感大鼠给予高盐饮食时发现血浆NO水平显著下降,而内皮eNOS表达也显著下降[4]。而DM+HS组p-eNOS水平要比HS组低,提示Akt活性的改变并不是导致eNOS活性下降的唯一原因。
在人体和动物的研究中,Cav-1已被认为与血管疾病有着密切关系。有研究显示糖尿病小鼠[12]和高盐饮食大鼠[13]中Cav-1的mRNA及蛋白表达水平升高和内皮依赖的舒张程度显著下降都与eNOS的活性下降有关。eNOS/Cav-1相互作用可能是心血管疾病发生发展的重要机制。eNOS激活过程是eNOS首先与Cav-1分开,从细胞膜小窝脱落,才能进一步被激活[14]。eNOS的Ser1177残基位的磷酸化被认为是eNOS激活的最主要机制[15]。很多机制解释Cav-1减少引起了肺、血管、心功能异常,而给予NOS的抑制剂则有所改善[16-17]。在Cav-1缺失小鼠伴eNOS缺失小鼠的实验中提示了心血管疾病与eNOS功能失调有关[18]。在尿糖浓度达到500~1 000 mg/dL时,对eNOS具有抑制作用的Cav-1 表达显著增加。糖尿病导致的氧化应激上调Cav-1,但有些研究显示糖尿病患者呈现每批细胞的小窝数量的减少,可能是由于外源性的ONOO-减少了窖蛋白的数量[19]。有实验发现糖尿病大鼠给予高盐饮食后血浆的NO水平和eNOS表达显著下降[4]。基于Cav-1和eNOS之间的密切关系,我们的实验发现糖尿病大鼠给予高盐饮食后胰岛素信号通路Akt-eNOS的活性降低,Cav-1表达增强。Cav-1-/-小鼠给予高盐饮食引起血管的收缩性下降,舒张作用增加,eNOS的表达和活性均增加[20]。这些结果均显示eNOS与Cav-1之间的关系非常密切,认为Cav-1可能通过调控eNOS的活性,在血管舒张功能上起着重要的调节作用。
综上所述,本研究证实在糖尿病的基础上给予高盐饮食可降低NO生成,严重破坏外周阻力血管的舒张功能。糖尿病合并高盐膳食导致的血管损伤程度比单纯的高盐饮食或单纯的糖尿病造成的血管损伤更为严重。在糖尿病通路Akt-eNOS活性减弱破坏血管内皮的基础上,高盐饮食不仅减弱eNOS的表达,还增强了Cav-1的表达,使eNOS磷酸化水平进一步降低,使NO表达下降,从而协同加重高血压的发生和发展。本研究提示,在激活胰岛素-Akt-eNOS信号的同时,适度抑制Cav-1的表达可能会阻断胰岛素抵抗和高血压发生发展之间的关键信号分子,降低糖尿病患者的血管损伤。
由于本研究仅观察了高盐饮食对糖尿病大鼠的血管功能的影响,并无阐明Cav-1和eNOS这2种蛋白之间如何相互作用,因此需要进一步的研究。
[1] Pojoga LH, Underwood PC, Goodarzi MO, et al. Variants of the caveolin-1 gene: a translational investigation linking insulin resistance and hypertension[J]. J Clin Endocrinol Metab, 2011, 96(8):E1288-E1292.
[2] Brown MJ, Castaigne A, de Leeuw PW, et al. Influence of diabetes and type of hypertension on response to antihypertensive treatment[J]. Hypertension, 2000, 35(5):1038-1042.
[3] Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030[J]. Diabetes Res Clin Pract, 2010, 87(1):4-14.
[4] Cao Y, Mu JJ, Fang Y, et al. Impact of high salt independent of blood pressure on PRMT/ADMA/DDAH pathway in the aorta of dahl salt-sensitive rats[J]. Int J Mol Sci, 2013, 14(4):8062-8072.
[5] de Boer IH, Kestenbaum B, Rue TC, et al. Insulin therapy, hyperglycemia, and hypertension in type 1 diabetes mellitus[J]. Arch Intern Med, 2008, 168(17):1867-1873.
[6] Ogihara T, Asano T, Ando K, et al. High-salt diet enhances insulin signaling and induces insulin resistance in Dahl salt-sensitive rats[J]. Hypertension, 2002, 40(1):83-89.
[7] Xing W, Yan W, Liu P, et al. A novel mechanism for vascular insulin resistance in normotensive young SHRs: hypoadiponectinemia and resultant APPL1 downregulation[J]. Hypertension, 2013, 61(5):1028-1035.
[8] Zhou MS, Schulman IH, Raij L. Vascular inflammation, insulin resistance, and endothelial dysfunction in salt-sensitive hypertension: role of nuclear factor kappa B activation[J]. J Hypertens, 2010, 28(3):527-535.
[9] Albinsson S, Shakirova Y, Rippe A, et al. Arterial remodeling and plasma volume expansion in caveolin-1-deficient mice[J]. Am J Physiol Regul Integr Comp Physiol, 2007, 293(3):R1222-R1231.
[10]Taguchi K, Sakata K, Ohashi W, et al. Tonic inhibition by G protein-coupled receptor kinase 2 of Akt/endothelial nitric-oxide synthase signaling in human vascular endothelial cells under conditions of hyperglycemia with high insulin levels[J]. J Pharmacol Exp Ther, 2014, 349(2):199-208.
[11]刘慰华,林双峰,石吉相,等. 1-磷酸鞘氨醇在高糖诱导血管内皮细胞功能损伤中的作用[J]. 中国病理生理杂志, 2016, 32(2):245-250.
[12]Lam TY, Seto SW, Lau YM, et al. Impairment of the vascular relaxation and differential expression of caveolin-1 of the aorta of diabetic +db/+db mice[J]. Eur J Pharmacol, 2006, 546(1-3):134-141.
[13]Ricchiuti V, Lapointe N, Pojoga L, et al. Dietary sodium intake regulates angiotensin II type 1, mineralocorticoid receptor, and associated signaling proteins in heart[J]. J Endocrinol, 2011, 211(1):47-54.
[14]Batova S, DeWever J, Godfraind T, et al. The calcium channel blocker amlodipine promotes the unclamping of eNOS from caveolin in endothelial cells[J]. Cardiovasc Res, 2006, 71(3):478-485.
[15]Mount PF, Kemp BE, Power DA. Regulation of endothelial and myocardial NO synthesis by multi-site eNOS phosphorylation[J]. J Mol Cell Cardiol, 2007, 42(2):271-279.
[16]Zhao YY, Liu Y, Stan RV, et al. Defects in caveolin-1 cause dilated cardiomyopathy and pulmonary hypertension in knockout mice[J]. Proc Natl Acad Sci U S A, 2002, 99(17):11375-11380.
[17]Fujita T. Mineralocorticoid receptors, salt-sensitive hypertension, and metabolic syndrome[J]. Hypertension, 2010, 55(4):813-818.
[18]Huang SS, Lu YJ, Huang JP, et al. The essential role of endothelial nitric oxide synthase activation in insulin-mediated neuroprotection against ischemic stroke in diabetes[J]. J Vasc Surg, 2014,59(2):483-491.
[19]Cassuto J, Dou H, Czikora I, et al. Peroxynitrite disrupts endothelial caveolae leading to eNOS uncoupling and diminished flow-mediated dilation in coronary arterioles of diabetic patients[J]. Diabetes, 2014, 63(4):1381-1393.
[20]Pojoga LH, Yao TM, Sinha S, et al. Effect of dietary sodium on vasoconstriction and eNOS-mediated vascular relaxation in caveolin-1-deficient mice[J]. Am J Physiol Heart Circ Physiol, 2008, 294(3):H1258-H1265.
(责任编辑: 卢 萍, 罗 森)
Fractalkine受体缺陷可削弱小胶质细胞和神经元对慢性应激的反应性
慢性应激是与抑郁症高度相关的触发因素之一。一般认为,小胶质细胞对应激乃至环境刺激具有高度反应性。然而,关于这些脑免疫细胞介导应激反应的作用机制尚不清楚。Fractalkine信号通路由趋化因子CX3CL1(主要由神经元表达)及其受体CX3CR1(几乎只存在于健康脑的小胶质细胞)组成,已被发现对小胶质细胞活性的调节极为重要。Milior等主要研究敲除CX3CR1基因以干扰小胶质细胞功能是否影响脑对慢性应激的反应。为此,他们以CX3CR1基因敲除和野生型成年小鼠为研究对象,分为对照组和压力环境组,历时2周,对小胶质细胞表型、突触间相互作用、突触传递、动物行为学反应及皮质酮水平等进行了检测。结果表明,通过CX3CR1-CX3CL1途径阻碍神经元-小胶质细胞之间的信息传递,可阻止慢性不可预测应激对小胶质细胞功能、短期和长期的神经元可塑性以及抑郁样行为的影响。总体而言,该研究表明小胶质细胞调节机制可能是应激易感性差异的基础,因而这种易感性可以通过经历应激事件如抑郁症而触发疾病。
Brain Behav Immun, 2016, 55:114-125(范冲竹)
Effect of caveolin-1 expression on high-salt diet-induced endothelial dysfunction in type 1 diabetic rats
LIU Ruo-hai1, WANG Ying2, WU Wen-jun3, JIN Peng-peng2, YU Li-qun2, CAO Hong2, LI Xu2
(1DepartmentofAnesthesiology,TheSecondAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325027,China;2DepartmentofPhysiology,RenjiCollege,3DepartmentofEndocrinology,TheFirstAffiliatedHospital,WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:lixu0577@126.com)
AIM: To investigate the underlying mechanisms responsible for endothelial dysfunction of type 1 diabetes mellitus (DM) rats fed with high-salt diet. METHODS: Type 1 DM was induced by intraperitoneal injection of streptozotocin (70 mg/kg). Normal and diabetic rats were fed high-salt food (HS, 8% NaCl) and standard food for 6 weeks, respectively. Isometric tension of the mesenteric arteries were measured. The expression of Akt, endothelial nitric oxide synthase (eNOS) and caveolin-1 (Cav-1) was examined by Western blot. RESULTS: The rats in DM+HS group exhibited more pronounced impairment of vasorelaxation to acetylcholine and insulin compared with either DM group or HS group (P<0.01). Akt and eNOS phosphorylation levels, and nitric oxide (NO) concentration in DM+HS group were significantly lower than those in DM group (P<0.01). The level of Cav-1 in DM+HS group was significantly higher than that in DM group and HS group. CONCLUSION: Impaired endothelial Akt activation, increased Cav-1 expression and resultant decreased eNOS activation contribute to aggravate high-salt diet-induced endothelial dysfunction and hypertension in DM rats.
High-salt diet; Diabetes mellitus; Caveolin-1; Endothelial nitric oxide synthase; Mesenteric arteries
1000- 4718(2016)10- 1757- 06
2016- 03- 02
2016- 08- 01
浙江省教育厅一般科研项目(No. Y201431185)
△通讯作者 Tel: 0577-86689769; E-mail: lixu0577@126.com
R363; R587.1
A
10.3969/j.issn.1000- 4718.2016.10.005
杂志网址: http://www.cjpp.net
