溶剂热法制备纳米TiO2可见光光催化剂
2016-11-23黄文艺史智鹏程昊谢炜彬李彦青李利军
黄文艺,史智鹏,程昊,谢炜彬,李彦青,李利军*
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室(广西科技大学),广西柳州545006;3.广西蔗糖产业协同创新中心,广西南宁530004;4.广西高校糖资源加工重点实验室(广西科技大学),广西柳州545006)
溶剂热法制备纳米TiO2可见光光催化剂
黄文艺1,2,3,4,史智鹏1,2,3,4,程昊1,2,3,4,谢炜彬1,2,3,4,李彦青1,2,3,4,李利军*1,2,3,4
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室(广西科技大学),广西柳州545006;3.广西蔗糖产业协同创新中心,广西南宁530004;4.广西高校糖资源加工重点实验室(广西科技大学),广西柳州545006)
采用溶剂热法合成可见光催化效果良好的纳米TiO2,并对制备过程中滴样速率、溶质比、反应温度3个影响因素进行优化得出最佳条件,利用XRD、拉曼光谱、动态光散射、紫外-可见光谱、红外光谱等技术对其晶型和粒径进行表征测试.结果表明:制备的纳米TiO2的最优化条件为:滴加速度0.5m L/min,溶质比1∶3,反应温度160℃;制备的纳米TiO2为具有良好结晶度的锐钛型晶体,其粒径为15 nm左右,且分布均匀,具有良好的光催化效果.本方法制备的纳米TiO2在复杂可见光光响应器件、可见光光降解有机污染物等方面具有一定的应用前景.
溶剂热法;纳米TiO2;光催化活性;可见光
0 引言
TiO2作为一种无毒、廉价的半导体类光催化剂,在治理环境污染以及催化制氢方面具有广泛的应用[1-2].然而,由于TiO2属于宽禁带半导体(3.2 eV)[3],使得它在紫外范围内才可以激发出价带电子形成电子-空穴对,而在可见光范围内,由于能量的限制,很难激发TiO2的价电子,这也就使TiO2在可见光范围内无法产生理想的光催化作用,从而限制了其进一步的应用.
为了克服TiO2的这个缺点,许多研究小组都对其进行了研究.例如:Kubacka的小组利用氧化钨胺为钨源和氮源合成钨、氮共掺杂的TiO2,提高了其可见光的光催化效率[4].同样是利用掺杂,Elaine的研究小组利用钨酸和硼酸三聚氰胺合成碳、钨共掺杂的TiO2,提高了其对可见光的利用率[5].这些方法虽然可以提高TiO2的可见光光催化效率,但是在制备过程中都需要高温处理来促进掺杂离子进入TiO2的晶格中;因此,所制备的纳米TiO2很容易发生团聚且耗能较高,在工业生产中的应用潜力很小[6-7].
为了解决上述问题,本文利用溶剂热法,以TiCl3为原料,甲醇和乙醇的混合溶液为溶剂,采用一步法,直接合成了表面具有碳层的纳米TiO2.这不仅减少了纳米TiO2表面的羟基数量防止其团聚,而且,纳米TiO2表面的碳层可以起到光敏剂的作用,将可见光的光能转移到TiO2上,增强了TiO2的可见光光催化效率.
1 实验部分
1.1试剂与仪器
TiCl3,盐酸,甲醇,无水乙醇均为分析纯.
TD3-WS离心机,YH水热反应釜,DF-101S磁力搅拌器,ZDHX5-4鼓风干燥箱,UNICO uv2102紫外分光光度计,JEOL JEM-2010高分辨率透射电镜,Nicolet Avatar 370傅里叶变换红外光谱仪,Malvern激光粒度仪.
1.2试验方法
1.2.1制备纳米TiO2
首先,将3mL 0.5M的盐酸加入到50mL的甲醇和无水乙醇混合液中,使其成为酸性;随后,将30mL的TiCl3在搅拌的条件下加入到上述甲醇和无水乙醇混合液中;在室温条件下搅拌30min后,将混合液倒入高压反应釜中,在高温下反应一段时间,反应完后用无水乙醇反复洗涤离心以去除反应中的残留物质;最后,所得产物在0℃下真空干燥,即可得纳米TiO2.
在实验过程中,通过对比在不同的TiCl3滴加速度、反应的溶质比和反应温度等条件下制备的纳米TiO2的可见光降解能力,确定最优制备条件.
1.2.2纳米TiO2可见光光催化测定
为了研究制备的纳米TiO2的光催化特性,利用LED灯(60W)作为光源降解亚甲基蓝.将0.25 g制备的纳米TiO2加入到50mL 6.7×10-5M亚甲基蓝溶液中,混合均匀,并在黑暗环境下搅拌2 h,得到浓度为5 g/L的TiO2亚甲基蓝蓝色溶液.将此蓝色溶液放置于装有LED灯的暗箱内进行照射.通过测量相同时间间隔的TiO2/亚甲基蓝混合溶液的紫外可见光谱(如图1所示),得到纳米TiO2的降解效率.P25(Degussa)以同样的方法做光催化对照实验.
2 结果与讨论
2.1纳米TiO2制备条件优化
通过对比不同的TiCl3的滴加速度、溶质比、反应温度等条件下制备的纳米TiO2在LED灯下对亚甲基蓝的降解率,可以获得制备纳米TiO2的最优方法.亚甲基蓝的降解率可以通过测量其溶液的脱色率来表示.具体降解情况如表1~表3所示.

图1 无TiO2的亚甲基蓝在LED灯下照射10 h的降解效率图Fig.1 The degradation efficiency figure of Methylene Blue under LED light
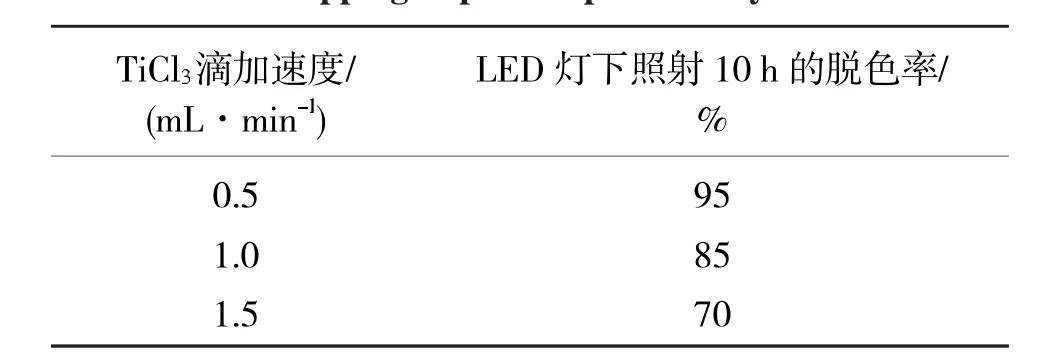
表1 滴加速度对光催化效果的影响Tab.1 Dropping impact on photocatalytic effect

表2 反应的溶质比对光催化效果的影响Tab.2 The mole ratio of solute impact on photocatalytic effect

表3 反应温度对光催化效果的影响Tab.3 The temperature of reaction impacts on photocatalytic effect
如图1所示,通过LED灯光照没有TiO2的亚甲基蓝溶液,发现在10 h内,基本没有发生降解,说明亚甲基蓝在LED灯下不会产生光分解反应.表1所示,滴加速度在0.5mL/min时制备的纳米TiO2光催化效果最好,且滴加速度越慢,脱色率越高,光催化效果越好.表2显示TiCl3和甲醇/乙醇的混合溶液的溶质比在1∶3时脱色率最高.表3显示反应温度对生成的纳米TiO2光催化的影响.从表3中可以看出,当温度控制在160℃时效果最好;因此,本文所选的纳米TiO2的最优制备条件为:TiCl3的滴加速度为0.5mL/min,TiCl3与甲醇/乙醇混合溶液的溶质比为1∶3,反应温度为160℃.
2.2纳米TiO2的表征
图2是TiO2不同放大倍数的透射电镜图.通过电镜图2(a),可以观察到,在较大放大倍数下,所制备的纳米TiO2颗粒分散比较均匀,颗粒尺寸较小.将放大倍数加大后,如图2(b),可以看出采用本文所述方法制备的纳米TiO2是由大量粒径在15 nm左右的类纺锤体颗粒组成.通过电镜图可知,采用最优工艺条件制备的TiO2为纳米级别,且粒径分布比较均一.

图2 优化条件下合成的TiO2的TEM图Fig.2 The TEM image of TiO2synthesized under the optimum conditions
图3为优化条件下制备的纳米TiO2XRD图.在25.3,37.68,47.82,53.74,55.16等位置出现的衍射峰分别为锐钛型纳米TiO2的(101),(004),(200),(211),(105)晶面的衍射峰,这些峰的宽度以及峰强表明制备出的纳米TiO2粒径小,结晶度高[8].由于XRD图中,没有出现其他的衍射峰;因此,可以确定所制备的纳米TiO2为纯锐钛型TiO2,无其他晶型.
图4为优化条件下合成的纳米TiO2拉曼光谱图.在152.46 cm-1,387.93 cm-1,510.59 cm-1,630.46 cm-1处分别发现和锐钛型TiO2相匹配的拉曼峰[9-10],并且这些峰的强度较高,这进一步表明所制备的TiO2为锐钛型,且结晶度良好.

图3 优化条件下合成的纳米TiO2的XRD图Fig.3 The XRD spectrogram of TiO2synthesized under the optimum conditions
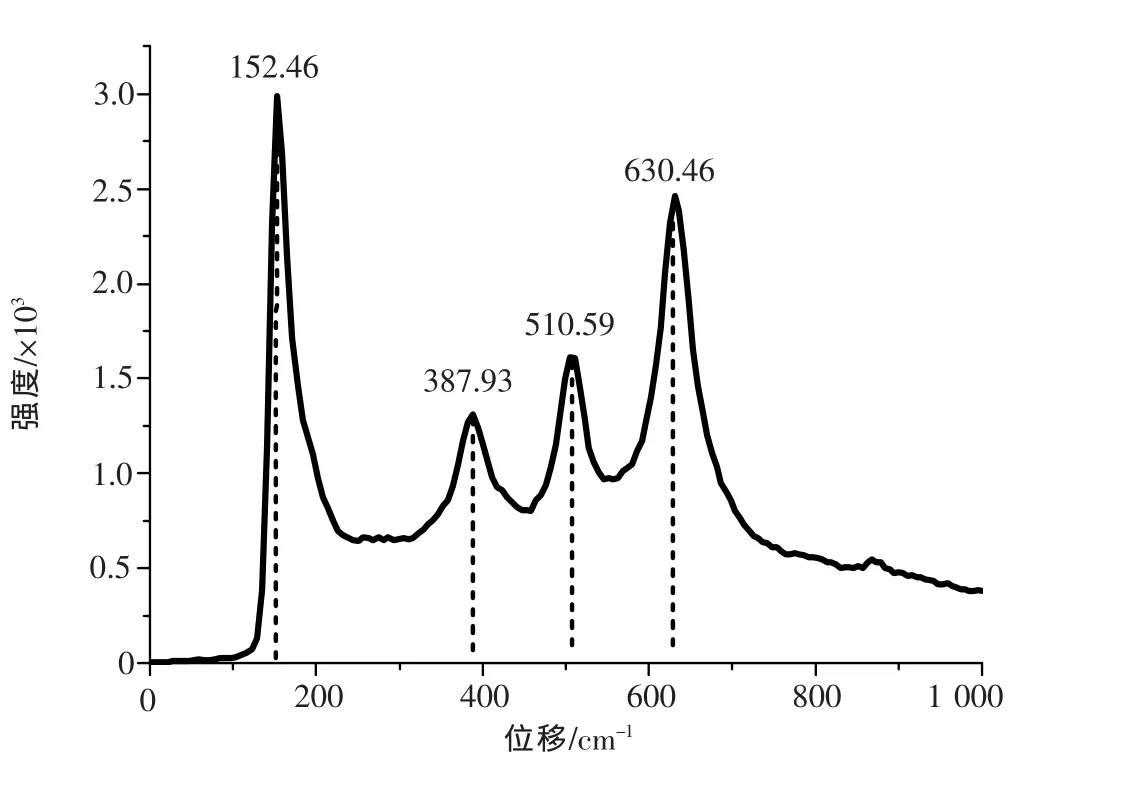
图4 优化条件下合成的纳米TiO2的拉曼光谱图Fig.4 The Raman spectrogram of TiO2synthesized under the optimum conditions
从图5可知,制备的纳米TiO2水力粒径集中在15 nm处,说明所制得的纳米TiO2粒径分布较均匀,这与透射电镜表征的结果(图2)基本一致.
从图6谱图中可以看出,相比于P25,自制的纳米TiO2具有更强的紫外可将光吸收.当吸收波长超过500 nm时,P25的吸光度已经降到一个比较低的水平,而自制的纳米TiO2的吸光度仍比P25高,表明通过优化纳米TiO2的制备条件,可以将其吸光度从紫外范围内延伸到可见光区.
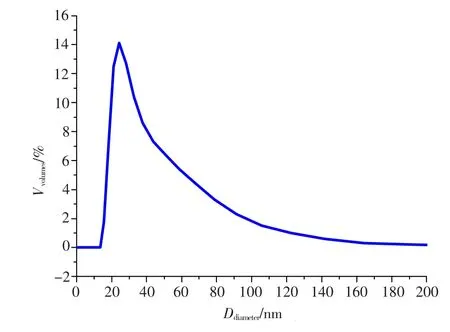
图5 优化条件下合成的纳米TiO2的DLS图Fig.5 The DLS spectrogram of TiO2synthesized under the optimum conditions

图6 优化条件下合成的纳米TiO2紫外可见光谱图Fig.6 The UV-Vis spectrogram of TiO2synthesized under the optimum conditions

图7 优化条件下合成的纳米TiO2的快速傅里叶变换红外光谱图Fig.7 The FT-IR spectrum of TiO2synthesized under the optimum conditions
在图7中,485.9 cm-1处的峰为TiO2本征峰.在3 316.5 cm-1处的吸收峰为制备的TiO2表面C-OH振动造成的.来自-CH2-中的C-H弹性振动造成了2 921.3 cm-1和2 851.6 cm-1处的峰.1 629.2 cm-1的峰为O-H弯曲振动峰[11].
从TEM,XRD,LDS和拉曼光谱的分析表明,所制备的纳米TiO2为纯锐钛矿型,其中并未发现金红石、板钛矿型TiO2的检测信号.从TiO2的紫外可见吸收光谱和快速傅里叶红外光谱中可以看出,所制备的TiO2在可见光范围内具有吸收,且在TiO2表面具有C成分存在;因此,本文制备的纳米TiO2为结晶度良好且具较强可见光吸收的锐钛型纳米TiO2.
2.3优化条件下合成的TiO2的可见光光催化性能
为了研究在优化条件下制备的纳米TiO2的可见光光催化性能,利用LED灯(60W)作为光源,P25作为对照组,进行亚甲基蓝降解实验:将1.25 g制备的纳米TiO2加入到250mL 6.7×10-5M亚甲蓝溶液中,混合均匀并分成5等份;随后在黑暗环境下搅拌2 h,得到5份浓度为5 g/L的TiO2/亚甲基蓝蓝色溶液;将这些蓝色溶液放置在装有LED灯的暗箱内照射不同时间,通过测量照射不同时间的TiO2/亚甲基蓝混合溶液的紫外可见光谱,得到纳米TiO2的降解效率. P25(Degussa)以同样的方法做光催化对照实验.
从图8中可以看出,亚甲基蓝溶液在光照下基本不会分解.加入优化条件下制备的TiO2和P25,在LED灯照射下,亚甲基蓝溶液开始出现褪色现象.从图中可以看出,在光照的前1 h内,P25的降解效率不明显,而自制的TiO2在前1 h内能降解将近60%的亚甲基蓝.随着照射时间不断延长,P25对亚甲基蓝开始逐渐降解,而自制的TiO2对亚甲基蓝的降解速率开始下降,不像前1 h那么明显.当照射5 h后,自制的TiO2降解了将近90%的亚甲基蓝,而P25则降解了将近50%的亚甲基蓝;没有加入TiO2的亚甲基蓝溶液则基本没有出现褪色现象.这说明亚甲基蓝在LED灯的照射下基本不出现分解现象,整个亚甲基蓝的褪色过程完全是由于TiO2的光催化作用引起.
通过TiO2降解实验可以知道,优化TiO2的制备条件,改善制备工艺,可以提高其在可见光下的光催化活性,并且其可见光的光催化活性比P25高出近1倍.

图8 优化条件下的TiO2和P25在LED灯下对亚甲基蓝溶液的降解效率图Fig.8 The degradation efficiency figure of TiO2synthesized under the optimum conditions and P25 for degradation Methylene Blue under LED light
3 结论
通过优化制备TiO2方法中TiCl3的滴加速率、TiCl3与甲醇/乙醇的溶质比、反应温度等条件,制备出了具有可见光吸收的纳米TiO2.结果表明:制备的纳米TiO2最优化条件为:滴加速度为0.5mL/min,溶质比为1∶3,反应温度为160℃;制备的纳米TiO2为具有良好结晶度的锐钛型晶体,其粒径为15 nm,且粒径分布均匀.相比于P25,制备出的纳米TiO2在LED灯下可以有效降解亚甲基蓝染料.
综上所述,文中制备的纳米TiO2能够充分利用太阳光中的可见光,对于充分利用清洁的太阳能资源提供了重要的参考依据,对于改善纳米TiO2的实际应用具有重要的意义[12].
[1]杨柯,刘阳,尹虹.纳米二氧化钛的制备技术研究[J].中国陶瓷,2004,40(4):8-12.
[2]李小红,郑旭煦,殷钟意,等.氟掺杂提高纳米二氧化钛光催化活性的研究进展[J].化学研究与应用,2013,25(3):7-12.
[3]邱松山,姜翠翠,海金萍.纳米二氧化钛表面改性及其抑菌性能研究[J].食品与发酵科技,2010,46(6):5-7,11.
[4]KATOH R,FURUBEA,YAMANAKA KI,etal.Charge Separation and Trapping in N-Doped TiO2Photocatalysts:A Time-Resolved Microwave Conductivity Study[J].Journal of Physical Chemistry Letters,2010,1(22):3261-3265.
[5]NEVILLE EM,MATTLEM J,LOUGHREY D,et al.Carbon-Doped TiO2and Carbon,Tungsten-Codoped TiO2through Sol-Gel Processes in the Presence of Melamine Borate:Reflections through Photocatalysis[J].Journal of Physical Chemistry C,2012,116(31):16511-16521.
[6]谭敏,尹荔松.稀土掺杂对TiO2薄膜光催化性能的影响[J].广西工学院学报.2010,21(1):28-31,49.
[7]盘荣俊,黄榜彪,徐柳苏.表面修饰铂的铜纳米颗粒的制备及催化性能[J].广西工学院学报.2007,18(2):77-80,88.
[8]AI Zhihui,WU Na,ZHANG Lizhi.A Nonaqueous Sol-G el Route to Highly Water Dispersible TiO2Nanocrystals with Superior Photocatalytic Performance[J].Catalysis Today,2014,224(4):180-187.
[9]张宁,许明霞,陈超,等.拉曼光谱对碘掺杂二氧化钛的晶相与表面结构[J].南昌大学学报(理科版),2008,32(2):130-133.
[10]吴健春,任亚平,王斌.利用拉曼光谱定量分析金红石型二氧化钛[J].分析试验室,2012,31(12):100-103.
[11]CHEN Lijing,CHEN Feng,SHI Yanfen,et al.Preparation and Visible Light Photocatalytic Activity of a Graphite-Like Carbonaceous Surface Modified TiO2Photocatalyst[J].Journal of Physical Chemistry C,2012,116(15):8579-8586.
[12]李群.纳米材料的制备与应用技术[M].北京:化学工业出版社,2008.
(学科编辑:黎娅)
Preparation of nanometer TiO2visible light photocatalyst by solvent-thermal method
HUANG Wen-yi1,2,3,4,SHI Zhi-peng1,2,3,4,CHENG Hao1,2,3,4,XIE Wei-bin1,2,3,4,LI Yan-qing1,2,3,4,LI Li-jun*1,2,3,4
(1.School of Biological and Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China;2.Guangxi Key Laboratory of Green Processing of Sugar Resources(Guangxi University of Science and Technology),Liuzhou 545006,China;3.Collaborative Innovation Center of Guangxi Sugar Industry,Nanning 530004,China;4.Key Laboratory for Processing of Sugar Resources of Guangxi Higher Education Institutes (Guangxi University of Science and Technology),Liuzhou 545006,China.)
The titanium dioxide nanoparticles were synthesized by solvothermal method.In the preparation process the conditions were optimized by changing the dropping rate,temperature,and solute/solvent ratio and the best conditions were obtained with these effect factors.Next the XRD,Raman,dynamic light scattering,UV-Vis spectrum and FT-IR spectrum were conducted on its crystal type,and diameter in the best condition,these results indicated that its hydraulic average radius for 15 nm,grain diameter distribution uniform,crystal type for anatase titanium type,and crystal degrees good.TiO2prepared herein can be used in the complex photoresponsive devices and visible light degradation of the organic pollutant.
solvent-thermal;TiO2nanoparticle;photocatalytic activity;visible light
TQ134.11
A
2095-7335(2016)03-0089-06
10.16375/j.cnki.cn45-1395/t.2016.03.016
2016-03-07
广西科技攻关项目(桂科攻1348018-3)资助.
李利军,博士,教授,研究方向:应用化学,E-mail:lilijun0562@sina.com.
