海南产沼蛙皮肤temporin家族抗菌肽抗菌活性及稳定性研究
2016-11-23钟亨任罗文杰宋彦亭邓世明张英霞
董 柱,钟亨任,罗文杰,宋彦亭,邓世明,张英霞
(海南大学 海洋学院,热带生物资源教育部重点实验室,海南 海口 570228)
海南产沼蛙皮肤temporin家族抗菌肽抗菌活性及稳定性研究
董 柱,钟亨任,罗文杰,宋彦亭,邓世明,张英霞
(海南大学 海洋学院,热带生物资源教育部重点实验室,海南 海口 570228)
用化学合成法合成了4种抗菌肽,并测定了其抗菌活性及温度、热处理时间和pH值等不同因素对抑菌活性的影响,结果表明:temporin-GHa~GHd对革兰氏阳性菌:金黄色葡萄球菌(Staphylococcus aureus)、耐甲氧西林金黄色葡萄球菌(methicillin-resistant S. aureus,MRSA);革兰氏阴性菌:大肠杆菌(Escherichia coli,D 31);真菌:白色念珠菌(Monilia albican)均具有抗菌活性.对金黄色葡萄球菌的最小抑菌浓度最低,分别为6.8,6.8,12.9和12.7μmol·L-1.除temporin-GHb对温度稍敏感外,temporin-GHa,temporin-GHc和temporin-GHd在25~100 ℃范围内,均具有较强的热稳定性,即使在80 ℃加热80 min,100 ℃加热20 min,其抗菌活性仍基本保持不变.4种抗菌肽在pH 2~10范围内稳定,即使在极端pH条件下(pH 2~3或9~10),其抗菌活性仍变化不大.
沼蛙; 抗菌肽; 抗菌活性; 稳定性
抗菌肽是广泛存在于动植物中的一类小肽,它在生物免疫系统中发挥着重要的作用.研究表明,抗菌肽具有多种生物活性[1-2],它对细菌、真菌、病毒、原虫和癌细胞具有抑制或杀灭作用,且不易产生耐药性[3],因此,它很有可能成为新一代的抗菌药物[4],目前,国外已经有抗菌肽应用于治疗人皮肤感染的报道[5].
沼蛙(Hylarana guentheri)常见于中国南部各省,沿低海拔的农田、溪流、池畔分布.有报导表明:不同地域的沼蛙其分泌物中的活性组分存在差异[6-7].抗菌肽的来源非常丰富,但是其在个体中的含量较少,相对分子质量也较低,其分离纯化的过程较复杂.本文以海南产沼蛙为材料,参考了已知的抗菌肽保守序列设计引物,并利用RT-PCR法在沼蛙皮肤mRNA反转录产物中快速筛选出4条temporin家族的抗菌肽序列,分别命名为temporin-GHa,temporin-GHb,temporin-GHc和temporin-GHd,通过化学方法合成并测定了其抗菌活性及在不同条件下的稳定性.
1 材料和方法
1.1 沼蛙皮肤总RNA提取 沼蛙采集于海南海口市郊区,将其用乙醚麻醉后置于冰上,然后迅速取其背部皮肤投于液氮中,快速将其研磨成粉末.根据Trizol Reagent (Invitrogent)说明书步骤来提取皮肤总RNA,并用cDNA第一链合成试剂盒PrimeScriptTM 1st strand cDNA Synthesis Kit (Takara, 中国)反转录合成cDNA第一链.
1.2 筛选抗菌肽序列 以合成的cDNA 第一链为模板扩增编码抗菌肽的cDNA序列.正向引物5′-GAWYYAYYHRAGCCYAAADATGTTCA-3′(W=A or T;Y=C or T;H=A, C or T;R=A or G;D=A, G, or T), 反相引物5′-GCTAAATGATATACCACATC-3′[8-9].PCR总体积为50 μL,条件为: 95 ℃预变性5 min;95 ℃变性20 s,46 ℃退火30 s,72 ℃适温延伸 30 s,共进行35个循环;最后延伸10 min.目标产物约300 bp.用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0 (Takara, 中国) 试剂盒回收目标条带,并克隆到载体pMD18-T Vector (Takara, 中国)上,所筛选的阳性克隆在上海生工生物股份有限公司测定序列.
1.3 数据分析 推导测定的核酸序列所编码的氨基酸序列,并在NCBI上进行Protein-Blast检索,同时选择PSI-Blast模式,其他以默认参数进行.用软件DNAMAN比较多个序列的相似性.
1.4 多肽合成 以固相合成法合成多肽(上海吉尔生化),并以RP-HPLC进行纯化,当纯度大于95%时收集组分,冻干,用MALDI-TOF检测合成的多肽.
1.5 抗菌活性的测定 实验菌株包括革兰氏阳性菌:金黄色葡萄球菌(Staphylococcus aureus,ATCC 25923)、耐甲氧西林金黄色葡萄球菌(methicillin-resistant S. aureus,MRSA,ATCC 43300);革兰氏阴性菌:大肠杆菌(Escherichia coli,D 31);真菌:白色念珠菌(Monilia albican,ATCC 10231).调整革兰氏阳性菌和革兰氏阴性菌单位体积的活菌个数至106 cfu·mL-1,真菌至105 cfu/mL,分别加100 μL菌液至96孔板的各孔中,第1至第10孔中等量加入以2倍梯度稀释的抗菌肽(终质量浓度为1.25~0.002 mg·mL-1),第11孔加等量2.5 mg·mL-1的卡那霉素,并将其作阳性对照,第12孔加等量的无菌水,作阴性对照.37 ℃恒温培养18 h,用酶标仪测定620 nm处的吸光值.以不长菌的孔所对应的最小质量浓度为该抗菌肽的最低抑菌质量浓度(minimum inhibitory concentration,MIC).分别设置3个重复孔.
1.6 温度对temporin家族抗菌活性的影响 分别取适量样品(temporin-GHa,temporin-GHb,temporin-GHc,temporin-GHd )溶于水中,定容至终质量浓度5 mg·mL-1.将样品分别在40 ℃,60 ℃,80 ℃及100 ℃恒温加热20 min,8 000 r·min-1离心5 min,无沉淀产生.以上述方法测定其对金黄色葡萄球菌(ATCC 25923)的抗菌活性.每孔等量上样10 μL,以无菌水作为阴性对照,常温下的样品作为阳性对照.设置3组重复,观察并测定其抑菌圈的平均直径.
1.7 加热时间对temporin家族抗菌活性的影响 将上述相同的样品在恒温80 ℃下分别加热20 min,40 min,60 min及80 min,并以8 000 r·min-1离心5 min,无沉淀产生.同样,检测其对金黄色葡萄球菌(ATCC 25923)的抗菌活性.每孔等量上样10 μL,以无菌水作为阴性对照,并以常温下的样品为阳性对照.设置3组重复,观察并测定其抑菌圈的平均直径.
1.8 不同pH条件对temporin家族抗菌活性的影响 取适量的4种样品,分别溶解于pH 2~10的水溶液,定容至终质量浓度5 mg·mL-1.以上述方法测定不同pH对抗菌肽抗金黄色葡萄球菌(ATCC 25923)活性的影响.设置3组重复,观察并测定其抑菌圈的平均直径.
2 实验结果
2.1 沼蛙皮肤抗菌肽cDNA克隆及序列分析 经测定,所提取的总RNA OD260/OD280 = 2.01,说明其纯度较高.RT-PCR产物经过w=1.5%的琼脂糖凝胶电泳后,在300 bp处有清晰的亮带出现.对68个阳性克隆进行测序,得到4条编码不同于抗菌肽的cDNA序列.去除信号肽序列,4种成熟抗菌肽由13个氨基酸组成,与来源于其他两栖动物的抗菌肽进行序列比对,发现这4种抗菌肽属于temporin家族,分别将其命名为temporin-GHa,temporin-GHb,temporin-GHc和temporin-GHd,经NCBI检索没有发现完全相同的序列.temporin-Gua及temporin-1Sc是分别从福建产沼蛙和北非蛙科动物Pelophylax saharicus中分离得到(图1)[6,10]的.Temporin家族的成熟抗菌肽在C末端通常会被酰胺化,故在化学合成该类抗菌肽时C末端胺基化.

黑色阴影部分表示完全保守序列,灰色阴影表示相对保守序列
2.2 抗菌肽对金黄色葡萄球菌的最小抑菌浓度 通过微量稀释法在96孔板上测得temporin家族抗菌肽对不同菌种的MIC值(见表1).4种抗菌肽对革兰氏阳性菌、革兰氏阴性菌和真菌均具有抗菌活性.金黄色葡萄球菌(ATCC 25923)对抗菌肽最敏感,其最低抑菌浓度分别为6.8,6.8,12.9,12.7 μmol/L.和其他3种抗菌肽比较,temporin-GHb的抗菌活性更强,其对不同菌株的最低抑菌浓度均相对较低.
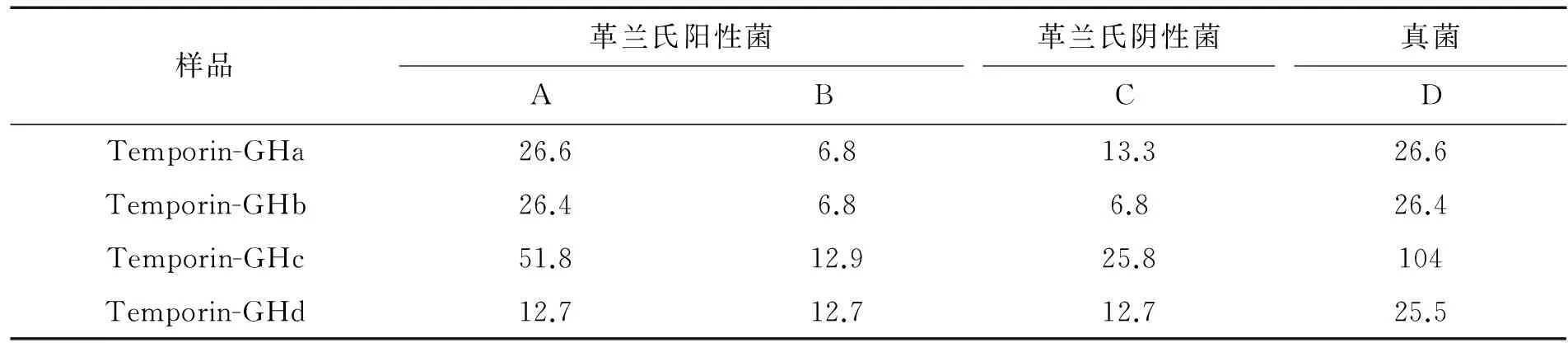
表1 沼蛙抗菌肽最低抑菌浓度的测定 μmol/L
A: 耐甲氧西林金黄色葡萄球菌 (ATCC 43300);B: 金黄色葡萄球菌(ATCC 25923);C: 大肠杆菌 (D 31);D: 白色念珠菌(ATCC 10231)
2.3 温度对抗菌肽抗菌活性的影响 在40 ℃,60 ℃,80 ℃及100 ℃分别加热处理4种抗菌肽20 min后,分别以8 000 r·min-1离心5 min,无明显沉淀,取上清检测其抗菌活性.结果显示,temporin-GHb对温度的耐受性相对稍差,经80 ℃及100 ℃处理后,其抗菌活性有所降低,抗菌圈直径由9 mm降至5 mm,而40 ℃及60 ℃处理对其抗菌活性无影响(见图 2).其他3种抗菌肽经几种温度处理后,其样品抑菌圈的直径变化不大(见表 2),即使在100 ℃加热20 min,仍基本保持其最初的抗菌活性,说明海南产沼蛙皮肤temporin家族的抗菌肽具有极佳的热稳定性.

A: temporin-GHa; B: temporin-GHb; C: temporin-GHc; D: temporin-GHd;1 :无菌水,常温;

mm
2.4 加热时间对抗菌活性的影响 在80 ℃下,分别加热4种抗菌肽(temporin-GHa~d)20 min,40 min,60 min和80 min,并以8 000 r·min-1离心5 min,无明显沉淀产生,取上清检测其抗菌活性.图 3 和表 2显示,temporin-GHa,temporin-GHc及temporin-GHd在80 ℃加热 80 min,其抑菌圈的直径变化不明显,在高温条件下其仍表现出良好的抗菌活性,具有突出的热稳定性.temporin-GHb在80 ℃经不同时间处理,其抑菌圈直径维持在5 mm左右.

A: temporin-GHa; B: temporin-GHb; C: temporin-GHc; D:temporin-GHd; 1: 无菌水;2: 80 ℃处理20 min;3: 80 ℃处理40 min;4: 80 ℃处理60 min;5: 80 ℃处理80 min

表3 加热不同时间后temporin-GHa~d抗金黄色葡萄球菌的抑菌圈直径 mm
2.5 不同pH条件对抗菌肽活性的影响 将抗菌肽在不同pH条件下处理,测定其对pH的耐受性,结果如图 4所示,4种temporin家族的抗菌肽在pH 2.0~10条件下,其抗菌活性基本未受影响,即使在强碱性条件下(pH=10),仍能保持最初的抗菌活性,说明该抗菌肽有较强的耐碱性,在强酸性条件下(pH=2),其抗菌活力也没有降低(表4),说明该抗菌肽在极端pH条件下仍可保持较好的稳定性.
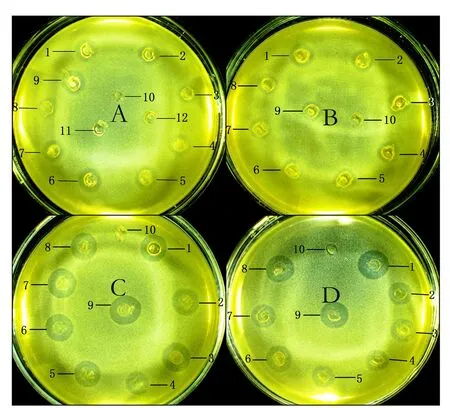
A: temporin-GHa; B: temporin-GHb; C: temporin-GHc; D: temporin-GHd; 1: pH=2; 2: pH=3; 3: pH=4; 4: pH=5; 5: pH=6; 6: pH=7; 7: pH=8; 8: pH=9; 9: pH=10; 10:无菌水; 11: pH=2 的无菌水; 12: pH=10的无菌水
图4 pH对temporin-GHa~d抗金黄色葡萄球菌抗菌活性的影响
3 讨 论
随着不同菌株对传统抗生素药物产生耐药性,亟待开发新型的抗菌药物.由基因编码的抗菌肽由于其具有广谱的抗菌活性、抗病毒、抗肿瘤、抗真菌、低毒等特点而备受关注.Temporin家族抗菌肽为首次从蛙科动物Rana temporaria的皮肤中分离得到[11],到目前为止,temporin类抗菌肽是自然界中所发现的分子质量最小的抗菌肽,该类抗菌肽通常含有10~14个氨基酸残基,并且在其C末端氨基酸被酰胺化[12].从海南沼蛙皮肤中克隆得到的抗菌肽temporin-GHa,temporin-GHb,temporin-GHc及temporin-GHd均含有13个氨基酸残基,经过分析,其不含碱性氨基酸,净电荷为零.经微量稀释法检测发现,这4种抗菌肽对革兰氏阳性菌、革兰氏阴性菌及真菌均具有抗菌性活,说明其具有广谱抗菌活性.其中,对革兰氏阳性菌和金黄色葡萄球菌最敏感,最低抑菌浓度分别为6.8,6.8,12.9,12.7 μmol/L.在这4种抗菌肽中,temporin-GHb对不同菌株的最低抑菌浓度均相对较低,表现出更强的抗菌活性.
在对其稳定性的研究中,于80 ℃ 处理temporin-GHb 20 min后,其抑菌圈从9 mm缩小至5 mm;在热处理时间对抗菌肽活性影响的研究中,于80 ℃及100 ℃加热temporin-GHb 80 min也能检测到其抗菌活性,其抑菌圈大小均为5 mm,说明温度对temporin-GHb的抗菌活性有一定的影响,但80 ℃是其抗热临界温度,在此温度其活性有所降低,超过此温度后抗菌活性仍保持;Temporin-GHa,temporin-GHc和temporin-GHd对温度具较强耐受性,在25~100 ℃范围内,均具有较强的热稳定性,即使在100 ℃加热80 min,其抑菌圈大小无显著变化,抗菌活性仍基本保持不变.temporin-GHa~d对pH变化不敏感,在极端pH条件下(pH 2~3或pH 9~10),其抗菌活性变化不大.
从海南沼蛙皮肤中克隆得到的抗菌肽temporin-GHa~d对革兰氏阳性菌、革兰氏阴性菌及真菌都表现出抗菌活性,尤其对耐甲氧西林金黄色葡萄球菌也具有较好的抗菌活性,说明其抗菌谱广.这4种抗菌肽具有较好的热稳定性和耐酸碱性,有一定的应用前景,本研究为其可能的应用提供了实验依据.
[1] 黄德娟,黄德超. 生物活性肽 [J]. 生物学通报,2007,41(4):17-18.
[2] 许若丹,钟理,张伟,等. 阳离子抗菌肽结构域抗菌活性的关系 [J]. 中国公共卫生,2005,21(9):1 141-1 143.
[3] 李晓平,朱倩,夏睿,等. 一类蛙源非典型结构抗菌肽cDNA的克隆以及成熟肽的预测 [J]. 现代生物医学进展,2010,10(8):1 429-1 433.
[4] 吴甜甜,杨洁. 天然抗菌肽的研究进展及应用前景 [J]. 生物技术通,2009:27-29.
[5] Dubin A,Mark P,Dubin G,et al. New generation of peptide antibiotics [J].Acta Biochim Pol,2005,52(3):633-638.
[6] Zhou J, McClean S, Thompson A, et al. Purification and characterization of novel antimicrobial peptides from the skin secretion of Hylarana guentheri [J]. Peptides,2006,27(12):3 077-3 084.
[7] Conlon J M, Power G J, Abdel-Wahab Y H A,et al. A potent,non-toxic insulin-releasing peptide isolated from an extract of the skin of the Asian frog,Hylarana guntheri (Anura: Ranidae) [J]. Regulatory Peptides,2008,151(3):153-159.
[8] Zhou M,Wang L,Owens D E,et al. Rapid identification of precursor cDNAs encoding five structural classes of antimicrobial peptides from pickerel frog (Rana palustris) skin secretion by single step "shotgun" cloning [J]. Peptides,2007,28(8):1 605-1 610.
[9] Yang X, Xia J, Yu Z, et al. Characterization of diverse antimicrobial peptides in skin secretions of Chungan torrent frog Amolops chunganensis [J]. Peptides,2012,38(1):41-53.
[10] Abbassi F, Oury B, Blasco T,et al. Isolation, characterization and molecular cloning of new temporins from the skin of the North African ranid Pelophylax saharica[J]. Peptides,2008,29(9):1 526-1 533.
[11] Simmaco M,Mignogna G , Canofeni S,et al. Temporins,antimicrobial peptides from the European red frog Rana temporaria [J]. European Journal of Biochemistry,1996,242(3):788-792.
[12] 黄颖桢,周建武,张洋,等. 沼水蛙皮肤抗菌肽Temporin-HZ的结构和功能 [J]. 莆田学院学报,2008,15(5): 30-36.
Antimicrobial Activities and Influential Factors of Temporin Family Antimicrobial Peptides Derived fromHylaranaguentheriof Hainan
Dong Zhu, Zhong Hengren, Luo Wenjie, Song Yanting, Deng Shiming, Zhang Yingxia
(Key Laboratory of Tropical Biological Resources of Ministry of Education, College of Marine Science, Hainan University, Haikou 570228, China)
In our report, the chemical synthesis method were performed to synthesis four antimicrobial peptides, temporin-GHa,temporin-GHb,temporin-GHc, and temporin-GHd, their antimicrobial activities were determined, and the effects of temperature, heat-treated time, and pH value on antimicrobial activities were analyzed. The results indicated that temporin-GHa~GHd has the antimicrobial activities against Gram-positive strains, Staphylococcus aureus, methicillin-resistant S. aureus (MRSA), Gram-negative strains Escherichia coli (D 31), and fungus, Monilia albican; S. aureus was the most sensitive strains, and the minimum inhibitory concentration (MIC) of four temporin family antimicrobial peptides against S. aureus is 6.8, 6.8, 12.9, and 12.7 μM, respectively; temporin GHa,temporin GHc和temporin GHd were stable over a broad range of temperatures (25-100 ℃), and pH (2-10).
Hylarana guentheri; antimicrobial peptides; antimicrobial activity; stability
2016-02-29
国家自然科学基金(31560593)
董柱(1990-),男,湖南衡阳人,海南大学海洋学院2013级硕士研究生,E-mail:dongzhuhd@163.com
张英霞(1973-),女,吉林集安人,教授,硕士生导师,研究方向:动物活性蛋白与多肽,E-mail:yingxiazhang@hotmail.com
1004-1729(2016)03-0250-07
Q 71
A DOl:10.15886/j.cnki.hdxbzkb.2016.0038
