定向结构Ⅰ/Ⅱ型胶原支架上兔软骨细胞生长增殖观察及新生组织生物力学检测
2016-11-22张加廷张东正侯建雷张仲文
张加廷 张东正 侯建雷 张仲文▲
1.武警后勤学院,天津300309;2.武装警察部队总医院骨软骨科,北京100039
定向结构Ⅰ/Ⅱ型胶原支架上兔软骨细胞生长增殖观察及新生组织生物力学检测
张加廷1,2张东正2侯建雷2张仲文2▲
1.武警后勤学院,天津300309;2.武装警察部队总医院骨软骨科,北京100039
目的探讨采用定向结构Ⅰ/Ⅱ型胶原软骨支架复合软骨细胞体外构建生物力学性能更好的组织工程软骨。方法利用牛跟腱和猪软骨分别提取Ⅰ型胶原和Ⅱ型胶原并以超微量分光光度计测定其最大紫外吸收峰。利用快速冷冻自然真空冻干筛选成型法制备垂直定向微孔结构的Ⅰ/Ⅱ型胶原复合支架,同时采用普通冷冻干燥法制备非定向Ⅰ/Ⅱ型胶原复合支架。将兔软骨细胞分别接种在两组支架上,体外静态培养3 d后扫描电子显微镜下观察软骨细胞生长情况,MTT法测量两组支架体外静态培养14 d内细胞生长情况,通过测量第7天和第14天杨氏模量和抗拉强度检测两种新生组织工程软骨的生物力学性能。结果扫描电镜观察在两组支架上体外培养3 d后的软骨细胞生长情况良好;定向Ⅰ/Ⅱ型胶原复合支架上种子细胞在5~11 d内增殖速度高于非定向Ⅰ/Ⅱ型胶原复合支架,两者差异有统计学意义(P<0.05);定向结构Ⅰ/Ⅱ型胶原软骨支架的压缩弹性模量和抗拉强度高于非定向Ⅰ/Ⅱ型胶原软骨支架,差异有统计学意义(P<0.05)。结论定向结构Ⅰ/Ⅱ型胶原软骨支架能够在特定时间段内促进细胞增殖,与软骨细胞体外静态培养后能够成功生成具有定向纤维结构、生物力学性能更好的组织工程软骨,是有良好应用前景的组织工程软骨支架材料。
Ⅰ/Ⅱ型复合胶原膜;定向支架;软骨细胞;软骨组织工程;生物力学
临床常见的关节软骨缺损很难自愈,传统治疗方法不能实现透明软骨修复[1]。组织工程软骨植入是治疗关节软骨缺损效果较为确切且安全性好的治疗方法[2]。Stark等[3]通过研究证明了软骨细胞在胶原膜上能够生存且进一步增殖。液态下的胶原蛋白形成一种胶状溶液,其作用可刺激细胞分裂,同时胶原蛋白的一部分降解产物可被细胞利用合成新的细胞外基质[4]。Yates等[5]的研究中使用Ⅰ型胶原海绵支架搭载牛软骨细胞,共培养后观察软骨细胞可以正常增殖并维持其表型稳定。基于Ⅱ型胶原蛋白具有促进去分化软骨细胞再分化与活化的能力[6],Ⅱ型胶原在组织工程软骨中越来越受重视。
关节软骨细胞外基质的胶原成分中Ⅱ型胶原蛋白含量为90%~95%[7]。正常人体关节软骨分为浅表层、移行层、柱状层和钙化层四层。钙化层是软骨与软骨下骨的过渡层,起着隔离软骨和软骨下骨的作用,同时将二者牢固地整合在一起,软骨营养主要来源于关节腔滑液,而关节液中的氧浓度明显低于软骨下松质骨的氧供浓度,软骨细胞适应低氧环境,低氧条件下有利于软骨细胞的分化、增殖,如果血液一旦侵入关节腔内,其中一些成分会因触发炎性反应而导致新生软骨细胞凋亡或坏死[17]。Ⅰ/Ⅱ型胶原复合支架的结构设计是与正常关节软骨的分层结构及软骨细胞顺胶原纤维方向呈柱状排列相对应,同时也有利于提高再生软骨组织的生物力学性能[8]。有学者曾采用温度梯度热诱导相分离(temperaturegradient-guidedthermal-inducedphaseseparation,TIPS)技术成功制备了软骨细胞基质来源的定向结构支架[9],此种方式较为繁琐,仪器设备要求较高,且其支架构成材料为单一Ⅱ型胶原,不能兼顾Ⅰ、Ⅱ型胶原在软骨细胞生长中的作用[10]。笔者在Ⅱ型胶原支架的制备中发现胶原在凝胶状态转置于超低温冰箱迅速冷冻后部分纤维结构可呈定向排列,经过真空冻干后可筛选接切出定向结构较为均匀的定向支架,再经过化学交联并与Ⅰ型胶原复合后可以制成具有纵向排列纤维结构的胶原支架。尚未见使用快速冷冻真空冻干法制备定向结构Ⅰ/Ⅱ型复合胶原支架并与软骨细胞共培养体外构建定向结构组织工程软骨的报道。
1 料与方法
1.1 材料
牛跟腱及关节软骨:北京市屠宰场购买的新鲜牛跟腱及猪膝关节关节软骨。
1.2 主要试剂及仪器
主要试剂:碳化二亚胺(EDC)(分析纯)(国药集团化学试剂有限公司);N-羟基琥珀酰亚胺(NHS)(分析纯)(国药集团化学试剂有限公司);乙烷磺酸(MES)(分析纯)(国药集团化学试剂有限公司);氯化钠(NaCl)(分析纯)(国药集团化学试剂有限公司);胃蛋白酶(美国Sigma);Ⅱ型胶原酶(美国Sigma);盐酸胍(国药集团化学试剂有限公司);氢氧化钠(NaOH)(分析纯)(国药集团化学试剂有限公司);超纯水(武警总医院医学实验中心提供);DMEM高糖培养基(Invitrogen,美国);胎牛血清(HyClon-e,美国)。
主要仪器:系统冷冻干燥机(中国四环LGJ-10C);磁力加热搅拌器(中国国华78-1);电子天平(美国DenverTB-2002/203);台式低温高速离心机(美国贝克曼);倒置荧光显微镜(日本奥林帕斯IX-71);超微量分光光度计(美国Alphaspecul);酸碱测定仪(美国贝克曼);立式恒温振荡器(美国精骐);Milliproe超纯水机制造系统(英国ELAGACENTRA-200);可调高速匀浆机(中国FS-1型);低速冷冻离心机(中国长沙湘智DL-5);-80℃低温冰箱(日本SANYO-530L);扫描电子显微镜(scanningelectronicmicroscope,SEM,Hitachi,日本);生物材料力学测试机(Shimadzu,日本)。
1.3 方法
1.3.1 定向结构Ⅰ/Ⅱ型胶原软骨支架制备及性能检测1.3.1.1Ⅰ型胶原蛋白的提取以新鲜牛跟腱为原料,采用乙醇脱脂-乙酸溶胀-胃蛋白酶消化-盐析-透析-真空冷冻干燥法提取Ⅰ型胶原蛋白,并用超微量分光光度计在220~800nm波长范围内,进行紫外吸收峰扫描,测定样品最大紫外吸收峰的波长。
1.3.1.2 Ⅱ型胶原蛋白的提取将猪膝关节股骨髁软骨以手术刀小心剃下,混入少量75%酒精后置于匀浆机打碎,采用乙醇浸泡脱脂-盐酸胍去糖蛋白-胃蛋白酶消化-盐析-透析-真空冷冻干燥提取Ⅱ型胶原蛋白[11],并用超微量分光光度计进行紫外吸收峰扫描,测定样品最大紫外吸收峰的波长。
1.3.1.3 定向与非定向结构Ⅱ型胶原支架制备Wu等[12]研究证明了单向冻干法制备定向多空明胶支架的可行性。笔者将制备好的Ⅱ型胶原二次溶胀制成凝胶状,浓度为150mg/mL,常温下小烧杯中磁力搅拌器搅拌6h,将凝胶状Ⅱ型胶原转置入培养皿中。胶原凝胶置于未预冷的真空冻干机中,打开真空抽干机,可见大量气泡逐渐膨胀破裂,待胶原凝胶膨胀至将要溢出器皿时关闭真空抽干机并放气,重复此操作3~5次可见胶原凝胶中气泡消失。将除完气泡的凝胶置于-80℃超低温冰箱快速冷冻24h,去除冷冻后的胶原凝胶快速置于提前遇冷至-35℃真空冻干机中真空冷冻抽干24h。观察冻干后的胶原支架有部分区域呈均匀定向排列,以眼科剪剪取直径5mm、厚度3mm具有垂直定向结构的Ⅱ型胶原支架。同时采用传统的真空冻干法制备非定向Ⅱ型胶原支架。
1.3.1.4 制备Ⅰ/Ⅱ复合胶原膜将制备好的Ⅰ型胶原二次溶胀,配制浓度为200mg/mL的Ⅰ型胶原凝胶,均匀铺在直径5 cm培养皿中,超净工作台中风干。将直径5mm、厚度3mm的定向结构Ⅱ型胶原支架铺于风干后的Ⅰ型胶原膜上。非定向Ⅱ型胶原海绵采取同样方法切割并铺于风干后的Ⅰ型胶原膜上,倒入配制好的碳二亚胺交联剂(含0.05 mol/LMES、0.033 mol/L EDC和0.02 mol/L NHS,95%的乙醇溶液)并置入立式恒温振荡器室温下交联24 h后,配制交联剂再次交联24 h,超纯水反复冲洗5次。普通光学显微镜及SEM观察定向支架及非定向支架的微观结构特咖。
1.3.2 构建新生组织工程软骨及相关检测
采用3周龄新西兰大白兔膝关节软骨为材料,经Ⅱ型胶原酶消化法提取关节软骨细胞[13],体外扩增培养至第2代,移液器吸取细胞悬液分别接种两组支架,细胞接种数量控制在10.0×105个/块。培养3 d后利用SEM观察软骨细胞在定向Ⅰ/Ⅱ型胶原支架和非定向支架上的形态及分布特咖,采用MTT方法检测细胞在两组支架上的增殖情况。在共培养第7天和第14天利用生物材料力学测试机分别测定两组新生组织工程软骨的杨氏模量(0.05 N,速率0.01 mm/s,行程:初始高度的4%,松弛相:2000 s)和抗拉强度(5mm/min拉伸),检测两组新生组织的生物力学性能。
1.4 统计学方法
采用SPSS 13.0统计软件,若数据符合正态分布以均数±标准差(表示。采用独立样本t检验(independent-tests)比较MTT法检测的细胞在两组支架上增殖情况,采用单因素方差分析(one-way ANOVA)比较两组新生组织工程软骨生物力学性能,以P<0.05为差异有统计学意义。
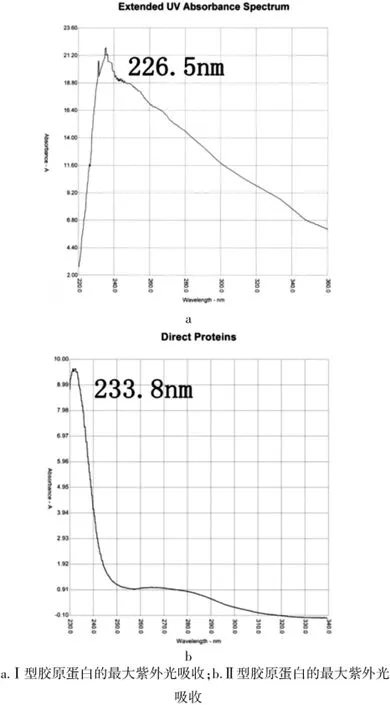
图1 胶原蛋白的紫外吸收峰

图2 定向结构支架与非定向结构Ⅰ/Ⅱ型支架示意图及Ⅱ型胶原定向与非定向支架
2 果
2.1 胶原紫外吸收峰及大体和显微镜观察支架结构
经过超微量分光光度计(Picdrop Application系统软件)测定Ⅰ型胶原蛋白的紫外光吸收值在226.5 nm左右形成一个波峰(图1a);Ⅱ型胶原凝胶在233.8 nm左右形成一个较高的波峰(图1b),这符合Ⅱ型胶原最大吸收峰特征[14]。支架大体结构及显微镜观察示Ⅰ/Ⅱ型双层复合胶原膜结构中,底层为高度致密、光滑、均匀的Ⅰ型胶原膜;顶层为相对低密度Ⅱ型胶原膜层,表面呈白色、粗糙、海绵样结构,镜下孔径致密,分布较均匀,为软骨细胞提供良好的生长环境;Ⅰ、Ⅱ型双层胶原膜之间经过化学交联,使它们结合紧密,坚固牢靠无空隙。交联后的定向结构支架显微镜下可见胶原纤维平行排列,非定向胶原支架纤维镜下可见胶原纤维无序排列(图2~3)。
2.2 扫描电镜观察定向与非定向双层支架微观结构
对定向支架横切面的SEM观察发现,横切面胶原纤维排列虽然缺少一定规律,但可见管状空道,孔道间有空隙相互贯通(图4a,封三)。纵切面观察可见上方纵向规律排列的Ⅱ型胶原纤维及与之密切交联、密度较大的Ⅰ型胶原底面(图4b,封三)。非定向支架SEM观察其横向和纵向切面胶原纤维排列无显著差异,纤维排列呈均匀多孔状结构,排列无序相互间有微孔贯通(图5a、b)。
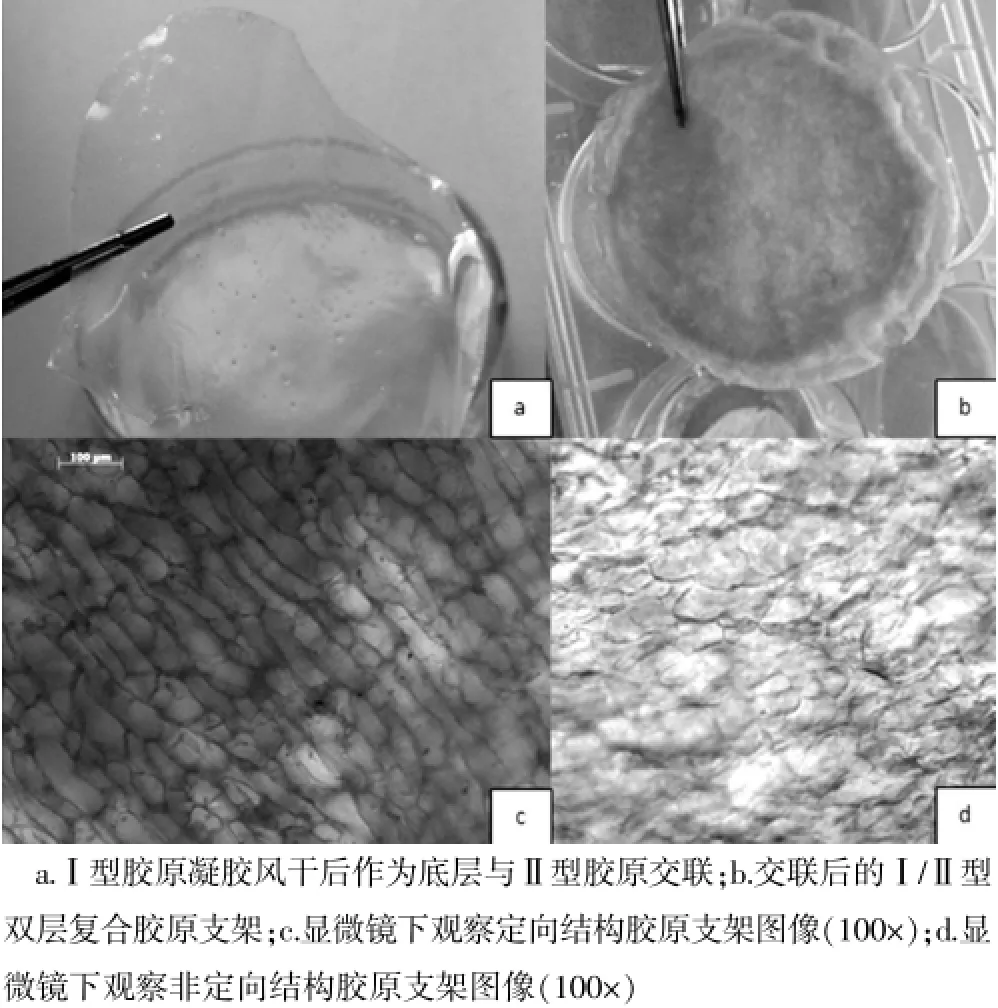
图3 定向结构Ⅰ/Ⅱ型胶原支架大体观察及显微镜下观察
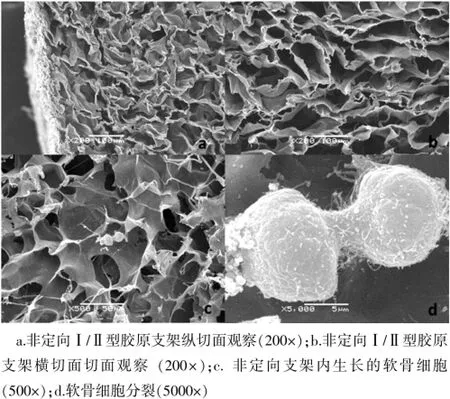
图5 扫描电子显微镜下非定向支架微结构观察
2.3 扫描电镜观察软骨细胞在两组双层支架上的生长情况
将兔软骨细胞植入两组胶原支架后共培养3 d,SEM观察两组支架上均能发现正常生长的软骨细胞,软骨细胞黏附于定向支架内平行排列微观孔道的孔壁上,细胞分布具有一定的规律性和方向性(图4c,封三),可见细胞伸出伪足,生长状况良好(图4d,封三);非定向软骨支架中的软骨细胞分布较为随机和均匀,无明显的方向性(图5c),生长状况良好(图5d)。
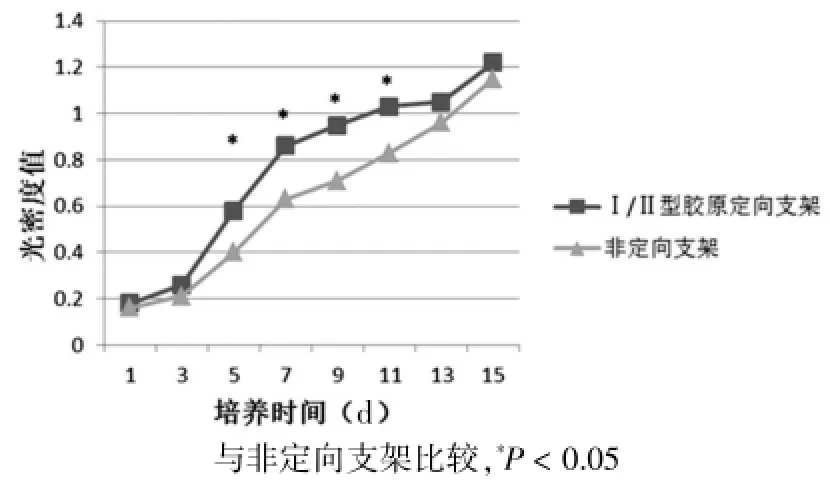
图6 软骨细胞在定向支架及非定向支架上的增殖
2.4 MTT法检测软骨细胞不同时间段在两组双层胶原支架上的增殖情况
第1~4天时定向结构Ⅰ/Ⅱ型胶原支架与非定向Ⅰ/Ⅱ型胶原支架上细胞数量差异无统计学意义(P>0.05);第5~11天定向结构Ⅰ/Ⅱ型胶原支架中细胞数量大于非定向支架组,差异有统计学意义(P<0.05);第12~15天两组支架细胞数量再次趋于一致,差异无统计学意义(P>0.05)(图6)。
2.5 生物力学检测
培养第7天,定向结构Ⅰ/Ⅱ型胶原支架与非定向Ⅰ/Ⅱ型胶原支架压缩弹性模量分别为(0.21± 0.04)、(0.11±0.03)MPa,差异有统计学意义(P<0.05);抗拉强度分别为(0.88±0.05)、(0.53±0.04)MPa,差异有统计学意义(P<0.05)。培养第14天,定向Ⅰ/Ⅱ型胶原支架压缩弹性模量为(0.33±0.09)MPa,非定向Ⅰ/Ⅱ型胶原支架压缩弹性模量为(0.20±0.06)MPa,差异有统计学意义(P<0.05);抗拉强度分别为(1.01±0.08)、(0.63±0.07)MPa,差异有统计学意义(P<0.05)。但两组均明显低于正常关节软骨的压缩弹性模量[(0.69± 0.09)MPa]、抗拉强度[(5.20±0.72)MPa],差异有统计学意义(P<0.05)(图7~8)。
3 论
当前国内临床医生在治疗关节软骨缺损时采取的主要方法有骨髓刺激技术,如软骨下钻孔术、微骨折手术等,而这些技术新生软骨大多为纤维样软骨,另一种常用的手术为马赛克技术,该技术取自体非负重区软骨作为移植供体,对于患者本身可能造成二次损伤[15]。近年蓬勃发展的基质诱导的自体软骨细胞移植(MACI)技术已应用于临床且被证明是一种临床效果显著、再生软骨以透明软骨为主的软骨缺损理想治疗方法[16]。但是当前国内用于构建组织工程软骨的细胞支架材料各不相同且多为单一类型支架,实验研究中若没有类似软骨基底层的隔离,来源于软骨下骨的血液会侵入关节腔内,其中一些成分不仅会对软骨缺损修复研究产生干扰,更严重地会触发炎性反应而导致新生软骨细胞凋亡或坏死。这也就要求我们在制备软骨细胞支架时要模拟正常关节的骨软骨分层结构,才能更好地促进关节骨软骨缺损的修复[17],其在临床中对人体关节软骨缺损的治疗作用尚待进一步试验证实。胶原纤维和软骨细胞整体上具有柱状排列的趋势并垂直于关节表面,这种高度方向性的排列方式对于正常关节软骨机械力学性能的维持尤为重要[18]。
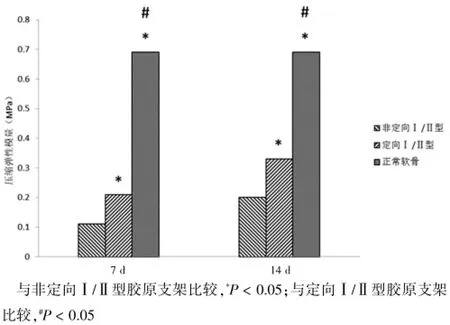
图7 新生组织工程软骨压缩弹性模量检测
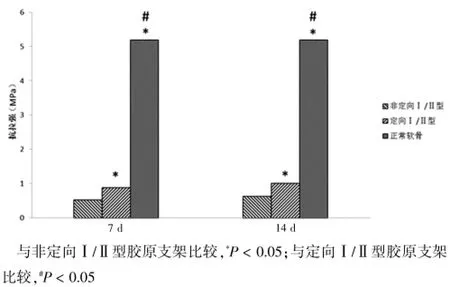
图8 新生组织工程软骨抗拉强度检测
Ⅰ/Ⅱ型双层复合胶原膜结构中,底层为高度致密、光滑、均匀的Ⅰ型胶原膜,镜下孔径微小;顶层为高浓度Ⅱ型胶原膜层,表面呈白色、粗糙、海绵样结构,镜下孔径致密,分布较均匀,为软骨细胞提供良好的生长环境;Ⅰ、Ⅱ型双层胶原膜之间经过化学交联,使它们结合紧密,坚固牢靠无空隙[19]。在培养第5~11天细胞增殖量定向Ⅰ/Ⅱ型胶原支架明显多于非定向支架,原因可能为培养初期软骨细胞沿着定向支架中纵向排列的微观孔道向支架内部快速迁移,同时代谢产物交换和营养物质输送得到了促进,因而导致细胞增殖速度明显提高[20]。随着支架上种子细胞的数量及软骨细胞不断分泌的基质成分持续增多,可能部分堵塞定向微管孔壁上相互贯通的孔隙,抵消了定向支架所具有的优势,导致两组支架上的细胞数量最终趋于一致。通过压缩弹性模量检测和抗拉强度检测说明定向结构Ⅰ/Ⅱ型胶原支架的机械力学性能高于传统非定向支架,原因可能是定向结构Ⅰ/Ⅱ型胶原支架所具有的垂直平行排列微管结构提高了组织工程软骨力学性能,在一定时间段内促进了软骨细胞的增殖和自分泌,这也可能有助于提高组织工程软骨的力学性能。虽然笔者在实验中未检测比较定向结构Ⅰ/Ⅱ型胶原支架与传统的定向结构支架间生物力学性能间的差别,但传统的定向结构微观通道软骨支架多为单纯Ⅱ型胶原,而本研究在此基础上于Ⅱ型胶原底部增加了较为致密且生物力学性能更强的Ⅰ型胶原,这也就大大增强了复合胶原膜的生物力学性能,而其增强程度有待于进一步研究。
[1]MarcacciM,FilardoG,Kon E.Treatmentofcartilage lesions:whatworksand why?[J].Injury,2013,44 Suppl1:S11-S15.
[2]Basad E,Wissing FR,Fehrenbach P,et al.Matrix-induced autologous chondrocyte implantation(MACI)in the knee:clinical outcomes and challenges[J].Knee Surg Sports TraumatolArthrosc,2015,23(12):3729-3735.
[3]Stark Y,Suck K,Kasper C,et al.Application of collagen matrices for cartilage tissue engineering[J].Exp Toxicol Pathol,2006,57(4):305-311.
[4]Tekari A,Luginbuehl R,Hofstetter W,et al.Chondrocytes expressing intracellular collagen typeⅡenter the cell cycle and co-express collagen type I in monolayer culture[J].J Orthop Res,2014,32(11):1503-1511.
[5]Yates KE,Allemann F,Glowacki J.Phenotypic analysis of bovine chondrocytes cultured in 3D collagen sponges:effect of serum substitutes[J].Cell Tissue Bank,2005,6(1):45-54.
[6]蒋萍,蔚芃,赵明才,等.Ⅰ、Ⅱ型胶原蛋白对人软骨细胞生物学特性的影响[J].中国组织工程研究,2014,18(30):4845-4850.
[7]Mirzayan R.Cartilage Injury in the Athlete[M].New York:Thieme Medical,2006:1-20.
[8]Duan W,Da H,Wang W,et al.Experimental study of tissue engineered cartilage construction using oriented scaffold combined with bonemarrow mesenchymal stem cells in vivo[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2013,27(5):513-519.
[9]Ding X,Zhu M,Xu B,et al.Integrated trilayered silk fibroin scaffold for osteochondral differentiation of adiposederived stem cells[J].ACSAppl Mater Interfaces,2014,6(19):16696-16705.
[10]罗琦,刘凯.细胞团块悬浮培养法对兔关节软骨细胞表型维持效果的研究[J].中国医药导报,2015,12(35):20-25.[11]刘安军,宋晓娣,郑捷,等.猪Ⅱ型胶原及胶原肽抗关节炎的研究[J].现代食品科技,2014,30(3):1-6.
[12]Wu X,Liu Y,LiX,etal.Preparationofaligned porousgelatin scaffolds by unidirectional freeze-dryingmethod[J].Acta Biomater,2010,6(3):1167-1177.
[13]闫虎,苏友新,林学,等.Ⅱ型胶原酶消化法培养兔关节软骨细胞[J].中国组织工程研究,2013,17(50):8647-8653.
[14]Ghezzi CE,Marelli B,Muja N,et al.Mesenchymal stem cell-seeded multilayered dense collagen-silk fibroin hybrid for tissue engineering applications[J].Biotechnol J,2011,6(10):1198-1207.
[15]Valderrabano V,Leumann A,Rasch H,etal.Knee-to-anklemosaicplasty for the treatmentof osteochondral lesions of the ankle joint[J].Am JSportsMed,2009,37 Suppl1:105S-111S.
[16]Wiewiorski M,Leumann A,Buettner O,et al.Autologous matrix-induced chondrogenesis aided reconstruction of a large focalosteochondral lesion of the talus[J].Arch Orthop Trauma Surg,2011,131(3):293-296.
[17]笪虎,刘建.致密层在骨软骨复合支架修复兔关节骨软骨缺损中作用的研究[D].西安:第四军医大学,2013.
[18]Wu JZ,HerzogW.Elastic anisotropy ofarticular cartilage is associated with the microstructures of collagen fibers and chondrocytes[J].JBiomech,2002,35(7):931-942.
[19]封占增.京尼平、戊二醛或EDC/NHS的交联对构建胶原/壳聚糖真皮支架的作用[D].杭州:浙江大学,2014.
[20]Tekari A,Luginbuehl R,HofstetterW,et al.Transforming growth factor beta signaling is essential for the autonomous formation of cartilage-like tissue by expanded chondrocytes[J].PLoSOne,2015,10(3):e0120857.
Observation of chondrocytes proliferation in oriented com posite typeⅠ/Ⅱcollagen scaffold and biomechanical property of new tissue
ZHANG Jiating1,2ZHANG Dongzheng2HOU Jianlei2ZHANG Zhongwen2▲
1.logistic University of People's Armed Police Force,Tianjin 300309,China;2.Department of Cartilaginous Orthopeadics,General Hospital of Armed Police Forces,Beijing 100039,China
Objective To fabricate an oriented composite typeⅠ/Ⅱcollagen scaffold combined with chondrocytes for enhancement of the biomechanical property of tissue-engineered cartilage in vitro.M ethods The typeⅠand typeⅡcollagen extracted from bovine tendon and pig knee articular cartilage were prepared.Collagen maximum UV absorption peak was detected by themicroliter spectrophotometer.Oriented composite typeⅠ/Ⅱcollagen scaffoldswere fabricated composed ofmicrotubules arranged in parallel in vertical sectionvia quick freezing and vacuum freeze-drying process.At the same time,non-oriented typeⅠ/Ⅱcollagen scaffolds were fabricated via the vacuum freeze drying method.Oriented typeⅠ/Ⅱcollagen scaffolds and non-oriented typeⅠ/Ⅱcollagen scaffolds were seeded with rabbit chondrocytes and the growth of chondrocytes were observed with scanning electronic microscope 3 days later.Cellscaffold constructs were measured by MTTmethod to observe the growth of chondrocytes within 14 days.Mechanical properties of oriented and non-oriented scaffolds were determined by measurement of Young modulus and tensile strength on the 7th day and 14th day after co-cultured vitro.Resu lts Under the scanning electron microscope,the cells adhered to both oriented scaffolds and non-oriented scaffolds grew well on the third day after co-culture.The proliferation was statistically significantly higher in the oriented typeⅠ/Ⅱcollagen scaffold group than in the non-oriented scaffold group from day 5 to day 11(P<0.05).The compressivemodulus and tensile strength of oriented scaffoldswere higher than thatof a typical non-oriented scaffold(P<0.05).Conclusion The results indicate that composite typeⅠ/Ⅱcollagen scaffolds can promote cell proliferation within certain time periods and enhance the biomechanical property of tissue-engineered cartilage in vitro and thus represent a promisingmaterial to tissue engineering cartilage.
TypeⅠ/Ⅱcollagen scaffold;Oriented scaffold;Chondrocytes;Cartilage tissue engineering;Biomechanical property
R684.3;R318.01
A
1673-7210(2016)05(c)-0025-06
2016-02-02本文编辑:张瑜杰)
武装警察部队总医院课题(WZ2012016)。
▲通讯作者
