西林火姜健康组培苗快繁体系的建立
2016-11-21黄皓周生茂尚小红郭元元文俊丽班美玲王玲平陶伟车江旅陈振东
黄皓 周生茂 尚小红 郭元元 文俊丽 班美玲 王玲平 陶伟 车江旅 陈振东
西林火姜健康组培苗快繁体系的建立
黄皓周生茂尚小红郭元元文俊丽班美玲王玲平陶伟车江旅陈振东
为了筛选出西林火姜健康组培苗快繁体系,以西林火姜的茎尖为组培材料,对其组培苗分化、增殖和生根同步培养基进行了筛选,并对组培苗进行了病菌和病毒检测。试验结果显示,适合西林火姜分化、增殖和生根一步成苗的培养基配方为MS+4.0 mg/L 6-BA+0.2 mg/L NAA;在组培苗后期壮苗时加入蔗糖、活性炭和多效唑的浓度分别以4%、0.10%和0.05%最佳;目前生产中对于常用的生姜健康组培苗还不能完全脱除病菌和脱毒,表明生姜健康组培苗快繁体系因生姜基因型而异,而且目前的脱病菌和脱毒技术还需改进。
生姜(Zingiber officinale Roscoe)为姜科姜属多年生草本宿根单子叶植物,富含挥发油和姜辣素等功能性有效成分,以地下肥大的肉质根状茎为食用器官,是典型的药食两用的经济作物,在我国中部、东南部和西南部各省广泛种植[1,2]。我国生姜常年种植面积达63万hm2,年产量已达1 000万t,约占世界产量的45%,出口量居世界第一[3]。广西是我国生姜的主要产区之一,据农业部门统计,常年种植面积达5万hm2,主要分布在桂西北的石山区和邻近云贵高原的县市区域,是当地农户的主要收入来源。因此,生姜产业对于广西乃至我国生姜种植户增收和实现小康极为关键。
生姜依照姜块大小和品质优劣可分为小姜型、中姜型和大姜型[4],在广西上述3种类型都有种植,其中小姜型种植面积最大,因为其药食和加工兼用。因为生姜在我国栽培时极少开花,即使开花,也常常无花粉,无法进行杂交种生产,所以,长期以来生产上主要靠块根进行无性繁殖,但无性繁殖会导致姜体积累大量的病菌和病毒[5]。其中,姜瘟病和花叶病毒病是生姜栽培中最主要的病害,一般产量损失可达20%~30%,重则50%~70%[5,6],严重制约了生姜产业可持续发展。
植物组培快繁技术快速发展,并成功应用于生姜组培苗的脱菌、脱毒,其作用明显,不仅提高了生姜的产量和品质,而且降低了姜种成本,获得了较好的经济效益[7]。但是在生姜组培苗生产过程中,也存在许多因素制约了产业的进一步发展,比如组培分化继代的时间过长、后期移栽成活率不高、种块生产成本过高等[8]。而且培养基还存在生姜基因型差异,比如先前利用莱芜大肉姜组培苗生产所用培养基进行西林火姜继代,但未获得理想的继代系数。为了解决这些问题,许多研究者根据试材特性,筛选更适合组培苗生长的配方,例如分化、增殖和生根一步成苗的配方;为提高后期移栽成活率,进一步摸索更好的壮苗配方;为继续压低组培苗生产过程中的成本,利用木薯粉替代蔗糖[9]或使用液体培养基[10],取得了很好的效果。
为了建立广西地方生姜品种西林火姜健康组培苗快繁体系,生产更多脱菌脱毒的姜种,促进西林火姜健康组培苗产业可持续发展,以西林火姜为组培材料,开展了西林火姜分化、增殖和生根一步成苗和培育健壮组培苗的培养基筛选试验。
1 材料与方法
1.1试验材料
西林火姜姜种由广西西林汇浤工贸有限责任公司提供。西林火姜又名细肉姜、小黄姜,株高80 cm,分枝较多,姜球较小,个体匀称,呈双层排列,根、茎、皮、肉皆为淡黄色,嫩芽紫红色,肉质致密,辛辣味浓,是制作烤姜块(片)的主要原料。
1.2试验方法
①分化、增殖和生根同步培养基的筛选a.培养基配制。为筛选出脱毒姜的分化、增殖和生根同步化培养基,首先,以MS培养基为组培的基本培养基,向MS中分别添加6-BA(以A表示,下同)、NAA(以B表示,下同)和IBA(以C表示,下同)3种激素,每种激素设4个浓度,然后,按正交设计表L16(43)确定组合处理数为 16个,除 1号处理为对照1外,另分别以仅加0.2 mg/L NAA(17号)、0.2 mg/L IBA(18号)和MS培养基(即无激素,19号)作为其他3个对照(表1)。
b.外植体培养与接种。西林火姜姜块用50%多菌灵800倍液浸泡处理30 min后捞出晾干,置于催芽盒中,在25℃条件下恒温催芽。当姜芽长到1~2 cm及时切下,先表面清洗,再用0.1%HgCl2溶液消毒并冲洗干净,在解剖镜下剥取大小为0.2~0.5 mm的茎尖,接种于培养基上。
每个处理10瓶,每瓶 2个单芽,60 d后统计并计算每个处理的平均分化率、芽增殖倍数和生根率,以此确立西林火姜芽尖分化、增殖和生根同步培养基。
②病原检测a.细菌检测。在超净工作台上选取每瓶组培苗根部组织和附近琼脂的混合样本约0.5 g,用总土壤DNA提取试剂盒 (美国Mpbio公司)提取样本总DNA。以提取的总DNA为模板,大肠杆菌活化菌株为阳性对照,用筛选出来的细菌16S rRNA扩增引物进行扩增,并电泳检测其条带的大小,以判断样品是否含有细菌。
b.病毒检测。利用ELISA试剂盒(购自上海裕平生物科技有限公司),对组培苗中的烟草花叶病毒进行检测。检测方法依照试剂盒说明进行,根据酶联板样品的显色情况,用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中烟草花叶病毒(TMV)浓度。
③不同因素对组培苗后期壮苗的影响为培育壮苗,提高后期移栽的成活率,分别探讨了蔗糖、活性炭和多效唑浓度3个因素对西林火姜组培苗生根后期生长发育的影响。基本培养基为MS+ 4.0 mg/L 6-BA+0.2 mg/L NAA,蔗糖浓度设0、4%、6%、8%4个梯度;活性炭浓度设0、0.05%、0.10%、0.20%4个梯度;多效唑浓度设0、0.5%、1.0%、1.5% 4个梯度。将通过检测的健康组培苗的芽分别接到含有不同浓度蔗糖、活性炭和多效唑的培养基中,每个芽长3 cm左右,每个处理20瓶,每瓶2个单芽,至第30天测定增殖数、株高、单株质量、单株生根率、单株生根数和单株平均根长等指标。
1.3数据统计
采用SPSS 18.0统计软件对数据进行统计,采用SSR法进行方差分析。

表1 西林火姜分化、增殖和生根同步培养基激素筛选的正交试验设计L16(43)表
2 结果与分析
2.1不同浓度6-BA、NAA和IBA对西林火姜平均分化率的影响
从表2结果可知,在3种激素不同浓度组合的处理中,6-BA浓度为3、4、5 mg/L组合处理的平均分化率均较高,都达到60%以上,而含2 mg/L 6-BA组合处理的平均分化率低于50%,不含6-BA的对照17、18、19号处理的平均分化率更是低于10%。且方差分析显示,6-BA浓度为3、4、5 mg/L的处理组合与浓度0、2 mg/L的组合处理差异显著,后2个处理间差异也达显著水平,说明培养基中添加6-BA显著促进姜芽分化;在6-BA浓度为3、4、5 mg/L的组合处理中,3、4 mg/L浓度组合处理的平均分化率普遍比5 mg/L的组合处理的高,处理5、6、9、11号的平均分化率超过70%,6号的最高,达75.05%,说明添加6-BA的浓度超过5 mg/L,组培西林火姜的分化率反而降低。当6-BA浓度在一定范围内,尽管NAA和IBA浓度不同,组培西林火姜的分化率差异变化不大,其中,以0.1 mg/L NAA的分化率较高,而不同IBA浓度诱导的分化率间不存在显著差异。说明3种激素中6-BA对西林火姜分化诱导作用最大,而NAA和IBA诱导作用较小,其中6号(A2B2C1)处理(MS+3.0 mg/L 6-BA+0.1 mg/L NAA)的诱导作用最优。
2.2不同浓度6-BA、NAA和IBA对西林火姜平均芽增殖倍数的影响
表2结果显示,在3种激素不同浓度组合处理中,6-BA浓度为0、2 mg/L的组合处理的芽增殖倍数均小于3(2号除外);而6-BA浓度为3、4、5 mg/L的组合处理的芽增殖平均倍数都大于4,在其他条件相同时,4 mg/L 6-BA组合处理的芽增殖倍数偏高;各处理间方差分析结果显示,3、4、5 mg/L组合处理的芽增殖倍数显著高于0、2 mg/L的组合处理,说明在培养基中添加6-BA有利于西林火姜组培的芽增殖。在相同6-BA浓度处理下,11号(A3B2C1)有最高的芽增殖平均倍数。这些结果说明,与NAA和IBA相比,6-BA对西林火姜组培芽增殖平均倍数的促进作用最大。
2.3不同浓度6-BA、NAA和IBA对西林火姜平均生根率的影响
从表2分析知道,除了1、19号组合处理外,其他组合处理的平均生根率均超过90%外;与对照19号相比,尽管1号处理与其促进生根作用的差异不显著,但是在培养基中添加NAA和IBA后,6-BA具有辅助促进生根的作用。在相同6-BA浓度条件下,西林火姜组培的平均生根率随着NAA浓度的增加而增加;在相同NAA浓度条件下,西林火姜组培的平均生根率也随着6-BA浓度的增加而增加;在相同的IBA浓度下,低浓度的NAA表现出低的平均生根率,但高浓度的NAA并不表现出高的平均生根率;上述结果说明,在促进西林火姜组培苗的生根作用上,NAA起主导作用,作用最大,6-BA与NAA起协调正向作用,而IBA的作用因浓度及其与不同浓度的6-BA和NAA组合而异。
综合分析认为,对西林火姜组培分化、增殖和生根影响最主要的因素为6-BA,其次是NAA,IBA虽然对后期生根有一定的影响,但作用的效果有抑有促,且不显著,另外,IBA对前期分化和增殖都起抑制作用,因此,研究认为西林火姜组培分化、增殖和生根同步培养基的适宜配方为 MS+4.0 mg/L 6-BA+0.2 mg/L NAA。
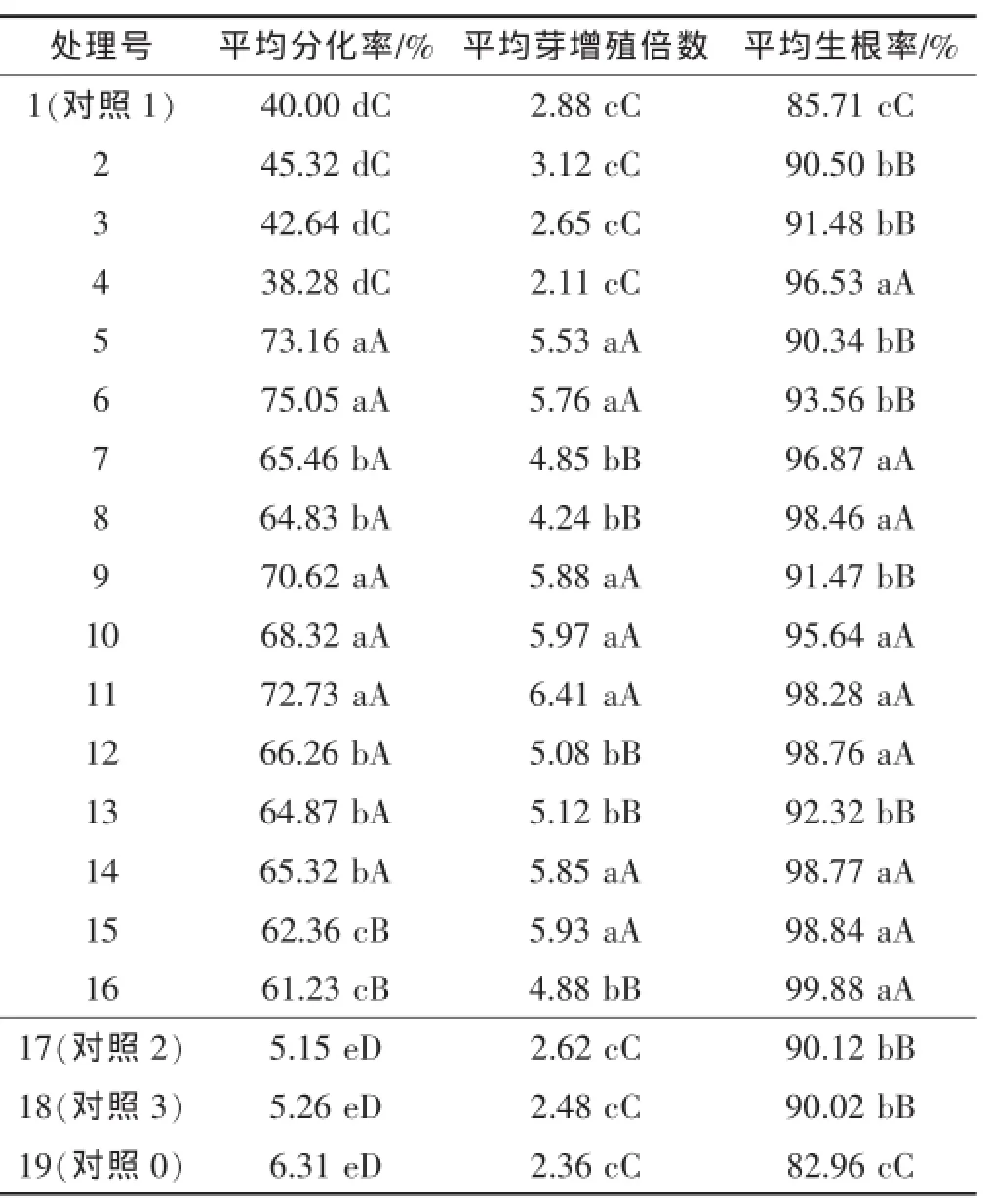
表2 西林火姜分化、增殖和生根同步培养基中不同浓度激素组合处理的结果
2.4病原检测
①细菌检测图1显示,以提取的样本总DNA为模板,用筛选出来的细菌16S rRNA扩增引物进行扩增,阳性对照扩增出大概1 500 bp左右的单一目的带,空白对照(阴性对照)没有条带,部分样品也出现目的带,说明部分样品可能带有内生菌。此检测方法可以快速方便地检测出组培苗是否含有细菌,达到快速筛选的目的。
②病毒检测用ELISA试剂盒对组培苗中的烟草花叶病毒进行检测。目前检测了部分组培苗烟草花叶病毒的含量,每1 g样品超过阈值4 ng TMV的有5个,占全部送样的30%左右,说明病毒脱毒率在70%左右。用茎尖培养出来的组培苗少部分还带有病毒,可能和茎尖大小、操作方法等因素有关。
2.5不同因素对组培苗后期壮苗的影响
①蔗糖浓度对组培苗壮苗的影响从表3可以看出,经过30 d培养后,随着蔗糖浓度的升高,平均增殖数和平均株高呈逐渐降低的趋势,这可能和较高浓度的蔗糖抑制芽的生长速率有关,但是平均单株质量、根长、根粗和生根数却先增加后减少,说明适当浓度的蔗糖能够促进根的生长。综合来说,添加4%、6%蔗糖的培养基中组培苗的平均单株质量、根长、根粗和生根数比其他蔗糖浓度高,其中添加4%蔗糖的培养基中组培苗增殖数相对较高,组培苗比较粗壮,而且根系较发达,叶色浓绿,说明4%是培育健壮组培苗的最佳蔗糖浓度。
②活性炭浓度对组培苗壮苗的影响从表4可以看出,加了不同浓度活性炭的培养基的组培苗平均增殖数都低于基本培养基,这可能与活性炭吸附部分激素导致激素不够有关。添加0.2%活性炭培养基的芽增殖数最低,但株高最高,较细弱。加了0.1%活性炭的培养基的平均根长、根粗和生根数都最高,说明0.1%活性炭可以适当促进组培苗根的生长,且苗粗壮、翠绿。
③多效唑浓度对组培苗壮苗的影响从表5可以看出,随着多效唑浓度的升高,平均增殖数和株高呈逐渐降低的趋势,可能和多效唑促进侧芽生长从而降低生长速率有关。平均单株质量、根长和根粗随着多效唑浓度升高而增加,但平均生根数却逐渐减少,说明较高浓度的多效唑促进根增粗、增长,但高浓度抑制根数的增多,也不利于根系的发育。添加0.05%多效唑培养基的组培苗相对较壮实,根系也较长、较粗,但较脆且易断,可能和多效唑促进横向增长且纤维减少有关,还需要进一步的研究。

图2 西林火姜组培苗脱菌检测示意
3 讨论与结论
随着植物组织培养技术的发展和应用,生姜健康种苗得到很好的开发,脱菌、脱毒效果明显,但是在组培培养基的利用上存在基因型的差异[5,11]。与韦坤华等[12]通过正交试验研究出莱芜大姜的繁殖生根同步化培养基为MS+2.5 mg/L 6-BA+0.4 mg/L NAA+0.2~0.3 mg/L ABT相比,本研究利用西林火姜为试材,结果是 MS+4.0 mg/L 6-BA+0.2 mg/L NAA更适合增殖和生根,而过高浓度的6-BA反而抑制分化且容易使芽产生玻璃化现象,且过高浓度NAA也不能显著促进根的生长发育,反而会降低芽的增殖倍数。齐兰等[14]以海南小黄姜的茎尖为外植体,摸索出适合外植体增殖和生根的培养基为MS+3.0 mg/L 6-BA+0.1 mg/L NAA,而Sathyagowri等[13]以本地生姜茎尖为材料,认为适合继代和生根的培养基为MS+5.0 mg/L 6-BA+0.5 mg/L NAA。研究结果的不一致可能和生姜基因型和培养方式不同等因素有关。
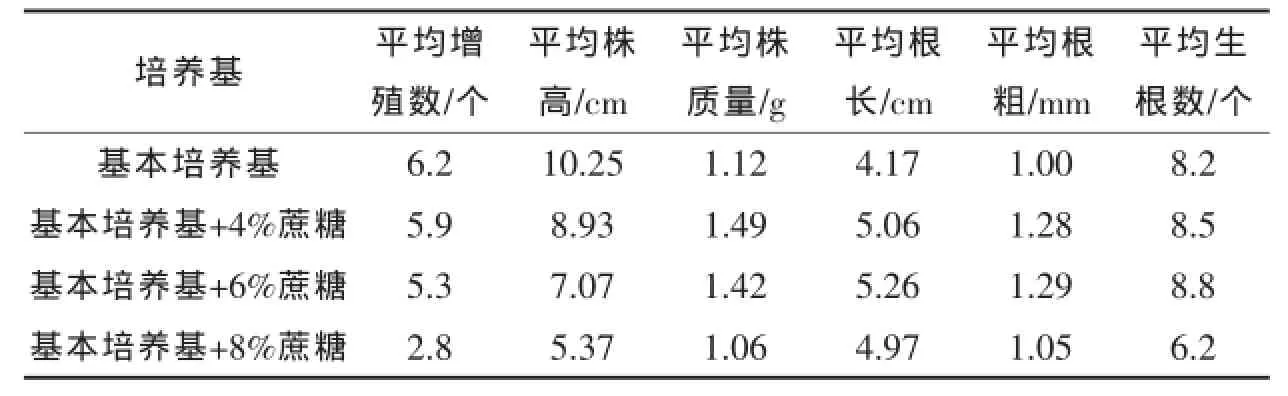
表3 不同浓度蔗糖处理30 d后对生姜组培苗增殖和生根的影响
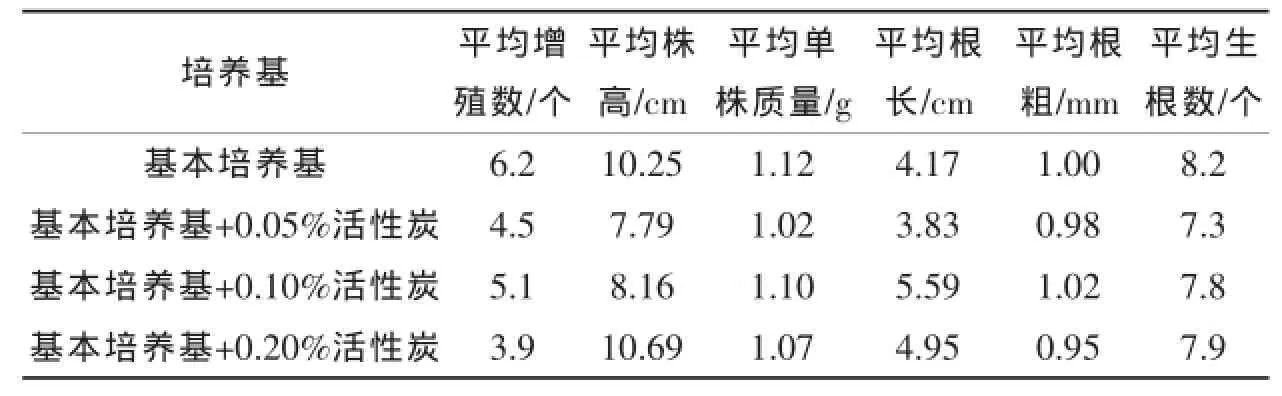
表4 不同浓度活性炭处理30 d后对生姜组培苗增殖和生根的影响

表5 不同浓度多效唑处理30 d后对生姜组培苗增殖和生根的影响
组培苗后期壮苗的培养也是一个重要的环节,培养出健壮的组培苗不仅能大大提高炼苗和移栽成活率,还可进一步降低生产成本。生姜组培主要用蔗糖作为碳源,不同时期需要的蔗糖浓度不一样。随着蔗糖浓度的增加,组培苗前期生长受到明显的抑制,部分表现出叶偏黄、生长缓慢等现象,但后期逐渐变壮,块根质量、根长和根数明显增加[14]。本研究结果表明,以4 mg/L蔗糖浓度为宜,过高浓度的蔗糖会抑制组培苗生长,因为组培苗难以承受过高的渗透压,这与周逊等[15]和Abbas等[16]的研究结果一致。活性炭也是影响壮苗的一个因素,它能吸附有害物质并提供暗环境促进根部发育。本研究发现,加入0.05%活性炭的培养基培育的苗最健壮且根部发达,适宜后期炼苗移栽,张华峰[17]研究表明,组培苗生根培养基中加入活性炭最合适的浓度为0.03%,而郭英华[18]研究则认为活性炭对根状茎诱导没有明显作用,因为过高浓度的活性炭会吸附过多的激素造成激素不足。多效唑大多用于培养试管姜,陈传红等[19]和王志敏等[20]研究多效唑对生姜组培苗和试管姜形成的影响时发现,一定浓度范围内的多效唑有利于组培苗的生长,并能提高组培苗的抗性。本研究发现,在培养基中加了0.05%多效唑,组培苗更壮实,根系更粗,但相对不加多效唑的培养基,组培苗根数减少,根系也相对脆,不太利于后期的移栽,这些问题有待于进一步的研究。综合来看,本研究的结论是生姜健康组培苗快繁体系因生姜基因型而异,而且目前的脱病菌和脱毒技术还需改进。
[1]木楠,刘焕芳,匡延凤,等.生姜根茎的发育过程及分泌腔的超微结构[J].热带亚热带植物学报,2015,23(2):151-159.
[2]朱丹实,刘仁斌,杜伟,等.生姜成分差异及采后贮藏保鲜技术研究进展[J].食品工业科技,2015,36(17):375-383.
[3]刘海芝,姜振升,侯文通,等.不同形态硅钙钾肥对生姜生长、产量及品质的影响[J].山东农业科学,2015,47(10):67-69.
[4]高山林,韦坤华.脱毒生姜培育和高产栽培技术[D].北京:金盾出版社,2013,3(1):7-9.
[5]宣朴,郭元林,岳春芳,等.生姜茎尖组培快繁技术研究[J].西南农业学报,2004,17(4):484-486.
[6]任清盛,于广霞,毕于义.姜脱毒及增产抗病性研究[J].中国植保导刊,2005(7):8-10.
[7]Seran T H.In vitro propagation of ginger(Zingiber officinaleRosc.)through direct organogenesis:a review[J]. Pakistan Journal of Biological Sciences,2013,16(24): 1 826-1 835.
[8]罗天宽.生姜脱毒快繁体系研究与脱毒姜推广体系探讨[D].杭州:浙江大学,2006.
[9]Umeh B U,Uguru M I.Comparative study on agar and cassava gelled media in in-vitro propagation of ginger[J]. African Journal of Agricultural Research,2013,22:2 793-2 798.
[10]李红梅,张侠,宋莉璐,等.生姜茎尖的组织培养及试管苗快繁体系的研究[J].山东科学,2008(5):36-38.
[11]Nkere C,Mbanaso E N A.Optimizing concentrations of growth regulators forin vitro ginger propagation[J].Journal of Agrobiology,2010,27(2):61-65.
[12]韦坤华,李林轩,缪剑华,等.姜的脱毒方法比较与繁殖生根同步化培养技术研究 [J].湖北农业科学,2013,52(18):4 522-4 525.
[13]Sathyagowri S,Seran T H.In vitroplant regeneration of ginger(Zingiber officinaleRosc.)with emphasis on initial culture establishment[J].International Journal of Medicinal and Aromati Plants,2011,3:195-202.
[14]齐兰,朱红林,陈健晓,等.海南小黄姜脱毒快繁技术研究[J].热带农业科学.2013(9):37-40.
[15]周逊,徐晓舒,潘辉,等.蔗糖浓度对遵义大白姜试管姜诱导的影响[J].湖北农业科学,2011,50(24):5 256-5 258.
[16]Abbas M,Aly U,Taha H,et al.In vitroproduction of microrhizomes in ginger(Zingiber officinale Rosc.)[J].Journal of Microbiology Biotechnology and Food Sciences,2014,4(2):142-148.
[17]张华峰.生姜(Zingiber officinale Rosc.)离体培养器官发生生理生化特性的研究[D].重庆:西南大学,2009.
[18]郭英华.生姜原生质体培养与体细胞变异[D].北京:中国农业大学,2005.
[19]陈传红,金卫根,杨柏云,等.蔗糖和多效唑对试管生姜形成的影响[J].热带亚热带植物学报,2006,14(2):146-150.
[20]王志敏,牛义,汤青林,等.多效唑对生姜试管苗生理特性的影响[J].西南大学学报:自然科学版,2009,31(10):39-42.
10.3865/j.issn.1001-3547.2016.20.012
广西科学研究与技术开发计划项目(桂科转14125003-2-10);广西农业重点科技计划项目(NY2014004);广西农业科学院科技成果转化项目(农成转2015008);广西农业科学院基本科研业务专项项目(2015YZ03);物种资源保护费项目(1120162130135252038)
黄皓,广西农业科学院蔬菜研究所,南宁,530007,
电话:0771-3247318,E-mail:804667483@qq.com
周生茂,通信作者,广西农业科学院蔬菜研究所,
E-mail:maomaozhou70@gxaas.net
尚小红,郭元元,文俊丽,陈振东,广西农业科学院蔬菜研究所
班美玲,广西环境保护科学研究院
王玲平,浙江省农业科学院蔬菜研究所
陶伟,车江旅,广西农业科学院
2016-06-21
