猫须草多糖脱蛋白脱色工艺
2016-11-21廖春燕许海润黄瑶
廖春燕,许海润,黄瑶
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室(广西科技大学),广西柳州545006)
猫须草多糖脱蛋白脱色工艺
廖春燕1,2,许海润1,黄瑶1,2
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室(广西科技大学),广西柳州545006)
以脱蛋白率和多糖保留率为指标,对Sevag法、三氯乙酸(TCA)法和三氯乙酸-正丁醇(TCA-NBA)法脱蛋白效果进行比较研究;采用活性炭脱色工艺,以脱色率和多糖保留率为指标,通过单因素和正交试验对影响脱色的因素进行了实验.结果表明:Sevag法为3种方法中最好的脱蛋白方法,活性炭脱色的最佳条件是脱色温度50℃,pH值等于6,活性炭用量1.5%,脱色时间20min.优化后的猫须草多糖脱蛋白脱色工艺稳定可靠,可为猫须草多糖的开发利用提供理论依据.
猫须草;多糖;脱蛋白;脱色
0 引言
猫须草为唇形科(Labiatae)肾茶属植物,学名为肾茶(Clerodendranthus spicatus).其性凉,可煎煮入药,服用具有排石利尿,清热利湿的功效,多用于治疗前列腺炎、乳腺癌、急慢性肾炎和肾衰竭等疾病[1-3].主要化学成分有糖苷类化合物、黄酮类化合物、多酚类化合物等[4-6].猫须草多糖具有多种药理活性,在抗肿瘤、降血糖和增强免疫机能方面具有独特的功效.
目前从中药提取多糖时多采用水作为提取剂[7-9].猫须草经热水浸提后得到的粗多糖常常混杂有色素、蛋白质等杂质,影响其进一步的开发和利用.
本试验采用sevag法、三氯乙酸法和三氯乙酸-正丁醇法对猫须草粗多糖进行脱蛋白处理[10-14],选择活性炭脱色法对多糖溶液进行脱色[15-18],确定最优工艺,为猫须草多糖的开发利用提供参考依据.
1 材料与方法
1.1材料与试剂
猫须草:购于柳州市中药店,产地广西;考马斯亮蓝G250、牛血清蛋白标准品:国药集团化学试剂有限公司;活性炭:广东省台山市化工厂;苯酚、无水乙醇、正丁醇、三氯甲烷等试剂均为分析纯.
1.2仪器与设备
SHZ-CD循环水式多用真空泵:上海普渡生化科技有限公司;UV-1100紫外可见分光光度计:上海美谱达仪器有限公司;DF-101S集热式恒温加热磁力搅拌器:上海普渡生化科技有限公司;800电动离心机:金坛市医疗仪器厂;HH-6数显恒温水浴锅:常州国华电器有限公司.
1.3试验方法
1.3.1猫须草多糖提取工艺
猫须草→烘干→粉碎→按料液比1∶25(g/mL)加入溶剂→60℃回流提取3 h→抽滤→旋转蒸发→浓缩液加入95%乙醇溶液在4℃下沉淀→无水乙醇、乙醚和丙酮洗涤沉淀后真空干燥→取适量沉淀用热水溶解,得粗多糖溶液.
1.3.2葡萄糖标准曲线的制作
多糖含量测定采用硫酸苯酚法[19].以葡萄糖为标准品,得标准曲线方程为y=2.412 1x-0.018 6,r=0.999 6.式中:x——葡萄糖质量浓度(mg/mL),y——吸光度.
1.3.3多糖保留率的测定
按照绘制标准曲线的方法测定样液的吸光度,计算样品中多糖含量,按下式计算多糖保留率.
1.3.4蛋白质标准曲线的制作
蛋白质含量测定采用考马斯亮蓝法[20].以牛血清白蛋白为标准品,得标准曲线方程y=0.328 0x+0.004 3,r=0.999 5.式中:x——蛋白质质量浓度(g/L),y——吸光度.
1.3.5脱蛋白率的计算
按照标准曲线的方法测定样液的吸光度,计算样品中多糖含量,按下式计算脱蛋白率.

1.3.6脱蛋白工艺的研究
sevag法:将氯仿与正丁醇以5∶1混合制得Sevag试剂.取20mL多糖质量浓度为1mg/mL的粗多糖溶液,按多糖溶液∶Sevag试剂=5∶1比例混合,剧烈振荡,待氯仿-正丁醇试剂与蛋白质反应完全后,4 000 r/min离心分离20min,弃去沉淀收集上清液,分别测定多糖含量和蛋白质含量,计算多糖保留率和脱蛋白率.
三氯乙酸法(TCA法):取质量浓度为1mg/mL粗多糖样品液20mL,加入0.2倍体积4%三氯乙酸溶液使之沉淀,20℃下混合25min,然后于4 000 r/min离心20min,弃去沉淀收集上清液,分别测定多糖含量和蛋白质含量,计算多糖保留率和脱蛋白率.
三氯乙酸-正丁醇法(TCA-NBA法):将三氯乙酸-正丁醇按体积比1∶5混合,然后取质量浓度为1mg/mL粗多糖溶液20mL加入等体积的三氯乙酸-正丁醇试剂,将混合物剧烈振摇30min,再静止1 h.分去水层与溶剂层(上层)交界处的变性蛋白,重复至水相与溶剂相的交界面无胶状变性蛋白质.澄清液分别测定多糖含量和蛋白质含量,计算多糖保留率和脱蛋白率.
1.3.7脱色率的测定
将猫须草多糖样液置于300 nm~700 nm波长下进行可见-紫外光全波长扫描.经扫描,猫须草多糖溶液在486 nm处有最大吸收峰;因此,选用486 nm作为猫须草多糖色素的测定波长.按下式计算脱色率:

1.3.8活性炭脱色单因素试验
脱色温度对脱色效果的影响:分别取pH值为6,质量浓度为1mg/mL的猫须草多糖溶液20mL,各加入1.5%活性炭,分别在30℃,40℃,50℃,60℃,70℃下脱色60min,抽滤,测定多糖含量和色素含量,计算多糖保留率和脱色率.
pH值对脱色效果的影响:分别取质量浓度为1mg/mL猫须草多糖溶液20mL,依次调节pH值为2,4,6,8,10,然后分别加入1.5%活性炭,于50℃恒温脱色60min,抽滤,测定多糖含量和色素含量,计算多糖保留率和脱色率.
活性炭用量对脱色效果的影响:分别取质量浓度为1mg/mL猫须草多糖溶液20mL,各加入0.5%,1%,1.5%,2%,2.5%活性炭,于50℃恒温脱色60min,抽滤,测定多糖含量和色素含量,计算多糖保留率和脱色率.
脱色时间对脱色效果的影响:分别取质量浓度为1mg/mL猫须草多糖溶液20mL,加入1.5%活性炭,分别于50℃恒温脱色20min,40min,60min,80min,100min,抽滤,测定多糖含量和色素含量,计算多糖保留率和脱色率.
1.3.9活性炭脱色正交试验[21-22]
在单因素试验的基础上,选取脱色温度(A),pH值(B),活性炭用量(C)和脱色时间(D)4个因素进行正交试验,以脱色率和多糖保留率为指标,按L9(34)正交表设计正交试验,因素水平表见表1.试验结果分析采用加权评分法;脱色率和多糖保留率的权重各为0.5,综合评分的计算方法为:
综合评分=(脱色率指标值/脱色率最大值)×0.5×100+(多糖保留率指标值/多糖保留率最大值)×0.5×100.

表1 因素水平表Tab.1 Factors and levels of theorthogonal test
2 结果与分析
2.1脱蛋白方法的比较
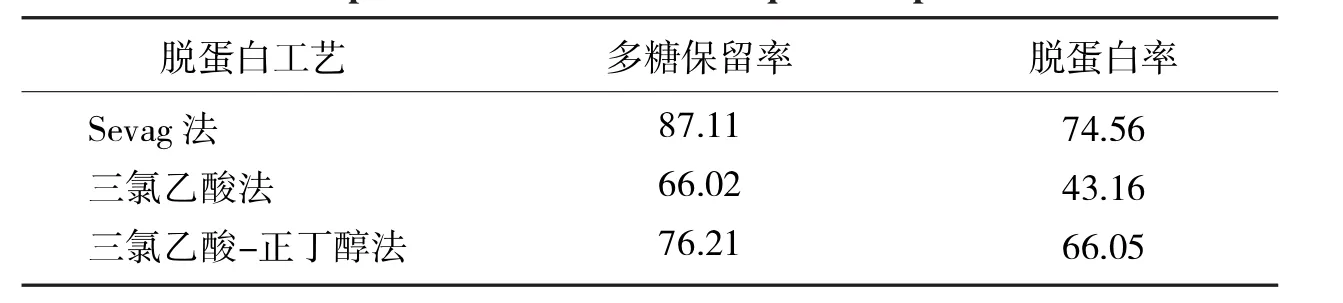
表2 不同方法脱蛋白效果比较Tab.2 Comparison of different techniquesfordeproteinization %
猫须草多糖溶液通过3种脱蛋白方法处理后,结果如表2所示.从表2可知,多糖保留率和脱蛋白率最高的是Sevag法,其次是三氯乙酸-正丁醇法和三氯乙酸法;因此,Sevag法对猫须草多糖脱蛋白效果最好.
2.2活性炭脱色工艺
2.2.1脱色温度对脱色效果的影响
由图1所示,随着温度升高,多糖保留率和脱色率先增大后减小,当温度为40℃时多糖保留率和脱色率均最大.温度较低时,分子扩散运动不明显,色素成分不能很好地与活性炭接触吸附;当温度过高时,多糖丧失活性,多糖损失量较大.综合考虑,温度选择在40℃左右.
2.2.2 pH值对脱色效果的影响
如图2所示,pH值增加,多糖保留率随之增加.pH值在2~4范围内多糖保留率较低.当pH>4时,多糖保留率增加.增大pH值,脱色率随之下降,表明酸性条件对脱色有利.综合考虑多糖保留率和脱色率,选择pH值为6左右.
2.2.3活性炭用量对脱色效果的影响
如图3所示,随着活性炭用量增加,脱色率增加.当活性炭用量大于2%时脱色效果增加缓慢.多糖保留量先增加后减小,当活性炭用量为1.5%时,保留率最高,随后随着活性炭用量增加,多糖损失量增大.原因是活性炭会吸附部分多糖.综合考虑,选择1.5%左右的活性炭用量.

图1 脱色温度对脱色效果的影响Fig.1 Effect of decoloring temperature on decolorization

图2 pH值对脱色效果的影响Fig.2 Effect of pH on decolorization
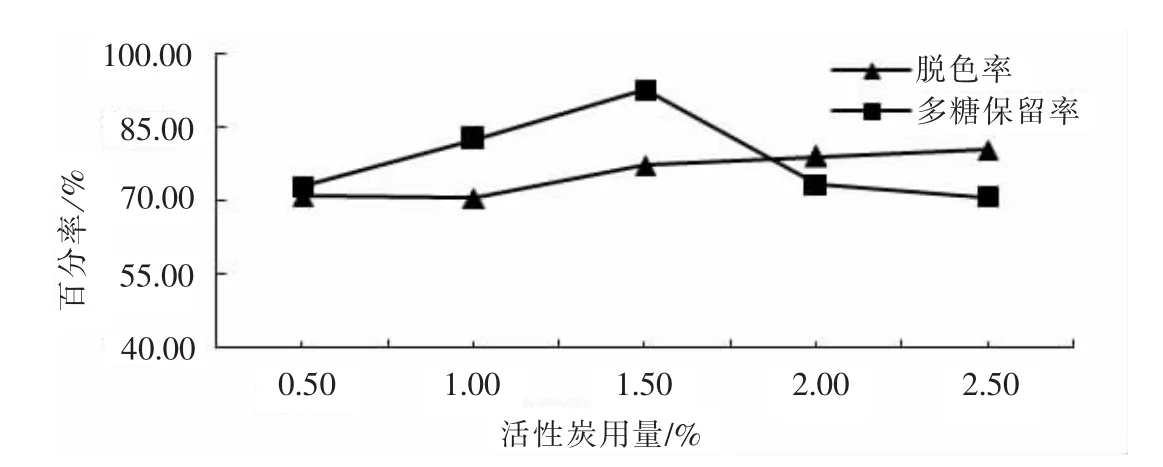
图3 活性炭用量对脱色效果的影响Fig.3 Effect of activated carbon dosage on decolorization
2.2.4脱色时间对脱色效果的影响
如图4所示,多糖保留率受时间影响不大,在40min时多糖保留率最高.脱色效果呈先増后减的趋势,40min时脱色效果最好,说明在一定时间内延长脱色时间有利于吸附脱色,当时间过长时可能使色素又溶于溶液中.综合考虑,选择脱色时间在40min左右.
2.2.5活性炭脱色正交试验
在单因素的基础上进行正交试验,以脱色率和多糖保留率为考察指标,确定最佳工艺条件.正交试验结果如表3所示,方差分析如表4所示.
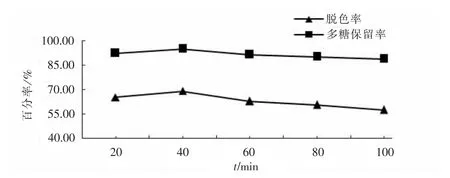
图4 脱色时间对脱色效果的影响Fig.4 Effect of decoloring time on decolorization
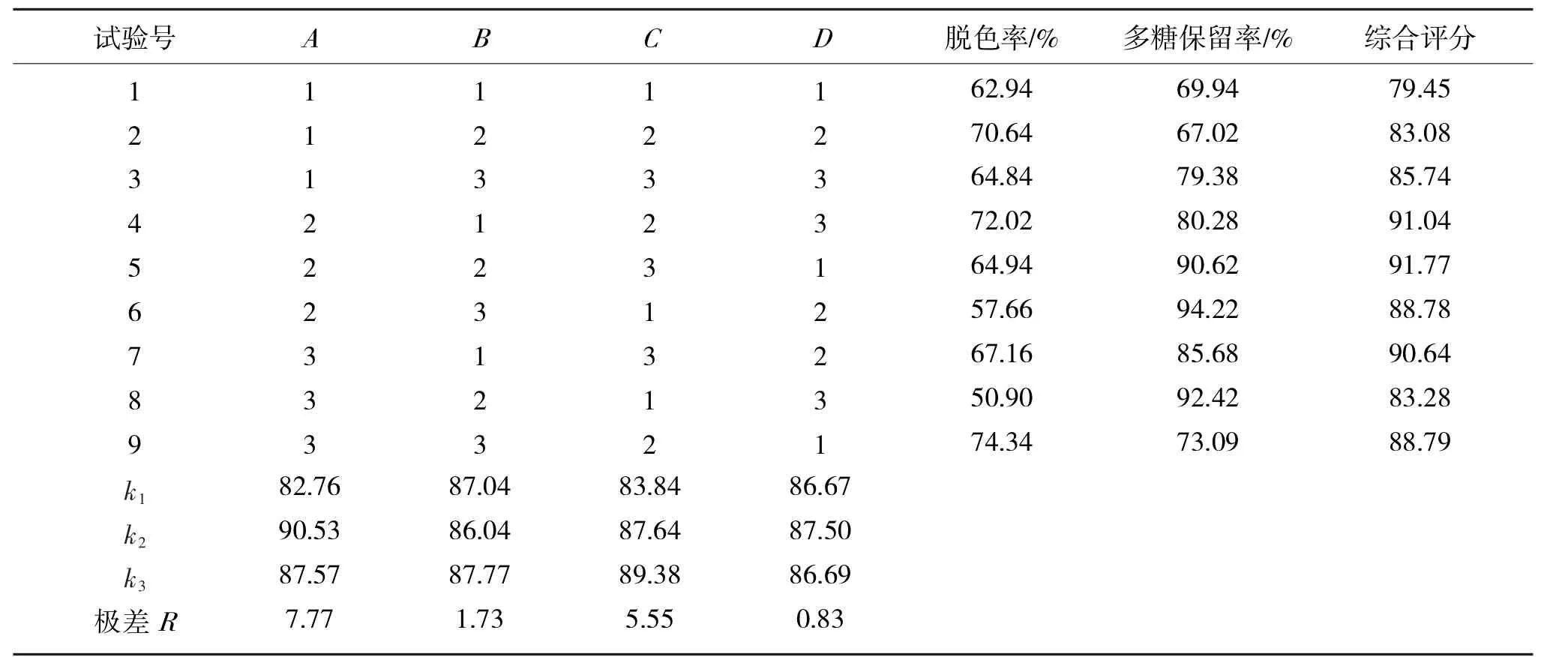
表3 正交试验结果Tab.3 Results of orthogonal tests
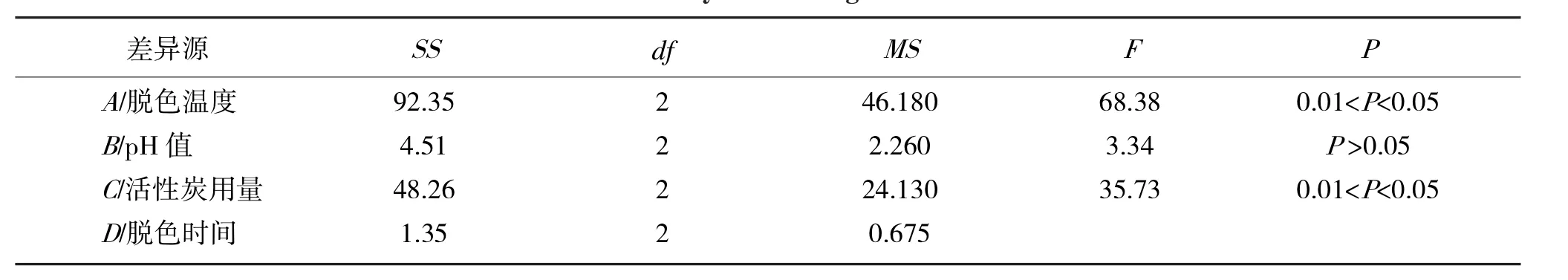
表4 方差分析表Tab.4 Variance analysis of orthogonal tests results
由表3分析可知,因素主次为脱色温度>活性炭用量>pH值>脱色时间;从方差分析表可知,A,C因素对结果有显著影响,由于D因素对结果影响不显著,从提高效率的原则选取脱色时间为20min;因此,确定活性炭脱色最优工艺条件为A2B3C3D3,即脱色温度50℃,pH值为6,活性炭最佳用量1.5%,脱色时间20min.在最佳条件下进行3次平行实验,得脱色率为72.37%,多糖保留率为85.57%,综合评分94.09,表明试验所确定的工艺条件为最优工艺条件.
3 结论
经比较,用Sevag法、三氯乙酸-正丁醇法、三氯乙酸法对猫须草多糖溶液进行脱蛋白实验,Sevag法脱蛋白效果最好.多糖损失的原因是Sevag试剂在去除蛋白变性胶状物时溶有一部分多糖.活性炭脱色最优工艺为反应温度50℃,pH值为6,活性炭用量1.5%,反应时间20min.该方法具有操作简便,原料易得,经济成本低,脱色效果明显等优点.样液经脱色后,由原来的浑浊黑褐色变成橙色透亮溶液,脱色效果明显.活性炭具有无臭、无味、无毒的优点可反复使用,成本低,适合产品在工业上大规模使用,但活性炭会吸附部分多糖,造成多糖损失;因此,在下一步的研究中可以考虑使用层析法进行脱色及分离其他杂质成分.
[1]许娜,许旭东,杨峻山.猫须草的研究进展[J].中草药,2010,41(5):848-852.
[2]任文辉,洪俪芳.猫须草的药理作用研究进展[J].中草药,2013,44(20):2946-2950.
[3]李金雨,康龙泉.猫须草的研究和开发利用进展[J].江西农业学报,2010,22(3):99-104.
[4]孙照翠,郑庆霞,吴海峰,等.猫须草水溶性化学成分的研究[J].中国药学杂志,2014,49(1):22-25.
[5]陈伊蕾,谭俊杰,陆露璐,等.肾茶水溶性成分的研究[J].中草药,2009,40(5):689-693.
[6]赵爱华,赵勤实,李蓉涛,等.肾茶的化学成分[J].云南植物研究,2004,26(5):563-568.
[7]俞娟,刘劲松,王刚,等.响应面法优化马兰多糖提取工艺研究[J].中成药,2015,37(1):222-225.
[8]李佩佩,杨子君,陈荫,等.薄荷多糖的提取工艺及其抗氧化、抗病毒活性的研究[J].食品科技,2014,39(12):196-201.
[9]陈波.番红花多糖的提取及耐缺氧能力研究[J].食品工业,2014,35(12):112-115.
[10]王周,黄生权,宁正祥.灵芝水溶性粗多糖脱蛋白方法研究[J].食品科技,2010,35(8):222-225.
[11]吴斌,谢勇,林秀洁,等.太子参粗多糖的提取及其除蛋白方法研究[J].福建农业学报,2013,28(6):589-592.
[12]郭思维,刘胜姿,李威,等.人工冬虫夏草多糖脱色脱蛋白工艺研究[J].食品科技,2013,38(5):207-211.
[13]李晋,齐红志,夏河山,等.洋葱粗多糖脱蛋白质方法比较[J].河南农业科学,2015,44(4):164-168.
[14]滕立平,曾红,汪河滨,等.裂盖马鞍菌粗多糖脱蛋白质工艺研究[J].河南农业科学,2013,42(9):138-141,160.
[15]肖平,陈建伟,陈亚运,等.板蓝根多糖活性炭脱色工艺及抗氧化活性研究[J].天然产物研究与开发,2014,26(12):2041-2045,2021.
[16]李双明,代福玲,杨雪姣,等.响应面法优化东北红豆杉多糖脱色工艺[J].食品工业,2014,35(10):31-35.
[17]周统武,梁志坚,吴天秀,等.熟地多糖活性炭脱色工艺的研究[J].天然产物研究与开发,2013,25(7):972-975,994.
[18]吴光杰,李玉萍,李资玲,等.马齿苋多糖的活性炭脱色工艺优选[J].中国实验方剂学杂志,2013,19(12):43-45.
[19]潘莹.冬枣多糖水提醇沉工艺研究[J].食品工业,2015,36(1):124-126.
[20]王文平,郭祀远,李琳,等.考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J].食品研究与开发,2008,29(1):115-117.
[21]韦媛媛,刘阳,龚帅,等.积雪草多糖的脱脂工艺研究[J].广西科技大学学报,2014,25(2):90-94.
[22]钟英英,钟春鹏,凌秋萍,等.葡萄愈伤组织中白藜芦醇提取工艺的研究[J].广西科技大学学报,2014,25(4):97-99,107.
(学科编辑:黎娅)
Decoloration and deproteinization of Clerodendranthus spicatus polysaccharide
LIAO Chun-yan1,2,XU Hai-run1,HUANG Yao1,2
(1.School of Biological and Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China;2.Guangxi Key Laboratory of Green Processing of Sugar Resources(Guangxi University of Science and Technology),Liuzhou 545006,China)
To optimize the method for decoloration and deproteinization of Clerodendranthus spicatus polysaccharides,this paper compared the Sevag method,TCA method and TCA-NBA method to screen the better deproteinization method.And the optimal method of deproteinization was evaluated by the protein removal rate and polysaccharides retention rate.The process of decoloration using acticarbon was evaluated by the single-factor and orthogonal test in terms of the decolorization rate and polysaccharide retention rate.The results showed that the deproteinization effect was optimal with sevag method.The best decoloration conditions was50℃,pH6.0,quantity of active carbon was1.5%and 20min.So this optimal technology is stable and efficient.It provides the theoretical basis for the production and use of Clerode ndranthus spicatus polysaccharide.
Clerode ndranthus spicatus;polysaccharide;deproteinization;decoloration
R284.2
A
2095-7335(2016)04-0111-05
10.16375/j.cnki.cn45-1395/t.2016.04.020
2016-04-27
广西高校大学生创新创业训练计划项目(201510594094)资助.
廖春燕,硕士,讲师,研究方向:生物分离,E-mail:5560043@qq.com.
