重组人甲状旁腺素对人骨髓间充质干细胞表达骨形态发生蛋白2的影响
2016-11-19李丁王俊芳张成玉
李丁 王俊芳 张成玉
【摘要】 目的:探讨不同浓度的重组人甲状旁腺素(hPTH1-34)对人骨髓间充质干细胞骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)表达的影响。方法:培养人骨髓间充质干细胞,分为空白对照组、阳性对照组、hPTH1-34组(共3组,PTH浓度分别为40 μg/L、400 μg/L、4000 μg/L组)。给药后第4、7、14天检测碱性磷酸酶活性、BMP2的表达。结果:给药第7、14天,较高剂量组(4000 μg/L、400 μg/L)碱性磷酸酶活性较低剂量组(40 μg/L)有下降。给药第14天,所有给药组的碱性磷酸酶活性均低于阳性对照组(P<0.05)。给药第7、14天,较高剂量组(4000 μg/L、400 μg/L)的BMP2含量低于低剂量组(40 μg/L)(P<0.05)。hPTH1-34低剂量组(40 μg/L)BMP2浓度较空白对照组明显高(P<0.05)。结论:在一定浓度范围内,hPTH1-34间歇用药有促成骨细胞增生与分化作用,并呈时间依赖性;超过一定浓度后则反而抑制成骨细胞的增殖与分化。
【关键词】 重组人甲状旁腺素; 人骨髓间充质干细胞; BMP2
中图分类号 R329.2 文献标识码 A 文章编号 1674-6805(2016)4-0005-03
Effect of Recombinant Human Parathyroid Hormone on the Expression of Bone Morphogenetic Protein 2 in Human Bone Marrow Mesenchymal Stem Cells/LI Ding,WANG Jun-fang,ZHANG Cheng-yu.//Chinese and Foreign Medical Research,2016,14(4):5-6
【Abstract】 Objective:To detect the effect of recombinant human parathyroid hormone(hPTH1-34) on the expression of bone morphogenetic protein 2(BMP2) in human bone marrow mesenchymal stem cells.Method:The cultured human bone marrow mesenchymal stem cells(MSCs) were divided into blank control group,positive control group,hPTH1-34 group(the concentrations were 40 μg/L,400 μg/L,4000 μg/L group).The alkaline phosphatase activity and the concentration of BMP2 were detected in the 4th,7th and 14th day after administration.Result:In the 7th and 14th day,the alkaline phosphatase activity of high dose group(4000 μg/L,400 μg/L) were lower than low dose group(40 μg/L).In the 14th day,the activities of the alkaline phosphatase in all hPTH1-34 groups were lower than the positive control group.In the 7th and 14th day,the BMP2 concentration in high dose group(4000 μg/L,400 μg/L) were lower than low dose group(40 μg/L).The BMP2 concentration in low dose group(40 μg/L) was significantly higher than the control group.Conclusion:In a certain concentration range,intermittent medication of hPTH1-34 can promote the proliferation and differentiation of osteoblast in a time-dependent manner.However,when exceeding certain concentration,hPTH1-34 can inhibit the proliferation and differentiation of osteoblasts.
【Key words】 Recombinant human parathyroid hormone; Human bone marrow mesenchymal stem cells; Bone morphogenetic protein 2
First-authors address:Wuxi Peoples Hospital Affiliated to Nanjing Medical University,Wuxi 214023,China
doi:10.14033/j.cnki.cfmr.2016.4.003
目前对于骨质疏松的治疗主要包括三个方面,(1)减少或延缓骨吸收:常用双膦酸盐类、降钙素类、雌激素类和选择性雌激素受体调节剂等;(2)活性维生素D、维生素K、锶盐、钙剂和中药等则通过其他途径改善骨量;(3)增加骨重建的药物包括氟化物、PTH(parathyroid hormone,甲状旁腺素)、他汀类和锶盐等[1]。
目前已知在体外实验中,PTH间歇性给药有利于骨髓间充质干细胞的成骨分化,而连续大剂量给药则抑制其向成骨细胞分化[2-4]。而BMP2是目前已知的最重要的促成骨细胞分化的生长因子之一。本实验通过添加不同PTH浓度及给药时间,检测骨髓间充质干细胞BMP2的表达量,探讨PTH与骨髓间充质干细胞表达BMP2间关系,为进一步研究PTH促骨髓间充质干细胞成骨分化的机制打下基础。
1 材料与方法
1.1 主要试剂
重组人甲状旁腺素1-34氨基酸片段,白色冻干粉,1 mg/支;L-DMEM、维生素C;淋巴细胞分离液;地塞米松;β-甘油磷酸,低糖DMEM培养基及胎牛血清(FBS),碱性磷酸酶测定试剂盒(南京建成生物工程研究所),人BMP2测定试剂盒(Abvona)。
1.2 骨髓间充质干细胞分离和培养
采用离心法培养骨髓间充质干细胞。无菌条件下,取无骨代谢疾病骨科手术患者骨髓组织约5 ml。肝素抗凝,等量PBS稀释,按2∶1比例加入淋巴细胞分离液。400 g离心30 min,取中间白膜层,PBS洗涤2遍,接种细胞于含基础培养基的培养皿中培养。
传代培养:PBS洗涤2遍,加入0.25%trypsin-EDTA消化2 min,使用等量含体积分数10% FBS的低糖DMEM培养基终止消化。150 g离心5 min,弃上清,接种细胞于培养皿中。
培养条件:37 ℃、体积分数5%CO2 95%的湿度,培养72 h后首次换液,以后每3天换液1次。
1.3 实验分组设计
所有实验采用传代细胞进行。传代细胞随机分为5组,分别为空白对照组(生理盐水组)、阳性对照组(OS液组,即100 nm地塞米松、10 mmβ-甘油磷酸、50 μg/ml维生素C)、hPTH1-34组(共3组,PTH浓度分别为40 μg/L、400 μg/L、4000 μg/L组)。每组研究数量n=6。PTH给药组为间歇性给药,以48 h为一个周期。即给药6 h后,更换不含药培养基。整个观察时间为14 d。
1.4 碱性磷酸酶活性的测定
细胞用PBS洗涤2遍,0.25%trypsin-EDTA消化1 min,等量含体积分数10% FBS的低糖DMEM培养基终止消化。离心后保存。分别收集空白对照组、阳性对照组、实验组4 d、7 d、14 d细胞,于冰水浴中超声粉碎。碱性磷酸酶测定试剂盒测定培养细胞中碱性磷酸酶活性。具体步骤根据试剂盒说明书进行。
1.5 ELISA检测hPTH1-34对BMP2表达的影响
将P2代细胞接种于96孔板,在给药后第4、7、14天测定。离心收集细胞,将细胞用超声波破碎仪破碎释放胞内的BMP-2蛋白进行检测。测定各组样品450 nm波长的吸光度(OD值)。具体步骤根据试剂盒说明书进行。
1.6 统计学处理
采用SPSS 13.0统计软件进行数据处理,计量资料以均数±标准差(x±s)表示,两组数据间比较采用t检验,各组间比较采用单因素方差分析,进行q检验,检验水准取α=0.05。
2 结果
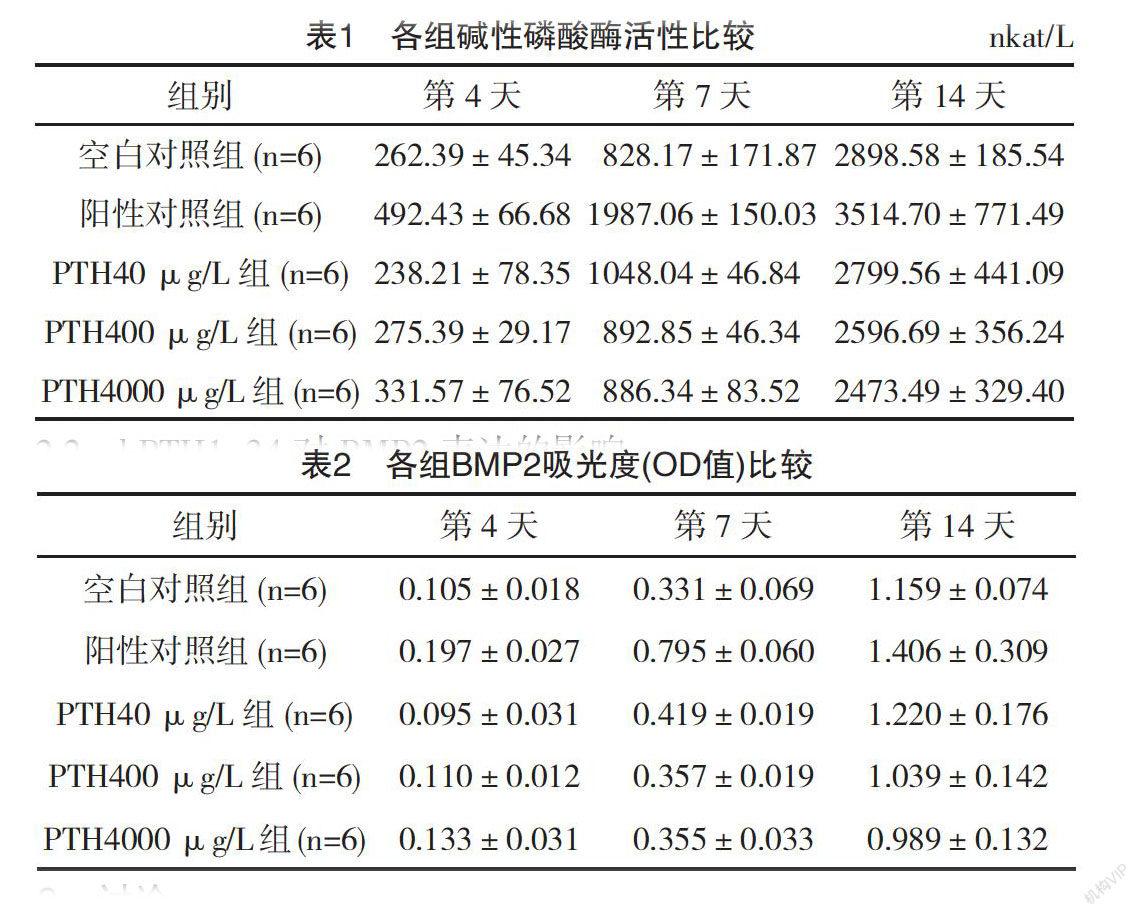
2.1 hPTH1-34对碱性磷酸酶活性的影响
结果如表1所示。阳性对照组的碱性磷酸酶活性明显高于空白对照组,差异有统计学意义(P<0.05)。且随着给药时间的延长,各组碱性磷酸酶活性均逐渐增加。给药第7、14天观察发现,较高剂量组(4000 μg/L、400 μg/L)与低剂量组40 μg/L相比,碱性磷酸酶活性有下降趋势。给药第14天hPTH1-34给药组的碱性磷酸酶活性均低于阳性对照组(P<0.05)。
2.2 hPTH1-34对BMP2表达的影响
检测上清液和胞内的BMP2表达总和,结果详见表2。随着时间的延长,BMP2含量各组均有升高,阳性对照组的BMP2含量显著高于空白对照组(P<0.05),给药第7、14天观察发现,较高剂量组(4000 μg/L、400 μg/L)的BMP2含量低于低剂量组40 μg/L,差异有统计学意义(P<0.05)。与空白对照组相比,第7、14天检测hPTH1-34低剂量40 μg/L组的BMP2浓度明显高(P<0.05),提示合适浓度的hPTH1-34可促进骨髓间充质干细胞分泌BMP2蛋白,具有一定的成骨作用。
表2 各组BMP2吸光度(OD值)比较
组别 第4天 第7天 第14天
空白对照组(n=6) 0.105±0.018 0.331±0.069 1.159±0.074
阳性对照组(n=6) 0.197±0.027 0.795±0.060 1.406±0.309
PTH40 μg/L组(n=6) 0.095±0.031 0.419±0.019 1.220±0.176
PTH400 μg/L组(n=6) 0.110±0.012 0.357±0.019 1.039±0.142
PTH4000 μg/L组(n=6) 0.133±0.031 0.355±0.033 0.989±0.132
3 讨论
人源性甲状旁腺素在甲状旁腺的内质网中合成,其在血中存在有3种形式:(1)具有生物活性的全段PTH,占5%~20%;(2)氨基端PTH片段(N.PTH1-34),含量甚少,具有生物活性;(3)羧基端PTH片段(C-PTH),为血循环中的主要部分,占75%~95%,但其只有免疫源性,而无生物活性。对PTH(1-34)这一生物活性片段的研究表明,PTH可能通过影响包括成骨细胞、破骨细胞、骨骼内衬细胞、骨细胞等众多种类的细胞系,并激活多种信号途径,从而达到促进骨形成的作用[4]。hPTH1-34是最早人工合成的具有全分子活性的PTH氨基端片段,目前被认为是最有前途的骨形成促进剂,有望应用于骨质疏松症的防治。国内韩亚娟等[5]报道在临床使用PTH(1-34)能显著提高腰椎(L2~L4)骨密度,对于原发性骨质疏松症治疗安全有效。目前,PTH已经被批准应用于骨质疏松的治疗,而且是第一代骨形成刺激药的首选药[6]。骨髓间充质干细胞为条件成骨细胞,许多研究表明,骨髓间充质干细胞在一定理化条件下可向成骨细胞方向转化,广泛应用于研究各种因素对成骨分化的影响[3]。其中地塞米松、β-甘油磷酸、维生素C的联合诱导作用已被公认。
BMP2是目前已知的最重要的成骨细胞因子之一,是BMP家族中成骨诱导作用最强的因子。可在损伤局部及异位促进细胞增殖,也是唯一能够在异位诱导成骨的信号分子[7]。甲状旁腺素对骨具有双向调节作用——即可促进骨形成,又可促进骨吸收,而此作用可能与甲状旁腺素的作用时间及作用剂量有关。Dobnig等[8]研究发现对实验动物使用泵控制给药时间小于2 h的引起骨合成,而长于2 h的则引起骨吸收。日本学者研究显示不同剂量重组人甲状旁腺素连续刺激对人成骨样细胞的影响也不同[9]。据此本实验主要从不同剂量的PTH间断刺激观察对人骨髓间充质细胞成骨分化及BMP2表达的影响。结果显示PTH作用后碱性磷酸酶的活性均有提高,提示PTH有促进骨形成的作用,与国内外文献[3,10]一致。随着给药实验时间的延长,PTH浓度为40 μg/L时碱性磷酸酶活性为三组中最高,说明在间歇刺激下低剂量PTH更能促进骨形成。三种浓度的实验组的碱性磷酸酶均低于阳性对照组,尤其是第14天甚至低于空白对照组;这提示PTH的长时间使用不利于人骨髓间充质干细胞向成骨细胞方向分化。虽然给药初期随着剂量的增加,碱性磷酸酶活性略有增加,可能与给药时间较短,骨合成作用占优势有关。这与张玲等[3]的动物实验结果相符。已有的体外实验结果提示PTH促成骨细胞表达BMP2具体机制可能为激活cAMP(cyclic adenosine monophosphate,环腺苷酸)-PKA(protein kinase A,蛋白激酶A)-CREB(cAMP response element binding protein,cAMP效应元件结合蛋白)通路[11-12]。PTH与其受体结合,引起cAMP生成,激活PKA活性,进一步磷酸化激活CREB;CREB进而与其余一些共激活因子,通过CRE(cAMP response element,cAMP效应元件)与靶基因结合,从而促进其转录。Fei等[13]研究表明在骨折愈合过程中FGF2信号通路与PTH信号在骨形成和修复方面存在交联,并相应引起BMP2表达改变。Yu等[14]研究发现PTH诱导骨髓间充质干细胞的成骨分化通过PTH和脂蛋白受体相关蛋白6(LRP6)实现,主要是通过增强BMP信号通路,增强Smad1的磷酸化。本实验结果PTH作用后BMP2含量均有所提高,验证了PTH与BMP2的相关性。与上述文献报道一致。随着给药实验时间的延长,PTH浓度为40 μg/L时BMP2含量为三组中最高,说明PTH的促成骨作用并非剂量依赖性,仅低浓度有利于成骨分化,在今后的临床应用中应注意给予合适的浓度。
本研究结果表明在一定浓度范围内间歇用药有促成骨细胞增生与分化作用,与既往文献[2,4]结果相似,并呈时间依赖性;超过一定浓度后则反而抑制成骨细胞的增殖与分化,同时给药浓度越高抑制作用越强。然而由于条件所限,确切的机制及信号传导通路未能进行深入研究。另外本研究的观察时间为14 d,14 d后的细胞增殖和分化有待于研究进一步完善;而PTH用于临床中促进成骨细胞增殖和分化从而用于防治骨质疏松的合适浓度等问题则需设计合理的临床研究进一步明确。
参考文献
[1]马尊良,邢学农.甲状旁腺素治疗骨质疏松的新进展[J].国际老年医学杂志,2010,31(6):273-276.
[2] Vahle J L,Sato M,Long G G,et al.Skeletal changes in rats given daily subcutaneous injections of recombinant human parathyroid hormone (1-34) for 2 years and relevance to human safety[J].Toxicol Pathol,2002,30(3):312-321.
[3]张玲,陆瑛,李雅娜,等.重组人甲状旁腺素(1-34)影响兔骨髓间充质干细胞增殖及向成骨细胞分化的量效关系[J].中国临床康复,2006,10(41):10-12.
[4]李宁,王满宜,贺良,等.间断性低剂量应用重组人甲状旁腺素(1-34)在骨折愈合早期促RunX2基因的表达[J].Clin Orthop Relat Res,2009,89(11):771-776.
[5]韩亚娟,薛耀明,王禹冰,等.重组人甲状旁腺素(1-34)治疗原发性骨质疏松症疗效观察[J].临床内科杂志,2011,28(2):110-112.
[6]金世鑫.治疗骨质疏松的成就和问题[J].中国骨质疏松杂志,2004,10(1):116-117.
[7] Seol Y J,Kim K H,Park Y J,et al.Osteogenic effects of bone-morphogenetic-protein-2 plasmid gene transfer[J].Biotechnol Appl Biochem,2008,49(Pt 1):85-96.
[8] Dobnig H,Turner R T.The effects of programmed administration of human parathyroid hormone fragment (1-34) on bone histomorphometry and serum chemistry in rats[J].Endocrinology,1997,138(11):4607-4612.
[9] Ishizuya T,Yokose S,Hori M,et al.Parathyroid hormone exerts disparate effects on osteoblast differentiation depending on exposure time in rat osteoblastic cells[J].J Clin Invest,1997,99(12):2961-2970.
[10] Zhang R,Edwards J R,Ko S Y,et al.Transcriptional regulation of BMP2 expression by the PTH-CREB signaling pathway in osteoblasts[J].PLo S One,2011,6(6):e20780.
[11] Schnoke M,Midura R J.Pulsed electromagnetic fields rapidly modulate intracellular signaling events in osteoblastic cells:comparison to parathyroid hormone and insulin[J].J Orthop Res,2007,25(7):933-940.
[12] Qin L,Partridge N C.Stimulation of amphiregulin expression in osteoblastic cells by parathyroid hormone requires the protein kinase A and cAMP response element-binding protein signaling pathway[J].J Cell Biochem,2005,96(3):632-640.
[13] Fei Y,Gronowicz G,Hurley M M.Fibroblast growth factor-2,bone homeostasis and fracture repair[J].Curr Pharm Des,2013,19(19):3354-3363.
[14] Yu B,Zhao X,Yang C,et al.Parathyroid hormone induces differentiation of mesenchymal stromal/stem cells by enhancing bone morphogenetic protein signaling[J].J Bone Miner Res,2012.27(9):2001-2014.
(收稿日期:2015-10-13)
