麻类脱胶菌的木糖发酵性能改造及初步检验
2016-11-19李智敏严理朱作华等
李智敏 严理 朱作华 等


摘要:通过引入丙酮酸脱羧酶和乙醇脱氢酶基因改造麻类脱胶优良菌株Ym68,以使其获得利用木糖发酵产生乙醇的能力。结果表明,虽然基因工程菌株PAP16的木糖利用率相对原始菌株Ym68差别不大,但明显提高了代谢产物乙醇。在5%木糖发酵试验中,原始菌株Ym68的木糖发酵液中乙醇含量低于0.2%,而改造后的菌株PAP16木糖发酵液的乙醇含量上升到1.6%。尽管此次基因改造可能影响了菌体表面特性,使得PAP16菌株容易形成凝聚而降低脱胶活性;但该菌株同时具备了脱胶预处理和产生目的产物乙醇两种性能,这对研究原料预处理和提高原料利用率较为有利。
关键词:脱胶菌;木糖发酵;乙醇
中图分类号:S563;S216 文献标识码:A 文章编号:0439-8114(2016)04-1031-04
DOI:10.14088/j.cnki.issn0439-8114.2016.04.054
Genetic Engineering of the Xylose Fermentation Property in Hemp
Degumming Bacteria and Preliminary Testing
LI Zhi-min,YAN Li,ZHU Zuo-hua,XIE Chun-liang,HU Zhen-xiu,PENG Yuan-de
(Institute of Bast Fiber Crops,Chinese Academy of Agricultural Sciences,Changsha 410205,China)
Abstract:For the advantage of high cellulose content, bast fiber crops are used as raw materials in the research of cellulosic fuel ethanol. The bacterial degumming technics is the most economical and environmentally friendly pretreatment methods in the bast cellulosic ethanol research. In this study, by constructing an expression plasmid of both pyruvate decarboxylase and alcohol dehydrogenase genes,the fine degumming bacterial strains Ym68 is genetically engineered to gain a xylose fermentation property to yield ethanol. By comparing the Ym68 and PAP16 fermentations of 5% xylose liquid medium,the results showed that though the xylose utilization of genetically engineered strain PAP16 is little difference to that of original strain Ym68,but the ethanol concentration in the fermentation broth rised from 0.2% to 1.6%. Despite this genetically engineering may change the bacterial cell surface, which led to cell aggregation and thus tempted to reduce the ability of degumming,but PAP16 is favorable for the study of raw materials pretreatment and utilization by having two kinds of properties, which are degumming and ethanol production.
Key words: degumming bacteria; xylose fermentation; ethanol
红麻、苎麻等麻类作物纤维含量高、糖化效果好,被认为是制备纤维质燃料乙醇的良好原材料[1,2]。对红麻、苎麻等纤维原料糖化之前需先对其进行脱胶处理,使果胶、半纤维素等物质降解,有利于后续纤维素的酶解糖化[3]。而利用微生物进行麻类脱胶是一种高效清洁型的脱胶方式[4],既减少用水量又避免酸碱等化学物质对后续酶解糖化的影响,因此微生物脱胶是麻类纤维制备燃料乙醇的理想预处理方法。微生物脱胶过程中会去除麻类果胶、半纤维素等物质,约占干物质的10%~20%[5]。从酶活和成分测定等方面分析,脱胶去除的成分当中含有大量的木糖、葡萄糖、甘露糖和阿拉伯糖等[6,7]。
本研究以脱胶菌Ym68[8]为研究对象,通过双基因表达质粒载体pACYCDuet-1把丙酮酸脱羧酶(PDC)和乙醇脱氢酶(AdhB)基因转化到脱胶菌Ym68中,以期使其能脱胶并同时利用脱胶液糖分用于发酵产生乙醇。
1 材料与方法
1.1 试验菌株及载体
麻类脱胶菌株Ym68为中国农业科学院麻类研究所选育的菌株。酮酸脱羧酶基因PDC和乙醇脱氢酶基因AdhB模板来源于KO11菌株基因组。双基因表达质粒载体pACYCDuet-1购于Voergen公司。
1.2 引物设计
利用Primer premier 5.0软件对PDC和AdhB基因的开放阅读框(ORF)序列设计引物。以pACYCDuet-1的多克隆位点1(MCS1)中的SalⅠ作为PDC基因的插入点,而多克隆位点2(MCS2)中的XhoⅠ作为AdhB基因的插入位点。PDC和AdhB基因引物加上酶切位点和保护碱基,并设计1对针对MCS1和MCS2多克隆位点载体构建的检测引物,引物序列如表1所示。
1.3 PDC和AdhB基因克隆
以KO11菌液为模板,进行PCR扩增。PCR反应体系为:模板菌液1 μL,Buffer 2.0 μL,dNTPs 0.4 μL,引物A 0.5 μL,引物B 0.5 μL,DNA polymerase 0.2 μL,ddH2O 15.4 μL。PCR反应程序为:94 ℃预变性4 min;35个循环(94 ℃变性30 s,Tm退火40 s,72 ℃延伸45 s);72 ℃延伸10 min。S-PDC-F和S-PDC-R引物退火温度54 ℃,X-AdhB-F和X-AdhB-R引物退火温度55 ℃。PCR产物用1%琼脂糖凝胶电泳,用凝胶回收试剂盒纯化。PDC和AdhB两个基因的纯化产物分别用SalⅠ和XhoⅠ进行单酶切,回收产物-70 ℃保存备用。
1.4 PDC和AdhB双基因表达载体构建
将含有pACYCDuet-1质粒的DH5α菌株经37 ℃、170 r/min过夜培养后提取质粒,并用SalⅠ单酶切后通过凝胶回收。PDC基因片段的SalⅠ酶切回收产物和pACYCDuet-1质粒的SalⅠ酶切回收产物按3∶1的比例,用T4 DNA 连接酶进行连接,并转化大肠杆菌DH5α感受态细胞[9]。然后将AdhB基因片段和pACYCDuet-1-PDC质粒的XhoⅠ酶切回收产物按浓度3∶1的比例混合连接过夜。菌液PCR鉴定阳性菌,并将阳性菌种送至南京金斯瑞生物科技有限公司进行测序鉴定。
1.5 Ym68阳性菌株鉴定
根据噬夏孢欧文氏菌感受态的方法[10]制备Ym68菌株感受态细胞。从含有pACYCDuet-1-PDC-AdhB质粒的大肠杆菌DH5α菌株中提取质粒,参考Sambrook等[11]的转化方法。用含100 μg/mL氯霉素的0.5%葡萄糖肉汤固体培养基进行筛选。随机挑取20个阳性菌落在0.5%葡萄糖肉汤液体培养基(含100 μg/mL氯霉素)中扩繁。以MCS1-F和MCS2-R引物进行PCR鉴定阳性菌株。
1.6 木糖发酵及检测
将Ym68和PAP16菌株分别接种于肉汤培养基(0.5%葡萄糖、1%牛肉膏和0.5%酵母粉)中,35 ℃、180 r/min培养到OD600 nm为0.8左右时作为菌种。Ym68和PAP16菌株分别按5%的接种量接种到250 mL发酵培养基(5%木糖、1%胰蛋白胨、0.5%酵母提取物和1% NaCl)中,以不接种的发酵培养基作为对照,6个重复,35 ℃、180 r/min进行发酵,72 h时进行还原糖浓度和乙醇浓度检测。每个处理的6个重复样品中两两混合,形成3份混合样品,随后取每份样品进行总糖浓度检测;以未发酵过的发酵培养基为对照。按DNS显色法检测还原糖浓度[12];以浓度为0、0.1%、0.2%、0.4%、0.8%和1.2%的木糖作标准曲线,随后对样品进行原糖浓度测定;混合样品经蒸馏后用酒精计法测定[13]。
1.7 苎麻脱胶
分别将初始菌株Ym68和工程菌株PAP16分别接种于肉汤培养基中,35 ℃、180 r/min培养菌株过夜作为菌种(OD600 nm为1.5左右)。以加肉汤培养基为对照,分别用Ym68和PAP16菌种进行脱胶試验,称取每份15 g的苎麻放于500 mL三角瓶中用于脱胶试验,35 ℃、150 r/min培养8 h,每个处理3个重复。脱胶效果根据11分级[14],经清水洗去可溶性物质并烘干后计算脱胶前后的干物质损失率。
1.8 菌液涂片显微观察
Ym68转化pACYCDuet-1空质粒的菌株命名为Ym68-K。将Ym68、Ym68-K和PAP16菌株分别接种于肉汤培养基中,35 ℃、180 r/min转速恒温摇床培养过夜。培养好的菌液立即用于涂片,用结晶紫染色后用显微镜观察、拍照。
2 结果与分析
2.1 pACYCDuet-1-PDC-AdhB载体的构建
利用XhoⅠ单酶切位点在多克隆位点MCS2上插入的PDC基因长度为1 707 bp,而在多克隆位点MCS1上插入的AdhB基因为1 152 bp,如图1所示。将两个基因插入pACYCDuet-1载体质粒后,提取质粒用XhoⅠ和SalⅠ双酶切。结果表明,1 500~2 000 bp间存在一条目的条带,而约1 000 bp处也存在一条目的条带,分别与PDC和AdhB基因大小相符,如图2所示。而在3 000~5 000 bp间有一条较亮的条带,在约500 bp处还有一条弱带,这两条带与原始质粒双酶切位置大小相符。结果表明,pACYCDuet-1-PDC-AdhB表达载体构建成功。
2.2 PAP16具有木糖发酵能力
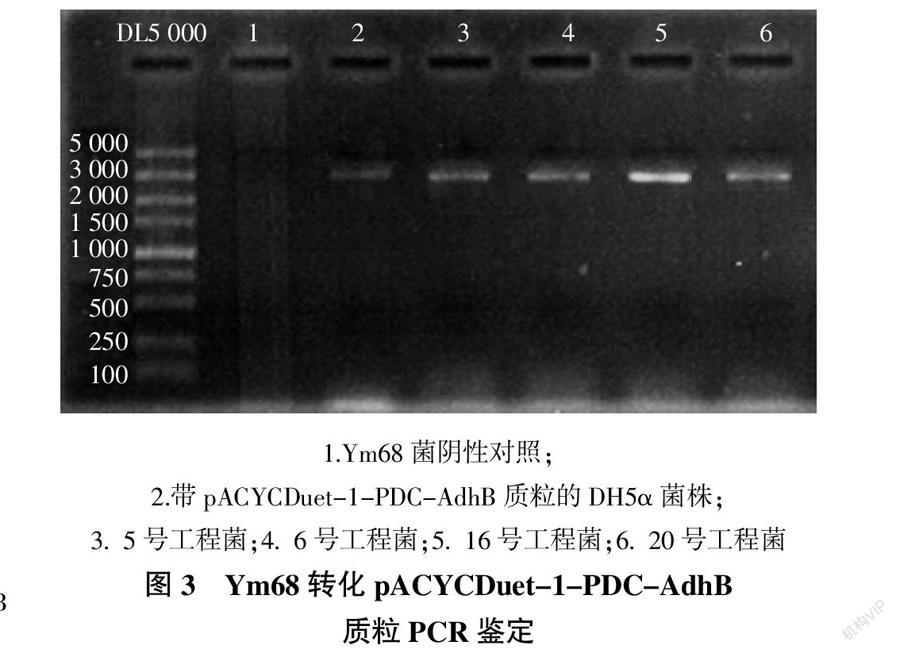
对Ym68转化pACYCDuet-1-PDC-AdhB质粒后,随机对5号、6号、16号和20号阳性单菌落进行PCR鉴定。单菌落与带有pACYCDuet-1-PDC-AdhB质粒的大肠杆菌DH5α扩增的条带大小一致,与预期载体构建后MCS1-F 和MCS2-R引物间的产物长度(约3 300 bp)相符;而原始菌株Ym68则未扩增出该条带,如图3所示。结果表明,带有pACYCDuet-1-PDC-AdhB质粒的Ym68工程菌株构建成功,16号菌株命名为PAP16。
用Ym68和PAP16菌株对含有5%木糖的发酵培养基进行发酵试验。从发酵后的还原糖浓度看,PAP16和Ym68对木糖的利用率基本相似。72 h发酵的Ym68菌株发酵液中还原糖浓度约为0.56%,而PAP16菌株发酵液的还原糖浓度约为0.23%;未经发酵的发酵培养基还原糖浓度为5.22%。从乙醇产量方面看,PAP16菌株发酵液乙醇浓度约为1.6%,而Ym68菌株的在0.2%以下;未发酵的培养基则未量出读数,如图4所示。结果表明, Ym68原始菌被改造成PAP16后虽然对木糖利用率的影响不明显,但发酵生成乙醇的能力提高。
2.3 PAP16苧麻脱胶性能
为检验PAP16的脱胶能力,通过苎麻脱胶试验对比Ym68和PAP16脱胶性能,结果如图5所示。只加培养基处理的对照无脱胶效果,干物质损失率在1%以下;Ym68菌株的脱胶级数达到10级,干物质损失率为12%左右;而PAP16脱胶级数为7级,干物质损失率为8%左右。从试验重复结果看,PAP16菌株的脱胶能力稍有减弱。在菌株的培养过程中发现,静置后的PAP16菌液相比Ym68更容易出现菌体沉淀。因此,对悬浮后的菌液涂片观察,PAP16菌液中菌体呈凝聚状态,而Ym68和转化有pACYCDuet-1空质粒的Ym68-K菌液其菌体则比较分散(图6),PAP16的菌体凝聚特性可能影响了其脱胶性能。
3 小结与讨论
脱胶菌株Ym68具有优良的苎麻脱胶性能,PDC和AdhB基因构建进去后其获得了发酵木糖产乙醇的能力。Ym68菌株属于欧文氏菌属,而欧文氏菌一般均可利用戊糖和己糖[15,16],试验结果也证明Ym68菌株可以利用木糖。其发酵液乙醇浓度小于0.2%可能是误差形成的结果,而并非真正产生乙醇。PAP16发酵液中乙醇浓度达到1.6%、糖醇转化率达到24%,说明将丙酮酸脱羧酶基因PDC和乙醇脱氢酶基因AdhB引入Ym68菌中使其获得了将木糖转化乙醇的能力。已早有类似研究报道,整合PDC和AdhB基因的大肠杆菌,其产生乙醇的能力也是从无到有[17]。这些说明Ym68菌株本身具有吸收木糖的能力,但引入PDC和AdhB基因后使得木糖代谢往乙醇产物方向转化。引入PDC和AdhB基因可能改变了Ym68菌体表面特征使得该基因工程菌容易形成凝聚,从而降低了其脱胶性能。通过改造代谢途径使得麻类预处理菌株获得利用木糖转化成乙醇产物的能力,这对研究提高麻类原料利用率和推进麻类燃料乙醇技术提供了可借鉴的依据。
参考文献:
[1] 阮奇城,祁建民,胡开辉,等.红麻秸秆发酵转化燃料乙醇[J].福建农林大学学报(自然科学版),2012,41(1):78-82.
[2] 郭芬芬,孙 婉,李雪芝,等.预处理苎麻秆和红麻秆糖化发酵生产燃料乙醇[J].生物工程学报,2014,30(5):774-783.
[3] 曹秀华,祁建民.红麻转化酒精糖化曲的构建及发酵酒精的工艺研究[J].国际遗传学杂志,2010,33(4):191-192.
[4] 孙进昌.高效清洁型红麻生物脱胶技术[J].中国农村科技,2002(3):39.
[5] 余秀艳,孙小寅,杨 微.苎麻生物酶脱胶工艺研究[J].纺织科技进展,2012(1):26-28.
[6] 成莉凤,刘正初,冯湘沅,等.草本纤维生物提取菌株分泌的关键酶研究[J].中国农学通报,2014,30(30):255-258.
[7] 陈杨栋. 苎麻纤维天然处理体系的微生态解析[D]. 上海:东华大学,2010.
[8] 彭源德,刘正初,郑 科,等.亚麻快速生物脱胶发酵条件研究[J].中国麻业,2005,27(2):77-80.
[9] 王 萍,殷春燕,盈 磊.不同方法转化大肠杆菌和农杆菌转化效率的研究[J].淮海工学院学报(自然科学版),2007,16(2):55-58.
[10] 汪靖超, 赵 驰,王 波,等.外源基因在噬夏孢欧文氏菌中的表达[J].青岛大学学报(工程技术版),2005,20(2):15-18.
[11] SAMBROOK J,RUSSELL D.Molecular Cloning: A Laboratory Method[M]. NY:Cold Spring Harbor Laboratory Press,2001.
[12] 管 斌,丁友昉,谢来苏,等.还原糖测定方法的规范[J].无锡轻工大学学报(食品与生物技术),1999(3):74-79.
[13] 张卫国,钟瑞敏,郭建恒.杨梅果酒发酵特性的研究[J].中国酿造,2006(11):42-44.
[14] 彭源德,冯湘沅.苎麻脱胶菌种的特性研究[J].中国麻作,1995(2):32-35.
[15] DIEN B S,NICHOLS N N,BOTHAST R J. Recombinant Escherichia coli engineered for production of L-lactic acid from hexose and pentose sugars[J]. Journal of Industrial Microbiology & Biotechnology,2001,27(4):259-264.
[16] SUTTON D D, STARR M P. Intermediary metabolism of carbohydrate by erwinia amylovora[J]. Journal of Bacteriology,1960,80(1):104-110.
[17] MONIRUZZAMAN M, LAI X,YORK S W,et al. Isolation and molecular characterization of high-performance cellobiose-fermenting spontaneous mutants of ethanologenic Escherichia coli KO11 containing the Klebsiella oxytoca casAB operon [J]. Applied & Environmental Microbiology,1997,63(12):4633-4637.
