基于微流控芯片的尿路感染细菌鉴定及抗生素敏感性测试
2016-11-19齐明月杜燕刘未平陈斌梁广铁徐邦牢刘大渔
齐明月 杜燕 刘未平 陈斌 梁广铁 徐邦牢 刘大渔


摘 要 发展了一种微流控芯片纸基细菌分析技术,用于多重细菌鉴定与抗生素敏感性测试。制备了阵列培养池芯片,以滤纸作为衬底固定显色培养基和抗生素。利用PVDF疏水薄膜止流阀,将尿液样品引入芯片并分隔于不同培养池。借助于培养池阵列的空间分辨力,实现多重细菌分析。根据特异性显色结果实现细菌鉴定,通过实时显色强度分析实现细菌定量,依据抑制显色反应的最低抗生素浓度确定抗生素敏感性。以3种泌尿系统感染常见病原菌(大肠杆菌、金黄色葡萄球菌和粪肠球菌)为模拟测试对象进行分析,结果表明,芯片方法可以在18 h内实现对3种细菌的同时鉴定及6种抗生素敏感性测试。对照实验显示,芯片法与传统方法细菌鉴定和抗生素敏感性测试结果一致性分别为94.1%和93.9%。本研究建立的微流控芯片细菌分析方法简便快速,非常适合于医疗资源匮乏条件下的细菌分析。
关键词 微流控芯片; 细菌鉴定; 抗生素敏感性测试; 快速检测
1 引 言
尿路感染是非常常见的感染性疾病[1,2],多由细菌引起,最常见的是大肠埃希菌,其次为粪肠球菌、铜绿假单胞菌、葡萄球菌属细菌和肺炎克雷伯菌等[2]。尿路感染可引起局部和全身不适症状,严重者可导致肾功能衰竭,甚至感染性休克,因而需要及时诊断和治疗。临床治疗尿路感染病例时,医生需要了解病原菌的种类、数量以及对于抗生素的敏感性,以便进行针对性治疗[3,4]。因此,临床上的细菌检测平台,需具备多重病原菌快速定性与定量分析以及抗生素敏感性测试的功能。
传统的尿路感染病原菌鉴定及抗生素敏感性试验(Antibiotic susceptibility testing, AST)主要采用平板培养法,但是耗时较长(一般需2~3天)[5,6],不利于及时诊断和抗生素选择指导。近年开发出了尿路感染病原菌检测新方法,如免疫荧光法[7]、干化学分析法[8]、流式细胞法[9]、聚合酶链式反应(PCR)[10]、质谱法[11]及新一代测序技术[12]等,虽然可以显著缩短检测时间,但这些方法大多依赖于大型或者精密设备,难以在基层医疗单位推广。因此,亟需简便、快速的尿路感染病原菌检测方法。
近年发展起来的微流控芯片细菌分析技术[13~19]较之传统方法具有很多优势。首先,芯片细菌分析平台小巧便携,操作简便,非常适合于现场快速检测[20];其次,芯片微分析平台有利于提高测试通量和降低试样消耗量[21],便于实现高通量分析;此外,大多数芯片细菌分析方法可以免去预增菌步骤,因而可以显著缩短分析时间[22]。因此,微流控芯片技术为细菌分析提供了一种理想的解决方案。然而,目前报道的微流控芯片细菌分析大多只针对单一种类细菌检测[16,18,20],无法满足临床上对病原菌的分析需求。
本研究组在前期工作[23]中进行了微流控芯片上多重细菌鉴定的初步探索。在此基础上,本研究将多重细菌鉴定与AST结合,为芯片病原分析方法用于临床诊疗奠定基础。在芯片上进行多重细菌分析与AST,要求同步完成多重生化反应,因而需要解决包括多重试剂的引入、多重反应的有效分隔以及多重检测指标的判定问题。针对上述问题,本研究发展了一种微流控芯片纸基细菌分析方法,在芯片培养池中以滤纸作为衬底组合固定菌种特异性显色培养基和抗生素。滤纸成分为纤维素,具有疏松多孔结构,不仅具有良好的生物相容性, 而且易于固定试剂[24]。借助于芯片集成PVDF疏水薄膜止流阀,引入芯片的尿液样品被分隔于不同培养池,以实现多重显色反应。根据特异性显色结果实现细菌定性鉴定,通过实时显色强度分析实现细菌定量测定,依据抑制显色反应的最低抗生素浓度确定抗生素敏感性,因此在芯片上实现了多重细菌的同时定性与定量分析和AST。本方法简便快速,尤其适于医疗资源匮乏条件下的细菌快速分析。
2 实验部分
2.1 仪器与试剂
TS2A四通道微量注射泵(保定兰格公司);XW80A漩涡振荡器(上海书培公司);尼康D7100数码相机(日本尼康公司);中速定性滤纸(杭州新华公司);SU8 3035光刻胶(MicroChem公司);聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)前体及引发剂(Dow Corning公司);PVDF膜(孔径0.23 μm,美国Millipore公司);海藻酸钠(上海生工公司);系列抗生素(Sigma公司);金黄色葡萄球菌、大肠杆菌、粪肠球菌特异性显色培养基(青岛海博公司);血平板、营养琼脂、MH肉汤培养基、营养肉汤培养基、McFarland 0.55.0 麦氏比浊管(广东环凯公司);金黄色葡萄球菌(ATCC25923)、大肠杆菌(ATCC25922)、粪肠球菌(ATCC29212)由本院检验科微生物室菌种保藏中心提供;尿路感染病人的尿液由本院检验科微生物室提供。实验用水为二次蒸馏水。
2.2 微流控装置
本实验使用自行搭建的微型化细菌培养装置 [23]。微流控芯片包含3层PDMS结构,采用软刻蚀工艺加工[25]而成。芯片顶层包含一系列通孔,分别对应流体出入口以及培养池排气孔(直径1 mm),后者以PVDF膜封闭;芯片中间层含有一系列通孔(直径3 mm),与底层无结构平板封接后形成培养池。培养池上游的折线形通道(长5.5 mm、宽0.05 mm)与进样通道连接;培养池下游借助通道与顶层排气孔连接。芯片各层经90℃烘烤2 h,紫外灯照射过夜。芯片封接在无菌条件下进行,先将中层与底层封接,然后将固定有特异性培养基及抗生素的纸片分别置于培养池中,等离子处理后将中层与顶层封接。最后,将PVDF膜借双面胶贴附于排气孔处,即制得完整芯片。
2.3 芯片上的实验操作
将质控菌株取出后接种于血平板上,置37 ℃培养箱中培养,细菌进入指数生长期后收获菌体。挑取数个菌落于无菌生理盐水中混匀后测定浊度,调整浊度至0.5 MCF,相当于1.5 × 108 cfu/mL细菌浓度,系列稀释后备用。临床标本为采集的中段尿液,直接灌注入芯片。进样时,通过微量注射泵向毛细管中吸入1 mL 细菌悬浮液,然后将毛细管与芯片进样通道连接,并以50 μL/min 流量注入。待全部培养池充盈后,驱除多余菌液, 并向通道中快速灌入1.5%(w/V)海藻酸钠溶液。进样后将芯片置于便携式培养装置中,37℃培养18 h。
2.4 细菌增殖检测
以金黄色葡萄球菌(ATCC25923)为例,比较芯片培养法与传统肉汤培养法中的细菌增殖状况。于0,2,4,6,8 和10 h 分别收获两组培养细菌菌液,用倾注平板法进行细菌计数,每2 h检测一次细菌数量。
2.5 芯片上的细菌定性与定量分析
芯片细菌培养每隔30 min拍照一次,使用Photoshop软件提取照片中培养池部位光密度值并描绘曲线。根据显色反应颜色判定细菌种类,依据显色时间确定细菌数量。设定培养池背景颜色强度偏差值3倍(3SD)为阈值,根据细菌显色强度达到阈值所需时间(Time threshold,Tt值)推断细菌初始浓度。
2.6 芯片上的细菌抗生素药敏测试
根据针对细菌种类选择抗生素,用于AST。对于金黄色葡萄球菌,选取红霉素、克林霉素、氨苄青霉素、万古霉素、庆大霉素、左氧氟沙星;对于大肠杆菌,选取亚胺培南、头孢唑啉、氨苄青霉素、头孢曲松、左氧氟沙星、庆大霉素;对于粪肠球菌,选取红霉素、克林霉素、四环素、氨苄青霉素、万古霉素、左氧氟沙星。
3 结果与讨论
3.1 微流控芯片设计
本研究所用的微流控装置能够为细菌生长提供适宜的温度、湿度以及氧含量。培养池体积约为19 μL,容纳11 μL显色培养基及8 μL细菌悬液,可为细菌生长提供足够的养分及空间。经培养后,根据培养基显色反应颜色判定细菌种类,依据显色时间确定细菌数量。本实验所用微流控芯片含63个培养池,分别用于细菌鉴定与AST。因此,每张芯片可同时鉴定3种细菌,以及6种抗生素3个水平的AST。结合菌种特异性培养基的颜色分辨力及培养池阵列的空间分辨力,本方法可实现多重细菌的定性与定量分析和抗生素敏感性判定。
本研究在以滤纸作为衬底的培养池中实现细菌培养和显色反应。滤纸具有疏松多孔结构,可以简便地固定显色培养基和抗生素。纸片封装时,将固定有抗生素的纸片置于顶层,固定有琼脂显色培养基的纸片置于底层。样品进入培养池时,由于纸片及琼脂的阻滞效应,可有效防止灌液时抗生素被流体冲走。
为防止培养池中试剂交互干扰,设计了一种基于PVDF膜的止流阀(图2)。初始状态下芯片主通道阻力大于分支通道,可以保证流体优先经分支通道充盈培养池。培养池下游通道连接排气口,后者以PVDF膜覆盖。疏水性PVDF膜具有透气特性,在液体充盈培养池过程中,允许气体通过排气口排出;而当液体接触PVDF膜后,由于流动阻力显著增加而无法通过。利用上述设计,样品可以顺序充满一系列培养池,不会造成试剂的交叉污染。完成进样后,主通道引入粘性的海藻酸钠溶液封闭培养池入口,避免培养池间的交互影响。采用与抗生素分子质量相当的溴酚蓝验证芯片性能。溴酚蓝为灵敏酸碱指示剂,低pH条件下呈黄色,遇碱则变蓝。将固定溴酚蓝的滤纸片与空白滤纸片相间封装于培养池中,向芯片中灌入0.1% NaOH溶液,溴酚蓝未扩散至相邻的空白滤纸(图3)。此结果表明,进样过程中,芯片培养池中的试剂未发生交叉污染。
图2 芯片操作步骤示意图。芯片培养池上游的折线形通道与进样通道连接, 下游通道与顶层排气孔连接,后者使用PVDF膜覆盖。进样过程:Ⅰ. 样品引入进样通道。由于主通道与分支通道阻力差异,标本优先进入分支通道;Ⅱ. 当样品接触到PVDF膜,由于表面张力效应分支通道内阻力增加因而起到止流作用,样品继续充盈下游培养池;Ⅲ. 待全部培养池充盈后,驱除主通道残留液体;Ⅳ. 主通道引入海藻酸钠封闭培养池。
3.2 芯片上的细菌增殖
以金黄色葡萄球菌为例,比较了芯片培养方法与传统肉汤培养方法中细菌的增殖情况。平板倾注法计数结果显示,使用两种方法培养的细菌在此阶段均呈指数增殖状态(图4),细菌增殖率无显著差异。
3.3 芯片上的细菌定性和定量分析
根据显色培养基说明,经培养后,大肠杆菌显粉红色, 金黄色葡萄球菌显蓝绿色, 粪肠球菌显黄色,如培养池中出现相应颜色则判定存在上述细菌。
由于环境中的细菌污染,健康人尿液样品也可能存在少量细菌。因此,细菌的准确定量对于尿路感染诊断是非常重要的。参考临床判定标准,如尿细菌密度≥105 /mL,判定为尿路感染;密度介于104~105/mL,为可疑阳性;如<104 /mL,判断为污染。由于细菌初始数量与显色时间存在相关性[26],本研究发展了一种实时显色强度定量方法,即根据Tt值推断细菌初始数量。在芯片上分别接种系列浓度金黄色葡萄球菌,拍照结果显示细菌显色时间Tt值与初始细菌密度相关(图5)。线性回归分析显示金黄色葡萄球菌、大肠杆菌和粪肠球菌的初始数量与Tt值均存在较好的线性关系(金黄色葡萄球菌R2=0.9576;大肠杆菌R2=0.9615;粪肠球菌R2=0.9464)。因此,依据Tt值可以推断出初始细菌密度。
3.4 抗生素敏感性测试
目前,由于广泛存在的细菌耐药问题,AST对于个体化治疗指导具有重要价值。本研究发展的芯片AST方法同样依赖于显色反应,其原理是足够剂量的敏感抗生素通过抑制细菌生长使显色反应呈现阴性。参照美国CLSI 对MIC(最小抑菌浓度)的解释,使用敏感、中介和耐药3个水平来解读细菌对于某种抗生素的敏感度[27]。如图6Ⅲ所示的大肠杆菌对于亚胺培南的敏感性测试,细菌对于该抗生素的敏感性依据最低的显色抑制浓度判定。亚胺培南对大肠杆菌的MIC解释标准中,敏感,中介、耐药浓度转折点分别为1,2和4 μg/mL。在抗生素(-)组显色的前题下,如以上3个药物浓度组均未显色,则判定对该抗生素敏感;如1 μg/mL浓度组显色,判定为中介;如1和2 μg/mL显色, 或3个浓度组都显色,判定为耐药。同理判断其它抗生素MIC(金黄色葡萄球菌对克林霉素见图6Ⅰ,肠球菌对左氧氟沙星见图6Ⅱ)。
3.5 临床样本分析
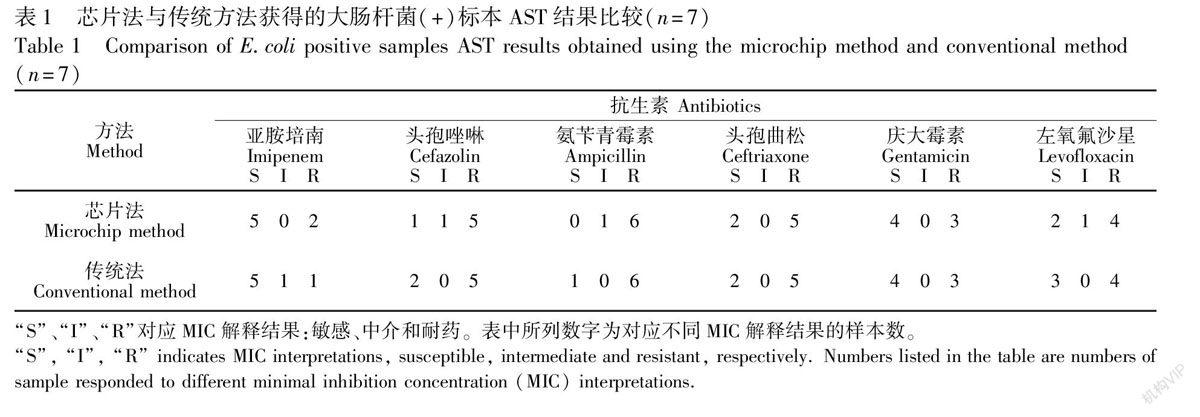
利用传统方法与芯片方法平行测试40例临床可疑尿液感染标本。传统方法和芯片方法对大肠杆菌、金黄色葡萄球菌和粪肠球菌的阳性检出例数分别为17例和16例,二者一致性为94.1%。由于本实验使用的细菌特异性显色培养基种类有限,芯片方法细菌鉴定仅限于3种细菌,因而总体阳性检出率显著低于对照方法(40% vs 80%),这需要在后续实验中增加显色培养基种类加以解决。对照常规方法检测结果,证实芯片方法鉴定阴性样品中待检致病菌数量均低于103 cfu/mL,而鉴定为细菌(+)的尿液标本中致病菌数量多数在105 cfu/mL水平。对照实验结果表明,芯片法与传统方法AST结果的总体一致率为93.9%, 显示两种方法具有较好的一致性。其中,金黄色葡萄球菌与粪肠球菌AST结果一致率均为100%,而大肠杆菌的AST结果一致率稍低,为90.7%(表1),这种差异可能是由于大肠杆菌显色反应定量偏差导致。
4 结 论
本研究发展了微流控芯片多重细菌鉴定和AST方法,具有操作简便、耗时短、低消耗和高通量的优势,适合于医疗资源匮乏条件下的细菌分析。后续工作将进一步扩展检测对象范围,以提高该技术的实际应用性能。
References
1 Honrado C, Dong T. Sensors (Basel), 2014, 14(8): 13851-13862
2 Mach K E, Wong P K, Liao J C. Trends Pharmacol. Sci., 2011, 32(6): 330-336
3 Graham J C, Galloway A. J. Clin. Pathol., 2001, 54(12): 911-919
4 WANG HongRu, BAO XiaoRong, YUAN YiQun. Chinese Journal of Nosocomiology, 2014, 24(08): 1859-1861
王宏儒, 鲍晓荣, 袁轶群.中华医院感染学杂志, 2014, 24(08): 1859-1861
5 Luo X, Shen K, Luo C, Ji H, Ouyang Q, Chen Y. Biomed. Microdevices, 2010, 12(3): 499-503
6 Meister L, Morley E J, Scheer D, Sinert R. Acad. Emerg. Med., 2013, 20(7): 631-645
7 Matos Pires N M, Dong T. Sensors (Basel), 2013, 13(12): 15898-15911
8 Devillé W L, Yzermans J C, van Duijn N P, Bezemer P D, van der Windt D A, Bouter L M. BMC. Urol., 2004, 4: 4
9 Pieretti B, Brunati P, Pini B, Colzani C, Congedo P, Rocchi M, Terramocci R. J. Clin. Microbiol., 2010, 48(11): 3990-3996
10 Cornut P L, Boisset S, Romanet J P, Maurin M, Carricajo A, Benito Y, Vandenesch F, Chiquet C. Surv. Ophthalmol., 2014, 59(3): 286-303
11 Nakanishi T. Rinsho Byori., 2015, 63(4): 465-471
12 Fournier P E, Drancourt M, Colson P, Rolain J M, La Scola B, Raoult D. Nat. Rev. Microbiol., 2013, 11(8): 574-585
13 Dong T, Zhao X. Anal. Chem., 2015, 87(4): 2410-2418
14 Feng S, Dong T, Yang Z. IEEE. Eng. Med. Biol. Soc. Conf. Proc., 2014: 3114-3117
15 Lee W, Kwon D, Choi W, Jung G Y, Jeon S. Sci. Rep., 2015, 5: 7717
16 He J, Mu X, Guo Z, Hao H, Zhang C, Zhao Z, Wang Q. Eur. J. Clin. Microbiol. Infect. Dis., 2014, 33(12): 2223-2230
17 Kalashnikov M, Campbell J, Lee J C, Sharon A, SauerBudge A F. J. Vis. Exp., 2014, (83): e50828
18 Tokel O, Yildiz U H, Inci F, Durmus N G, Ekiz O O, Turker B, Cetin C, Rao S, Sridhar K, Natarajan N, Shafiee H, Dana A, Demirci U. Sci. Rep., 2015, 5: 9152
19 Cira N J, Ho J Y, Dueck M E, Weibel D B. Lab Chip, 2012, 12(6): 1052-1059
20 FunesHuacca M, Wu A, Szepesvari E, Rajendran P, KwanWong N, Razgulin A, Shen Y, Kagira J, Campbell R, Derda R. Lab Chip, 2012, 12(21): 4269-4278
21 Sun P, Liu Y, Sha J, Zhang Z, Tu Q, Chen P, Wang J. Biosens. Bioelectron., 2011, 26(5): 1993-1999
22 Sakamoto C, Yamaguchi N, Nasu M. Appl. Environ. Microbiol., 2005, 71(2): 1117-1121
23 WEN XiaoXia, XU BangLao, WANG WeiXin, LIANG GuangTie, CHEN Bin, YANG YinMei, LIU DaYu. Chinese J. Anal. Chem., 2014, 42(6): 791-798
文小霞, 徐邦牢, 王伟鑫, 梁广铁, 陈 斌, 杨银梅, 刘大渔. 分析化学, 2014, 42(6): 791-798
24 Cate D M, Adkins J A, Mettakoonpitak J, Henry C S. Anal. Chem., 2015, 87(1): 19-41
25 Stedtfeld R D, Tourlousse D M, Seyrig G, Stedtfeld T M, Kronlein M, Price S, Ahmad F, Gulari E, Tiedje J M, Hashsham S A. Lab Chip., 2012, 12(8): 1454-1462
26 Jokerst J C, Adkins J A, Bisha B, Mentele M M, Goodridge L D, Henry C S. Anal. Chem., 2012, 84(6): 29002907
27 Clinicaland Laboratory Standards Institute, Performance Standards for Antimicrobial Susceptibility Testing. TwentyThird Informational Supplement. www.clsi.org, 2013
Uropathogenic Bacteria Identification and Antibiotic
Susceptibility Testing on a Microfluidic Chip
QI MingYue1, DU Yan1, LIU WeiPing1, CHEN Bin1, LIANG GuangTie1,2,
XU BangLao*1,2, LIU DaYu1,2
1(Department of Laboratory Medicine, Guangzhou First People′s Hospital,
Affiliated Hospital of Guangzhou Medical University, Guangzhou 510180, China)
2 (Clinical Molecular Medicine and Molecular Diagnosis Key Laboratory of Guangdong Province, Guangzhou 510180, China)
Abstract A microfluidic chip assay was described for bacteria identification and antibiotic susceptibility test (AST). Filter paper pads were embedded in arrayed microchambers, with immobilized antibiotics and chromogenic medium. By taking advantage of the polyvinylidene fluoride (PVDF) membrane based valves, urine sample introduced was distributed in individual chambers without cross contamination. The simultaneous analysis of multiple bacteria was achieved by using the culture chamber array design. The identification of a bacterium was based on its specific colorimetric result. The density of a bacterium was determined by realtime monitoring color intensity in the chamber, and its susceptibility to an antibiotic was determined relying on the lowest antibiotic concentration that inhibited the colorimetric reaction. A set of three common uropathogenic bacteria were selected as models to test the microfluidic approach. Our results showed that the developed microfluidic assay was able to complete bacteria identification and the sixantibiotic AST in 18 h. In comparison with the conventional method, the microchip method showed a coincidence of 94.1% and 93.9% with regard to bacteria identification and AST, respectively. The developed microfluidic approach is simple and rapid, thus hold the potential to serve as a powerful tool for bacterial analysis under conditions of poor medical resource.
Keywords Microfluidic chip; Bacterial identification; Antibiotic susceptibility testing; Rapid detection
(Received 14 January 2016; accepted 3 February 2016)
This work was supported by the National Natural Science Foundation of China (Nos. 81371649, 81271730,81501831) and the Natural Science Foundation of Guangdong Province, China (No. 2014A030313677)
