姜黄素对人骨肉瘤MG-63细胞生长抑制及对MAPK基因调控作用的探讨*
2016-11-19夏晓燕
夏晓燕,吴 亚,吴 健
(江苏省盐城市第一人民医院:1.血液科实验室;2.骨科;3.检验科 224001)
·临床研究·
姜黄素对人骨肉瘤MG-63细胞生长抑制及对MAPK基因调控作用的探讨*
夏晓燕1,吴 亚2△,吴 健3
(江苏省盐城市第一人民医院:1.血液科实验室;2.骨科;3.检验科 224001)
目的 研究姜黄素对人成骨肉瘤细胞MG-63的生长抑制作用,并检测对骨肉瘤细胞中MAPK基因表达的调控作用,初步明确姜黄素对骨肉瘤细胞的作用机制。方法 以人骨肉瘤细胞株MG-63为研究对象,采用不同剂量姜黄素处理。MTT法检测5、10、15、20、25、30、35、40、50 μmol/L姜黄素作用24、48、72 h对细胞的毒性作用;Transwell小室侵袭试验法检测5、10、15 μmol/L姜黄素对细胞的侵袭能力,黏附试验法检测对细胞的黏附能力;Western blot法检测5、10、15 μmol/L姜黄素作用后MAPK蛋白表达水平的影响,RT-PCR法检测对细胞中MAPK基因mRNA转录水平的影响。结果 姜黄素(浓度>15 μmol/L,作用时间>24 h)对骨肉瘤细胞的生长抑制呈时间和剂量依赖性,浓度≤15 μmol/L,作用时间为24 h时,对骨肉瘤细胞无明显毒性作用;细胞侵袭能力和黏附能力随着姜黄素浓度的增加而逐渐降低,以15 μmol/L姜黄素浓度处理效果最明显(P<0.05);姜黄素可明显抑制MAPK基因mRNA转录水平,其抑制作用与剂量呈高度依赖性(P<0.05)。结论 姜黄素可以通过调控MAPK基因表达降低人骨肉瘤细胞株MG-63的侵袭性。
姜黄素; 骨肉瘤; MAPK基因; 侵袭
骨肉瘤是骨组织最常见的原发性肿瘤,多发于青少年并且恶性程度高[1-2]。目前治疗骨肉瘤的方法主要是新辅助化疗和手术,其5年生存率仍然维持在60%~70%,无明显提高。这主要是对骨肉瘤发病机制尚不清楚所致。近年来,随着分子生物学与遗传学的研究,为骨肉瘤发病机制的研究提供了帮助。
丝裂原激活的蛋白激酶是重要的信号级联分子之一,也是多种信号通路的中心,在许多细胞增殖相关信号通路中起着关键的作用[3-4]。在未受到特异性细胞刺激时,MAPK处于静止状态。当受到生长因子等相关因素刺激后,MAPK接收MKK和MKKK的活化信号而被激活,表现为逐级磷酸化,进而转入细胞核内活化一些原癌基因,从而促进细胞增殖,阻碍细胞凋亡[5-6]。所以目前定义为1种癌基因[7]。同时,MAPK也在肿瘤微环境中高表达,所以,抑制肿瘤细胞及其微环境细胞MAPK表达被认为是肿瘤治疗的1个靶点。
姜黄素是1种天然植物多酚类色素,从姜科植物姜黄中提取,也存在其他姜科植物中,广泛存在于我国传统中药姜黄的根茎中。已有研究证实,姜黄素是安全有效的MAPK的1种抑制剂,如在T细胞白血病中[8-9]。姜黄素通过抑制MAPK上游JAK激酶的活性,从而阻止了MAPK的组成性磷酸化,在骨肉瘤中,姜黄素是否能通过抑制MAPK信号通路从而阻止肿瘤的侵袭转移,至今尚未见明确报道。本试验通过对不同浓度姜黄素对人成骨肉瘤细胞MG-63细胞MAPK表达的影响,进一步探讨影响骨肉瘤侵袭转移的机制,为姜黄素应用于临床治疗骨肉瘤提供理论依据。
1 材料与方法
1.1 仪器及试剂 人成骨肉瘤细胞MG-63由中国科学院上海细胞生物研究所提供,姜黄素购自中国药品生物制品检定所,MTT购自美国Sigma公司,RPMI1640培养基购自美国GIBCO公司,Transwell小室购自Milliproe公司,PCR引物及BSA稀释液由上海生工合成,ReverTraAce-α-RT-PCR kit购自TOYOBO公司,蛋白干粉购自中国博士德公司。
1.2 方法
1.2.1 细胞培养 MG-63细胞生长在10%胎牛血清(FBS)的RPMI1640培养基,37 ℃、5%CO2环境放置细胞培养箱,当细胞生长至80%融合时,用0.25%胰消化酶传代。
1.2.2 MTT法检测姜黄素处理细胞杀伤力 将对数生长期细胞,分别加入4×103个细胞在96孔板每孔中,按照王晓飞等[10]试验方法分组及操作程序后,在490 nm波长处酶标仪测定光密度A值,按以下公式计算细胞生存率(%),并进行重复试验2次。细胞生存率(%)=(试验组A490-空白对照组A490)/试验对照组A490×100%。
1.2.3 Transwell小室侵袭试验法检测姜黄素对细胞侵袭能力 将对数生长期细胞按以下分组:阴性对照组(0.1%DMSO);姜黄素5 μmol/L处理组;姜黄素10、15 μmol/L处理组;姜黄素15 μmol/L处理组。参考王晓飞等[10]方法进行Transwell小室侵袭试验步骤进行。
1.2.4 黏附试验法检测姜黄素对细胞的黏附能力 按以上试验分组对细胞进行预处理,配制纤维连接蛋白溶液终浓度为10 μg/mL,包被96孔细胞,每孔50 μL加入培养板,密封,4 ℃12 h;PBS连续洗涤5次,加入RPMI1640培养基,50 μL/孔,37 ℃封闭2 h;再用0.25%胰酶消化细胞,细胞浓度调至为2×104个/孔,再孵育1.5 h;PBS连续洗涤5次,加入2 mg/mL MTT,50 μL/孔,孵育3 h;弃去MTT,每孔加入DMSO 150 μL,振荡15 min,酶标仪490 nm测定A值,按以下公式计算黏附细胞量:黏附细胞量=试验组A490-阴性对照组A490。
1.2.5 Western blot法检测姜黄素对骨肉瘤细胞MAPK和P-MAPK蛋白表达 将MG-63细胞按1×104个/cm2接种到培养瓶中,贴壁后按以下4组加入相应的药物:阴性对照组(0.1%DMSO),姜黄素(5、10、15 μmol/L)处理组。培养24 h后再提取细胞蛋白,10%SDS-PAGE分离后,转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,封闭后用TBST洗5次,每次5 min,敷一抗4 ℃12 h后,TBST洗5次,每次10 min,敷二抗,室温摇床振荡1 h,TBST洗5次,每次10 min。ECL成像系统成像,拍照。
1.2.6 RT-PCR法检测姜黄素对细胞中MAPK基因mRNA转录水平的影响 将MG-63细胞按2×105个/cm2接种至6孔板中,贴壁后再按1.2.5项4组给药。培养24 h后,提取细胞总RNA进行测定,用ReverTraAce-α-RT-PCR kit将其逆转录成cDNA,总体系为20 μL,99 ℃进行5 min,4 ℃进行5 min,将cDNA引物在-20 ℃保存。引物(序列见表1)购自上海生工生物工程股份有限公司。β-action基因作为内参物。反应条件如下:94 ℃预变性3 min,94 ℃再变性30 s,退火30 s(MAPK 55 ℃),72 ℃延伸2 min,循环进行26次;72 ℃环境延伸10 min,琼脂糖电泳鉴定扩增产物,成像系统进行图像数据分析。

表1 RT-PCR引物序列
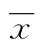
2 结 果
2.1 姜黄素对细胞杀伤力 姜黄素浓度15 μmol/L,时间24 h为作用临界点,当姜黄素浓度>15 μmol/L,作用时间>24 h,细胞生长抑制和时间、剂量呈依赖性,差异有统计学意义(P<0.001);当姜黄素浓度≤15 μmol/L,时间≤24 h时,姜黄素对细胞毒性作用差异无统计学意义(P>0.05),细胞存活率大于85%。见表2。以姜黄素浓度≤15 μmol/L,作用时间为≤24 h时为侵袭和黏附试验的条件。

表2 各组浓度梯度姜黄素对MG-63细胞作用后的抑制率
注:与5、10、15 μmol/L比较,*P<0.05;与5、10 μmol/L比较,△P<0.05;与5、10、20、25 μmol/L比较,◇P<0.05;与5、15、20、25 μmol/L相比,#P<0.05;与24 h相比,■P<0.05;与48 h相比,●P<0.05。
2.2 姜黄素对细胞侵袭能力结果 对照组及5、10、15 μmol/L姜黄素处理组细胞穿膜细胞数分别是(445.33±35.17)、(311.13±37.66)、(190.15±16.16)和(125.43±7.98)/视野。与对照组相比,穿膜细胞数随着姜黄素药物浓度的增加而逐渐减少,以15 μmol/L组试验效果最明显,试验各组之间差异均有统计学意义(F=84.76,P<0.05),见图1。
2.3 姜黄素对细胞黏附能力结果 对照组及5、10、15 μmol/L姜黄素处理组的细胞黏附量分别是(1.425±0.049)、(0.856±0.012)、(0.498±0.029)和(0.313±0.016)。与对照组相比,细胞黏附能力随着姜黄素药物浓度的增加而呈现逐渐下降的趋势,15 μmol/L处理组作用效果最明显,各试验组之间差异有统计学意义(F=368.72,P<0.01)。

注:A表示阴性对照组;B表示5 μmol/L姜黄素处理组;C表示10 μmol/L姜黄素处理组;D表示15 μmol/L姜黄素处理组。
图1 姜黄素对MG-63细胞体外侵袭能力的影响(×100)
2.4 MAPK和P-MAPK蛋白表达水平 P-MAPK表达随着姜黄素浓度的增加,抑制作用逐渐增强,且与剂量呈高度相关性,其中15 μmol/L组效果最明显,各试验组之间差异有统计学意义(F=109.52,P<0.05)。而总MAPK蛋白水平差异有统计学意义。见图2、3。

图2 姜黄素对MG-63细胞中MAPK蛋白表达的影响

图3 Western blot检测姜黄素处理后MG-63

图4 姜黄素对MG-63细胞中MAPK基因
2.5 MAPK基因mRNA转录水平 姜黄素对MAPK基因mRNA转录水平的抑制作用随着药物浓度的增加而增强,与姜黄素剂量呈高度相关性,5、10、15 μmol/L姜黄素处理组细胞中MAPK基因mRNA转录水平分别为0.525±0.157、0.289±0.062、0.055±0.002。与对照组0.820±0.145比较,转录水平明显降低,以15 μmol/L试验组效果最明显(t=9.766,P<0.01),各试验组间差异有统计学意义(F=25.166,P<0.05),见图4。
3 讨 论
目前已被证实,MAPK在多种肿瘤细胞和肿瘤微环境中各种细胞高表达,抑制肿瘤细胞及其微环境各种基质细胞MAPK已被公认为肿瘤治疗的靶点[11-12]。本研究为了探讨姜黄素通过抑制MAPK信号通路以及MAPK基因表达对人成骨肉瘤细胞MG-63细胞侵袭的抑制作用,以MG-63为研究对象,采用不同剂量姜黄素处理,利用MTT法检测不同浓度姜黄素作用细胞株后对细胞的毒性作用,采用Transwell小室侵袭试验法检测了不同浓度姜黄素作用后细胞侵袭能力的影响,进行黏附试验检测细胞黏附能力的改变。试验显示,姜黄素浓度15 μmol/L,作用时间24 h为作用临界点,姜黄素浓度>15 μmol/L,作用时间>24 h细胞的生长抑制与时间和剂量呈依赖性,当浓度≤15 μmol/L,作用时间为24 h时,对细胞无明显毒性作用,细胞侵袭能力、黏附能力随着姜黄素浓度增加而逐渐降低,其中15 μmol/L姜黄素处理效果最好。
本次研究采用Western blot法检测不同浓度作用细胞株后MAPK及P-MAPK蛋白水平的变化,还采用RT-PCR检测了不同浓度姜黄素作用细胞株后MAPK基因mRNA转录水平的影响,显示姜黄素可明显抑制MAPK基因mRNA转录水平,其抑制作用呈剂量依赖性。
Cyclin D1为MAPK为表达的下游基因,受到MAPK的活化的调节来影响人成骨肉瘤细胞的侵袭过程,促进肿瘤细胞的侵袭转移[13-16]。本研究通过姜黄素抑制MAPK信号通路的活性及此信号通路靶基因MAPK的表达明显减弱,尝试可以从源头上防止P-MAPK信号传导途径诱导Cyclin D1过度表达,从而导致成骨肉瘤产生的影响提供理论依据,这将为临床药物抗肿瘤治疗及基因干扰治疗提供了1种可能,开辟1条新的重要途径[17-18]。但是本次研究仅限于体外试验,而姜黄素能否在体内安全浓度范围内发挥其抗癌作用还需要进行动物实验,这也是下一步的研究方向。
[1]施鑫,徐明,刘玉秀,等.一线化疗方案联合血管生成抑制剂治疗四肢成骨肉瘤随机、对照、多中心研究的初步报告[J].中华骨科杂志,2012,32(11):1027-1031.
[2]李甲振,闻嘉,张岩,等.含有WW结构域的氧化还原酶基因对人骨肉瘤细胞MG-63生长抑制作用及机制[J].中华实验外科杂志,2013,30(2):367-369.
[3]王晓天,宋永胜,崔军.膀胱移行细胞癌WWOX基因启动子区甲基化及mRNA表达及其临床意义[J].中国医科大学学报,2012,41(11):995-999.
[4]Talbot JJ,Song X,Wang X,et al.The cleaved cytoplasmic tail of polycystin-1 regulates Src-dependent STAT3 activation[J].J Am Soc Nephrol,2014,25(8):1737-1748.
[5]Aparicio-Siegmund S,Sommer J,Monhasery N,et al.Inhibition of protein kinase Ⅱ(CK2) prevents induced signal transducer and activator of transcription(STAT) 1/3 and constitutive STAT3 activation[J].Oncotarget,2014,5(8):2131-2148.
[6]Liu L,Gaboriaud N,Vougogianopoulou K,et al.MLS-2384,a new 6-bromoindirubin derivative with dual JAK/Src kinase inhibitory activity,suppresses growth of diverse cancer cells[J].Cancer Biol Ther,2014,15(2):178-184.
[7]Wang J,Zhang L,Chen G,et al.Small molecule 1′-acetoxychavicol acetate suppresses breast tumor metastasis by regulating the SHP-1/STAT3/MMPs signaling pathway[J].Breast Cancer Res Treat,2014,148(2):279-289.
[8]Uehara Y,Inoue M,Fukuda K,et al.Inhibition of β-catenin and STAT3 with a curcumin analog suppresses gastric carcinogenesis in vivo[J].Gastric Cancer,2015,18(4):774-783.
[9]Hu A,Huang JJ,Jin XJ,et al.Curcumin suppresses invasiveness and vasculogenic mimicry of squamous cell carcinoma of the larynx through the inhibition of JAK-2/STAT-3 signaling pathway[J].Am J Cancer Res,2015,5(1):278-288.
[10]王晓飞,郭变琴,张曦文,等.联氨基姜黄素抑制STAT3信号通路对乳腺癌MDA-MB-231细胞侵袭迁移性的影响[J].第三军医大学学报,2011,33(2):111-115.
[11]Kraljik N,Rosso M,Ageel A,et al.The incidence of skin squamous cell carcinoma in Osijek-Baranja County--an epidemiological study[J].Coll Antropol,2011,35(Suppl 2):77-80.
[12]Jian W,Zhang JR,Jie Q,et al.Methylation of E-cadherin and p14 ARF gene promoters[J].Int J Clin Exp Med,2014,7(7):1808-1812.
[13] Snyder M,Huang J,Huang XY,et al.A STAT3/NF κB Complex is Necessary for the Expression of Fascin in Metastatic Breast Cancer Cells in Response to IL-6 and TNF-α[J].J Biol Chem,2014,289(43):30082-30089.
[14]Kang JH,Kang HS,Kim IK,et al.Curcumin sensitizes human lung cancer cells to apoptosis and metastasis synergistically combined with carboplatin[J].Exp Biol Med (Maywood),2015,240(11):1416-1425.
[15]Toden S,Okugawa Y,Buhrmann C,et al.Novel evidence for curcumin and boswellic Acid-Induced chemoprevention through regulation of miR-34a and miR-27a in colorectal cancer[J].Cancer Prev Res(Phila),2015,8(5):431-443.
[16]Fiala M.Curcumin and omega-3 fatty acids enhance NK cell-induced apoptosis of pancreatic cancer cells but curcumin inhibits interferon-γ production:benefits of omega-3 with curcumin against cancer[J].Molecules,2015,20(2):3020-3026.
[17]Zhou GZ,Sun GC,Zhang SN.The interplay between autophagy and apoptosis induced by one synthetic curcumin derivative hydrazinobenzoylcurcumin in a549 lung cancer cells[J].J Biochem Mol Toxicol,2015,29(6):267-273.
[18]Kim GT,Lee SH,Kim YM.Quercetin regulates sestrin 2-AMPK-mTOR signaling pathway and induces apoptosis via increased intracellular ROS in HCT116 colon cancer cells[J].Journal of Cancer Prevention,2013,18(3):264-270.
江苏省盐城市科技立项支持项目(2015003)。
10.3969/j.issn.1673-4130.2016.20.033
A
1673-4130(2016)20-2884-04
2016-05-07
2016-07-15)
△通讯作者,E-mail:2295422684@qq.com。
