microRNAs:高密度脂蛋白胆固醇干预治疗心血管疾病的新靶标*
2016-11-19刘梦迪李金容综述周云涛审校
刘梦迪,李金容,吴 冰,石 璐 综述,周云涛,田 卫,2,3△ 审校
(1.河北医科大学研究生学院,石家庄 050011;2.河北省唐山市工人医院 063000;3.河北省唐山市临床分子诊断与治疗重点实验室 063000)
·综 述·
microRNAs:高密度脂蛋白胆固醇干预治疗心血管疾病的新靶标*
刘梦迪1,李金容2,3,吴 冰2,3,石 璐2,3综述,周云涛2,3,田 卫1,2,3△审校
(1.河北医科大学研究生学院,石家庄 050011;2.河北省唐山市工人医院 063000;3.河北省唐山市临床分子诊断与治疗重点实验室 063000)
心血管疾病; 高密度脂蛋白胆固醇; miRNAs
《中国心血管病报告2014》指出“心血管病已成为仅次于脑卒中危害我国居民健康的第2大病死原因,冠心病的发病率和病死率呈持续性增长趋势”。这一现状使心血管事件的“剩留风险问题”变得更为突出。“剩留风险问题”是低密度脂蛋白胆固醇(LDL-C)水平控制达标情况下,心血管事件再发生的临床实践问题。强化他汀类药物治疗能够进一步减低心血管事件和病死风险,但仍未完全解决与高密度脂蛋白胆固醇(HDL-C)、高三酰甘油(TG)密切相关的剩留风险问题。“提高HDL-C水平”为心血管事件剩留风险的防控提供了一种解决方案[1]。然而,一项汇集117 411例标本的荟萃分析显示,在广泛使用他汀类药物治疗背景下,提高HDL-C水平的药物,如烟酸、贝特类、CETP抑制剂等,未能降低心血管病的病死率,说明这类药物未能达到改善HDL-C功能的作用[2]。microRNAs介导的胆固醇代谢精细调控理论为“HDL-C功能改善”的假说提供了新的契机。现对miRNA在胆固醇代谢调控机制的研究进展综述如下。
1 microRNAs生物学特点与功能
microRNAs是一类长约22个核苷酸的非蛋白编码的RNA。通过转录后翻译抑制作用,参与基因表达调控。miRBase数据库已收录人类基因组miRNAs前体1 881个,miRNAs成熟体2 588个,有超过60%的人类基因受到miRNAs调控[3]。miRNA信号通路的生物信息学预测分析和功能验证表明,miRNAs与mRNAs形成错综复杂的信号调控网[4]。miRNA的优势特征是能够以蛋白质与miRNA复合体、微泡、外泌体、HDL颗粒等形式稳定存在于血清、血浆、尿液及其他体液中,参与细胞间信号通讯,调节机体生命活动[5]。
2 经典HDL的合成、转运、摄取及代谢过程
HDL的合成发生在肝脏和小肠,ATP结合盒转运蛋白A1(ABCA1)是一个以ATP为能源进行物质转运的膜蛋白家族成员,它促进胆固醇和磷脂从细胞内转移至细胞外,再与乏脂的载脂蛋白A1(ApoA-Ⅰ)结合,形成HDL的前体。该过程是合成HDL的第1步,同时也是胆固醇逆向转运(RCT)的关键调控点。HDL前体中游离的胆固醇在卵磷脂胆固醇脂酰转移酶(LCAT)作用下发生酯化,最终形成成熟的HDL颗粒。
成熟的HDL胆固醇酯有3条途径:(1)约20%的HDL胆固醇酯直接经B族Ⅰ型清道夫受体(SR-BⅠ)作用而被肝脏摄取。(2)约70%胆固醇酯在胆固醇酯转移蛋白(CETP)作用下,与VLDL、LDL完成胆固醇酯交换,间接地通过VLDL和LDL与肝细胞表面LDL受体(LDLR)结合,被肝脏摄取。(3)剩余10%经由ApoE受体清除。
LXR信号通路在调节胆固醇的合成与转运过程发挥主导作用。肝X受体(LXR)是核激素受体家族的成员,存在LXRα和LXRβ 2种类型。LXRα作为胆固醇的敏感器,当细胞内胆固醇过多时,通过与固醇调节元件结合蛋白(SREBP)的协调作用,上调与RCT过程相关的靶基因,如ABCA/G1、ABCG5、ABCG8、磷脂转运蛋白、ApoE等,促进胆固醇外流,在胆固醇合成与转运过程中发挥重要作用。
3 miRNAs与HDL-C精细调控网络
miRNAs靶向调节HDL合成、转运、摄取和代谢过程及信号调控网路中关键基因,如ABCA1、LDLR、LXRα和SR-BⅠ等基因的表达水平与活性[6-24]。目前,HDL胆固醇酯主要清除途径中的关键调节点是CETP,然而由于该基因3′非编码区的长度相对较短(<200 bp),尚无证据表明miRNA参与调节CETP基因表达。见表1。
3.1 靶向调控ABCA1基因表达的miRNAs 10多种miRNAs已被证实参与靶向抑制ABCA1基因表达。其中miR-33在胆固醇稳态的调节机制和抗动脉粥样硬化作用中的研究颇为全面。
miR-33是一种内含子型的miRNA,存在miR-33a和miR-33b 2种形式,分别定位于编码固醇调节元件结合蛋白2(SREBF2)和1(SREBF1)基因内。miR-33通过与其宿主基因SREBF共转录方式,靶向抑制ABCA1,调控细胞内胆固醇含量。SREBP作为细胞内胆固醇的另一敏感器,通过Insig-Srebp-Scap途径对细胞内胆固醇进行反馈性调节。在低胆固醇的环境下,SREBP被激活,调控细胞膜LDLR或HMG CoA还原酶,提高胞内胆固醇水平,共转录的miR-33靶向抑制ABCA1基因表达,进一步阻止细胞内胆固醇的外流。见表2。
多种miRNAs,如miR-144、miR-758、miR-106b、miR-19b、miR-145、miR-10b、 miR-26和miR-27b等,均可通过经典的转录后翻译抑制作用,负向调节ABCA1基因表达,调控HDL-C的合成与转运过程。研究证实第1个正向调控ABCA1基因表达的RNA分子,miR-28-5p通过靶向抑制ERK2,从转录和翻译水平上调ABCA1[16]。miR-28-ERK2-ABCA1正向信号通路的证实,提示靶向抑制ERK2的miRNAs,作为天然的ABCA1激动剂,可能均具有上调ABCA1的作用,为改善HDL-C功能提供了新的思路与干预手段。

表1 miRNAs调控HDL-C靶向作用基因和作用部位
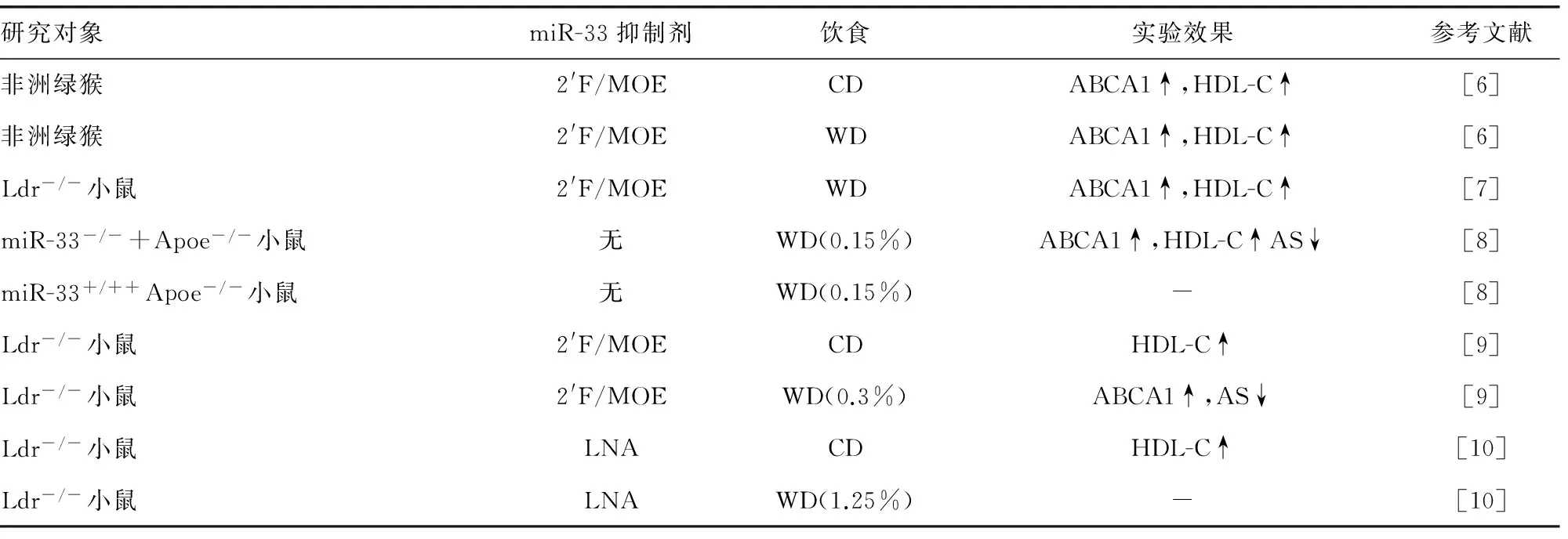
表2 抑制miR-33表达的相关实验研究
注:2′F/MOE(miR-33抑制剂),LNA锁核酸(miR-33抑制剂),CD素食饮食,WD高胆固醇饮食,“-”无效果。
3.2 靶向调控LXRα基因表达的miRNAs LXRα是胆固醇合成与转运过程的关键调节子。已证实肝脏细胞中miR-1、miR-206、miR-613靶向调控LXRα,进而影响其下游靶基因如ABCA1、ABCG1、SREBP和乙酰辅酶A羧化酶等基因的表达,产生级联效应[21]。巨噬细胞中过表达miR-206,反而激活LXRα的活性,上调LXRα信号通路关键基因[22]。miR-206的特性可能在维系肝脏与外周组织间的胆固醇稳态中发挥作用。miR-613受到SREBP-1c的转录激活,同时靶向抑制LXRα的活性与表达,形成LXR-SREBP-miR-613负反馈调节回路,调节细胞内胆固醇稳态[23]。
3.3 靶向调控B族Ⅰ型清道夫受体的miRNAs SR- BⅠ是胆固醇反向转运过程的重要成员,参与肝脏HDL胆固醇酯选择性摄取过程。在肝细胞中miR-185、miR-96、miR-223靶向抑制SR-BⅠ的基因表达,调节HDL-C选择性摄取过程[24]。miR-125a和miR-455可直接靶向作用SR-BⅠ,负向调控HDL胆固醇摄取过程,以及减少以胆固醇为原料的固醇类激素的合成[25]。尽管以靶向抑制SR-BⅠ的miRNAs为干预手段,能够促使机体HDL-C水平升高,但由于限制了肝细胞对HDL-C的选择性摄取过程,反而阻碍了胆固醇的反向转运过程,加速动脉粥样硬化进程,说明应侧重于miRNA介导的HDL-C功能改善的作用,而不能盲目性强调HDL-C水平的变化程度。
3.4 肝脏特异性miRNA与胆固醇代谢调控 miR-122在肝脏中含量最多,占肝脏所有miRNAs的80%,是肝脏特异性miRNA分子。尽管miR-122靶向抑制基因与信号途径尚未被证实,但已有证据显示miR-122正向调控胆固醇合成相关分子,如3-羟基-3-甲基-辅酶A合成酶1、7-脱氢胆甾醇还原酶和鲨烯环氧酶等[26]。在小鼠和非人灵长类动物高脂模型中证实,应用miR-122抑制剂能够大幅降低血浆总胆固醇水平,而胆红素、转氨酶和肌酐等肝功能生化指标未发生显著变化,说明miR-122抑制剂的靶向干预具有一定的安全性[27]。
4 小结与展望
在miRNA介导的胆固醇代谢精细调控网络中,既有以靶向抑制胆固醇代谢关键基因的负向调节性miRNA分子,又有通过RNA激活或间接激活方式作用的正向调节性miRNA分子。相对烟酸、贝特类、CETP抑制剂等药物而言,胆固醇代谢调节性miRNA抑制剂或模拟物具有改善HDL-C功能的预期效果,为心血管事件剩留风险问题提供了一种全新的解决方案。作为一种新型的干预策略,其临床应用的有效性与安全性,尚需充分利用生物信息学技术,剖析其调控网络的多样性与复杂性,并通过科学系统性的临床前试验进行重复性功能验证。
[1]Shah PK.Apolipoprotein A-I/HDL infusion therapy for plaque stabilization-regression:a novel therapeutic approach[J].Curr Pharm Des,2007,13(10):1031-1038.
[2]Keene D,Price C,Shun-Shin MJ,et al.Effect on cardiovascular risk of high density lipoprotein targeted drug treatments niacin,fibrates,and CETP inhibitors:meta-analysis of randomised controlled trials including 117,411 patients[J].BMJ,2014,349(349):g4379.
[3]Lewis BP,Burge CB,Bartel DP.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15-20.
[4]Dweep H,Gretz N.miRWalk2.0:a comprehensive Atlas of microRNA-target interactions[J].Nat Methods,2015,12(8):697.
[5]Turchinovich A,Samatov TR,Tonevitsky AG,et al.Circulating miRNAs:cell-cell communication function?[J].Front Genet,2013,4(6):119.
[6]Rayner KJ,Esau CC,Hussain FN,et al.Inhibition of miR-33a/b in non-human primates raises plasma HDL and lowers VLDL triglycerides[J].Nature,2011,478(7369):404-407.
[7]Rayner KJ,Sheedy FJ,Esau CC,et al.Antagonism of miR-33 in mice promotes reverse cholesterol transport and regression of atherosclerosis[J].J Clin Invest,2011,121(7):2921-2931.
[8]Horie T,Baba O,Kuwabara Y,et al.MicroRNA-33 deficiency reduces the progression of atherosclerotic plaque in ApoE-/-mice[J].J Am Heart Assoc,2012,1(6):e003376.
[9]Rotllan N,Ramírez CM,Aryal B,et al.Therapeutic silencing of microRNA-33 inhibits the progression of atherosclerosis in Ldlr-/-mice-brief report[J].Arterioscler Thromb Vasc Biol,2013,33(8):1973-1977.
[10]Marquart TJ,Wu J,Lusis AJ,et al.Anti-miR-33 therapy does not alter the progression of atherosclerosis in low-density lipoprotein receptor-deficient mice[J].Arterioscler Thromb Vasc Biol,2013,33(3):455-458.
[11]De Aguiar Vallim TQ,Tarling EJ,Kim T,et al.MicroRNA-144 regulates hepatic ATP binding cassette transporter A1 and plasma high-density lipoprotein after activation of the nuclear receptor farnesoid X receptor[J].Circ Res,2013,112(12):1602-1612.
[12]Lv YC,Tang YY,Peng J,et al.MicroRNA-19b promotes macrophage cholesterol accumulation and aortic atherosclerosis by targeting ATP-binding cassette transporter A1[J].Atherosclerosis,2014,236(1):215-226.
[13]Ramirez CM,Dávalos A,Goedeke L,et al.MicroRNA-758 regulates cholesterol efflux through posttranscriptional repression of ATP-binding cassette transporter A1[J].Arterioscler Thromb Vasc Biol,2011,31(11):2707-2714.
[14]Kim J,Yoon H,Ramírez CM,et al.MiR-106b impairs cholesterol efflux and increases Aβ levels by repressing ABCA1 expression[J].Exp Neurol,2012,235(2):476-483.
[15]Kang MH,Zhang LH,Wijesekara N,et al.Regulation of ABCA1 protein expression and function in hepatic and pancreatic islet cells by miR-145[J].Arterioscler Thromb Vasc Biol,2013,33(12):2724-2732.
[16]Liu J,Liu XQ,Liu Y,et al.MicroRNA 28-5p regulates ATP-binding cassette transporter A1 via inhibiting extracellular signal-regulated kinase 2[J].Mol Med Rep,2016,13(1):433-440.
[17]Wang D,Xia M,Yan X,et al.Gut microbiota metabolism of anthocyanin promotes reverse cholesterol transport in mice via repressing miRNA-10b[J].Circ Res,2012,111(8):967-981.
[18]Sun D,Zhang J,Xie J,et al.MiR-26 controls LXR-dependent cholesterol efflux by targeting ABCA1 and ARL7[J].FEBS Lett,2012,586(10):1472-1479.
[19]Goedeke L,Rotllan N,Ramírez CM,et al.miR-27b inhibits LDLR and ABCA1 expression but does not influence plasma and hepatic lipid levels in mice[J].Atherosclerosis,2015,243(2):499-509.
[20]Goedeke L,Rotllan N,Canfrán-Duque A,et al.MicroRNA-148a regulates LDL receptor and ABCA1 expression to control circulating lipoprotein levels[J].Nat Med,2015,21(11):1280-1289.
[21]Zhong D,Huang G,Zhang Y,et al.MicroRNA-1 and microRNA-206 suppress LXRα-induced lipogenesis in hepatocytes[J].Cell Signal,2013,25(6):1429-1437.
[22]Vinod M,Chennamsetty I,Colin S,et al.miR-206 controls LXRα expression and promotes LXR-mediated cholesterol efflux in macrophages[J].Biochim Biophys Acta,2014,1841(6):827-835.
[23]Ou Z,Wada T,Gramignoli R,et al.MicroRNA hsa-miR-613 targets the human LXRα gene and mediates a feedback loop of LXRα autoregulation[J].Mol Endocrinol,2011,25(4):584-596.
[24]Wang L,Jia XJ,Jiang HJ,et al.MicroRNAs 185,96,and 223 repress selective high-density lipoprotein cholesterol uptake through posttranscriptional inhibition[J].Mol Cell Biol,2013,33(10):1956-1964.
[25]Hu Z,Shen WJ,Kraemer FB,et al.MicroRNAs 125a and 455 repress lipoprotein-supported steroidogenesis by targeting scavenger receptor class B type I in steroidogenic cells[J].Mol Cell Biol,2012,32(24):5035-5045.
[26]Elmén J,Lindow M,Schütz S,et al.LNA-mediated microRNA silencing in non-human primates[J].Nature,2008,452(7189):896-899.
[27]Najafi-Shoushtari SH,Kristo F,Li Y,et al.MicroRNA-33 and the SREBP host genes cooperate to control cholesterol homeostasis[J].Science,2010,328(5985):1566-1569.
河北省人社厅留学人员科技活动资助项目(2013)。
10.3969/j.issn.1673-4130.2016.20.025
A
1673-4130(2016)20-2867-04
2016-04-07
2016-06-05)
△通讯作者,E-mail:tianwei0@hotmail.com。
