姜黄素调控糖尿病小鼠主动脉平滑肌大电导钙激活钾通道β1亚基蛋白表达的研究
2016-11-19樊苗苗孙述昱夏雄飞
吴 宾 樊苗苗 孙述昱 夏雄飞 袁 铭 陶 凌 易 甫
·基础研究·
姜黄素调控糖尿病小鼠主动脉平滑肌大电导钙激活钾通道β1亚基蛋白表达的研究
吴 宾 樊苗苗 孙述昱 夏雄飞 袁 铭 陶 凌 易 甫
目的:探讨姜黄素对糖尿病小鼠主动脉平滑肌大电导钙激活钾通道β1亚基(BK-β1)蛋白表达的影响及可能的机制。 方法:以注射链脲霉素的方法制备糖尿病小鼠模型,将雄性C57/BL6J小鼠分为4组:对照组、姜黄素对照组、糖尿病组和姜黄素糖尿病组,每组15只。姜黄素对照组和姜黄素糖尿病组给予姜黄素100 mg/(kg·d)灌胃,对照组和糖尿病组给予5%的羧甲基纤维素钠灌胃。灌胃8周后,Western blot检测腹主动脉BK-β1、肌肉环指蛋白1(MuRF1)、核因子κB1(NF-κB1)/p50和NF-κB/Rel家族成员RelA/p65的表达水平;免疫组化检测腹主动脉BK-β1和MuRF1的表达水平;动脉血管舒张反应性实验检测腹主动脉对BK通道激动剂NS-1619的反应性。 结果:与对照组相比,糖尿病组的BK-β1的表达显著降低,MuRF1、NF-κB1/p50和RelA/p65的表达显著增加,腹主动脉血管环对NS-1619的舒张反应性降低(P<0.05);与糖尿病组相比,姜黄素糖尿病组的BK-β1的表达显著增加,MuRF1、NF-κB1/p50和RelA/p65的表达显著降低,腹主动脉对NS-1619的舒张反应性显著改善(P<0.05)。 结论:姜黄素通过抑制MuRF1上调糖尿病小鼠主动脉平滑肌BK-β1表达,改善腹主动脉对NS-1619的舒张反应性,其机制可能与其抑制NF-κB的表达有关。
姜黄素;大电导钙激活钾通道;糖尿病;肌肉环指蛋白1;核因子κB
糖尿病会使动脉的舒缩功能下降,出现心血管并发症,这是糖尿病致死/致残的主要原因[1]。大电导钙激活钾通道(large conductance Ca2+-activated K+channel,BK)由孔道形成亚基α与调节亚基β组成,在血管平滑肌内广泛表达,参与血管扩张[2]。糖尿病血管平滑肌内BK-β1亚基表达降低,导致BK通道功能下调,提示BK-β1亚基可能是糖尿病血管并发症的一个新的治疗靶点[3-5]。
姜黄素(curcumin)是从姜黄粉中分离出的一种多酚类化合物,具有抗炎、抗氧化、抗肿瘤和抗菌等作用[6]。基础研究证实,姜黄素及其类似物可改善和延缓糖尿病血管并发症[7-11]。但是关于姜黄素对糖尿病内皮功能和血管平滑肌离子通道蛋白作用的研究较少[12]。本文通过建立糖尿病小鼠模型,探讨姜黄素对糖尿病小鼠主动脉平滑肌BK-β1蛋白表达的影响及可能的机制。
1 材料和方法
1.1 实验试剂
姜黄素、链脲霉素、NS-1619(BK通道的激动剂)购于Sigma公司,组织裂解液、BCA蛋白定量试剂盒、配胶试剂盒购于碧云天公司,ECL超敏发光液购于Pierce公司,肌肉环指蛋白1(MuRF1)抗体、核因子κB1(NF-κB1)/p50抗体、BK-β1抗体购于Abcam公司,RelA/p65(NF-κB/Rel家族成员)抗体购于CST公司,辣根过氧化物酶标记的山羊抗兔二抗购于Earthox公司。
1.2 糖尿病小鼠模型的建立
4周龄的雄性C57/BL6J小鼠购于第四军医大学实验动物中心,小鼠给予单次腹腔内注射链脲霉素(100 mg/kg,溶于0.1 mmol/L的枸橼酸钠,pH4.4),2周后测定血糖浓度,如果血糖浓度低于16.7 mmol/L,再次给予腹腔内注射等剂量的链脲霉素。动态监测小鼠的血糖水平,血糖浓度持续8周高于16.7 mmol/L诊断为糖尿病。对照组小鼠腹腔注射0.1 mmol/L的枸橼酸钠溶液。
1.3 实验分组
将小鼠随机分为4组:对照组、姜黄素对照组、糖尿病组、姜黄素糖尿病组,每组15只。所有动物在相同条件下喂养,环境温度(20±2)℃,湿度为30%~70%,自由取食和饮水。造模成功后,姜黄素对照组和姜黄素糖尿病组给予100 mg/(kg·d)姜黄素灌胃,对照组和糖尿病组给予5%的羧甲基纤维素钠灌胃,灌胃持续8周。
1.4 腹主动脉和动脉血管环的制备
小鼠腹腔内注射戊巴比妥钠40 mg/kg进行麻醉,心脏放血处死,迅速取出腹主动脉并置于4℃的Krebs缓冲液中。取材的过程中尽量避免牵拉血管以减少对动脉血管活性的影响,于解剖显微镜下仔细分离腹主动脉,去除血管周围的结缔组织。截取长度3 mm的腹主动脉(以髂总动脉分支处为起始点向近心端截取)血管环,将分离好的血管环置于氧合的4℃的Krebs缓冲液中,以进行动脉血管的舒张反应性测定。
1.5 Western blot检测
将分离的小鼠腹主动脉组织匀浆后提取蛋白,采用BCA法进行蛋白定量。蛋白调至等浓度后,加入上样缓冲液混合,离心后上样。随后进行蛋白电泳、转膜、牛奶封闭、孵育一抗过夜。第2日孵育二抗,ECL显影,保存图片,计算各条带OD值,以检测蛋白与GAPDH的OD值比值代表蛋白的相对表达量。
1.6 免疫组化检测
小鼠腹主动脉于多聚甲醛固定48 h,石蜡包埋切片,常规脱蜡,抗原修复。血清封闭后,分别加入MuRF1和BK-β1一抗孵育过夜。第2日孵育二抗,DAB显色液显色,苏木素衬染,脱水封片。用Image-Pro Plus 6.0进行MuRF1和BK-β1的染色强度分析,分别以MuRF1和BK-β1染色面积与切片平滑肌面积的比值作为染色强度值。
1.7 动脉血管舒张反应性测定
将腹主动脉血管环悬挂于两个不锈钢三角挂钩上,并置于有15 mL Krebs缓冲液的恒温浴槽中,另一端连接张力换能器,采用Powerlab软件记录血管张力变化。浴槽中持续充以95%O2、5%CO2的混合气,维持37℃恒温。腹主动脉在浴槽中平衡60 min,在此期间每10 min更换一次Krebs缓冲液。平衡过程中腹主动脉以0.2个的步幅逐步升高使血管达到最高静息张力。血管舒张反应性检测在最适静息张力下进行,首先使用10-6mol/L苯肾上腺素预收缩腹主动脉,使其达到收缩平台,然后加入累积浓度的NS-1619(10-9~10-5mol/L)以获得浓度-效应曲线。血管环舒张程度=NS-1619作用后舒张血管幅度/苯肾上腺素预收缩血管幅度×100%。
1.8 统计学分析
采用SPSS19.0软件进行统计学分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 BK-β1和MuRF1的表达
Western blot和免疫组化检测结果显示,与对照组相比,糖尿病组BK-β1的表达显著降低,MuRF1的表达显著增加(P<0.05);与糖尿病组相比,姜黄素糖尿病组BK-β1的表达显著增加,MuRF1的表达显著降低(P<0.05);姜黄素对照组和对照组之间BK-β1和MuRF1的表达无统计学差异。见图1、图2和表1。

图1 Western blot检测各组腹主动脉中BK-β1和MuRF1的表达水平
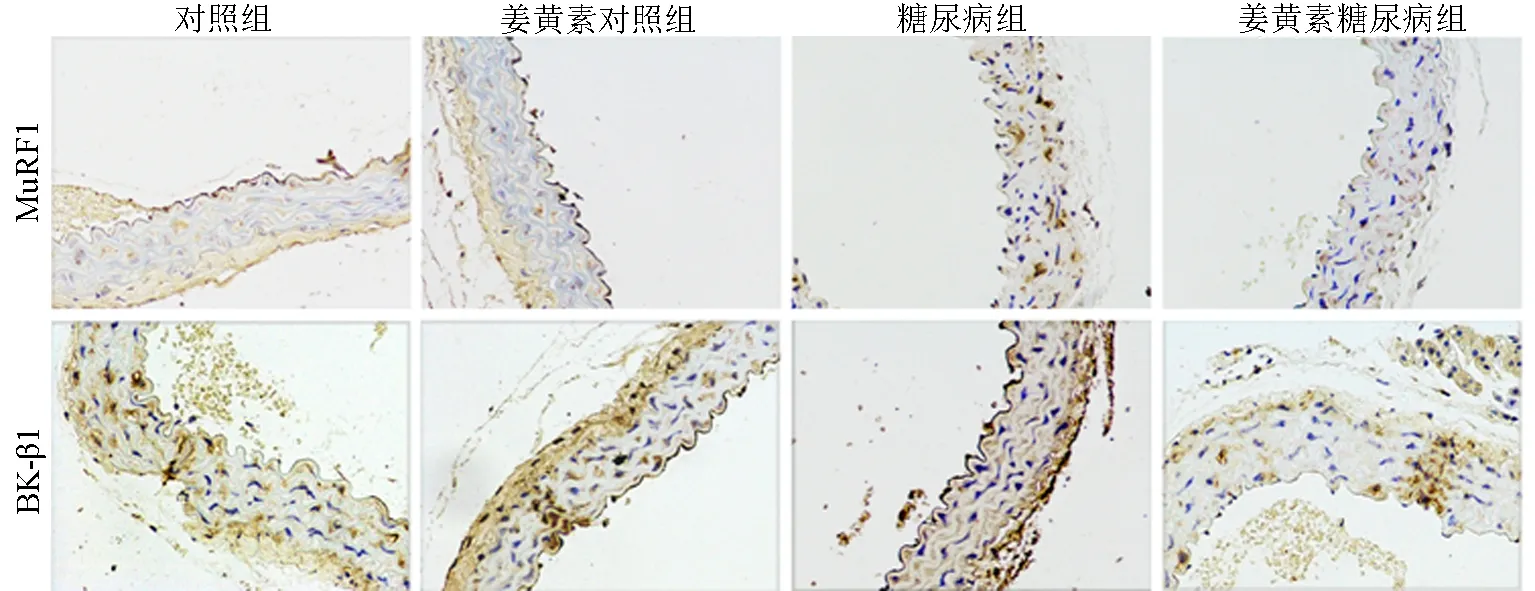
图2 免疫组化检测各组腹主动脉平滑肌组织中BK-β1和MuRF1的表达水平(×400)

表1 各组腹主动脉中BK-β1和MuRF1蛋白表达的比较
注:与对照组比较,(1)P<0.05;与糖尿病组比较,(2)P<0.05
2.2 动脉血管环对NS-1619的舒张反应性
NS-1619浓度在10-7mol/L以上时,糖尿病组小鼠腹主动脉血管环对NS-1619的舒张程度明显低于对照组(P<0.05),姜黄素糖尿病组腹主动脉对NS-1619的舒张程度明显高于糖尿病组(P<0.05);对照组和姜黄素对照组腹主动脉对NS-1619的舒张程度无显著性差异,见图3。

注:与对照组比较,(1)P<0.05;与糖尿病组比较,(2)P<0.05图3 各组腹主动脉血管环对NS-1619的舒张反应性
2.3 NF-κB1/p50和RelA/p65的表达
Western blot检测结果显示,与对照组相比,糖尿病组NF-κB1/p50和RelA/p65的表达均显著增加(P<0.05);与糖尿病组相比,姜黄素糖尿病组NF-κB1/p50和RelA/p65的表达显著降低(P<0.05);姜黄素对照组和对照组之间NF-κB1/p50和RelA/p65的表达无显著性差异,见图4和表2。

图4 Western blot检测各组腹主动脉中NFκB1/p50和RelA/p65的表达
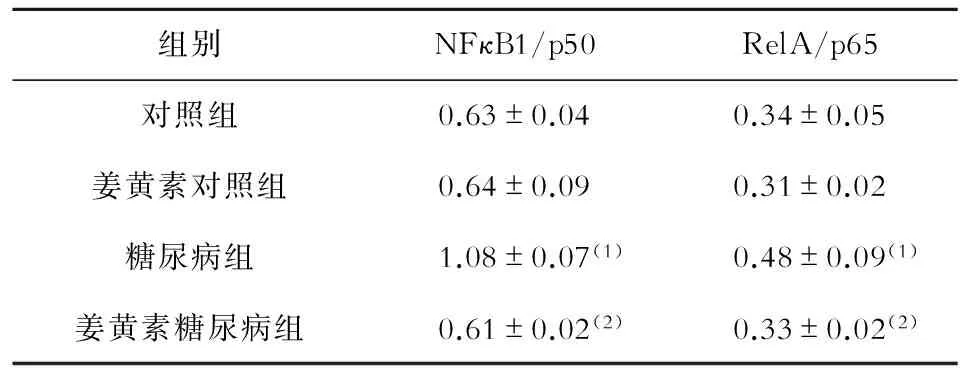
表2 各组腹主动脉中NFκB1/p50和RelA/p65蛋白相对表达量的比较
注:与对照组比较,(1)P<0.05;与糖尿病组比较,(2)P<0.05
3 讨论
糖尿病心血管并发症是糖尿病高死亡率的首要原因[13]。研究显示糖尿病导致的动脉血管平滑肌功能异常与平滑肌细胞上的钾通道,尤其是BK通道活性受损有关[14]。糖尿病可使血管BK-β1亚基表达下降,引起通道激活所需钙离子的最大有效浓度升高、通道平均开放时间缩短、平均关闭时间延长,导致BK通道功能下调,这提示BK-β1亚基是BK通道的重要调节因子[15]。本研究证实,姜黄素可以上调糖尿病小鼠腹主动脉平滑肌BK-β1的表达,提高糖尿病小鼠腹主动脉对NS-1619的舒张反应性,改善糖尿病小鼠血管平滑肌的功能。姜黄素有望成为治疗和预防糖尿病血管并发症的有效药物。
泛素-蛋白酶体途径是细胞内蛋白质选择性降解的重要途径,参与降解80%~90%细胞内蛋白[16]。MuRF1是泛素连接酶E3s中的一种,主要在肌肉组织中表达,已经证实MuRF1参与多种心脏疾病的发生发展[17]。我们在前期研究中发现,MuRF1的coiled-coil结构域与BK-β1亚基的N端结合,参与BK-β1泛素化降解过程[5]。本研究发现,姜黄素可降低糖尿病小鼠腹主动脉MuRF1的表达,使BK-β1亚基的表达上调,验证了糖尿病血管平滑肌中MuRF1可介导BK-β1的降解,结果与我们前期研究结论一致,而且本研究发现姜黄素可以通过MuRF1/BK-β1途径影响BK通道功能,发挥血管保护作用。
在心肌萎缩模型中,NF-κB激活可使MuRF1转录增加,MuRF1可造成心肌的泛素化降解,引起心肌萎缩[18],但动脉血管平滑肌内NF-κB对MuRF1的作用尚不明确。研究证实,姜黄素可通过抑制NF-κB途径对糖尿病及其并发症起保护作用[19-22]。本研究发现,糖尿病血管平滑肌中NF-κB1/p50和RelA/p65表达增加,而姜黄素可降低NF-κB1/p50和RelA/p65的表达。结合MuRF1和BK-β1在血管中的表达情况,推测NF-κB可能是血管平滑肌MuRF1/BK-β1途径的上游调控因子,姜黄素可能通过抑制NF-κB影响MuRF1/BK-β1途径。
本研究为姜黄素治疗和预防糖尿病血管并发症提供了实验依据,对于研究姜黄素改善糖尿病血管并发症,特别是糖尿病人群冠状动脉异常收缩具有重要意义。糖尿病血管平滑肌BK-β1降解有不同的途径[5, 23-26],因而姜黄素上调糖尿病血管BK-β1表达可能有其他的机制,另外,姜黄素在冠状动脉上是否存在相同作用,均需后续进一步研究明确。
[1] Dall TM, Yang W, Halder P, et al. The economic burden of elevated blood glucose levels in 2012: diagnosed and undiagnosed diabetes, gestational diabetes mellitus, and prediabetes[J]. Diabetes Care, 2014,37(12):3172-3179.
[2] Carvalho-de-Souza JL, Varanda WA, Tostes RC, et al. BK channels in cardiovascular diseases and aging[J]. Aging Dis, 2013,4(1):38-49.
[3] 吴 宾, 陶 凌, 易 甫. 糖尿病对冠状动脉平滑肌细胞大电导钙激活钾通道的影响[J]. 国际心血管病杂志, 2015,42(4):245-247.
[4] Wang RX, Shi HF, Chai Q, et al. Molecular mechanisms of diabetic coronary dysfunction due to large conductance Ca2+-activated K+channel impairment[J]. Chin Med J (Engl), 2012,125(14):2548-2555.
[5] Yi F, Wang H, Chai Q, et al. Regulation of large conductance Ca2+-activated K+(BK) channel beta1 subunit expression by muscle RING finger protein 1 in diabetic vessels[J]. J Biol Chem, 2014,289(15):10853-10864.
[6] Oliveira AS, Sousa E, Vasconcelos MH, et al. Curcumin: a natural lead for potential new drug candidates[J]. Curr Med Chem, 2015,22(36):4196-4232.
[7] Rivera-Mancia S, Lozada-Garcia MC, Pedraza-Chaverri J. Experimental evidence for curcumin and its analogs for management of diabetes mellitus and its associated complications[J]. Eur J Pharmacol, 2015,756(6):30-37.
[8] Devadasu VR, Wadsworth RM, Kumar MN. Protective effects of nanoparticulate coenzyme Q10 and curcumin on inflammatory markers and lipid metabolism in streptozotocin-induced diabetic rats: a possible remedy to diabetic complications[J]. Drug Deliv Transl Res, 2011,1(6):448-455.
[9] Jeenger MK, Shrivastava S, Yerra VG, et al. Curcumin: a pleiotropic phytonutrient in diabetic complications[J]. Nutrition, 2015,31(2):276-282.
[10] Meng B, Li J, Cao H. Antioxidant and antiinflammatory activities of curcumin on diabetes mellitus and its complications[J]. Curr Pharm Des, 2013,19(11):2101-2113.
[11] Nabavi SF, Thiagarajan R, Rastrelli L, et al. Curcumin: a natural product for diabetes and its complications[J]. Curr Top Med Chem, 2015,15(23):2445-2455.
[12] Liu Y, Wang Y, Miao X, et al. Inhibition of JNK by compound C66 prevents pathological changes of the aorta in STZ-induced diabetes[J]. J Cell Mol Med, 2014,18(6):1203-1212.
[13] 李俭强, 李 悦, 薛竟宜, 等. 冠心病患者血糖管理策略[J]. 国际心血管病杂志, 2013,40(1):38-40.
[14] Lu T, Ye D, He T, et al. Impaired Ca2+-dependent activation of large-conductance Ca2+-activated K+channels in the coronary artery smooth muscle cells of zucker diabetic fatty rats[J]. Biophys J, 2008,95(11):5165-5177.
[15] Qian L, Liu X, Wang R. Role of BK(Ca) channels in diabetic vascular complications[J]. Chin Med J (Engl), 2014,127(9):1775-1781.
[16] Aghdam SY, Sheibani N. The ubiquitin-proteasome system and microvascular complications of diabetes[J]. J Ophthalmic Vis Res, 2013,8(3):244-256.
[17] Willis MS, Bevilacqua A, Pulinilkunnil T, et al. The role of ubiquitin ligases in cardiac disease[J]. J Mol Cell Cardiol, 2014,71(6):43-53.
[18] Willis MS, Rojas M, Li L, et al. Muscle ring finger 1 mediates cardiac atrophy in vivo[J]. Am J Physiol Heart Circ Physiol, 2009,296(4):H997-H1006.
[19] Pan Y, Zhang X, Wang Y, et al. Targeting JNK by a new curcumin analog to inhibit NF-κB-mediated expression of cell adhesion molecules attenuates renal macrophage infiltration and injury in diabetic mice[J]. PLoS One, 2013,8(11):e79084.
[20] Rungseesantivanon S, Thengchaisri N, Ruangvejvorachai P, et al. Curcumin improves prostanoid ratio in diabetic mesenteric arteries associated with cyclooxygenase-2 and NF-kappaB suppression[J]. Diabetes Metab Syndr Obes, 2010,3(12):421-429.
[21] Soetikno V, Sari FR, Veeraveedu PT, et al. Curcumin ameliorates macrophage infiltration by inhibiting NF-kappaB activation and proinflammatory cytokines in streptozotocin induced-diabetic nephropathy[J]. Nutr Metab (Lond), 2011,8(1):35.
[22] Zhang F, Yang F, Zhao H, et al. Curcumin alleviates lung injury in diabetic rats by inhibiting NF-kappaB pathway[J]. Clin Exp Pharmacol Physiol, 2015,42(9):956-963.
[23] Zhang DM, He T, Katusic ZS, et al. Muscle-specific f-box only proteins facilitate bk channel beta(1) subunit downregulation in vascular smooth muscle cells of diabetes mellitus[J]. Circ Res, 2010,107(12):1454-1459.
[24] Lu T, Chai Q, Yu L, et al. Reactive oxygen species signaling facilitates FOXO-3a/FBXO-dependent vascular BK channel beta 1 subunit degradation in diabetic mice[J]. Diabetes, 2012,61(7):1860-1868.
[25] Lu T, Zhang D, Wang X, et al. Regulation of coronary arterial BK channels by caveolae-mediated angiotensin II signaling in diabetes mellitus[J]. Circ Res, 2010,106(6):1164-1348.
[26] Zhang Z, Li M, Lu R, et al. The angiotensin II type 1 receptor (AT1R) closely interacts with large conductance voltage- and Ca2+-activated K+(BK) channels and inhibits their activity independent of G-protein activation[J]. J Biol Chem, 2014,289(37):25678-25689.
(收稿:2016-03-20 修回:2016-06-13)
(本文编辑:胡晓静)
The effects of curcumin on the expression of β1 subunit of the large conductance Ca2+-activated K+channel in aortic smooth muscle of diabetic mice
WUBin1,FANMiaomiao1,SUNShuyu2,XIAXiongfei2,YUANMing1,TAOLing1,YIFu1.
1.DepartmentofCardiology,XijingHospital,FourthMilitaryMedicalUniversity; 2.FirstCadetBrigade,FourthMilitaryMedicalUniversity,Shannxi710032,China
Objective:To explore the effects and mechanism of curcumin on the expression of β1 subunit of the large conductance Ca2+-activated K+channel (BK-β1) in aortic smooth muscle of diabetic mice. Methods:Diabetes was induced by a single intraperitoneal of streptozotocin. Male C57/BL6J mice were randomly divided into four groups: control group, curcumin control group, diabetes group, curcumin diabetes group, each groupn=15. Curcumin control group and curcumin diabetes group were given by a dose of 100 mg/(kg·d)curcumin, while control and diabetes groups received 5% sodium carboxymethyl cellulose gavage. After 8 weeks, western blot was used to determine the expression of BK-β1, muscle RING finger protein 1 (MuRF1), nuclear factor-κB1 (NF-κB1)/p50 and RelA/p65. The expressions of BK-β1 and MuRF1 were also tested by immunochemistry. Concentration-response of NS-1619 (the activator of BK channel) on aortic vasodilatation was measured by functional vasoreactivity test. Results:Compared with control group, expression of BK-β1 decreased significantly in diabetes group, with significantly increased expression of MuRF1, NF-κB1/p50 and RelA/p65, and there was a reduction of NS-1619-mediated aortic dilation through function vasoreactivity test in diabetes group (P<0.05 for all). Compared with diabetes group, protein level of BK-β1 increased while MuRF1, NF-κB1/p50 and RelA/p65 decreased significantly, and the response to NS-1619 was restored by treatment of curcumin in curcumin diabetes group (P<0.05 for all). Conclusion:Curcumin increases the expression of BK-β1 in aortic smooth muscle through inhibiting MuRF1 and restores the response to NS-1619 in diabetic mice, possibly by decreasing the expression of NF-κB.
Curcumin; Large conductance Ca2+-activated K+channel; Diabetes; Muscle RING finger protein 1; Nuclear factor-κB
国家自然科学基金(81470479)
710032 西安,第四军医大学西京医院心内科(吴 宾,樊苗苗,袁 铭,陶 凌,易 甫);第四军医大学学员一旅(孙述昱,夏雄飞)
易 甫,Email:yi12fu56@126.com
10.3969/j.issn.1673-6583.2016.05.009
