小花棘豆对羊血浆中抗氧化指标的影响
2016-11-19王选东陶大勇
何 雯,王选东,陶大勇
(塔里木大学动物科学学院,新疆阿拉尔843300)
研究简报
小花棘豆对羊血浆中抗氧化指标的影响
何 雯,王选东,陶大勇
(塔里木大学动物科学学院,新疆阿拉尔843300)
为了探讨小花棘豆中苦马豆素的中毒机理及其对羊体内氧自由基代谢的影响,将12只卡拉库尔羊随机分为2组,即对照组、实验组。采用紫外可见分光光度法分别测定了对照组和攻毒组羊血浆中超氧化物歧化酶(SOD)的活性、还原型谷胱甘肽(GSH)的活性、脂质过氧化终末代谢产物丙二醛(MDA)的含量、总巯基(TSH)、非蛋白巯基(NPSH)的含量及一氧化氮(NO)。结果表明:攻毒组羊血浆中SOD活性和GSH、TSH、NPSH含量在攻毒21 d之后均显著或极显著低于对照组(P<0.05,P<0.01),MDA含量和NO含量在攻毒21 d之后均极显著高于对照组(P<0.01)。表明苦马豆素能诱发机体内氧自由基的产生,显著降低机体主要器官和组织中某些抗氧化酶的活性,提高MDA的含量;发生脂质过氧化反应而损伤机体主要组织器官,细胞发生空泡变性,可能是苦马豆素引起中毒的原因之一。
小花棘豆;羊;抗氧化指标
小花棘豆为豆科棘豆属的多年生草本植物,主要成分为苦马豆素(swainsonine,SW)。国内外大量研究资料证实,SW能抑制溶酶体α-甘露糖苷酶、高尔基体α-甘露糖苷酶和内质网及胞质α-甘露糖苷酶的活性,使细胞内蛋白的N-糖基化合成、加工、转运以及富含甘露糖的寡聚糖代谢等过程发生障碍,导致细胞表面膜黏附分子、细胞膜受体正常功能变化,出现生殖、内分泌及免疫功能异常及细胞广泛空泡变性,使家畜中枢神经系统和实质器官受到损害,造成细胞功能紊乱,尤其是神经细胞功能紊乱,而使家畜表现出一系列神经症状[1-2]。
小花棘豆中毒的主要组织病理学特征是脑、脊髓、各内脏器官以及外周血液淋巴细胞的胞浆空泡变性,与氧自由基(oxygeli free radical,OFR)引起的空泡变性相似,可能是由于脂质过氧化反应而引起。因此,本研究通过对羊进行小花棘豆攻毒,测定不同时期血浆中抗氧化指标变化,进而分析验证小花棘豆对羊的毒性作用,进一步完善小花棘豆的中毒机理。
1 材料和方法
1.1 材料
小花棘豆2013年7月采集于新疆策勒县恰哈乡,由塔里木大学动物科学学院草业科学学科组鉴定。取植株地上部分,阴干、保存备用。新疆卡拉库尔羊12只。
1.2 试剂与仪器
试剂:SOD测定试剂盒(南京建成生物工程研究所),GSH测定试剂盒(南京建成生物工程研究所),MDA测定试剂盒(南京建成生物工程研究所),GSH标准品,2-硝基苯甲酸(DTNB),乙二胺四乙酸二钠,Tris缓冲液,磺基水杨酸,TCA溶液,甲醇,对硝基酚标准液:用0.1mol/L甘氨酸-氢氧化钠缓冲液(pH值10.14)将分析纯的对硝基酚配成2mmol/L的母液,然后稀释成浓度分别为100,200,300……1 500μmol/L的标准对硝基酚溶液以制成标准曲线,对-硝基苯基-α-D-甘露糖吡喃糖苷(Sigma公司),醋酸盐缓冲液,0.1mol/L甘氨酸-氢氧化钠缓冲液(pH值10.14)。
仪器:美的2110电磁炉,Analyst800型原子吸收分光光度计(Perkin Elmer公司),自动超纯水系统(美国密理博),FA1004N电光分析天平(上海精密科学仪器有限公司),恒温水浴锅,酶标仪(美国伯乐公司),等等。
1.3 方法
1.3.1 实验动物的初步处理 对12只实验羊用驱虫净进行前期驱虫处理,随机分为2组,每组6只。对照组羊饲喂青干草和少量精料,实验组羊每天按照10 g/kg体重的剂量饲喂小花棘豆干粉,待采食完毕后,再添加青干草和精料(饲养量同对照组)。自由饮水。在实验开始和实验终止时称重,每天饲喂时进行临床症状观察。
1.3.2 样品采集和处理 实验开始和实验终止时于卡拉库尔羊颈静脉采血5 mL,装于肝素钠抗凝管中,做好标记,3 000 r/min离心20 min,分离血浆,4℃冷藏保存,备用。
1.3.3 SOD活性测定 采用紫外分光光度法测定。
1.3.4 GSH活性测定 采用DTNB直接法测定。
1.3.5 MDA含量测定 采用硫代巴比妥酸(TBA)反应比色法测定。
以上方法均按各试剂盒说明书进行。
1.3.6 数据处理 采用Excel2007进行初步处理,用统计软件SAS9.2中的ANOVA进行单因素分析,若差异显著时用Dunan氏法进行多重比较,以P<0.05作为差异显著的判断标准。
2 结果与分析
通过羊的攻毒试验,每一周分别采取对照组和攻毒组羊的全血,分离血清,对抗氧化指标SOD活性及GSH、MDA、TSH、NPSH、NO等含量进行测定(见表1)。对照组羊随时间的增加,抗氧化指标GSH、TSH含量呈现明显上升趋势,而MDA含量和NO含量呈现明显下降趋势,SOD活性和NPSH含量变化不明显;攻毒组羊随攻毒时间的增加,抗氧化指标SOD活性、GSH、TSH、NPSH含量呈现明显的下降趋势,而MDA含量和NO含量呈现明显的上升趋势。与对照组相比,攻毒组羊随着攻毒时间的增加,SOD含量在连续攻毒15 d时表现差异显著(P<0.05),攻毒到21 d至实验终止表现差异极显著(P<0.01);GSH含量在连续攻毒8 d时表现差异显著(P<0.05),攻毒到15 d至实验终止表现差异极显著(P<0.01);MDA含量在连续攻毒8 d时表现差异显著(P<0.05),攻毒到15 d至实验终止表现差异极显著(P<0.01);TSH含量在连续攻毒21 d时表现差异显著(P<0.05),攻毒到28 d至实验终止表现差异极显著(P<0.01);NPSH含量在连续攻毒21 d时表现差异显著(P<0.05),攻毒到28 d至实验终止均表现差异极显著(P<0.01);随着实验组羊SW在体内积累的增多,NO含量呈现缓慢增长趋势,在攻毒21 d至实验终止均表现差异极显著(P<0.01)。
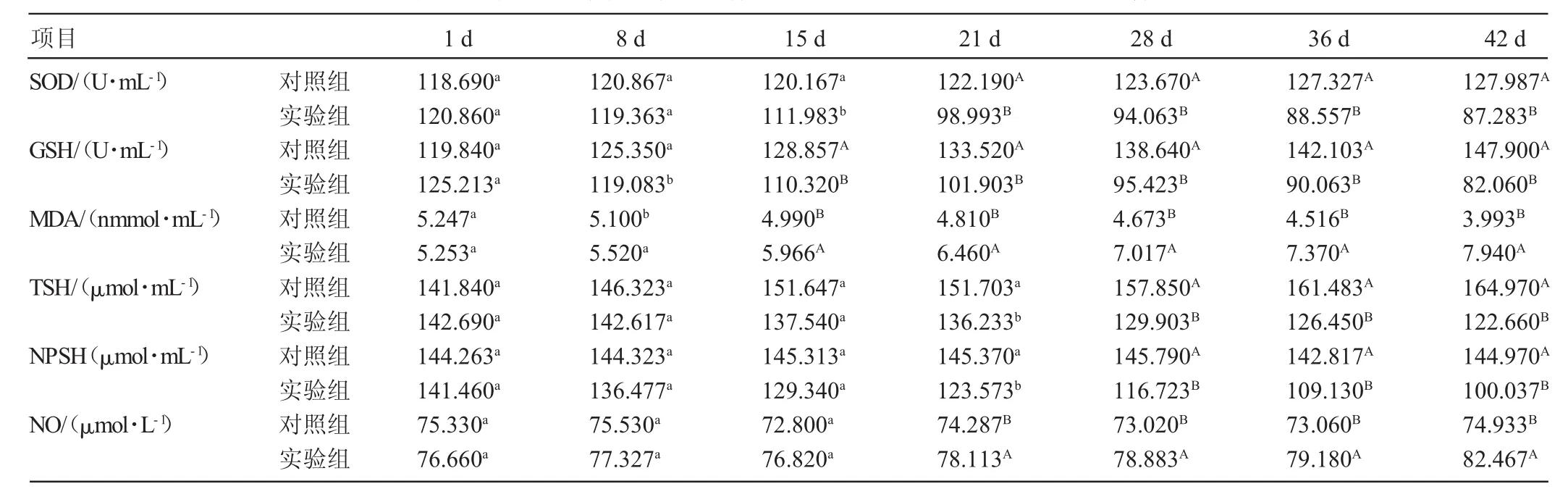
表1 攻毒组与对照组羊攻毒期间血清SOD、GSH、MDA、TSH、NPSH、NO含量对比
3 讨论
本实验在前期对羊的临床症状、剖检、组织学及血清学进行了观察及测定,进而对抗氧化指标进行了检测,验证SW对机体抗氧化系统的影响,进一步完善了SW中毒机制。SOD是机体内一种具有特定生物催化功能的蛋白质,主要分布于胞液和线粒体基质中。SOD能与O2·-发生化学反应,消除O2·-过程中产生了H2O2,对机体同样造成损害[3]。由本实验结果可以看出,给羊饲喂一段时间苦马豆素后,SOD活性在羊的血浆和脑组织中均显著降低。表明苦马豆素对羊SOD活性的影响是很严重的,而SOD活性的显著降低,说明机体抗氧化能力显著减弱,机体清除氧自由基的能力严重降低,自由基代谢发生障碍,使得机体组织器官受到损伤,而脑组织损伤最为严重。说明小花棘豆中毒引起的神经系统的损伤与机体血浆和脑组织中SOD活性的降低有关。
还原型谷胱甘肽(GSH)是机体内最重要的非酶性抗氧化物,具多种重要的生理功能,是一种能够清除多种氧化物的小分子清除剂,而GSH含量的多少是反映机体抗氧化能力的重要指标[4]。SW能显著降低血浆中GSH的含量,使得机体合成GSH-PX和GSH-ST的量减少,不能足够地分解氢过氧化物,造成血红蛋白及其他辅因子受氧化损伤,脂质过氧化作用增强,引起动物机体组织器官发生病变,出现小花棘豆中毒后的组织病理学变化。梁刚等[5]研究表明,在氟中毒后,引起大鼠体内脂质过氧化作用增强,抗氧化能力降低,在这种情况下口服GSH,发现氟中毒引起的脂质过氧化作用显著降低,使得抗氧化能力增强。说明GSH能够作用于脂质过氧化反应,也为治疗小花棘豆中毒引起的脂质过氧化作用提供了研究方向。
MDA作为反映氧化损伤的指标之一,其生成量与氧自由基生成量成正相关[6]。通过对MDA含量测定,机体能够正确快速地反映出受到自由基影响的程度及脂质过氧化的程度,进而评估出机体损伤的严重程度。本实验中,血浆及脑组织MDA含量都随着SW含量的积累而升高,说明SW中毒时,机体自由基大量产生,细胞损伤严重。
巯基水平的降低可增强自由基的氧化损伤作用。研究表明[7],巯基含量的降低可加重氧自由基的脂质过氧化损伤作用,主要起着内源性抗氧化损伤作用,在一定程度上,NPSH含量变化比较敏感。由本实验结果可知,实验组羊攻毒至21 d时,其血浆中TSH和NPSH含量与对照组相比明显下降,表现差异显著(P<0.05)。表明当羊采食一定量的小花棘豆后,总巯基、非蛋白巯基的含量会出现下降,使得体内组织中多余的氧自由基不能有效清除,加重了氧自由基诱发的脂质过氧化损伤,对组织和细胞造成严重的损伤。NO具有舒张血管的作用,能调节组织器官的血流量,又是血管内皮细胞、脑细胞及吞噬细胞产生的一种较稳定的自由基[8]。NO在体内具有复杂的病理生理作用。
4 结论
本实验对血浆中抗氧化指标含量进行测定,发现小花棘豆苦马豆素对血浆中的指标都有影响,影响随中毒量的变化而改变,使得机体抗氧化能力减弱,清除氧自由基能力降低,引起自由基代谢发生障碍,组织器官发生病理性损伤,引起疾病的发生。这些变化也是引起小花棘豆苦马豆素中毒后的组织器官病理学变化重要指标。
[1]Hueza IM,Dagli M L,Gorniak S L,et al.Toxic effect of prenatal Ipomoe a carnea administration to rats[J].Vet Hum Toxicol,2003,45:298-302.
[2]Barbosa RC,Riet-Correa F,Medeirosb RM T,et al.Intoxication by Ipomoea sericophylla and Ipomoea riedelii in goats in the state of Parai'ba,Northeastern Brazil[J].Toxicon,2006,47:371-379.
[3]廖日滔,郭静科,李冰洁,等.自由基相关细胞信号传导的研究进展[J].中国细胞生物学学报,2014,11:1573-1583.
[4]刘爱华.还原型谷胱甘肽的作用机制及其临床应用[J].中国医药指南,2013(9):391-393.
[5]梁刚,孙贵苑,黄丽君,等.口服谷胱甘肽对氟所致大白鼠脂质过氧化的影响[J].环境与健康杂志,2001,18(2):77-79.
[6]陈瑗.自由基医学[M].北京:人民医学出版社,1991:83-84.
[7]陈震阳,潘立群,谭淑珍,等.血清中总巯基和非蛋白巯基含量分别测定研究[J].卫生毒理学杂志,1999,4(4):268-269.
[8]刘兆红,岳炳辉.氧自由基对动物机体的毒性作用[J].上海畜牧兽医通讯,2005,3:57.
S826.1
A
2095-3887(2016)04-0062-03
10.3969/j.issn.2095-3887.2016.04.017
2016-05-26
国家自然科学基金(31160520);校级研究生科研创新项目(TDGR1201504)
何雯(1989-),女,硕士研究生。
陶大勇(1967-),男,教授,硕士生导师,主要从事临床兽医学及中草药学研究。
