以贻贝贝壳为原料制备的无定形磷酸钙及其性质
2016-11-19韩义忠崔正阳孔祥东
韩义忠,崔正阳,陈 岑,叶 婷,孔祥东,
(浙江理工大学,a.材料与纺织学院; b.生命科学学院, 杭州 310018)
以贻贝贝壳为原料制备的无定形磷酸钙及其性质
韩义忠a,崔正阳b,陈 岑b,叶 婷b,孔祥东a,b
(浙江理工大学,a.材料与纺织学院; b.生命科学学院, 杭州 310018)
以废弃的贻贝贝壳资源为原料,将贝壳简单粉碎后作为钙源制备出了无定形磷酸钙(ACP)。在反应过程中先后加入磷酸、三聚磷酸钠及尿素,快速制备了直径为250~450 nm的球形亚微米颗粒,该颗粒粒径分布范围窄,尺寸均一,表面积大,颗粒表面电位(Zeta电位)为27.5 mV。该无定形磷酸钙颗粒与量子点结合性良好,MTT试验表明该无定形磷酸钙颗粒对成骨细胞(MC3T3-E1)不显示毒性,生物相容性良好。
无定形磷酸钙;贻贝贝壳;生物相容性
0 引 言
无定形磷酸钙(amorphous calcium phosphate,ACP)是一种短程有序,长程无序磷酸钙的总称[1],ACP可以被归为具有可变化学组成(Ca/P比范围可在1.0~2.0之间变化)、化学性质与玻璃相似的一类磷酸钙盐[2]。ACP是在中性或酸性条件下合成羟基磷灰石(HAp)过程中发现的一种磷酸钙的无定形中间相,所以X衍射分析显示非晶特征[3]。
贻贝(mussel) 俗称青口、海红,其干制品称淡菜。贻贝属于软体动物门(Mollosca),瓣鳃纲(Lanellibranchia),异柱目(Anisomyaria),贻贝科(Mytidea),是一种营足丝附着生活的双壳类软体动物[5]。贻贝贝壳约占贻贝总质量的55%,贻贝贝壳的主要无机成分为碳酸钙(95%),还有一些有机物质(蛋白质和多糖)和镁、钾、锶、氮、硫、磷等微量元素[6]。贻贝贝壳中的CaCO3主要组成为方解石和霰石[7]。随着我国海洋养殖业的发展,在沿海地区产生了大量废弃的贻贝贝壳,贝壳堆积既占用大量的土地,又容易造成环境污染,还是一种生物资源的浪费。
以贻贝贝壳为原料制备无定形磷酸钙时,贝壳中的镁、钾、锶等离子可进入到颗粒中,天然骨中除了钙离子外还含有多种与贝壳中相同的金属元素,所制备的无定形磷酸钙具有更好的生物相容性。贝壳中的镁、锶、碳酸根等离子还可以有效地抑制晶态磷酸钙晶粒的形成和生长,从而促进ACP的形成[2]。无定形磷酸钙的生物降解速率可控、骨传导性能优异,具有良好的细胞粘附性、生物活性,可以用作骨科材料、组织工程支架、牙科材料和释放载体等[2]。
本研究充分利用了废弃的贻贝贝壳资源,既有助于缓解环境问题,还可以提高废弃资源的附加值,变废为宝。
1 实验部分
1.1 试剂与材料
贻贝贝壳(取自舟山市嵊泗县),丙酸(分析纯,上海展云化工有限公司),三聚磷酸钠(分析纯,天津市永大化学试剂有限公司),尿素(分析纯,无锡市展望化工试剂有限公司),无水乙醇(分析纯,杭州高晶精细化工有限公司),去离子水由milipore纯水仪制备。
1.2 仪 器
AK-98流水式超细中药粉碎机(奥力中药机械有限公司),HL-2B恒流泵(上海嘉鹏科技有限公司),磁力搅拌器(杭州惠创仪器设备有限公司),ZEISS-ULTRA55扫描电子显微镜,JEM-2100透射电子显微镜,ARL-X’TRA X射线粉末衍射仪,Nicolet 5700傅里叶红外光谱(Thermo Electron),Pyris Diamond TGA热重分析仪(PerkinElmer),ZEN3600动态光散射仪(马尔文仪器有限公司),DNA export酶标仪(TECAN),Nano Drop 2000超微量分光光度计(Thermo Scientific),F-4500荧光分光光度计(日本日立公司)。
1.3 无定形磷酸钙的制备
贻贝贝壳从舟山市嵊泗县采集,将贻贝贝壳清洗干净,干燥后粉碎,置于干燥环境中备用。取少量样品进行XRD、FTIR、TG分析。
取0.5 g贻贝贝壳粉于100 mL的烧杯中,加入40 mL浓度为5%的丙酸,使其充分反应,离心后取上清液,将得到的溶液稀释至50 mL,然后将浓度为0.06 M的磷酸溶液50 mL滴加到烧杯中,滴加完成后向烧杯中加入0.6 mmol的三聚磷酸钠,反应30 min后加入6 g尿素,搅拌使尿素充分溶解后,将烧杯置于90 ℃的水浴中,搅拌3 min后静置至出现沉淀。将沉淀离心,用去离子水洗涤2次,乙醇洗涤2次,将其在70 ℃下干燥24 h,得到ACP白色粉末。
1.4 材料表征
1.4.1 透射电子显微镜(TEM)观察
取适量颗粒于无水乙醇中,超声使颗粒均匀分散到无水乙醇中,用毛细管取分散液滴于碳膜上,然后放到红外灯下干燥10 min,用JEM-2100型透射电镜观察颗粒形貌、颗粒尺寸。
1.4.2 场发射扫描电子显微镜(FE-SEM)观察
取适量颗粒于无水乙醇中,超声使颗粒均匀分散到无水乙醇中,然后滴加到清洗干净的硅片表面,待无水乙醇挥发后将硅片粘贴到导电胶上,采用FE-SEM(加速电压为3.0 kV)对颗粒形貌进行观察。
1.4.3 X射线粉末衍射仪(XRD)分析
将颗粒均匀地置于载玻片表面,用X射线粉末衍射仪(管电压40 kV,管电流35 mA,扫描速度为5°/min,扫描范围2θ=20°~60°)对颗粒进行结晶性能分析。
1.4.4 傅里叶红外光谱仪(FTIR)分析
将颗粒与溴化钾研磨混合均匀,采用溴化钾压片法,质量比为1∶100,研磨后将混合物进行压片(30 MPa,45 s)。利用傅立叶红外光谱仪(扫描范围为4000~400 cm-1,分辨率为4 cm-1)对样品中的化学基团进行分析。
1.4.5 动态光散射(DLS)
取适量颗粒于无水乙醇中,超声使颗粒均匀分散到无水乙醇中,取分散好的颗粒悬液于样品池中,将样品池插入动态光散射仪中,测量颗粒的大小、分布与Zeta电位。
1.4.6 热重分析(TG)
热重分析(Pyris Diamond TGA, PerkinElmer)在氮气的气氛下(氮气流量为20 mL/min),温度范围为室温至800 ℃,升温速率为20 ℃/min。
1.5 ACP颗粒与量子点的结合
取1 mg/mL的无定形磷酸钙悬液与1 mL纯化后的量子点混合;然后将混合溶液在100 W超声振荡20 min,在转速为8000 rpm 离心3 min,吸去上清液;将得到的沉淀用去离子水洗涤2遍,得到纯净量子点与无定形磷酸钙结合后的颗粒。使用Nano Drop 2000超微量分光光度计测量得到的颗粒激发波长,使用荧光分光光度计测量颗粒的发射荧光光谱。
1.6 生物相容性实验
将ACP颗粒在紫外灯照射下灭菌12 h,使用PBS配置成不同浓度的悬液。铺MC3T3-E1细胞96孔板,每孔细胞数为5×105个,将96孔板置于37 ℃、5% CO2的细胞培养箱中培养,待细胞贴壁后每孔加入10 μL的不同浓度ACP悬液,置于培养箱中培养不同时间(24 h、48 h、72 h)后,每孔加入20 μL的MTT(3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐),培养4 h后使用真空安全吸液器(VACOSAFE 158 3XX, INTEGRΛ)吸出培液,每孔加入150 μL的DMSO(二甲基亚砜),震荡10 min后,使用酶标仪在OD 490 nm处读取各孔的吸光值,使用公式:细胞生存率/%=(OD实验组-OD调零孔)/(OD对照组-OD调零孔)×100,计算出细胞成活率并作图。
2 结果与讨论
2.1 贻贝贝壳的结构表征
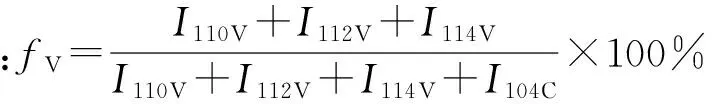
谱可以看出:在1444、1083、873 cm-1出现的特征吸收峰均为球霰石中的特征吸收峰;在1444、873、713 cm-1处出现的特征吸收峰分别为方解石的特征吸收峰[9]。

图1 贻贝贝壳粉的XRD和FTIR图谱
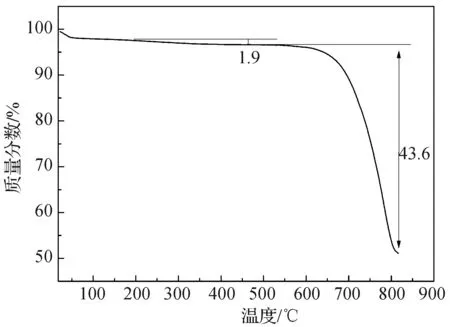
图2 贻贝贝壳粉的热重分析曲线
由热重曲线可以看出,在200~475 ℃之间贻贝贝壳粉失重率为1.9%,该失重是由有机物的分解造成的。在610~817 ℃之间又发生了一次明显的失重现象,失重率为43.6%,说明占贻贝贝壳的主要无机成分(CaCO3)开始了分解,分解的化学方程式为:CaCO3→CaO+CO2↑。自然界中大部分碳酸钙矿物在800 ℃以上的温度下才能分解(方解石在898 ℃分解,文石和球霰石分别在825 ℃和800 ℃分解为氧化钙和二氧化碳),ZHAO等人利用丝胶蛋白调控生物矿化法制备的碳酸钙在800 ℃左右分解[10],而贝壳生物矿物的分解温度则较低,在600 ℃附近已分解。贻贝贝壳的分解温度低于不含有机成分的碳酸钙矿物,原因可能是贻贝贝壳在加热的过程中,有机质逐步分解,与有机物键合的钙离子被游离出来,以有机物为模板的碳酸钙晶粒更易受到破坏,从而导致碳酸钙在较低的温度下分解。
2.2 ACP颗粒的表征
2.2.1 ACP颗粒的形貌表征

由粒径分布图(图3c)可以看出颗粒的粒径分布范围窄,颗粒直径大部分位于250~450 nm,大小均一,与图3中的SEM图和TEM图相对应。动态光散射仪测出所制备颗粒表面电位为27.5 mV。Kandori K等[11]研究认为颗粒表面化学本质决定了这些材料的表面Zeta电位并进而决定其蛋白吸附能力。

图3 制得ACP颗粒的形态
2.2.2 ACP颗粒的X射线衍射分析
由XRD图谱可以看出在2θ=30°附近有个馒头峰[12],表明所制备的颗粒主要为无定形状态,进一步证明得到的产物为ACP。在XRD图谱中没有发现其他物质的衍射峰,说明得到的ACP为纯相,而且为无定形相。与TEM中的选区电子衍射相对应,表明成功的合成了ACP颗粒。

图4 制得颗粒的XRD图谱
2.2.3 ACP颗粒的傅里叶红外光谱分析
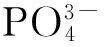

图5 制得颗粒的FTIR图谱
2.2.4 ACP的热重分析
图6为利用贻贝贝壳制得无定形磷酸钙的热重(TG)分析曲线,由图可以看出制得的无定形磷酸钙在加热过程中不稳定,在室温加热到800 ℃的过程中总的失重为34.5%。ACP的失重主要分为两个过程,第一个过程在25~150 ℃之间有个明显的失重现象,为无定形磷酸钙团簇间的分子水,失重率约为17.1%,符合无定形磷酸钙含10%~20%的分子水范围。第二个过程150~800 ℃可能是由于ACP中结合水分解以及ACP相变导致的重量损失。

图6 制得颗粒的热重分析曲线
2.3 ACP颗粒与量子点的结合性
量子点材料是涉及多种学科的交叉领域,量子点荧光稳定、明亮,激发光谱宽, 发射光谱窄。由于其不同于块体材料的许多性质,因此在很多方面具有潜在的应用价值,目前量子点最有前途的应用领域是作为生物体系中作荧光标记物[14]。为了更好地应用制备的ACP颗粒,使用CdTe量子点与制得ACP颗粒结合。图7中的(a)、(b)为ACP颗粒与CdTe量子点结合后的荧光显微镜图,由荧光显微镜图可以看出ACP颗粒与量子点有着良好的结合。图7中的(c)图为ACP颗粒与CdTe量子点结合后的发射光谱图,在激发波长为219 nm下,在437 nm处有最强的荧光强度,峰宽为67.6 nm。由此可以说明当本实验制得的ACP被用作药物载体时,可以使用CdTe量子点标记,从而可以直观观察ACP颗粒与细胞的相互作用。

图7 ACP与量子点结合图片
2.4 制得ACP的生物相容性实验
为了检测本研究合成的ACP颗粒是否具有毒性,本实验采用成骨细胞(MC3T3-E1)作为研究对象,设置不同浓度的ACP悬液(0、0.001、0.01、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)检测它们对成骨细胞活性的影响。由图8可以看出,不同浓度的ACP悬液与成骨细胞共培养不同时间(24、48、72 h)后,细胞的成活率都在90%以上。随着ACP悬液浓度的增加细胞的成活率有增加的趋势,在ACP悬液的浓度较高时(0.6、0.8、1.0 mg/mL)成骨细胞的成活率在100%以上,表明所合成的ACP颗粒具有促进细胞增殖的特性。由图8还可以看出随着培养时间的延长,ACP颗粒可以加快细胞的生长。利用贻贝贝壳为钙源制备的无定形磷酸钙,会有镁、钾等离子进入到其中,这使其和骨的成分更为相似,具有良好的生物相容性。图8可以说明利用贻贝贝壳粉制备的ACP颗粒对成骨细胞不具毒性,安全性高,有良好的生物相容性,可以用作药物载体和骨修复材料。曹俊等[15]研究了纳米磷酸钙对MG63细胞增殖过程的影响作用,结果表明纳米磷酸钙对MG63细胞增殖具有促进作用。
无定形磷酸钙具有良好的生物相容性,已被用作生物陶瓷、药物载体、组织工程支架等。王皓宇等[16]利用无定形磷酸钙负载重组人骨形态发生蛋白-2(rhBMP-2)制备了纳米缓释体,对制得的材料进行体外和体内试验,表明纳米缓释体具有良好的生物相容性和安全性,可适用于骨缺损修复的治疗。贺文慧等[17]研究了空心纳米无定形磷酸钙,并且以牛血清蛋白(BSA)为模型体系研究了材料的载药和释放性能,发现所制备的纳米磷酸钙钙不仅具有良好的蛋白质负载量而且还具有优异的可释放性,明显优于传统的羟基磷灰石体系。本研究利用贻贝壳为原料合成的无定形磷酸钙亚微粒,具有良好的生物相容性,在医用材料或药物载体领域有潜在的应用前景。本研究可以利用废弃的贻贝壳资源,使其变废为宝,缓解环境污染问题,有很大的实际意义。

图8 不同浓度的ACP悬液对成骨细胞(MC3T3-E1)的毒性检测
3 结 论
以贻贝贝壳粉为原料制备了无定形磷酸钙颗粒,颗粒粒径为250~450 nm亚微粒,颗粒粒径分布范围窄,大小均一,表面积大,表面电位(Zeta电位)为27.5 mV。三聚磷酸钠可以络合溶液中的Ca2+,从而影响无定形磷酸钙的形貌。CdTe量子点与制得ACP颗粒与CdTe量子点具有良好的结合性,在激发波长为219 nm下,复合颗粒在437 nm处有最强的荧光强度,峰宽为67.6 nm。所制备的无定形磷酸钙颗粒对成骨细胞(MC3T3-E1)有着良好的生物相容性,显示了该材料在医用材料或药物载体领域有潜在的应用前景。
[1] DOROZHKIN S V. Amorphous calcium(ortho)phosphates[J]. Acta Biomaterialia,2010,6(12):4457-4475.
[2] 李延报,李东旭,翁文剑.无定形磷酸钙及其在生物医学中的应用[J].无机材料学报,2007(5):775-782.
[3] PETERS F, SCHWARZ K, EPPLE M. The structure of bone studied with synchrotron X-ray diffraction, X-ray absorption spectroscopy and thermal analysis[J]. Thermochimica Acta,2000,361(1):131-138.
[4] HUANG X, YANG D, YAN W, et al. Osteochondral repair using the combination of fibroblast growth factor and amorphous calcium phosphate/poly(L-lactic acid) hybrid materials[J]. Biomaterials,2007.28(20):3091-3100.
[5] 段伟文,罗伟,段振华,等.贻贝的加工利用研究进展[J].渔业现代化,2013(3):51-55.
[6] 孙会玲,陈庆国,刘梅,等.天然材料贻贝壳的应用研究[J].安徽农业科学,2014,13:4069-4071.
[8] KAPLAN D L. Mollusc shell structures: novel design strategies for synthetic materials[J]. Current Opinion in Solid State and Materials Science,1998,3(3):232-236.
[9] ANDERSEN F A, BRECEVIC L, BEUTERG, et al. Infrared spectra of amorphous and crystalline calcium carbonate[J]. Acta Chemica Scandinavica,1991,45(10):1018-1024.
[10] ZHAO Z B, HAN H F, DING S, et al. Effect of silk sericin on morphology and structure of calcium carbonate crystal[J]. Frontiers of Materials Science,2013,7(2):177-183.
[11] KANDORI K, SHIMIZU T, YASUKAWA A, et al. Adsorption of bovine serum albumin onto synthetic calcium hydroxyapatite: influence of particle texture[J]. Colloids and Surfaces B: Biointerfaces,1995,5(1):81-87.
[12] URCH H, VALLET-REGI M, RUIZ L, et al. Calcium phosphate nanoparticles with adjustable dispersability and crystallmity[J]. Journal of Materials Chemistry,2009,19(15):2166-2171.
[13] 张鹏,邱淑璇,杨兆钰,等.无定形磷酸钙的制备及表征[J].西南民族大学学报,2012,38(2):273-276.
[14] 徐海娥,闫翠娥.水溶性量子点的制备及应用[J].化学进展,2005(5):800-808.
[15] 曹俊,蔡玉荣,马寅孙,等.纳米磷酸钙对MG63细胞生物学行为的影响[J].中国组织工程研究,2012,29:5341-5344.
[16] 王皓宇,吴小涛,张绍东,等.无定形磷酸钙负载rhBMP-2纳米缓释体的生物相容性及安全性[J].中国矫形外科杂志,2008,22:1720-1723.
[17] 贺文慧,唐睿康,徐旭荣.纳米磷酸钙载药体系的制备与表征[J].无机化学学报,2011,27(7):1233-1238.
(责任编辑: 唐志荣)
Synthesis and Properties of Amorphous Calcium Phosphate Microspheres with Mussel Shells
HANYizhonga,CUIZhengyangb,CHENCenb,YETingb,KONGXiangdonga, b
(a. College of Materials and Textiles; b. College of Life Sciences,Zhejiang Sci-Tech University, Hangzhou 310018, China)
Amorphous calcium phosphate (ACP) was successfully synthesized by utilizing the calcium precursor of mussel shell powder. Phosphoric acid, sodium tripolyphosphate and urea were added during the reaction To fast prepare spherical submicron particles with the diameter of 250~450 nm. Particle size distribution range is narrow. The size is uniform and the superficial area is large. Potential of particle surface (Zeta potential) is 27.5 mV. The amorphous calcium phosphate microspheres can well bond with quantum dots. The MTT test results indicate that the ACP microspheres are not toxic to osteoblasts cells (MC3T3-E1), and have good biocompatibility.
amorphous calcium phosphate; mussel shells; biocompatibility
10.3969/j.issn.1673-3851.2016.11.009
2015-12-26
国家自然科学基金项目(51272236,51002139)
韩义忠(1988-),男,山东聊城人,硕士研究生,主要从事生物材料方面的研究。
孔祥东,E-mail:Kongxiangdong@gmail.com
Q279
A
1673- 3851 (2016) 06- 0849- 06 引用页码: 110209
