面向生物医学应用的光学氧气纳米传感器
2016-11-19彭洪尚申睿颖王小卉
彭洪尚, 申睿颖, 王小卉
(1. 北京交通大学 理学院, 北京 100044; 2. 中央民族大学 理学院, 北京 100081)
面向生物医学应用的光学氧气纳米传感器
彭洪尚1,2*, 申睿颖1, 王小卉1
(1. 北京交通大学 理学院, 北京 100044; 2. 中央民族大学 理学院, 北京 100081)
在生物医学领域,溶氧的检测具有十分重要的意义。近年来氧气传感器的研究取得了重要的进展,尤其是纳米尺寸的光学氧气传感器倍受重视。光学氧气纳米传感器具有检测灵敏度高、稳定性好、易于生物功能化等优点,特别适用于在(亚)细胞层次或者生物组织内溶氧的实时检测。本文主要从氧气荧光探针的种类、传感器的基质构成、纳米传感器的构建方法、检测模式和生物医学应用等几个方面出发,结合本研究组在光学氧气纳米传感器的研究进展进行综述,并对其在生物医学领域中的主要应用进行了阐述。
光学纳米传感器; 氧气传感; 磷光猝灭; 生物医学成像
1 引 言
氧气是一种重要的化学物质。对哺乳动物而言,氧气是维持其正常生理机能所需能量的源泉。当氧含量过低时,机体的正常生理进程就会受到影响;而当氧含量过高时,则会产生过多的活性氧使核酸、蛋白质等发生氧化反应,从而影响其正常生理功能[1-2]。因此,氧含量的检测在生物医学领域具有十分重要的意义。
氧气浓度的检测方法有多种,主要包括化学(碘量法)、电化学(电流分析法)及光学方法。其中化学和电化学传感存在操作过程复杂且易对生物样品产生损伤的缺点[3-4]。光学传感方法具有不受电磁场干扰、反应过程中不消耗氧气和易于微型化等优点[5]。1985年,Vanderkooi等研制出一种基于磷光猝灭的氧气探针分子,并将其应用于生物组织中氧的检测,从此开启了生物溶氧检测的新时代[6]。当前,大部分光学氧气传感器都是基于氧气对荧光探针的磷光猝灭原理而构建的[7]。
在生物医学检测中,光导纤维和光学薄膜传感器由于尺寸限制或侵入性而影响了其在活体实时检测中的进一步应用[8-9]。小分子或超分子氧气探针虽然可用于细胞内的氧气传感与成像[10-13],但生理环境的复杂性往往会影响探针分子的稳定性,进而影响检测的准确性。近年来,随着纳米技术的发展,荧光氧气纳米传感器在生物医学检测中得到了广泛的应用,它主要具有以下优点:(1)相比于单个氧气探针分子,纳米传感器内封装有大量氧气探针,从而具有更高的发光亮度;(2)纳米传感器的小粒径(10~100 nm)可保证其对细胞内或生物组织中的溶氧进行非侵入性检测[14-15];(3)纳米基质不仅提高了传感器的化学稳定性,还降低了探针的生物毒性[16-18];(4)纳米传感器大的比表面积为其生物功能化提供了保证,从而可满足生物医学中的检测需求[14,19]。
本文主要对光学氧气纳米传感器的探针分子类型、基质材料、结构类型、检测模式和相关生物医学应用进行了综述,以期引导读者依据具体的生物医学应用来选择合适的光学氧气纳米传感器和检测平台。
2 光学氧气纳米传感器的构建
光学氧气纳米传感器的制备方法主要有溶胶凝胶[20-21]、微乳液[22-23]和再沉淀法[24]。其中,微乳液和溶胶凝胶方法均为化学方法,所制得的纳米颗粒需要经过进一步的处理,以适应生物医学检测的需要[25]。本研究组发展的再沉淀法是一种制备有机-无机杂化纳米粒子的简易方法。它不使用任何活性剂,仅基于有机分子的疏水相互作用和有机硅氧烷的水解缩聚而形成生物兼容性良好的氧气探针纳米粒子。特别是利用静电吸附作用可实现多聚赖氨酸生物分子在纳米粒子表面的自组装,通过核壳结构既提高了纳米粒子的生物兼容性,也为靶向功能化提供了位点。利用再沉淀法制备的氧气纳米传感器具有较高的亮度,光稳定性较好,表面修饰简单,在生物检测领域具有很好的应用前景。氧气纳米传感器的构成核心是高敏感的氧气探针分子,以及可封装探针分子但同时具有良好通透性的基质材料。在检测过程中,分子氧通过基质孔道渗透到探针分子,并与之发生碰撞而发生荧光猝灭,依据发光强度(或寿命)与氧气浓度的定量关系即可推算出周围环境中氧气的浓度。因此,纳米传感器的设计需要考虑探针分子和基质材料的类型,以及二者之间相互作用等因素。
2.1 荧光探针的选择
过渡金属配合物是目前应用最为广泛的氧气探针分子,其中心离子为具有d6或d8电子组态的过渡金属,如Ru(Ⅱ)、Os(Ⅱ)、Pt(Ⅱ)、Pd(Ⅱ)、Ir(Ⅱ)等;而配体一般都采用双齿或多齿结构,如联吡啶、苯基吡啶、卟啉等。在光致激发下,电子从过渡金属配合物的基态跃迁到金属-配体电荷转移态(MLCT),而后以非辐射跃迁的形式从单线态MLCT转移到能级较低的三线态MLCT,系间窜越效率接近100%。当电子到达三线态MLCT态后,可以辐射跃迁(或非辐射跃迁)的途径回到基态产生磷光(或热);或者与氧分子接触发生碰撞,将激发能量传递给氧分子而发生磷光猝灭。
比较常见的过渡金属配合物类氧气探针有Pt(Ⅱ)的卟啉化配合物,如八乙基卟吩铂(PtOEP)、四(五氟苯基)卟啉铂(PtTFPP)[16-20],以及二亚胺钌配合物[21,25]。相比较而言,Pt(Ⅱ)卟啉化合物在可见光区有强吸收,具有长寿命(数十微秒)、高量子产率、大Stokes位移和高氧气猝灭率等特点;二亚胺钌配合物在可见光区也具有较强的吸收,但其氧气敏感度相对较低。
2.2 基质的选择
在荧光氧气纳米传感器的构建中,基质材料的选择对于传感器性能的优化起着非常重要的作用。理想的基质材料应具有良好的氧气通透性,以实现周围环境中的分子氧与纳米传感器中探针分子的快速接触;能够有效地包覆氧气探针分子,减少探针分子泄漏及浓度猝灭。常用的基质材料有二氧化硅[21]、有机硅[20]、共轭聚合物[12,18,26]、脂质体[25]、聚苯乙烯(PS)[14,27]和聚甲基丙烯酸甲酯(PMMA)[19]。表1给出了不同基质材料的氧气纳米传感器的具体信息。由表中可以看出,在氧气探针相同的情况下,以共轭聚合物、有机硅和聚苯乙烯为基质的纳米传感器,因良好的氧气通透性而具有较高的氧气敏感度。本研究组曾制备了以PS和PMMA为基质、以八乙基卟吩铂(PtOEP)为探针的荧光氧气纳米传感器,通过实验对比发现,PS基质的传感器氧气猝灭率达到94%[14],远远高于PMMA基质的传感器(77%)[19]。
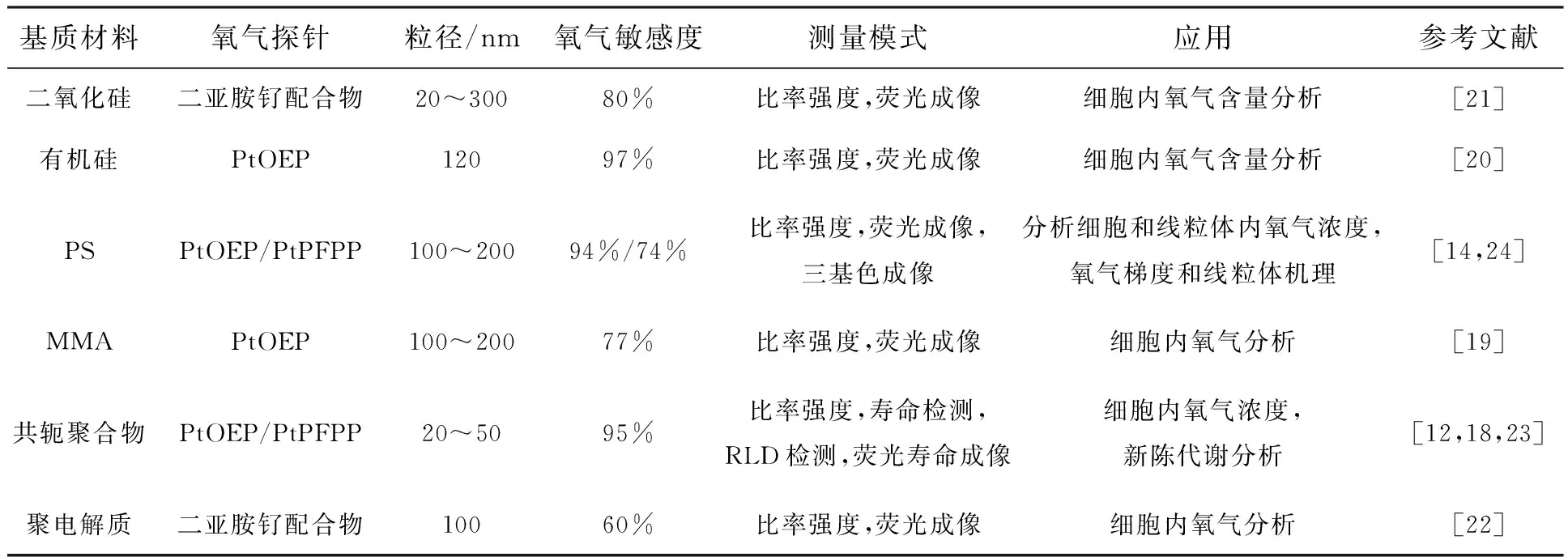
表1 代表性光学氧气纳米传感器
2.3 氧气纳米传感器的结构类型
根据荧光探针分子在纳米粒子中的相对位置,氧气纳米传感器的结构大致可以分为以下3类:(1)内掺型,探针分子随机分布于纳米粒子内部[27-30](图1(a));(2)核壳结构型,内部掺杂有探针分子的纳米粒子表面包覆有保护壳层[25](图1(b));(3)表面型,探针分子偶联于纳米粒子表面[31-33](图1(c))。对于内掺型和核壳结构型传感器,氧气探针分子一般为疏水型分子,而表面型则要求探针分子具有良好的水溶性。在稳定性方面,核壳结构性型既可以避免内掺型传感器中探针分子的泄露,又可以防止复杂生理环境对表面型中探针分子的攻击,因此在生物领域有很好的应用前景。
Fig.1 Schematic diagrams of various designs of optical oxygen nanosensors. (a) Inner doped type. (b) Core-shell type. (c) Surface type.
3 荧光氧气纳米传感器的检测模式
在生物医学领域,荧光氧气纳米传感器的检测基于荧光强度和荧光寿命。在荧光强度方面,单一波长模式最为简单,但易受激发光强度起伏和探针分子浓度分布不均匀的影响而产出测量误差。相比较而言,比率荧光检测由于内在参比荧光的作用而具有更高的准确性。在构建比率荧光氧气纳米传感器时,纳米粒子内需要同时掺杂对氧气不敏感的荧光参比分子和氧气探针分子[34-35]。二者的吸收谱带一般具有较大的重叠,但是发射峰能明显分辨开,以保证在单一波长激发下同时产生参比荧光和探测荧光。
在检测过程中,光辐照难以避免对纳米传感器的荧光漂白而导致测量误差。基于氧气探针荧光寿命的检测则更为客观和准确[36-38]。氧气纳米传感器的寿命一般为微秒量级,对激发光源和探测仪器的要求都不高[39]。除了通过监测磷光发射强度的动态衰减来获得荧光寿命(寿命拟合),荧光寿命检测也可以简化为一个快速的检测模式(RLD)[40-41],即通过收集探针被激发后在两个不同衰减窗口(t1,t2)内的荧光强度(F1,F2),进而根据以下公式获得荧光寿命:
(1)
目前基于RLD测量的仪器主要为多标记分析仪[ 38]。该仪器基于微孔板扫描,具有快速处理大批量样品的特点,可以较为精确地测量氧气浓度变化[42]。需要注意的是,该仪器的RLD模式适用于具有较长荧光寿命的氧气探针,如Pt(Ⅱ)配合物(寿命为数十微秒),对于短寿命的荧光探针则不适用,如Ru(Ⅱ)配合物(几百纳米)。

相对于荧光强度成像,寿命成像模式降低了背景荧光,不受光漂白干扰,是较为精确的成像检测模式。常用的荧光寿命成像检测方法是时间相关单光子成像模式,衰减曲线可以通过大量脉冲随时间的整合获得[44];但该技术对仪器的精确度要求比较高,且耗费时间较长。目前,结合RLD模式和CCD成像技术的传感系统已经被研制[45-46],该成像方法可以用来检测复杂样品的氧气分布,是一种非常有应用前景的氧气检测工具。
4 光学氧气纳米传感器的生物医学应用
光学氧气纳米传感器在生物医学领域具有广泛的应用空间,一方面可以直接检测生物体中溶氧的变化情况,直接获取有关溶氧浓度和动态变化的信息;另一方面可以根据溶氧的变化来间接获取与氧有关的生理进程的信息。针对不同的检测目的,氧气纳米传感器通常需进行不同的生物功能化以满足其空间定位的需要。例如为了实现细胞不同位置的氧气浓度检测,需要制备定位于细胞外(EC)、细胞内(IC)和线粒体内(IM)的氧气纳米传感器[47]。EC传感器应具有较高的水溶性,且不能穿透细胞膜。对IC传感器而言,需能够穿透细胞膜,以便检测细胞内部的呼吸过程和氧气浓度变化。而IM传感器既要能够穿透细胞膜,还需靶向线粒体,进而对线粒体内的氧气含量进行检测。
4.1 胞外氧气检测
将EC氧气纳米传感器与细胞共培育,利用荧光强度或者寿命模式均可测量细胞外溶氧的浓度。使用光谱仪,通过测量细胞悬浮液的荧光强度可以获取细胞外溶氧的浓度;但该方法容易被散色光干扰,且不适用于贴壁细胞[48]。寿命检测模式,尤其是RLD方法不仅适用于悬浮细胞,也可用于贴壁细胞外溶氧浓度的检测。如果需要测量细胞外绝对氧气的消耗率,则需在密封环境下进行[49]。若仅对比不同样品的相对氧气消耗率,则可以简化测试条件,例如在测试前将矿物油加入微孔或者比色皿中,可以获得部分密封的效果[42,49]。

4.2 胞内溶氧检测
近年来,IC氧气纳米传感器被广泛用于细胞内氧气含量的检测和成像。Papkovsk课题组应用磷光RLD检测模式对细胞内的氧气浓度、氧气消耗量和氧气梯度等进行了研究[26,38,54]。根据细胞的种类及检测目的,需要对细胞密度、代谢活动和温度等参数进行调控和优化[55]。在最近的研究工作中,我们利用IC氧气纳米传感器对光动力作用下肿瘤细胞的损伤进行了评估。其机理就是对细胞内溶氧消耗速率进行监测(细胞的有氧呼吸),而呼吸速率大小正比于细胞的活性[56]。对肿瘤细胞损伤的评估与传统MTT方法的结果相吻合,特别是可以评估光动力的直接损伤,克服了MTT在评估细胞毒性时间上的滞后性。
Fig.2 Wide field FLIM microscopy images of MEF cells stained with PtTFPP-based nanosensors measured at different levels of atmospheric O2
基于纳米传感器的荧光成像也是评估细胞内的溶氧浓度的一个有力手段。Kondrashina等制备了基于PtTFPP的细胞内氧气纳米探针,通过磷光寿命成像实现了对三维细胞球中溶氧分布的检测[26]。如图2所示,随着氧气浓度的增加,探针寿命逐渐变长,结果与实验预期一致。Fercher等在细胞内氧气成像实验中,通过线粒体刺激药品来调节溶氧浓度的变化,进而监测负载有IC氧气纳米传感器细胞的荧光强度[15],如图3所示。由图中可以看出,不论荧光强度测量还是荧光成像,均反映出FCCP刺激导致呼吸速率增加和溶氧量的减少(荧光强度增加),以及AntiA对细胞呼吸的抑制(荧光强度降低)这一现象。
图3 负载PtTFPP纳米颗粒的小鼠胚胎成纤维细胞在新陈代谢刺激剂FCCP 和 AntiA作用下的荧光成像。(a)荧光强度值;(b)荧光成像照片。
Fig.3 Fluorescent imaging of MEFs cells loading PtTFPP nanosensors and their responses to metabolic stimulation. (a) Intensity profiles for the three regions. (b) Corresponding images treated with 2 μmol/L FCCP and 10 μmol/L AntiA.
4.3 线粒体内溶氧检测
线粒体是细胞有氧呼吸的主要场所,对线粒体溶氧的检测显然可以更加准确地反映细胞的状态。常用的线粒体内氧气探针主要为原卟啉Ⅸ[57-58]和 MitoXpress[59],主要用于对单独分离出的细胞线粒体内溶氧的检测。最近,本课题组结合光学氧气纳米传感方法和线粒体靶向技术,制备了三苯基溴化磷(TPP)偶联的氧气纳米传感颗粒,并能较准确地靶向细胞内的线粒体[60]。图4中线粒体靶向纳米颗粒(TPP-NPs)的绿色成像与线粒体染料的红色成像重合,证明TPP偶联纳米颗粒已成功靶向线粒体。在此基础上,我们利用IM氧气纳米传感器,基于寿命检测的RLD方法对癌症细胞和正常细胞内线粒体的有氧呼吸速率进行了灵敏检测[61],基于细胞呼吸速率实现了对肿瘤细胞线粒体功能障碍的评估,有望应用于肿瘤细胞的诊断。
图4 分别负载EC(Si-NPs)、IC(PLL-NPs)和IM (TPP-NPs)氧气纳米传感器的HepG2细胞的共聚焦成像。绿色通道是纳米颗粒成像,红色通道是线粒体示踪剂的成像。
Fig.4 Confocal fluorescence images of HepG2 cells treated with Si-NPs (extracellular), PLL-NPs (intracellular) and TPP-NPs (intra-mitochondrial). Cells are viewed in the green channel for nanosensors and the red channel for Mito Tracker Red (mitochondrial dye), respectively.
4.4 葡萄糖检测
糖尿病是一种严重威胁人类健康的疾病,对血液中葡萄糖的灵敏检测对于疾病诊断、治疗和控制均具有重要意义[62]。荧光葡萄糖纳米传感器的原理是将葡萄糖氧化酶与荧光氧气纳米传感器相结合,通过检测氧化酶与葡萄糖的氧化反应中对氧的消耗,根据溶氧量的变化间接测定葡萄糖的含量[63]。Xu等制备了基于Ru[dpp(SO3Na)2]3)Cl2的葡萄糖纳米传感器,其具有较小的粒径和良好的生物相容性,在细胞内葡萄糖检测方面具有很好的应用前景[21]。本研究组在氧气纳米传感器基础上,利用其面氨基与葡萄糖氧化酶的交联制备了葡萄糖荧光纳米传感器,通过比率荧光强度和荧光寿命测量均实现了对葡萄糖的灵敏检测,并成功实现了对人血清中血糖的准确检测[64]。
5 结论与展望
本文主要从光学氧气纳米传感器的构建、检测模式和生物医学应用等几个方面出发,对近几年的氧气纳米传感器的研究进展进行了综述。所报道的多种类型的荧光氧气纳米传感器不仅用于对体外和活体内溶氧的检测与成像,而且根据所获取溶氧信息可分别用于细胞活性的评估、疾病诊断和肿瘤成像等生物医学领域中。可以预计,激发和发射波长均位于近红外光谱的氧气纳米传感器未来会得到更为迅速发展,因为它可以减少生物组织对光的吸收和散射以及背景荧光的产生。此外,长寿命的氧气纳米传感器(~μs)通过时间分辨技术可以极大降低背景荧光信号强度(~ns),因此在生物医学领域应具有更大的发展前景。
光学氧气纳米传感器虽然具有诸多优点,但欲在生物医学领域发挥更大的作用还面临着诸多挑战:(1)发光效率问题。溶氧的检测基于探针分子的磷光猝灭,在低浓度区域的发光亮度(荧光寿命)远大于在高浓度区域的荧光强度(荧光寿命)。生物体中溶氧的含量是动态变化的,因此要求纳米传感器需具有足够高的荧光量子效率,以实现对一些动态生理过程的监测。(2)活体中溶氧荧光检测的组织穿透深度问题。由于磷光的氧气猝灭是基于激发态探针分子与基态氧分子的能量传递,目前近红外纳米传感器的发射波长一般位于近红外Ⅰ窗口(700~900 nm),穿透深度仅为毫米量级。相比较而言,近红外Ⅱ窗口(1 060~1 700 nm)具有更深的穿透深度,可达到厘米量级。因此,研制发射波长在近红外Ⅱ窗口的氧气纳米传感器(氧气探针)对于活体中溶氧检测与成像具有重要的意义。
[1] SEMENZA G L. Oxygen-dependent regulation of mitochondrial respiration by hypoxia-inducible factor 1 [J].Biochem.J., 2007, 405(1):1-9.
[2] BRAND M D, NICHOLLS D G. Assessing mitochondrial dysfunction in cells [J].Biochem.J., 2011, 435(2):297-312.
[3] AIBA S.HorizonsofBiochemicalEngineering[M]. Oxford: Oxford University Press, 1987:213.
[4] SKOOG D A, WEST D M, HOLLER F J.FundamentalsofAnalyticalChemistry[M]. 5th ed. New York: Saunders College Publishing, 1988:344.
[5] AMAO Y. Probes and polymers for optical sensing of oxygen [J].Microchim.Acta, 2003, 143(1):1-12.
[6] LONGMUIR I S.OxygenTransporttoTissueⅧ [M]. New York: Plenum Press, 1986:189-193.
[7] MCDONAGH C, BURKE C S, Maccraith B D. Optical chemical sensors [J].Chem.Rev., 2008, 108(2):400-422.
[8] WANG X D, CHEN X, XIE Z X,etal.. Reversible optical sensor strip for oxygen [J].Angew.Chem.Int.Ed., 2008, 47(39):7450-7453.
[9] WANG X D, MEIER R J, LINK M,etal.. Photographing oxygen distribution [J].Angew.Chem.Int.Ed., 2010, 49(29):4907-4909.
[10] FERCHER A, PONOMAREV G V, YASHUNSKI D,etal.. Evaluation of the derivates of phosphorescent Pt-coproporphyrin as intracellular oxygen-sensitive probes [J].Anal.Bioanal.Chem., 2010, 396(5):1793-1803.
[11] DUNPHY I, VINOGRADOV S A, WILSON D F. Oxyphor R2 and G2: phosphors for measuring oxygen by oxygen-dependent quenching of phosphorescence [J].Anal.Biochem., 2002, 310(2):191-198.
[12] FOERG C, MERKLE H P. On the biomedical promise of cell penetrating peptides: limits versus prospects [J].J.Pharm.Sci., 2008, 97(1):144-162.
[13] DMITRIEV R I, ROPIAK H, PONOMAREV G V,etal.. Cell-penetrating conjugates of coproporphyrins with oligoarginine peptides: rational design and application for sensing intracellular O2[J].BioconjugateChem., 2011, 22(12):2507-2518.
[14] WANG X H, PENG H S, DING H,etal.. Biocompatible fluorescent core-shell nanoparticles for ratiometric oxygen sensing [J].J.Mater.Chem., 2012, 22(31):16066-16071.
[15] FERCHER A, BORISOV S M, ZHDANOV A V,etal.. Intracellular O2sensing probe based on cell-penetrating phosphorescent nanoparticles [J].ACSNano, 2011, 5(7):5499-5508.
[16] KUMAR S, HARRISON N, RICHARDS-KORTUM R,etal.. Plasmonic nanosensors for imaging intracellular biomarkers in live cells [J].NanoLett., 2007, 7(5):1338-1343.
[17] LEE K Y E, SMITH R, KOPELMAN R. Nanoparticle PEBBLE sensors in live cells andinvivo[J].Annu.Rev.Anal.Chem., 2009, 2(1):57-76.
[18] WU C F, BULL B, CHRISTENSEN K,etal.. Ratiometric single-nanoparticle oxygen sensors for biological imaging [J].Angew.Chem.Int.Ed., 2009, 48(15):2741-2745.
[19] WANG X H, PENG H S, CHANG Z,etal.. Synthesis of ratiometric fluorescent nanoparticles for sensing oxygen [J].Microchim.Acta, 2012, 178(1-2):147-152.
[20] KOO Y E L, CAO Y F, KOPELMAN R,etal.. Real-time measurements of dissolved oxygen inside live cells by organically modified silicate fluorescent nanosensors [J].Anal.Chem., 2004, 76(9):2498-2505.
[21] XU H, AYLOTT J W, KOPELMAN R,etal.. A real-time ratiometric method for the determination of molecular oxygen inside living cells using sol-gel-based spherical optical nanosensors with applications to rat C6 glioma [J].Anal.Chem., 2001, 73(17):4124-4133.
[22] MISTLBERGER G, MEDINA-CASTILLO A L, BORISOV S M,etal.. Mini-emulsion solvent evaporation: a simple and versatile way to magnetic nanosensors [J].Microchim.Acta, 2011, 172(3-4):299-308.
[24] PENG H S, CHIU D T. Soft fluorescent nanomaterials for biological and biomedical imaging [J].Chem.Soc.Rev., 2015, 44(14):4699-4722.
[25] GUICE K B, CALDORERA M E, MCSHANE M J. Nanoscale internally referenced oxygen sensors produced from self-assembled nanofilms on fluorescent nanoparticles [J].J.Biomed.Opt., 2005, 10(6):064031.
[26] KONDRASHINA A V, DMITRIEV R I, BORISOV S M,etal.. A phosphorescent nanoparticle-based probe for sensing and imaging of (intra)cellular oxygen in multiple detection modalities [J].Adv.Funct.Mater., 2012, 22(23):4931-4939.
[27] WANG X D, GORRIS H H, STOLWIJK J A,etal.. Self-referenced RGB colour imaging of intracellular oxygen [J].Chem.Sci., 2011, 2(5):901-906.
[28] LEE Y E K, ULBRICH E E, KIM G,etal.. Near infrared luminescent oxygen nanosensors with nanoparticle matrix tailored sensitivity [J].Anal.Chem., 2010, 82(20):8446-8455.
[29] JI J, ROSENZWEIG N, JONES I,etal.. Molecular oxygen-sensitive fluorescent lipobeads for intracellular oxygen measurements in murine macrophages [J].Anal.Chem., 2001, 73(15):3521-3527.
[30] MCEVOY A K, MCDONAGH C M, MACCRAITH B D. Dissolved oxygen sensor based on fluorescence quenching of oxygen-sensitive ruthenium complexes immobilized in sol-gel-derived porous silica coatings [J].Analyst, 1996, 121(6):785-788.
[31] MCLAURIN E J, GREYTAK A B, BAWENDI M G,etal.. Two-photon absorbing nanocrystal sensors for ratiometric detection of oxygen [J].J.Am.Chem.Soc., 2009, 131(36):12994-13001.
[32] LIU L N, LI B, YING J,etal.. Synthesis and characterization of a new trifunctional magnetic-photoluminescent-oxygen-sensingnanomaterial [J].Nanotechnology, 2008, 19(49):495709.
[33] AMELIA M, LAVIE-CAMBOT A, MCCLENAGHAN N D,etal.. A ratiometric luminescent oxygen sensor based on a chemically functionalized quantum dot [J].Chem.Commun., 2011, 47(1):325-327.
[34] FENG Y, CHENG J H, ZHOU L,etal.. Ratiometric optical oxygen sensing: a review in respect of material design [J].Analyst, 2012, 137(21):4885-4901.
[35] ZHANG G Q, PALMER G M, DEWHIRST M W,etal.. A dual-emissive-materials design concept enables tumour hypoxia imaging [J].Nat.Mater., 2009, 8(9):747-751.
[36] QUARANTA M, BORISOV S M, KLIMANT I. Indicators for optical oxygen sensors [J].Bioanal.Rev., 2012, 4(2-4):115-157.
[37] FERCHER A, O’RIORDAN T C, ZHDANOV A V,etal.. Imaging of cellular oxygen and analysis of metabolic responses of mammalian cells [J].MethodsMol.Biol., 2010, 591:257-273.
[38] DMITRIEV R I, PAPKOVSKY D B. Optical probes and techniques for O2measurement in live cells and tissue [J].Cell.Mol.LifeSci., 2012, 69(12):2025-2039.
[39] PAPKOVSKY D B. Methods in optical oxygen sensing: protocols and critical analyses [J].MethodsEnzymol., 2004, 381:715-735.
[40] O’RIORDAN T C, ZHDANOV A V, PONOMAREV G V,etal.. Analysis of intracellular oxygen and metabolic responses of mammalian cells by time-resolved fluorometry [J].Anal.Chem., 2007, 79(24):9414-9419.
[41] SHARMAN K K, PERIASAMY A, ASHWORTH H,etal.. Error analysis of the rapid lifetime determination method for double-exponential decays and new windowing schemes [J].Anal.Chem., 1999, 71(5):947-952.
[42] HYNES J, MARROQUIN L D, OGURTSOV V I,etal.. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes [J].Toxicol.Sci., 2006, 92(1):186-200.
[44] HOLST G, KOHLS O, KLIMANT I,etal.. A modular luminescence lifetime imaging system for mapping oxygen distribution in biological samples [J].Sens.ActuatorsB, 1998, 51(1-3):163-170.
[45] WOODS R J, SCYPINSKI S, LOVE L J C. Transient digitizer for the determination of microsecond luminescence lifetimes [J].Anal.Chem., 1984, 56(8):1395-1400.
[46] LIEBSCH G, KLIMANT I, FRANK B,etal.. Luminescence lifetime imaging of oxygen, pH, and carbon dioxide distribution using optical sensors [J].Appl.Spectrosc., 2000, 54(4):548-559.
[47] PAPKOVSKY D B, DMITRIEV R I. Biological detection by optical oxygen sensing [J].Chem.Soc.Rev., 2013, 42(22):8700-8732.
[48] DIEPART C, VERRAX J, CALDERON P B,etal.. Comparison of methods for measuring oxygen consumption in tumor cellsinvitro[J].Anal.Biochem., 2010, 396(2):250-256.
[49] HYNES J, NATOLI E JR, WILL Y.FluorescentpHandOxygenProbesofTheAssessmentofMitochondrialToxicityinIsolatedMitochondriaandWholeCells[M]. Current Protocols in Toxicology, Chapter 2: Unit 2.16, 2009.
[50] WOTZLAW C, BERNARDINI A, BERCHNER-PFANNSCHMIDT U,etal.. Multifocal animated imaging of changes in cellular oxygen and calcium concentrations and membrane potential within the intact adult mouse carotid bodyexvivo[J].Am.J.Physiol.CellPhysiol., 2011, 301(2):C266-C271.
[51] HUPPERT T J, ALLEN M S, BENAV H,etal.. A multicompartment vascular model for inferring baseline and functional changes in cerebral oxygen metabolism and arterial dilation [J].J.Cereb.BloodFlowMetab., 2007, 27(6):1262-1279.
[52] NAPP J, BEHNKE T, FISCHER L,etal.. Targeted luminescent near-infrared polymer-nanoprobes forinvivoimaging of tumor hypoxia [J].Anal.Chem., 2011, 83(23):9039-9046.
[53] LIU J N, LIU Y, BU W B,etal.. Ultrasensitive nanosensors based on upconversion nanoparticles for selective hypoxia imaginginvivoupon near-infrared excitation [J].J.Am.Chem.Soc., 2014, 136(27):9701-9709.
[54] DMITRIEV R I, ZHDANOV A V, JASIONEK G,etal.. Assessment of cellular oxygen gradients with a panel of phosphorescent oxygen-sensitive probes [J].Anal.Chem., 2012, 84(6):2930-2938.
[55] ZHDANOV A V, OGURTSOV V I, TAYLOR C T,etal.. Monitoring of cell oxygenation and responses to metabolic stimulation by intracellular oxygen sensing technique [J].Integr.Biol., 2010, 2(9):443-451.
[56] MA H R, PENG H S, YOU F T,etal.. Sensitive detection of PDT-induced cell damages with luminescent oxygen nanosensors [J].MethodsAppl.Fluoresc., 2016, 4(3):035001.
[57] MIK E G, STAP J, SINAASAPPEL M,etal.. Mitochondrial PO2measured by delayed fluorescence of endogenous protoporphyrin Ⅸ [J].Nat.Methods, 2006, 3(11):939-945.
[58] MIK E G, JOHANNES T, ZUURBIER C J,etal..Invivomitochondrial oxygen tension measured by a delayed fluorescence lifetime technique [J].Biophys.J., 2008, 95(8):3977-3990.
[59] WILL Y, HYNES J, OGURTSOV V I,etal.. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes [J].Nat.Protoc., 2007, 1(6):2563-2572.
[60] WANG X H, PENG H S, YANG L,etal.. Poly-L-lysine assisted synthesis of core-shell nanoparticles and conjugation with triphenylphosphonium to target mitochondria [J].J.Mater.Chem. B, 2013, 1(38):5143-5152.
[61] WANG X H, PENG H S, YANG L,etal.. Targetable phosphorescent oxygen nanosensors for the assessment of tumor mitochondrial dysfunction by monitoring the respiratory activity [J].Angew.Chem.Int.Ed., 2014, 126(46):12679-12683.
[62] STEINER M S, DUERKOP A, WOLFBEIS O S. Optical methods for sensing glucose [J].Chem.Soc.Rev., 2011, 40(9):4805-4839.
[63] BORISOV S M, WOLFBEIS O S. Optical biosensors [J].Chem.Rev., 2008, 108(2):423-461.
[64] PING J T, PENG H S, DUAN W B,etal.. Synthesis and optimization of ZnPc-loaded biocompatible nanoparticles for efficient photodynamic therapy [J].J.Mater.Chem. B, 2016, 4(25):4482-4489.
彭洪尚(1975-),男,山东临沂人,教授,博士生导师,2007年于北京交通大学获得理学博士学位,研究方向为生物医学光子学。2005~2006年,于美国克莱姆森大学化学系作学术访问。2007年获德国洪堡奖学金资助于德国雷根斯堡大学从事博士后研究。2009年11月~2015年11月于北京交通大学发光与光信息技术教育部重点实验室工作。2013~2014年,于美国华盛顿大学(西雅图)化学系作学术访问。2015年11月至今在中央民族大学理学院工作。
近年来,在针对肿瘤微环境特征参量的荧光纳米传感器的构建及生物医学应用方面取得了一系列成果,发表SCI收录论文50余篇,SCI引用1 500余次, H因子为19。曾先后荣获德国洪堡奖学金(2007)和教育部新世纪优秀人才计划支持(2012)。主持了国家自然科学基金、教育部留学归国基金、中央高校基本科研业务费等科研项目,研究经费200余万。近年来担任国家自然科学基金项目信息学部通讯评议专家,以及北京市自然科学基金评议专家。目前任光学学会第二届生物医学光子学专委会委员。
代表性文章:
[1] J PING, H PENG*, W DUAN,etal.. Synthesis and optimization of ZnPc-loaded biocompatible nanoparticles for efficient photodynamic therapy [J].J.Mater.Chem. B, 2016, 4:4482-4489.
[2] S GAO, H PENG*, X WANG,etal.. Preparation of fluorescent enzymatic nanosensors for glucose sensing [J].Sens.ActuatorsB:Chem., 2016, 222:638-644
[3] H PENG, D T CHIU*. Soft fluorescent nanomaterials for biological and biomedical imaging [J].Chem.Soc.Rev., 2015, 44:4699
[4] X WANG, H PENG*, L YANG,etal.. Assessment of tumor mitochondrial dysfunction by monitoring respiratory activity using targetable phosphorescent nanosensors for oxygen [J].Angew.Chem.Int.Ed., 2014, 53:12471
[5] H PENG, M I J STICH, J YU,etal.. Luminescent europium (Ⅲ) nanoparticles for sensing and imaging of temperature in the physiological range [J].Adv.Mater., 2010, 22:716.
[6] H PENG*, J STOLWIJK, L SUN,etal.. A nanogel for ratiometric fluorescent sensing of physiological pH values [J].Angew.Chem.Int.Ed., 2010, 49:4246.
Optical Oxygen Nanosensors Towards Biomedical Applications
PENG Hong-shang1,2*, SHEN Rui-ying1, WANG Xiao-hui1
(1.CollegeofScience,BeijingJiaotongUniversity,Beijing100044,China;2.CollegeofScience,MinzuUniversityofChina,Beijing100081,China)
*CorrespondingAuthor,E-mail:hshpeng@bjtu.edu.cn
The determination of oxygen concentration is of great importance in biological applications. In recent years, significant progress has been made in the field, and nanosized optical oxygen sensors have gained particular attraction owing to the merit of high sensitivity, good photostability, facile bioconjugation and ideal dimension forinvitroandinvivoapplications. In this review, we focus on optical oxygen nanosensors, including the types of suitable oxygen probes, structure properties, preparation methods, and different detection modalities. In addition, for different O2nanosensors, the analytical performance and applicability in specific biological applications are also outlined. Generally this review is meant to give the potential user a guide to select the most suitable optical oxygen nanosensor and detection modalities for their particular biological detection.
optical nanosensor; oxygen sensing; phosphorescence quenching; biomedical imaging
1000-7032(2016)10-1167-10
2016-08-07;
2016-08-21
国家自然科学基金(61575017); 教育部新世纪优秀人才支持计划(12-0771)资助项目
O433.4; O482.31
A
10.3788/fgxb20163710.1167
