超声波辅助酶法提取红豆中的膳食纤维
2016-11-18赵泰霞张明玉
赵泰霞,张明玉
(武夷学院茶与食品学院,福建武夷山 354300)
超声波辅助酶法提取红豆中的膳食纤维
赵泰霞,张明玉
(武夷学院茶与食品学院,福建武夷山 354300)
采用超声波辅助酶解法提取红豆中的膳食纤维(DF),用木瓜蛋白酶和α-淀粉酶对已经干燥并且脱脂后的红豆粉进行酶解。酶解过程以木瓜蛋白酶添加量、α-淀粉酶添加量、酶解溶液pH值、酶解温度和酶解时间为单因素,研究各单因素对膳食纤维(DF)得率和其中可溶性膳食纤维(SDF)所占百分比的影响,用正交法对试验工艺进行优化。试验结果表明,木瓜蛋白酶添加量0.9%,酶解溶液pH值4.5,酶解温度70℃,酶解时间60 min时,膳食纤维(DF)得率最高,为43.68%;可溶性膳食纤维(SDF)所占百分比为14.66%。
红豆;膳食纤维;酶解法;SDF;超声波
膳食纤维(DF)作为第七大营养素,素有“肠道清洁夫”之称,对预防龋齿、降血脂、促进肠道消化吸收、防止便秘[1]、减肥、降低血糖、降低血压等都有一定的作用[2]。除此之外,膳食纤维还对降低与荷尔蒙相关的癌症(如乳腺癌等)有一定的功效。膳食纤维因此受到了广泛关注,其保健功能也为越来越多的人所知晓。
膳食纤维(DF)可分成两大类,分别是可溶性膳食纤维(SDF)和水不溶性膳食纤维(IDF),二者在生理功能和保健方面作用效果各有不同。
红豆,又称红小豆,种子中含有丰富的淀粉、蛋白质、膳食纤维以及B族维生素等营养物质,可作为粮食和副食品,并且是进补的良好食材。红豆皮是很好的膳食纤维来源,纤维含量高达60%,且其不仅有较好的质感和良好的口感,还可以通过加工而成为高纯度、高品质、高附加值的膳食纤维[3]。
1 材料
1.1 试验材料
红豆,市售;木瓜蛋白酶(酶活≥100×104U/g),上海蓝季科技发展有限公司提供;α-淀粉酶,北京奥博星生物技术有限责任公司提供;石油醚(分析纯)、95%乙醇(分析纯)、氢氧化钠(分析纯),由国药集团化学试剂有限公司提供;一水合柠檬酸(食品级),吴江信诚精细化工有限公司提供。
1.2 仪器设备
DHG-9245A型电热恒温鼓风干燥箱,上海慧泰仪器制造公司产品;DK-8D型数显恒温水浴锅,金坛市盛威实验仪器厂产品;高速万能粉碎机,天津市泰斯特仪器公司产品;DT5-4型离心机,北京时代北利离心机公司产品;SHB-III型循环水式真空泵,郑州长城科工贸公司产品;KQ-50DB型数控超声波清洗器,昆山市超声仪器公司产品。
2 试验方法
2.1 工艺流程
预处理→脱水干燥→石油醚脱脂→抽滤→干燥→脱脂→水洗→木瓜蛋白酶酶解→灭酶→α-淀粉
①滤液→浓缩至原体积1/3→4倍体积95%乙醇沉淀1.5 h→真空抽滤→滤出物干燥→可溶性膳食纤维(SDF);
②滤渣→热水浸泡至中性(80℃,10 min)→真空抽滤→滤出物烘干→水不溶性膳食纤维(IDF)。
2.2 操作要点[4-5]
2.2.1 脱水预处理
挑选干净整齐的红豆,用粉碎机粉碎,过100目筛备用。
2.2.2 脱水干燥
红豆本身含有一些水分,故在粉碎后将其置于电热恒温鼓风干燥箱中干燥至恒质量,并计算其含水量。
2.2.3 脱脂
本试验用超声波协同脱脂,用沸程60~90℃的石油醚为溶剂,55℃下辅助超声20 min,然后抽提2次,每次90 min,最后抽滤收集滤渣,除去溶剂即可认为脱脂完成。
2.2.4 酶处理
用一定量的木瓜蛋白酶和α-淀粉酶,在一定的酶解溶液pH值、酶解温度以及酶解时间下对原材料进行酶解,然后煮沸灭酶。
2.2.5 离心过滤
将煮沸灭酶后的样品置于离心机中离心(转速4 000 r/min,20 min),分离出上清液和沉淀物[6]。
2.2.6 SDF的制取
将上述上清液转移至250 mL中的烧杯中,其中加入4倍体积95%的乙醇,静置90 min使SDF沉淀,抽滤,沉淀物干燥,得到SDF。
2.2.7 IDF的制取
将2.2.5中沉淀用热水浸泡至中性(80℃,10 min)再真空抽滤,烘干,粉碎,即得IDF[7]。
2.2.8 DF得率和SDF所占百分比计算[8]
试验中称取1.00g经前期脱脂和干燥的脱脂干豆渣,其中含脂肪0.64%,含水率11.96%,因此本试验中计算公式如下:
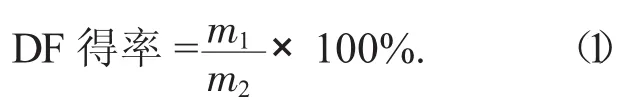
式中:m1——提取出的DF总质量,g;
m2——所用脱脂干豆渣的质量,g。
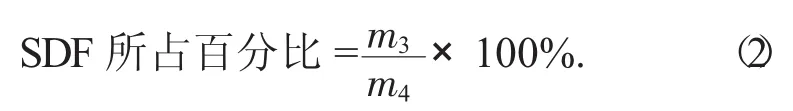
式中:m3——提取出的SDF总质量,g;
m4——所用脱脂干豆渣的质量,g。
2.3 单因素试验设计
由于红豆中含较高的蛋白质和淀粉等,故该试验将酶解过程中的加酶量(%) (木瓜蛋白酶和α-淀粉酶)、酶解溶液pH值、酶解温度、酶解时间设为单因素,每个因素分别设5个水平。其中,木瓜蛋白酶添加量分别为0.5%,0.6%,0.7%,0.8%,0.9%;α-淀粉酶添加量分别为0.8%,0.9%,1.0%,1.1%,1.2%;酶解溶液pH值分别为3.5,4.0,4.5,5.0,5.5,酶解温度分别为55,60,65,70,75℃;酶解时间分别为40,60,80,100,120 min。
2.3.1 木瓜蛋白酶添加量对DF得率及SDF所占百分比的影响
称取1.00g的脱脂干豆粉5份,置于贴有标签的烧杯中,按料液比1∶30[8],先分别向其中加入30 mL蒸馏水,再分别向5个烧杯中加入0.5%,0.6%,0.7%,0.8%,0.9%的木瓜蛋白酶[9],调节α-淀粉酶的添加量为0.9%,在酶解溶液pH值为5.0,60℃下酶解90 min。重复试验3次,研究木瓜蛋白酶添加量对DF得率和SDF所占百分比的影响。
2.3.2 α-淀粉酶添加量对DF得率及SDF所占百分比的影响[10-12]
称取1.00g的脱脂干豆粉5份,置于贴有标签的烧杯中,按料液比1∶30,向其中加入30 mL蒸馏水。在料液中分别加0.8%,0.9%,1.0%,1.1%,1.2%的α-淀粉酶,调节木瓜蛋白酶添加量为0.8%,在酶解溶液pH值为5.0,60℃的条件下酶解90 min。重复试验3次,研究α-淀粉酶添加量对DF得率和SDF所占百分比的影响。
2.3.3 酶解溶液pH值对DF得率及SDF所占百分比的影响
称取1.00g的脱脂干豆粉5份,置于贴有标签的烧杯中,按料液比1∶30,向其中加入30 mL蒸馏水。再向其中加入0.8%的木瓜蛋白酶,0.9%的α-淀粉酶,调节酶解溶液pH值分别为4.0,4.5,5.0,5.5,6.0,在酶解温度为60℃的条件下酶解90 min。重复试验3次,以考察不同酶解溶液pH值对DF得率及SDF所占百分比的影响。
2.3.4 酶解温度对DF得率及SDF所占百分比的影响
称取1.00g的脱脂干豆粉5份,置于贴有标签的烧杯中,按料液比1∶30,向其中加入30 mL蒸馏水。调节酶解溶液pH值为5.0,加入0.8%的木瓜蛋白酶,0.9%的α-淀粉酶,将料液分别置于55,60,65,70,75℃的酶解温度下酶解90 min。重复试验3次,考察酶解温度对DF得率及SDF所占百分比的影响。
2.3.5 酶解时间对DF得率及SDF所占百分比影响
称取1.00g的脱脂干豆粉5份,置于贴有标签的烧杯中,按料液比1∶30,向其中加入30 mL蒸馏水,再加入0.3%的木瓜蛋白酶,0.8%的α-淀粉酶,调节酶解溶液pH值为5.0,在酶解温度为50℃的条件下,分别酶解40,60,80,100,120 min。重复试验3次,以考察不同酶解时间对DF得率及SDF所占百分比的影响。
2.4 正交试验
在单因素试验的基础上,结合提取效率、经济成本综合分析,考虑选取木瓜蛋白酶添加量、酶解溶液pH值、酶解时间、酶解温度4个因素作为正交试验的因素,设计L9(34)正交表。最后以DF得率为评价指标,通过对正交试验的结果进行分析,从而确定红豆渣中DF的最佳提取工艺条件。每个试验重复3次。
L9(34)正交试验因素与水平设计见表1。

表1 L9(34)正交试验因素与水平设计
3 结果与讨论
3.1 木瓜蛋白酶添加量对DF得率及SDF所占百分比的影响
木瓜蛋白酶添加量对DF得率及SDF所占百分比的影响见图1。

图1 木瓜蛋白酶添加量对DF得率及SDF所占百分比的影响
由图1可知,当木瓜蛋白酶添加量小于0.8%时,随着木瓜蛋白酶添加量的增多,DF得率和SDF所占百分比都有所提升;但是当木瓜蛋白酶添加量大于0.8%时,DF得率和SDF所占百分比反而有所下降。综合考虑,木瓜蛋白酶的添加量为0.8%最适合。
3.2 α-淀粉酶添加量对DF得率及SDF所占百分比的影响
α-淀粉酶添加量对DF得率及SDF所占百分比的影响见图2。
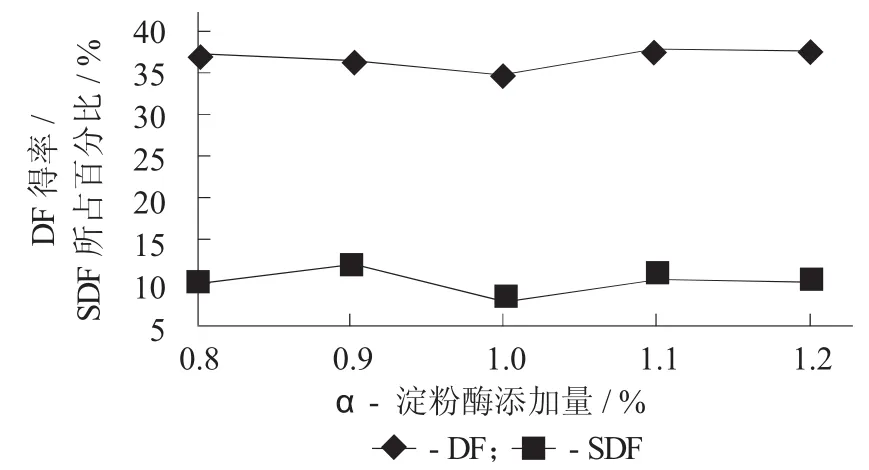
图2 α-淀粉酶添加量对DF得率及SDF所占百分比的影响
由图2可知,α-淀粉酶添加量小于1.0%时,随着α-淀粉酶添加量的增加而稍微有所下降;当添加量大于1%时稍微有所下降;当α-淀粉酶添加量大于1.1%时,DF得率又有所下降,但是幅度不是很明显。综合考虑,α-淀粉酶添加量为1.1%为较合适水平。
3.3 酶解溶液pH值对DF得率及SDF所占百分比的影响
酶解溶液pH值对DF得率及SDF所占百分比的影响见图3。
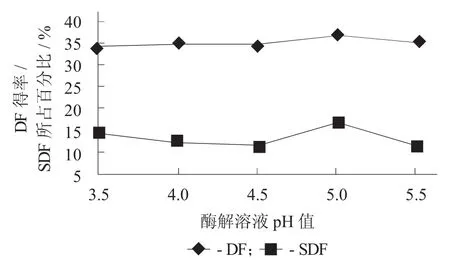
图3 酶解溶液pH值对DF得率及SDF所占百分比的影响
由图3可知,当酶解溶液pH值为3.5~4.0时,随着酶解溶液pH值的增大,DF得率与SDF所占百分比都有所下降;但是当酶解溶液pH值大于4.5时,二者都有比较明显的上升趋势;当酶解溶液pH值为5.0时,二者达到最大。因此综合分析,酶解溶液pH值为5.0为较适合水平。
3.4 酶解温度对DF得率及SDF所占百分比的影响
酶解温度对DF得率及SDF所占百分比的影响见图4。
由图4可知,当酶解温度从55℃上升到65℃时,随着酶解温度的升高,DF得率也有所增加;但是当酶解温度达到65℃后,随着酶解温度的上升,DF得率反而有所下降。可能原因是酶解温度低于65℃,酶活随着酶解温度的升高而增大;当酶解温度大于65℃,酶活有所降低,因而导致DF得率减少。因此,最适合的酶解温度为65℃。
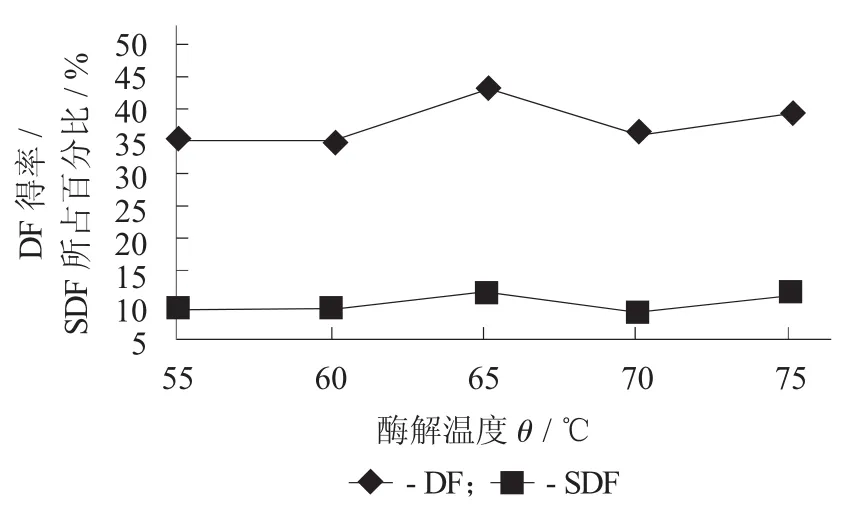
图4 酶解温度对DF得率及SDF所占百分比的影响
3.5 酶解时间对DF得率及SDF所占百分比的影响
酶解时间对DF得率及SDF所占百分比的影响见图5。
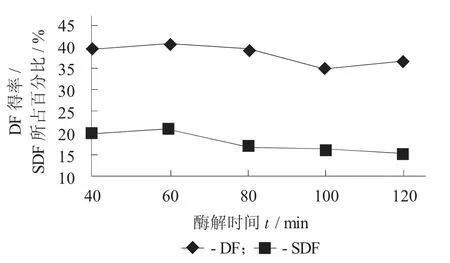
图5 酶解时间对DF得率及SDF所占百分比的影响
由图5可知,酶解时间从40~60 min时,其DF得率有所提升,但是幅度小;而酶解80 min后则DF得率呈下降趋势,虽然有提升,但是效果不明显。其原因可能是在较短时间内酶解不够充分,部分DF无法水解出来;但是若酶解时间偏长,则又可能导致某些半纤维素被水解成非DF成分[13]。因此,从提取效率和经济成本的角度出发,较为适合的酶解时间为60~80 min。
3.6 正交试验结果
正交试验结果见表2。

表2 正交试验结果
由正交试验R可知,A>C>B>D,可知影响的主次顺序为木瓜蛋白酶添加量>酶解时间>酶解温度>酶解溶液pH值。确定出最优工艺方案组合为A3C2B3D1,即当木瓜蛋白酶添加量为0.9%,酶解时间为60 min,酶解温度为70℃,酶解溶液pH值为4.5时,DF得率最高。以最佳工艺条件平行重复3组试验,测得DF得率为43.68%,SDF所占百分比为14.66%,验证表明优化水平较为可靠。
3.7 DF后期处理
从红豆中提取出的SDF呈淡黄褐色粉末状,IDF呈淡红褐色,外观性状较为理想;再从持水性和膨胀力方面分析提取出DF的性状。
3.7.1 持水性
准确称取1.00g DF,置于100 mL烧杯中,加入蒸馏水50 mL,25℃下电磁搅拌2 h,取悬浮液转移至离心杯中,于4 000 r/min下离心30 min,取出,弃去上清液,称质量。
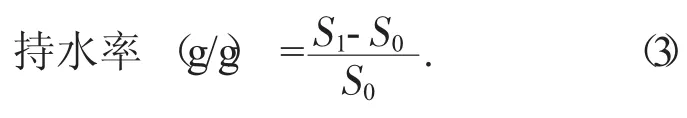
式中:S0——DF干质量,g;
S1——DF湿质量,g。
试验结果为持水率5.61g/g。
3.7.2 膨胀性
取1.00g DF于量筒中,测定体积后,加入5 mL蒸馏水,浸泡24 h测定体积,并计算其膨胀力。
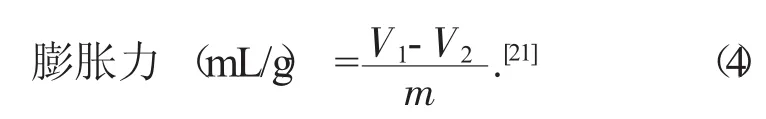
式中:V1——溶胀后的总体积,mL;
V0——溶胀前的总体积,mL;
m——所用DF的质量,g。
试验结果为膨胀力8.80 mL/g。
4 结论
试验中以木瓜蛋白酶添加量、α-淀粉酶添加量、酶解溶液pH值、酶解温度和酶解时间为单因素,所得DF得率和SDF所占百分比作为评价指标,选出影响较大的几个因素。单因素试验结果表明,木瓜蛋白酶添加量、酶解溶液pH值、酶解温度和酶解时间是影响比较大的因素。用木瓜蛋白酶添加量、酶解溶液pH值、酶解温度和酶解时间进行L9(34)正交试验,结果显示,当木瓜蛋白酶添加量为0.9%、酶解时间为60 min、酶解温度为70℃,酶解溶液pH值为4.5时,DF得率最高,为43.68%;SDF所占百分比为14.66%。酶法的优点是提取条件温和、节约能源、操作简单方便,而且相比一些经过了高温高压或者其他比较剧烈方式处理工艺提取出来的膳食纤维性能更优良,还可以省去部分工艺和设备,有利于环境保护,酶法特别适合于原料中淀粉和蛋白质含量高的制备工艺[14]。
[1] 权美平.膳食纤维的生理保健功能及其提取工艺的研究进展 [J].保鲜与加工,2013,13(1):49-51.
[2] 高宗颖.膳食纤维的生理保健作用 [J].农业工程技术(农产品加工业),2011(1):43-45.
[3] 赵建民.烹饪营养学 [M].北京:中国财政经济出版社,2001:135-137.
[4] 代养勇.大豆食品豆腥味研究进展 [J].中国粮油学报,2007,22(4):1-2.
[5] 金晶,徐志宏,魏振承,等.超声微波辅助法提纯菜籽蛋白的研究 [J].现代食品科技,2009,25(3):275-278.
[6] 那仁图雅.红小豆分离蛋白的特性研究以及抗氧化肽制备 [D].呼和浩特:内蒙古农业大学,2011.
[7] 刘绍.食品分析与检验 [M].武汉:华中科技大学出版社,2011:47-52.
[8] 吴晖.大豆水溶性膳食纤维的提取研究 [J].现代食品科技,2008,24(4):338-339.
[9] 刘建平.超声辅助酶解法提取豆渣膳食纤维研究 [J].食品研究与开发,2010,31(11):12-13.
[10]张向前.酶解法提取红枣膳食纤维的工艺研究 [J].安徽农业科学,2012,40(1):114-115.
[11]Elizabeth R N,Anneteh,Franciscogr,et al.Antioxidant and antimutagenic activity of pH enolic compoundsin three different colourgroups of common bean cultivars[J].Food Chemistry,2007,103:521-527.
[12]Itoh T,Itoh Y,Hibasami H,et al.Vignoside,a novel new sesquiterpeneglucoside obtained from a hot-water extract of adzuki bean(Vigna angularis) [J].Journal of the Japanese Society for Food Science and Technology,2005,52(7):319-323.
[13]刘莹.双酶法提取褐蘑菇膳食纤维的最佳工艺条件研究 [J].湖南农业科学,2011(21):86-87.
[14]陈菲菲.膳食纤维的生理功能及其提取方法的研究进展 [J].福建水产,2008(2):51-52.◇
Extraction of Dietary Fiber from Red Beans by Ultrasonic Assisted Enzymatic Method
ZHAO Taixia,ZHANG Mingyu
(Tea and Food College,Wuyi University,Wuyishan,Fujian 354300,China)
Using ultrasound-assisted hydrolysis method to extract dietary fiber from red beans in this study.Using papain and alpha amylase to digest the red beans which is degreased and dried already.Papain amount,alpha amylase amount,solution pH,hydrolysis temperature,hydrolysis time are regarded to single factors in the digestion process,so that can study the influence of each single factors to the extraction rate of dietary fiber(DF)and the influence of SDF percentage.On this basis,using orthogonal experiment to optimize it.The results show that the DF extraction rate and the SDF percentage are higest when it is under the condition that the papain is 0.9%,the solution pH is 4.5,hydrolysis time is 60 min,hydrolysis temperature is 70℃.It is 43.68%of DF and 14.66%of SDF.
red beans;DF;enzymatic hydrolysis;SDF;ultrasound
TS214.9
A
10.16693/j.cnki.1671-9646(X).2016.04.003
1671-9646(2016)04a-0008-04
2016-01-13
赵泰霞(1983— ),女,硕士,助教,研究方向为食品微生物学。
