HMGB1、MMP9在子宫内膜癌中的表达和临床意义*
2016-11-18段玉真周晓慧张玉娟
段玉真,周晓慧,张玉娟△
(1.承德医学院附属医院,河北承德 067000;2.承德医学院基础医学院)
HMGB1、MMP9在子宫内膜癌中的表达和临床意义*
段玉真1,周晓慧2△,张玉娟1△
(1.承德医学院附属医院,河北承德 067000;2.承德医学院基础医学院)
目的:探讨高迁移率组蛋白1(HMGB1)和基质金属蛋白酶-9(MMP-9)mRNA在子宫内膜癌中的表达水平和临床意义。方法:应用RT-PCR法检测正常子宫、单纯性增生症、非典型增生症和子宫内膜癌子宫内膜组织HMGB1和MMP9 mRNA的表达水平。结果:子宫内膜癌组织HMGB1、MMP-9 mRNA的表达量明显高于正常子宫、单纯性增生症、非典型增生症子宫内膜组织(P<0.05);子宫内膜癌组织HMGB1、MMP-9 mRNA的表达均与FIGO分期、淋巴结转移和浸润深度有关(P<0.05)。结论:HMGB1、MMP-9在子宫内膜癌的发生、发展和转移过程中可能起着重要作用。
子宫内膜癌;HMGB1;MMP9;RT-PCR
子宫内膜癌(endometrial carcinoma,EC)是世界范围内第五常见的女性恶性肿瘤,在发达国家子宫内膜癌的发病率已超过卵巢癌[1]。高迁移率组蛋白1(HMGB1)是一种与肿瘤侵袭与转移相关的染色质核蛋白,在多种恶性肿瘤中高表达,可直接或间接地参与肿瘤的浸润、侵袭与转移[2]。基质金属蛋白酶-9(MMP-9)在肿瘤侵袭和转移的过程中发挥着重要作用,主要是通过降解细胞外基质的各种成分,如层粘连蛋白、胶原及纤维蛋白等,使细胞外基质的结构不完整,从而有利于癌细胞通过部分缺失的细胞外基质,并进一步向周围组织浸润。本研究联合检测HMGB1、MMP-9在子宫内膜癌组织中的表达情况,旨在探讨二者表达水平变化与子宫内膜癌组织浸润和转移的相关性,以期为阐明子宫内膜癌浸润转移的病理机制提供有价值的理论和实验依据。
1 材料与方法
1.1 组织标本 2013年10月至2014年10月在承德医学院附属医院因子宫内膜癌行手术治疗患者的新鲜标本32例,患者年龄35-60岁,术后经病理检测证实均为子宫内膜腺癌。根据2009 FIGO子宫内膜癌手术病理分期,Ⅰ期子宫内膜癌18例、Ⅱ期子宫内膜癌8例、Ⅲ期子宫内膜癌6例,有淋巴结转移的6例、无淋巴转移的26例,高分化20例、中分化6例、低分化6例。所有病人手术前均未接受放化疗和激素治疗。收集同期行全子宫切除术的新鲜正常子宫内膜组织32例,单纯性增生症32例,非典型增生症32例。所有组织的收集均经承德医学院附属医院伦理委员会同意,患者均签署知情同意书。
1.2 实验材料 Trizol,美国invitrogen公司;逆转录试剂盒、DL600 marker,日本TAKARA公司;引物,上海生工生物工程技术有限公司设计并合成。
1.3 RT-PCR法检测HMGB1、MMP-9 mRNA的表达 提取各组子宫内膜组织的总RNA,进行反转录。PCR引物:①HMGB1:上游引物:5′-GATGGGCAAAGGAGATCCTA-3',下游引物:5'-CTTGGTCTCCCCTTTGGGGG-3',片段大小191bp;②MMP-9:上游引物:5'-GCAATGCTGATG GGAAACCC-3',下游引物:5'-AGAAGCCGAAGAG CTTGTCC-3',片段大小141bp;③GAPDH:上游引物:5′-CCGGGAAACTGTGGCGTGATGG-3',下游引物:5′-AGGTGGAGGAGTGGGTGTCGHCTGTT-3',片段大小309bp。反转录的cDNA,PCR仪扩增;94℃5min,94℃30s,60℃30s,72℃30s,共30个循环。应用Gel Pro4.0软件进行定量分析,以目的条带的光密度与内参条带光密度的比值,作为各目的基因mRNA表达的相对水平。
1.4 统计分析 采用SPSS 17.0统计软件进行数据处理,计量资料的比较采用单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 子宫内膜组织HMGB1 mRNA和MMP-9 mRNA的表达情况 子宫内膜癌组、非典型增生组子宫内膜组织HMGB1 mRNA和MMP-9 mRNA的表达量明显高于正常组和单纯性增生组(P<0.05);子宫内膜癌组子宫内膜组织HMGB1 mRNA和MMP-9 mRNA的表达量明显高于非典型增生组(P<0.05)。见表1:
表1 子宫内膜组织HMGB1和MMP-9 mRNA的表达情况(±s,n=32)
与正常组比较:aP<0.05;与单纯性增生组比较:bP<0.05;与非典型增生组比较:cP<0.05
组别HMGB1 mRNAMMP-9 mRNA正常组0.232±0.0310.156±0.021单纯性增生组0.244±0.0200.162±0.037非典型增生组0.444±0.020ab0.318±0.028ab子宫内膜癌组0.906±0.021abc0.698±0.059abc
2.2 HMGB1、MMP-9 mRNA表达与子宫内膜癌临床病理参数的关系 子宫内膜癌组织HMGB1、MMP-9 mRNA的表达与年龄、分化程度无关(P>0.05);与FIGO分期、淋巴结转移和浸润深度有关(P<0.05):浸润>1/2明显高于≤1/2,Ⅲ期明显高于Ⅰ+Ⅱ期,有淋巴结转移明显高于无淋巴结转移。见表2:
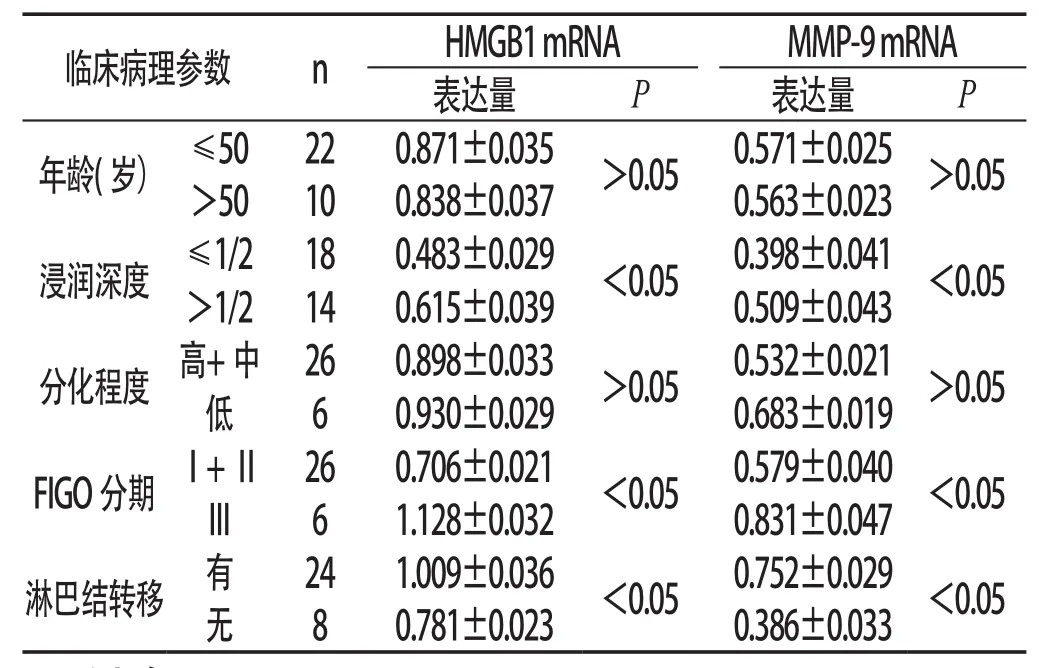
表2 HMGB1、MMP-9 mRNA表达与子宫内膜癌临床病理参数的关系
3 讨论
最近的研究表明,HMGB1 在乳腺癌[3]、前列腺癌[4]、大肠癌[5]和宫颈癌[6]等肿瘤组织或血清中高表达。Schlueter等[7]发现,HMGB1参与肿瘤的发生、发展、侵袭和转移,可能与促进肿瘤周围血管生成有关;Zhu等[8]研究HMGB1在大肠癌中的意义,发现HMGB1可通过RAGE/Snail/ NF-κB信号通路促进肿瘤上皮细胞向间质细胞的转化过程,从而促进肿瘤细胞的转移。本研究发现,子宫内膜癌组织HMGB1 mRNA的表达量明显高于正常、单纯性增生和非典型增生子宫内膜组织,并且子宫内膜癌组织HMGB1 mRNA的表达量与与FIGO分期、淋巴结转移和浸润深度有关,提示HMGB1可能参与了子宫内膜癌的发生、发展过程。
MMP-9又称为明胶酶B,被激活后形成Ⅳ型胶原酶,降解、破坏靠近肿瘤表面的Ⅳ型、Ⅴ型胶原和明胶,有助于肿瘤细胞沿缺失的基底膜向周围浸润,最终导致肿瘤的侵袭和转移。本研究显示,子宫内膜癌组织MMP-9 mRNA的表达量明显高于正常、单纯性增生和非典型增生子宫内膜组织,并且子宫内膜癌组织MMP-9 mRNA的表达量与与FIGO分期、淋巴结转移和浸润深度有关。与卢建军等[9]报道的采用免疫组织化学法检测MMP-9在子宫内膜癌组织中的表达结果一致,提示MMP-9可能参与了子宫内膜癌的发生、发展过程。
本研究发现,HMGB1 mRNA、MMP-9 mRNA的表达量均随FIGO分期的增高、出现淋巴结转移和浸润深度加深而升高,表明HMGB1与MMP-9与子宫内膜癌的侵袭和转移有关。因此提示,HMGB1和MMP-9可能成为子宫内膜癌早期诊断、预后评价的分子标志物和新的治疗靶点。
[1]Ferlay J, Soerjomataram I, Ervik M, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-386.
[2]Tang D, Kang R, Zeh HR, et al. High-mobility group box 1 and cancer[J]. Biochim Biophys Acta, 2010, 1799 (1/2): 131-140.
[3]Shang GH, Jia CQ, Tian H, et al. Serum high mobility group box protein 1 as a clinical marker for non-small cell lung cancer[J]. Respir Med, 2009, 103(12): 1949-1953.
[4]Ishiguro H, Nakaigawa N, Miyoshi Y, et al. Receptor for advanced glycation end products (R AGE) and its ligand, amphoterin are overexpressed and associated with prostate cancer development[J]. Prostate, 2005, 64(1): 92-100.
[5]Liu W, Zhang Z, Zhang Y, et al. HMGB1-mediated autophagy modulates sensitivity of colorectal cancer cells to oxaliplatin via MEK/ERK signaling pathway[J]. Cancer Biol Ther, 2015, 16(4): 511-517.
[6]Wang L, Wang Q, Li HL, et al. Expression of MIR200a,miR93,metastasis-related gene RECK and MMP2/ MMP9 in human cervical carcinoma-relationship with prognosis[J]. Asian J Cancer Prev, 2013, 14(3): 2113- 2118.
[7]Schlueter C, Weber H, Meyer B, et al. Angiogenetic signaling through hypoxia: HMGB1: an angiogenetic switch molecule[J]. Am J Pathol, 2005, 166(4): 1259-1263.
[8]Zhu L, Li X, Chen Y, et al. High-mobility group box 1: a novel inducer of the epithelial-mesenchymal transition in colorectal carcinoma[J]. Cancer Lett, 2015, 357(2): 527-534.
[9]卢建军,伊莉萍,托娅,等.基质金属蛋白酶-9在子宫内膜癌组织中的表达水平及临床意义[J].实用临床医药杂志,2014,18(15):63-65.
EXPRESSION AND CLINICAL SIGNIFICANCE OF HMGB1 AND MMP-9 IN ENDOMETRIAL CARCINOMA
DUAN Yu-zhen, ZHOU Xiao-hui, ZHANG Yu-juan
(The Affiliated Hospital of Chengde Medical College, Hebei Chengde 067000, China)
Objective: To investigate the expression and clinical signifi cance of high-mobility group box 1 protein(HMGB1) and matrix metalloproteinases-9 (MMP-9) mRNA in endometrial carcinoma. Methods: RT-PCR was used to detect the HMGB1 and MMP-9 mRNA expression level in normal endometrial tissue, endometrial hyperplasia, atypical endometrial hyperplasia and endometrial carcinoma. Results: The HMGB1 and MMP-9 mRNA expression level in endometrial carcinoma were obviously higher than normal endometrial tissue, endometrial hyperplasia and atypical endometrial hyperplasia (P<0.05). In endometrial carcinoma, the expression of HMGB1 and MMP-9 were all related to FIGO stage, lymph node metastasis and infi ltration depth (P<0.05). Conclusions: HMGB1 and MMP-9 may play important role in genesis, development and metastasis of endometrial carcinoma.
Endometrial carcinoma; HMGB1; MMP9; RT-PCR
R737.33
A
1004-6879(2016)02-097-03
* 河北省科技厅项目(14277766D)
△
(2015-10-11)
