绿僵菌素A对家蚕cecropin B和gloverin 4基因表达的影响
2016-11-18胡维娜何广位李福霞胡琼波
胡维娜,何广位,李福霞,胡琼波
(华南农业大学农学院,广州510642)

绿僵菌素A对家蚕cecropin B和gloverin 4基因表达的影响
胡维娜,何广位,李福霞,胡琼波*
(华南农业大学农学院,广州510642)
绿僵菌素A(DA)是由金龟子绿僵菌Metarhiziumanisopliae产生的一种环缩羧肽类次生化合物,具有抗昆虫免疫作用,但是人们对其影响免疫相关基因调控的机理缺乏了解。本实验以家蚕Bm12细胞为材料,采用RNAi技术沉默相关转录因子,结合荧光定量PCR(qPCR)技术,明确DA处理或沉默TOLL和IMD信号通路相关转录因子后抗菌肽cecropin B和gloverin 4基因表达的变化。实验发现,DA能引起抗菌肽cecropin B基因表达上调和gloverin 4基因表达下调。利用特异性siRNA分别沉默转录因子BmRelish1、BmRelish2、BmRel、BmFOXg1后,发现只有沉默转录因子BmRelish时,cecropin B和gloverin 4基因表达才下调,说明这两种抗菌肽的合成均通过IMD信号通路调控。当沉默 BmRelish1或 BmRel基因及DA处理联合作用时,cecropin B基因显著下调,说明在抑制cecropin B合成时,DA与转录因子BmRelish1或者BmRel之间存在密切的协同效应;同样,在促进gloverin 4合成时,DA与转录因子BmRelish2之间也存在着协同效应。
绿僵菌素A; Bm12 细胞; cecropin; gloverin
绿僵菌素(destruxins)是由金龟子绿僵菌Metarhiziumanisopliae产生的一类环缩羧肽类次生代谢物质,具有杀虫活性,也是绿僵菌的关键致病因子(Kershawetal., 1999; Pedrasetal., 2002)。目前已经发现39种绿僵菌素同系物,其中绿僵菌素A和B(DA和DB)是最常见的同系物种类(Liu and Tzeng, 2012)。研究表明,绿僵菌素破坏昆虫的先天性免疫系统,影响血细胞中的钙离子与氢离子平衡(Chenetal., 2014),影响血细胞的吞噬与囊胞化功能(Veyetal., 2002),抑制果蝇抗菌肽合成(Paletal., 2007),而且绿僵菌素A对家蚕浆血细胞与粒血细胞具有毒性(Chenetal., 2014; Fanetal., 2014)。但是,目前对绿僵菌素作用的分子机理并不清楚。
一般认为,Rel/NF-κB信号通路在昆虫免疫中发挥着重要作用,Toll和Imd两条通路均属于Rel/NF-κB信号通路。昆虫对真菌与革兰氏阳性细菌的免疫响应通过TOLL信号通道激活,而革兰氏阴性细菌则是通过激活IMD信号通路引起免疫响应。Rel蛋白是Toll通路中的下游的转录因子,它被激活后即进入细胞核,启动抗菌肽等靶标基因的转录,Dorsal是Rel家族蛋白的重要代表,能高效调节抗菌肽的合成(张明明等, 2012;初源等, 2013)。家蚕BmRel基因通过选择性剪切为 BmRelA和BmRelB两个转录本,分别编码Dorsal isoform A和Dorsal isoform B两种蛋白(Tanakaetal., 2008;Suetsuguetal., 2013)。参与IMD信号转导通路的Rel蛋白是Relish,家蚕的Relish1和Relish2基因分别编码NF-κB p110 subunit isoform 1和NF-κB p110 subunit isoform 2两种蛋白质(Tanakaetal., 2008;Suetsuguetal., 2013),它们能调控抗菌肽基因的转录。另一个转录因子FOXg1,在细菌刺激后表达量会显著变化,可能与免疫相关(Tanakaetal., 2010)。
DA处理家蚕血细胞后,影响Bm_nscaf3098_42和Bm_nscaf1071_17基因表达,表达谱分析表明基因Bm_nscaf3098_42编码葛佬素4前体(gloverin 4 precursor),而基因Bm_nscaf1071_17编码家蚕抗菌肽B前体(cecropin-B precursor)(Gongetal., 2014)。家蚕的葛佬素(gloverin)是一种富含甘氨酸的抗菌肽,具有热稳定性,对大肠杆菌、革兰氏阳性细菌、真菌和病毒有生物活性,家蚕有4种Gloverin(Kanekoetal., 2007; Kawaokaetal., 2008; Yietal., 2013)。Cecropin-B属于cecropins家族,对革兰氏阳性与阴性细菌都有效,其肽链中碱性氨基酸主要分布在N-端,疏水基团主要分布在其C-端,在许多特定位置有较保守的残基,如2位的色氨酸(Trp),6、7位具一对赖氨酸(Lys),4位具天冬酰胺(Asn),6位具精氨(Arg),不含半胱氨酸(Cys)和二硫桥;但在第8位为苯丙氨酸(Phe),有别于其它的抗菌肽(陈玉清等, 2006; 周启升等, 2011)。
因此,本研究以家蚕Bm12 细胞为材料,采用RNAi方法分别敲除BmRel、BmRelish1、BmRelish2、BmFOXg1等转录因子,考察绿僵菌素A对抗菌肽gloverin基因Bm_nscaf3098_42和cecropin基因Bm_nscaf1071_17表达的影响,增进对绿僵菌素作用机理的认识。
1 材料与方法
1.1 细胞与培养
供试细胞系:家蚕BombyxmoriBm12细胞由华南农业大学动科学院曹阳教授馈赠,采用TNM-FH培养基(Hyclone公司)加入10%胎牛血清(Gibco公司),在27℃下恒温培养传代,每隔2-4 d传代1次,取对数期细胞用于实验。
1.2 绿僵菌素
绿僵菌素A(DA)由本实验室从金龟子绿僵菌金龟子变种Metarhiziumanisopliaevar.anisopliae菌株MaQ10中分离纯化(Huetal., 2006)。取DA 1 mg,加入100 μL二甲基亚砜(DMSO,Sigma公司)溶解,制成10000 μg/mL的绿僵菌素贮备液,-80℃保存备用。
1.3 处理方法
小干涉RNA(siRNA)制备:根据目标基因的核苷酸序列,选择3′端相邻的核苷酸作为侯选的siRNA靶点,合成用于RNAi的小干涉RNA(siRNA)(上海英骏生物技术有限公司设计并合成),包括针对转录因子BmRel、BmRelish1、BmRelish2和BmFOXg1的siRNA(表1)。
siRNA-lipo2000混合液的准备:将lipofectimine2000(Bio-Rad公司)轻轻摇匀,然后取2 μL,再用无血清TNM-FH培养基200 μL稀释,轻轻混合,室温孵育5 min;另取2 μL siRNA,用无血清TNM-FH培养基200 μL稀释,轻轻混合;将孵育好的lipofectimine 2000与稀释好的siRNA轻轻混合,室温孵育20 min,形成siRNA-lipofectimine 2000混合液供细胞转染实验。
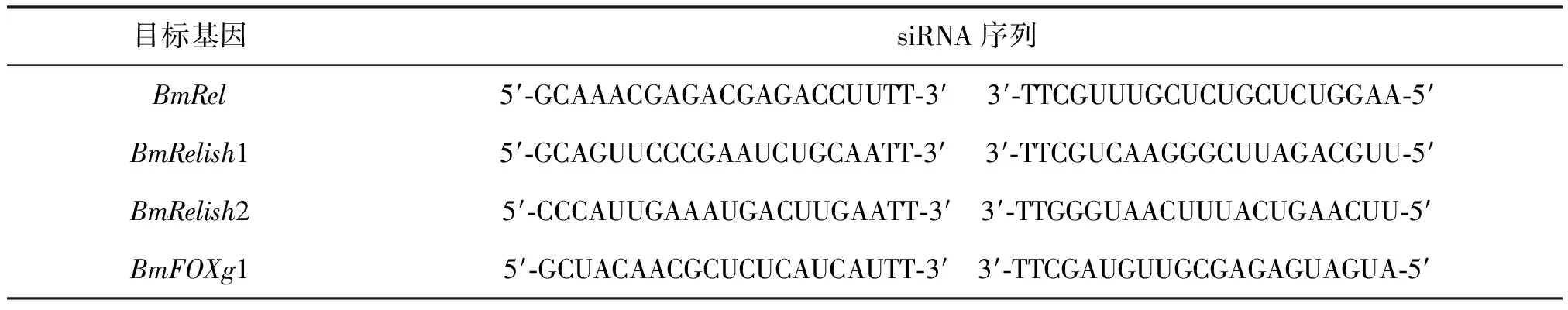
表1 用于沉默目标基因的小干涉RNA(siRNA)
细胞转染:取对数生长期Bm12细胞接种至12孔板(美国Corning Incorporated 公司),培养24 h 后,将培养液吸出,再加入无血清TNM-FH培养基100 μL,轻轻摇匀让培养基铺满底部;取siRNA-lipofectimine 2000混合液400 μL,缓慢加入12孔板中,非转染组则将200 μL孵育好的lipofectimine 2000与200 μL无血清TNM-FH培养基混匀,缓慢加入12孔板中,27℃下培养4 h,吸去上清液,终止转染,更换新鲜的含血清TNM-FH培养基继续培养20 h;再加入DA贮备液使培养液中DA的终浓度达到200 μg/mL,非DA处理组则加二甲基亚砜(DMSO,Sigma公司)对照使其终浓度达到0.1%,处理8 h后,提取细胞总RNA(RNA提取试剂盒:Omega公司)。RNA的纯度与浓度采用SimpliNano微量分光光度计(GE Healthcare Life Science)进行检测。
1.4 基因表达量分析
siRNA或DA处理的细胞作为实验组,未经转染和DA处理的细胞作为对照,提取总RNA,实验重复3次;qPCR方法参照Livak文献(Livak and Schmittgen, 2001),反应液体系为反转录的cDNA 1 μL,上下游引物各1 μL(表2),SYBR Premix Ex TaqTM(Bioscenece公司)10 μL,ddH2O 7 μL;反应程序为95℃预变性3 min,95℃变性10 s,60℃退火10 s,72℃延伸30 s,39个循环后95℃ 10 s,65℃至95℃ 5 s。
1.5 数据处理
qPCR数据采用2-ΔΔCt法(Pfaffl, 2001)进行数据分析处理,利用家蚕GAPDH基因作为内参,具体计算公式:ΔΔCt = (Ct目标基因-Ct持家基因)实验组-(Ct目标基因-Ct持家基因)对照组,实验处理组中目标基因的相对表达量(Q)计算公式:Q = 2-ΔΔCt,实验结果采用SPSS软件(IBM,美国)分析基因相对表达量。

表2 内参基因GAPDH(甘油醛-3-磷酸脱氢酶)和家蚕待检测基因引物
2 结果与分析
2.1 对转录因子的干扰效率
Bm12细胞被siRNA转染24 h后,经qPCR检测 BmRel、 BmRelish1、 BmRelish2和 BmFOXg1基因显著下调,干扰效率大于70%(图1)。
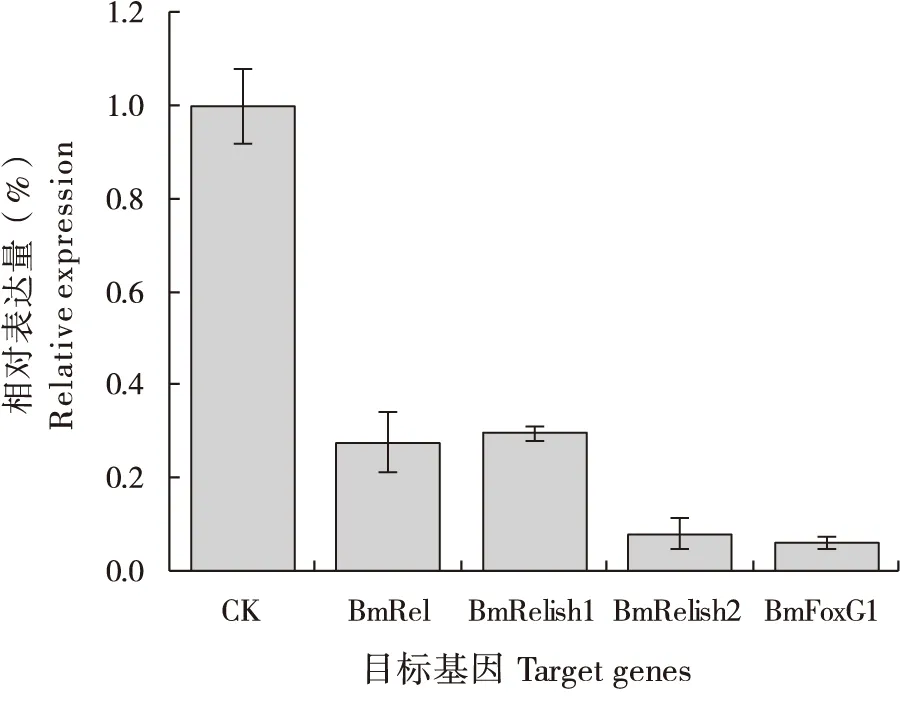
图1 siRNA对转录因子的干扰效率Fig. 1 siRNA to interference efficiency of transcription factors
2.2 绿僵菌素A与转录因子对cecropin B基因表达的影响
DA处理细胞8 h后,抗菌肽cecropin B基因Bm_nscaf1071_17表达量明显上调(图2)。沉默基因 BmRelish2后,cecropin基因Bm_nscaf1071_17显著下调;而沉默基因 BmRelish1、 BmRel和BmFOXg1,cecropin基因表达量基本不变(图2)。在敲除转录因子与DA联合处理实验中发现,先沉默 BmRelish1或 BmRel基因再用DA处理8 h(图2中BmRelish1+DA和BmRel+DA)时,cecropin基因的表达水平显著低于 BmRelish1、BmRel或DA各自单独处理时的水平;而先沉默其他基因再用DA处理(图2中BmRelish2+DA和BmFOXg1+DA),cecropin基因的表达水平相较于转录因子或DA单独处理时的水平未发生显著上调或者下调现象(图2)。
2.3 绿僵菌素A与转录因子对gloverin 4基因表达的影响
DA处理细胞8 h后,gloverin基因Bm_nscaf3098_42显著下调(图3)。沉默基因 BmRelish2后,gloverin 4基因Bm_nscaf3098_42显著下调,而沉默基因 BmRelish1、 BmRel和 BmFOXg1后,基因显著上调(图3)。在敲除转录因子与DA联合处理实验中发现,先沉默 BmRelish2基因再用DA处理8 h(图3中BmRelish2+DA)时,gloverin 4基因的表达水平显著上调,显著高于 BmRelish2或DA单独处理时的水平;而先沉默其他基因再用DA处理(图3中BmRelish1+DA、BmRel+DA、BmFOXg1+DA),gloverin基因的表达水平总是介乎于转录因子或DA单独处理时的水平之间(图3)。
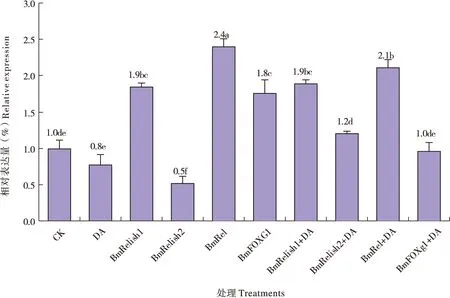
图2 绿僵菌素A与转录因子对cecropin-B基因Bm_nscaf1071_17的表达量的影响Fig.2 Effect of destruxin A and transcription factors on Bm_nscaf1071_17 gene expression of cecropin B
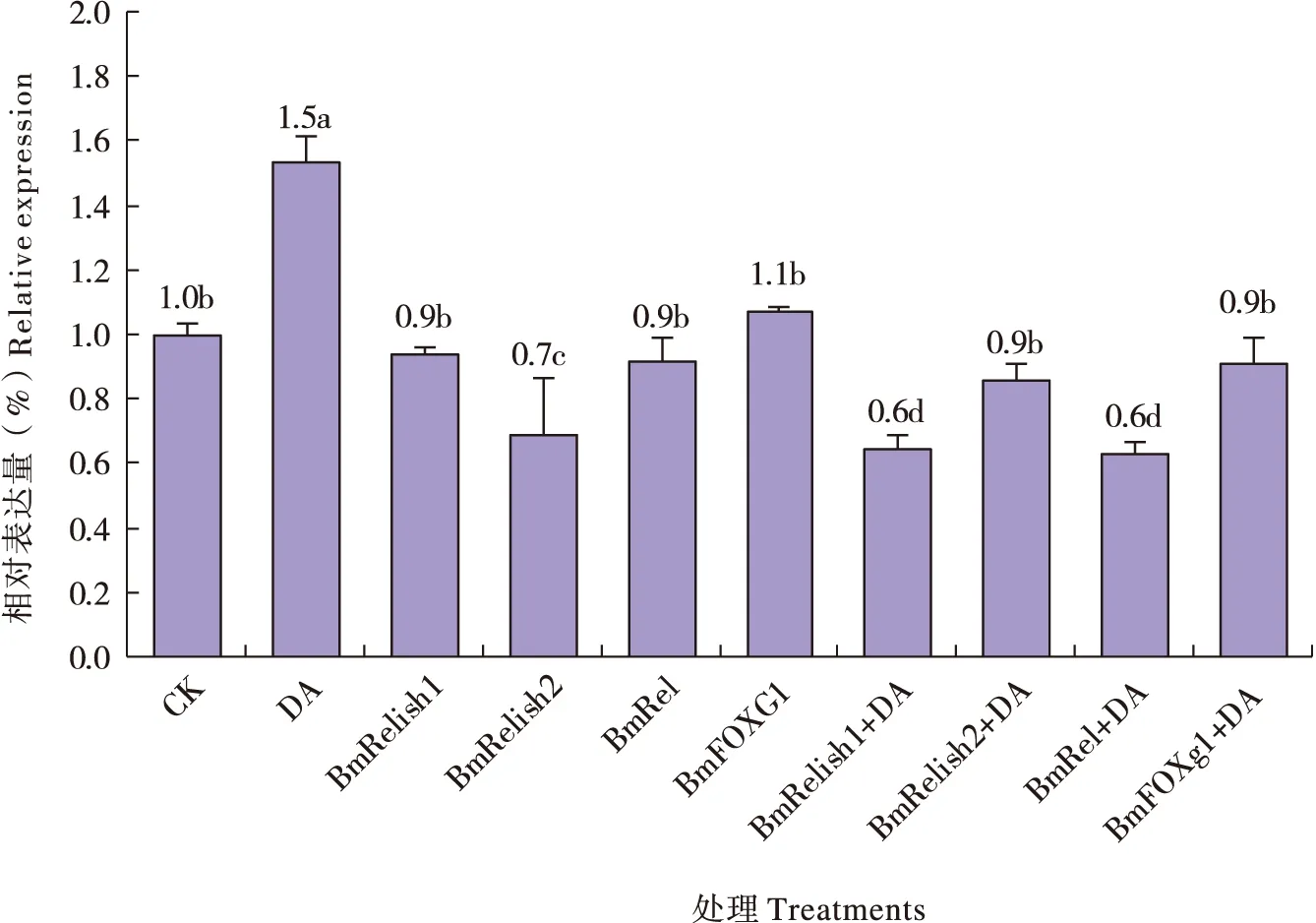
图3 绿僵菌素A与转录因子对抗菌肽gloverin基因Bm_nscaf3098_42表达量的影响Fig. 3 Effect of destruxin A and transcription factors on Bm_nscaf3098_42 gene expression of gloverin 4
3 结论与讨论
实验表明,DA处理Bm12细胞后,cecropin B基因显著上调表达,而gloverin 4基因显著下调表达。家蚕的cecropin 的抗菌谱较广,对革兰氏阴性细菌、阳性细菌及真菌均有活性(孙伟等, 2009; Yangetal., 2011),DA又是虫生真菌-绿僵菌产生的毒素,所以家蚕在DA刺激下,可能激发cecropin B的合成,有利于家蚕抵御虫生真菌的侵染,而gloverin 只对革兰氏阴性细菌具有活性,因此家蚕在DA刺激下不会激发gloverin 4的合成。
沉默转录因子基因BmRelish2后,cecropin B基因Bm_nscaf1071_17显著下调,而沉默 BmRelish1、BmRel和 BmFOXg1转录因子基因后,该基因表达量基本不变。这一结果说明cecropin B的生物合成是通过IMD信号通路调控的,转录因子BmRelish2在发挥着关键作用,而转录因子BmRelish1为什么对cecropin B基因表达影响不显著,也许是因为该基因未参与供试细胞Bm12细胞的IMD信号通路,抑或是其他更复杂的原因。然而,在进一步的转录因子沉默与DA处理联合实验中,先沉默 BmRelish1或 BmRel基因再用DA处理(图2中BmRelish1+DA和BmRel+DA)时,cecropin B基因的表达水平显著低于 BmRelish1、BmRel或DA各自单独处理时的水平,这个结果暗示DA与转录因子BmRelish1或者BmRel之间存在强烈的直接或间接的相互作用,从而强烈抑制cecropin B的合成。毫无疑问,DA与转录因子BmRelish1或者BmRel之间的关系值得进一步深入研究。
已有研究表明,gloverin也是通过TOLL信号通路调控的,因为斜纹夜蛾Spodopteraexigua的Toll基因SeToll被沉默后,gloverin的合成被抑制(Park and Kim, 2012)。但是,本研究发现,转录因子BmRelish2被沉默后,gloverin 4基因显著下调,而沉默转录因子BmRelish1、BmRel和BmFOXg1后,该基因又显著上调,这个结果说明gloverin 4的合成是通过IMD信号通路调控,但TOLL信号通路可能也发挥某些作用,可见抗菌肽合成的调控机理是相当复杂的。先沉默 BmRelish2基因再用DA处理后,gloverin 4基因的表达水平显著高于 BmRelish2或DA单独处理时的水平,这个结果表明,在调控gloverin 4的合成时,DA与转录因子BmRelish2之间存在强烈的直接或间接的相互作用。
总之,本实验发现,绿僵菌素A处理后,引起家蚕Bm12细胞抗菌肽cecropin B基因表达上调和gloverin 4基因表达下调,家蚕细胞在DA刺激后,能够启动cecropin B基因表达,增强其体内的抗真菌能力。沉默转录因子 BmRelish2基因后,cecropin B和gloverin 4基因均下调表达,说明这两种抗菌肽的合成均通过IMD信号通路调控。沉默 BmRelish1或 BmRel基因及DA处理联合作用时,cecropin B基因显著下调,说明在抑制cecropin B的合成时,DA与转录因子BmRelish1或者BmRel之间存在密切的协同效应。同样,在促进gloverin 4的合成时,DA与转录因子BmRelish2之间也存在着协同效应。揭示DA与这些转录因子之间相互作用调控家蚕抗菌肽cecropin B和gloverin 4的合成的机理,将有助于解析绿僵菌素的作用机制及绿僵菌的致病机理,从而有助于真菌生物防治剂的开发与应用。
致谢:感谢华南农业大学动物科学学院曹阳教授馈赠Bm12细胞。
References)
Chen XR, Hu QB, Yu XQ,etal. Effects of destruxins on free calcium and hydrogen ions in insect hemocytes[J].InsectSci., 2014, 21(1): 31-38.
Chen YQ, Li BC, Wu X,etal. The purification and identification of the antibacterial peptides cecropin D and lysozyme from silkworm larave,Bombyxmori[J].JournalofNanjingNormalUniversity(Natural Science), 2006, 29(3): 103-107. [陈玉清, 李保存, 吴希,等. 家蚕抗菌蛋白Cecropin D和Lysozyme的分离纯化及性质鉴定[J]. 南京师大学报 (自然科学版), 2006, 29(3): 103-107]
Chu Y, Zhou F, Zhang MM,etal. Frontiers of research on the innate immune response in insects[J].ChineseJournalofAppliedEntomology, 2013, 50(2): 311-320. [初源, 周帆, 张明明,等. 昆虫天然免疫反应研究前沿[J]. 应用昆虫学报, 2013, 50(2): 311-320]
Fan JQ, Han PF, Chen XR,etal. Comparative proteomic analysis ofBombyxmorihemocytes treated with destruxin A[J].ArchivesofInsectBiochemistryandPhysiology, 2014, 86(1): 33-45.
Gong L, Chen XR, Liu CL,etal. Gene expression profile ofBombyxmorihemocyte under the stress of destruxin A[J].PLoSONE, 2014, 9(5).
Hu QB, Ren SX, Wu JH,etal. Investigation of destruxin A and B from 80 metarhizium starins in China, and the optimization of cultural conditions for the strain MaQ10[J].Toxicon, 2006, 48: 491-498.
Kaneko Y, Furukawa S, Tanaka H,etal. Expression of antimicrobial peptide genes encoding enbocin and gloverin isoforms in the silkworm,Bombyxmori[J].BioscienceBiotechnologyandBiochemistry, 2007, 71(9): 2233-2241.
Kawaoka S, Katsuma S, Daimon T,etal. Functional analysis of four gloverin-like genes in the silkworm,Bombyxmori[J].ArchivesofInsectBiochemistryandPhysiology, 2008, 67(2): 87-96.
Kershaw MJ, Moorhouse ER, Bateman R,etal. The role of destruxins in the pathogenicity ofMetarhiziumanisopliaefor three species of insect[J].JournalofInvertebratePathology, 1999, 74(3): 213-223.
Liu BL, Tzeng YM. Development and applications of destruxins:A review[J].BiotechnologyAdvances, 2012, 30(6): 1242-1254.
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-DELTADELTACT method[J].Methods, 2001, 25(4): 402-408.
Pal S, Leger RJS, Wu LP. Fungal peptide destruxin a plays a specific role in suppressing the innate immune response inDrosophilamelanogaster[J].JournalofBiologicalChemistry, 2007, 282(12): 8969-8977.
Park JA, Kim Y. Eicosanoid biosynthesis is activated via Toll, but not Imd signal pathway in response to fungal infection[J].JournalofInvertebratePathology, 2012, 110(3): 382-388.
Pedras MSC, Zaharia LI, Ward DE. The destruxins:Synthesis, biosynthesis, biotransformation, and biological activity[J].Phytochemistry, 2002, 59(6): 579-596.
Pfaffl MW. A new mathematical model for ralative quantification in real-time RT-PCR[J].NucleicAcidsResearch, 2001, 29: 2002-2007.
Suetsugu Y, Futahashi R, Kanamori H,etal. Large scale full-length cDNA sequencing reveals a unique genomic landscape in a lepidopteran model insect,Bombyxmori[J].G3-GenesGenomsGenetics, 2013, 3(9): 1481-1492.
Sun W, Shen YH, Xiang ZH,etal. Advances in antimicrobial peptide genes in the silkworm,Bombyxmori[J].ScienceofSericulture, 2009, 35(1): 196-203. [孙伟, 沈以红, 向仲怀,等. 家蚕抗菌肽基因研究进展[J]. 蚕业科学, 2009, 35(1): 196-203]
Tanaka H, Ishibashi J, Fujita K,etal. A genome-wide analysis of genes and gene families involved in innate immunity ofBombyxmori[J].InsectBiochemistryandMolecularBiology, 2008, 38(12): 1087-1110.
Tanaka H, Suzuki N, Nakajima Y,etal. Expression profiling of novel bacteria-induced genes from the silkworm,Bombyxmori[J].ArchivesofInsectBiochemistryandPhysiology, 2010, 73(3): 148-162.
Vey A, Matha V, Dumas C. Effects of the peptide mycotoxin destruxin E on insect haemocytes and on dynamics and efficiency of the multicellular immune reaction[J].JournalofInvertebratePathology, 2002, 80(3): 177-187.
Yang WY, Cheng TC, Ye MQ,etal. Functional divergence among silkworm antimicrobial peptide paralogs by the activities of recombinant proteins and the induced expression profiles[J].PLoSONE, 2011, 6(3).
Yi HY, Deng XJ, Yang WY. Gloverins of the silkwormBombyxmori: Structural and binding properties and activities[J].InsectBiochemistryandMolecularBiology, 2013, 43(7): 612-625.
Zhang MM, Chu Y, Zhao ZW,etal. Progress in the mechanisms of the innate immune responses in insects[J].ActaEntomologicaSinica, 2012, 55(10): 1221-1229. [张明明, 初源, 赵章武,等. 昆虫天然免疫反应分子机制研究进展[J]. 昆虫学报, 2012, 55(10): 1221-1229]
Zhou QS, Yu Q, Liu QX. Progress and application prospect of transgenic silkworm[J].ActaEntomologicaSinica, 2011, 54(2): 197-210. [周启升, 于奇, 刘庆信. 转基因家蚕的研究进展及应用前景[J]. 昆虫学报, 2011, 54(2): 197-210]
Effect of destruxin A on expression of cecropin B and gloverin 4 genes of silkworm
HU Wei-Na, HE Guang-Wei, LI Fu-Xia, HU Qiong-Bo*
(College of Agriculture, South China Agricultural University, Guangzhou 510642, China)
Destruxin A (DA), a cyclodepsipeptidic mycotoxin isolated from entomopathogenic fungus,Metarhiziumanisopliae, has anti-immunity activity against insects, but the mechanism of immune regulation is not clear yet. In the current experiment, by means fluorescence quantitative PCR (qPCR), the silkworm cell line Bm12 was used to survey the expression level of antimicrobial peptides cecropin B and gloverin 4 genes after the cells treated with DA or silence of transcription factors in TOLL and IMD signal pathways. The results indicated that the cecropin B gene was up-regulated and gloverin 4 gene was down-regulated after the DA treatment. Respectively silencing transcription factors BmRelish1, BmRelish2, BmRel, BmFOXg1 with specific siRNA, found that after only the transcription factorsBmRelish2 gene was silenced, cecropin B and gloverin 4 genes were all down-regulated. This illustrated that the two antimicrobial peptides were biosynthesized through IMD signal pathway. Furthermore, when the silence of transcription factorsBmRelish1 orBmRelgenes and DA treatment were combined, cecropin B gene was significantly down-regulated, which suggested that there were some synergism between DA and transcription factors BmRelish1 or BmRel to inhibit the biosynthesis of cecropin B. Similarly, there were close synergistic relations between DA and transcription factors BmRelish2 to promote the biosynthesis of gloverin 4.
Destruxins A; Bm12 cell; cecropin; gloverin
1674-0858(2016)05-0984-06
国家自然科学基金面上项目(31272057)
胡维娜,女,1990年生,河南周口人,硕士生,研究方向为昆虫毒力,E-mail: hwn688094@163.com
*通讯作者Author for correspondence, E-mail: hqbscau@scau.edu.cn
Received: 2015-11-11; 接受日期 Accepted: 2016-03-14
Q965;S476
A
