共振能量转移分子显像在生物医学中的应用
2016-11-18聂大红唐刚华
聂大红,唐刚华
(1.中山大学附属第一医院 广东省医用放射性药物转化应用工程技术研究中心,广东 广州 510080;2.中山大学附属第一医院 放疗科,广东 广州 510080;3.中山大学附属第一医院 核医学科,广东 广州 510080)
共振能量转移分子显像在生物医学中的应用
聂大红1,2,唐刚华1,3
(1.中山大学附属第一医院 广东省医用放射性药物转化应用工程技术研究中心,广东 广州 510080;2.中山大学附属第一医院 放疗科,广东 广州 510080;3.中山大学附属第一医院 核医学科,广东 广州 510080)
共振能量转移分子显像(RETI)能显著改善光信号强度和组织穿透性,可用于活体深度组织光学显像。共振能量转移(RET)是指发生在近距离的供体与受体之间的能量转移,包括非放射共振能量转移和放射共振能量转移。RETI是基于共振能量转移的光学成像技术,主要包括荧光共振能量转移显像(FRETI)、生物发光共振能量转移显像(BRETI)、化学发光共振能量转移显像(CRETI)和放射共振能量转移显像(RRETI)。目前,RETI是分子显像研究的热门领域,已用于生物医药学研究各领域。本文对RETI技术原理及其在生物医学中的应用进行综述。
共振能量转移分子显像;荧光共振能量转移;生物发光共振能量转移;化学发光共振能量转移;放射共振能量转移
随着生命科学研究的深入,无论是疾病临床诊疗,还是基础研究,都迫切需要一种高度灵敏、快速、可靠、操作简便、易自动化的分析技术。光学成像(OI)因其高灵敏度、高分辨率、操作简单及经济实用等优点,现已发展成为应用最为广泛的分子影像技术之一,在生物医药学各研究领域和临床浅表组织光学显像方面发挥着独特作用,并在术中导向治疗方面显示巨大应用前景。传统OI存在光信号强度较弱、组织穿透性较差的缺陷,从而限制了进一步发展。基于能量转移的光学成像技术能显著改善OI光信号强度和组织穿透性,倍受人们青睐。共振能量转移(resonance energy transfer, RET)是指发生在距离足够近(一般小于10 nm)的供体与受体之间的能量转移,包括非放射共振能量转移[1-7]和放射共振能量转移(RRET)[8-10]。非放射共振能量转移主要包括荧光共振能量转移(FRET)[2,5-7]、生物发光共振能量转移(BRET)[2]和化学发光共振能量转移(CRET)[3-4];RRET包括内照射共振能量转移[8-10]和外照射共振能量转移[11]。其中,FRET和外照射共振能量转移需要外部射线或光源激发,而BRET、CRET、内照射共振能量转移由内部射线或光源(自发光)激发,不需外部射线或光源。
近年来,共振能量转移分子显像(RETI)是分子显像研究的热点。RETI主要包括荧光共振能量转移显像(FRETI)、生物发光共振能量转移显像(BRETI)、化学发光共振能量转移显像(CRETI)[3-4]和放射共振能量转移显像(RRETI)。本文主要对RETI技术原理及其在生物医学中的应用进行综述并展望发展趋势。
1 共振能量转移分子显像原理
1948年,Foster提出了荧光共振能量转移(FRET)原理。FRET的基本原理是当供体和受体两个荧光发色基团距离小于10 nm,供体分子吸收一定频率光子后被激发到更高的电子能态。在回到基态前荧光能量通过分子间偶极-偶极作用,以非辐射性能量跃迁方式,将供体激发态能量转移到受体激发态能量,实现能量向邻近受体分子转移,即发生能量共振转移[7,12-13]。通过能量共振转移后供体荧光强度降低,而受体可以发射强于本身的特征荧光(敏化荧光),同时也可延长荧光寿命[7,12],实现活体分子显像。通过能量共振转移后受体也可能不发荧光(荧光猝灭),同时也伴随着荧光寿命的相应缩短,不利于分子显像。能量转移效率与供体发射光谱和受体吸收光谱的重叠程度、供体与受体跃迁偶极的相对取向、供体与受体之间的距离等因素有关。FRET发生必须满足以下条件:1) 供体和受体之间的距离必须足够小,一般小于10 nm;2) 供体和受体的发射偶极子和吸收偶极子的方向具有特异性,为了防止振动互相抵消而影响FRET信号的产生,必须保持在一个非90度的角度[12];3) 供体的发射光谱和受体的激发(或吸收)光谱必须重叠,而且重叠要小,以降低背景荧光的干扰。
分子发光的激发模式除了光致发光(荧光)外,还有生物发光、化学发光和放射发光等方式。当存在合适能量的受体时,这些激发模式可以作为供体光源引发共振能量转移。根据其分子发光的激发模式的不同,分为生物发光共振能量转移(BRET)、化学发光共振能量转移(CRET)和放射共振能量转移(RRET)。BRET、CRET和RRET不需要外部激发光源,其共振能量转移原理与FRET相似。共振能量转移效率和供受体间距离的六次方成反比,可用方程式表示[7,14]:
(1)
式中,E为共振能量转移效率,R为供体和受体间的距离,R0为能量转移效率达到50%时供体和受体间的距离。基于以上特征和原理,共振能量转移技术可用于分子显像,实现共振能量转移分子显像(RETI),基本原理示于图1。
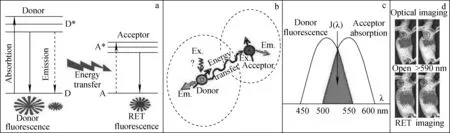
a——供体和受体能级跃迁;b——供体和受体间共振能量转移;c——供体发射光谱和受体激发(或吸收)光谱;d——荧光显像和RET显像图1 共振能量转移分子显像基本原理a——Energy level transition from a donor to an acceptor; b——Resonance energy transfer from a donor to an acceptor;c——Emission spectrum from a donor and excitation spectrum (or absorption spectrum) from an acceptor;d——Fluorescent imaging and RET imagingFig.1 Basic principle of resonance energy transfer molecular imaging
2 共振能量转移分子显像
2.1 荧光共振能量转移分子显像
FRET具有分析速度快、灵敏度高、选择性好、无污染或污染小等优点。利用生物体自身的荧光或者将有机荧光染料标记到目标物上,制成FRET探针,用于核酸检测、蛋白质结构和功能分析、免疫分析、细胞器结构功能检测、糖类分析和药物分析等方面[6,15]。近年来,荧光共振能量转移显像(FRETI)在生物医药学中的应用也得到一定发展。
传统有机荧光染料吸收光谱窄,发射光谱伴有拖尾,影响供体发射光谱与受体吸收光谱的重叠程度,存在供体和受体发射光谱产生相互干扰、荧光寿命短、斯托克斯位移小(易发生发光光谱重叠)和能量转移效率低等缺陷,在一定程度上限制了其应用[15]。将发光量子点用于共振能量转移研究,克服了有机荧光染料的不足之处。纳米材料,特别是量子点(QD)的出现,解决了共振能量转移效率和荧光寿命短的缺陷,使FRET得到不断发展,极大地推动了其在生命科学中的应用[6-7]。另外,一些作为能量受体和反应载体的新型纳米材料如金纳米(AuNPs)、碳纳米管、石墨烯、氧化石墨烯(GO)、稀土金属等[16]的出现,使供受体对之间的转移距离增大,扩大了FRET的应用范围。
目前,一些有机荧光染料已用于活体FRETI。Zou等[17]构建了含供体染料(DiD)和受体染料(DiR)的聚(环氧乙烷)-b-聚苯乙烯(PEO-PS)纳米粒FRET探针(DiD/DiR-PEO-PS),在此基础上将油酸包被氧化铁(IONP)参入DiD/DiR-PEO-PS纳米粒中,制成了IONP-DiD/DiR-PEO-PS探针。活体裸鼠静脉给予DiD/DiR-PEO- PS和IONP-DiD/DiR-PEO-PS后不同时间内行FRETI,结果发现:FRET比率(即IFRET/(IFRET+IDiD))降低,且DiD/DiR释放到细胞膜中较慢,表明无创伤性FRETI可用于研究活体聚合物纳米粒药物释放[17]。Zhang等[18]将近红外荧光(NIRF)供体菁染料Cy5连接在含装载药物的N-(2-羟丙基)甲基丙烯酰胺(HPMA)共聚物骨架主链上,NIRF受体菁染料Cy7连接在酶敏感寡肽(GFLG)侧链末端,构建了含Cy5和Cy7的FRET探针2P-Cy5-Cy7。静脉注射2P-Cy5-Cy7,对荷A2780 人卵巢肿瘤鼠模型进行FRETI。FRET探针在瘤组织高通透性和滞留效应下被肿瘤细胞摄取而积聚在肿瘤中,在组织蛋白酶B(cathepsin B)作用下,酶敏感寡肽GFLG和Cy7间键断裂释放Cy7,扩散到细胞质中代谢和消除,导致FRET信号散失。由于相对分子质量的差异,Cy5标记大分子(Cy5标记含装载药物-HPMA的GFLG联结基)清除较慢,而游离Cy7分子清除相对较快,从而导致Cy5/Cy7摩尔比增加。随着时间延长,受体分子Cy7越少,肿瘤细胞中的能量转移也更少,导致ICy5/IIFRET比率增加。而断裂后形成的Cy5标记含装载药物-HPMA的GFLG联结基,由于相对分子质量较大,可延长药物在体内循环时间,提高肿瘤摄取,最终增强治疗效果。结果表明,FRETI可用于研究大分子治疗剂结合物的酶反应性药物释放[18]。Bouchaala等[19]构建了含长烷基链和四苯硼酸盐离子对的亲脂性菁染料Cy5.5LP和 Cy7.5LP纳米载体FRET探针,用其对活体动物和荷瘤模型行FRETI,结果表明,FRETI可用于研究评估活体纳米载体完整性、药物传递以及影像导向外科治疗。活体QD-FRETI也有较少报道,Li等[20]通过靶向基质金属蛋白酶-2 (MMP-2)特异性多肽底物(GPLGVRGKGG)结合供体QD和受体罗丹明B(RB)或近红外荧光染料 ICG-Der-02(MPA),构建了体外FRET探针540QD-peptide-RB 和活体FRET探针720QD-peptide-MPA,用其分别对活体细胞和荷瘤模型行FRETI,检测MMP-2活性。结果表明,基于QD-FRETI法可高度灵敏和特异地检测酶断裂反应活性。AuNPs、碳纳米管、石墨烯、氧化石墨烯(GO)、稀土金属等纳米材料已用于细胞FRETI,但其活体FRETI尚无文献报道。
2.2 生物发光共振能量转移分子显像
BRET与FRET相比,不会产生细胞光敏、没有荧光团的光漂白和自身荧光背景的影响[15]。BRET技术是基于在某些海生动物体内存在某种酶共振能量转移现象,并导致能量供体和能量受体之间非放射性的能量转移而设计的。BRET的能量供体是发光酶,主要发光酶有萤火虫荧光素酶和海肾荧光素酶(renilla luciferase, Rluc),前者与红色荧光蛋白(RFP)结合可提供红移信号,但缺乏灵敏性和光谱分辨率;后者克服了前者局限性,应用较广。供体发光酶(如Rluc)通过催化氧化底物(如腔肠荧光素)发生化学反应时发射光,受体荧光蛋白或量子点(QD),在一定波长范围内吸收供体发射光,导致受体发射长波荧光,产生BRET[21]。产生BRET的必要条件是供体的发射光谱与受体的吸收光谱应该互相重叠。BRET技术主要用于生物大分子蛋白质相互作用机制、非侵入性活细胞及活体成像等研究[15]。
BRET大致可分为BRET1、BRET2、eBRET和BRET3四类[21-22]。前三类BRET的供体均为Rluc,其差异为底物和能量受体的不同。BRET1使用的荧光素酶底物为腔肠荧光素-h (coelenterazine h),能量受体为增强型黄色荧光蛋白(EYFP);BRET2使用的荧光素酶底物为腔肠素衍生物,即深蓝C (deepblue C),受体为绿色荧光蛋白(GFP);eBRET使用的荧光素酶底物为荧光素酶底物前体EnduRen,该前体可以在活细胞内被酯酶代谢成腔肠荧光素-h。这三类BRET技术主要用于研究生物大分子蛋白质相互作用,其中eBRET具有较大优势,但必需在活细胞内进行检测,仍不能用于活体小动物成像[22]。BRET3技术涉及一个自身发光融合蛋白的构建,该融合蛋白由供体海肾荧光素酶突变体(Rluc8)和受体红色荧光蛋白突变体(mOrange)组成。与其他BRET技术相比,BRET3技术提高了数倍光强度,使光输出发生最大程度的红移(发射波峰为 564 nm),光谱分辨率大约维持在85 nm。因此,BRET3技术能用于单个活细胞中蛋白质-蛋白质相互作用的检测以及活体小动物各种体表和深度组织的显像[22]。为进一步改善BRET3性能,使其更适合于活体小动物比率BRET检测和深度组织显像,Dragulescu-Andrasi等[21]对BRET3技术进行了改进,以海肾荧光素酶突变体RLuc8和RLuc8.6作为供体,两种红色荧光蛋白TagRFP和TurboFP635作为受体,并以合成腔肠素衍生物腔肠荧光素-v(coelenterazine-v)为底物,构建了新的发射红光BRET体系。结果表明,改进的BRET技术可用于荷瘤模型深度组织显像以及在药物筛选和靶标确认方面涉及有关的蛋白质间相互作用研究。
BRET技术主要使用荧光蛋白作为受体,为提高它在细胞和活体内成像的实用性和灵敏度,需要对BRET受体的一些特性如Stokes位移能进行改善。QD可在大于600 nm的波长处发射荧光,且具有较好的生物相容性,容易利用生化方法键合到表达蛋白上,且更容易进入细胞内部。因而,QD可代替荧光蛋白成为新型BRET受体,并已发展成为新一类QD-BRET。Rao等[2]通过化学方法将海肾荧光素酶Luc8偶联到QD表面,Luc8催化氧化底物腔肠荧光素,将生物发光能量转移给QD,导致QD发射长波荧光,首次构建了以Luc8为供体和QD为受体的QD-BRET新体系,已用于活体动物BRETI和蛋白酶活性检测。Kamkaew等[23]以小荧光素酶(NLuc)为供体和QD为受体,Furimazine为底物,构建了QD-NLuc体系,并偶联环状肽cRGD为QD-NLuc-cRGD体系,已成功应用于活体动物内淋巴结和荷瘤模型BRETI。Hsu等[24]建立了一种活体内光动力学治疗(PDT)的BRET新方法,当加入底物腔肠荧光素时,海肾荧光素酶固定的QD-655(QD-RLuc8)产生BRET现象,QD发出的光进一步活化胶束中包裹的光敏剂Foscan,产生活性氧(ROS)杀死癌细胞,有效地抑制了肿瘤细胞生长。
2.3 化学发光共振能量转移分子显像
与FRET不同,CRET与BRET一样,不需要外部激发光源。CRET是由化学发光(CL)底物作为能量供体,将氧化反应产生的能量转移给合适的受体分子,是一个非辐射能量转移过程。主要化学发光体系有鲁米诺(Luminol)、吖啶酯化合物、过氧化草酸酯等,其中Luminol是化学发光体系中最为广泛研究与应用的试剂。一般情况下,在合适氧化剂(如铁氰化钾、过氧化氢、高锰酸钾、高碘酸钾等)和碱性水溶液条件下,可将Luminol 氧化转化为激发态,随后回到基态时发射光最大波长为425 nm[15]。传统CRET主要使用小分子荧光染料作为能量受体,其斯托克斯位移差异小,供受体对发射光谱容易发生重叠,CRET转移效率低。一些纳米材料如多聚纳米粒、QD、AuNPs、石墨烯等作为能量受体,由于具有较大的Stokes位移和较高的能量转移效率,使CRET得到了极大地发展,并在蛋白质和核酸分析以及活体动物显像等领域引起了广泛关注[15]。
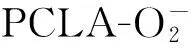
QD相对于有机荧光团具有更长的激发寿命,将QD作为CRET的受体,有机荧光团作为供体产生CRET引起了研究者极大兴趣,但活体QD-CRETI报道仍较少。Huang等[28]于2006年以QD为能量受体和Luminol为能量供体,构建了QD-辣根过氧化物酶(HRP)催化Luminol-H2O2的CL体系,首次建立了QD-CRET分析方法,提出了该催化体系的CL反应机理为化学发光能量转移(CRET)。此后,Zhang等[29]以QD为能量受体和Luminol为能量供体,构建了QD和Luminol混合物(Luminol-R)的CL体系,将该混合物体系注射到荷肺炎或转移性癌症鼠模型体内,首次实现了活体动物QD-CRET显像,成功地检测出深度组织髓过氧物酶(MPO)活性,明显优于检测MPO活性的Luminol-生物发光显像法。为减少QD细胞毒性,Lee等[30]以PEG化的QD(PEG-QD)为能量受体,以具有CL强度比Luminol高100倍的luminol衍生物(L012)为能量供体,在PEG-QD表面修饰L012,设计合成了H2O2-响应的杂交纳米粒探针(HNPs),对荷瘤模型和炎症模型进行了CRETI,取得了较好效果。
2.4 放射共振能量转移分子显像
利用放射性核素衰变所产生的带电粒子在生物组织中产生切伦科夫辐射(CR),对其发射的紫外光到可见光波段进行光学成像探测,即为切伦科夫光学成像(cerenkov luminescence imaging, CLI)[10]。CLI出现后,使用单一放射性核素标记分子探针可同时进行CLI和核素显像双模式成像,推动了多模式成像技术的发展。但是,CLI光信号强度弱和组织穿透性较差。为解决这些难题,利用CR激发荧光团,将CR光信号转换为信号和穿透性更强的红外波段光信号,实现CR-RETI,进而发展为RRETI,从而解决了CLI存在的问题。RRET基本原理与FRET类似,但以放射性同位素衰变(或X射线)为能量供体和荧光团为能量受体,涉及高能粒子通过某种介质诱导瞬时偶极矩,从而实现能量转移[10-11]。外照射共振能量转移显像主要由X射线激发稀土纳米探针如Eu3 +纳米粒引起发光,实现活体光学成像,包括X射线辐射致切伦科夫光成像(X-CLI)[11]和X射线辐射致发光成像(X-Radioluminescence imaging,X-RLI)[31-32]。内照射共振能量转移显像主要有切伦科夫辐射共振能量转移成像(CRRETI)[10]、多种放射性致发光成像(MR-RLI)[33]和γ-射线辐射致发光成像(GR-RLI)[34-35]。RRETI已在肿瘤诊断、疗效评价、靶区确定和导向治疗等方面展现出巨大的应用前景。
RRETI受体主要有QD、金纳米粒和稀土纳米粒。Dothager等[10]采用QD纳米粒的斯托克斯效应,以18F-氟代脱氧葡萄糖(18F-FDG)为能量供体和QD为能量受体,在2010年首先建立了切伦科夫辐射共振能量转移显像(CRRETI)技术,获得了在生物体内产生切伦科夫光红移成波长更长的荧光,也增加了切伦科夫光信号的组织穿透性。同年,Liu等[33]以发射β和γ射线的131I为供体和QD为受体,用发射宽连续波长131I内激发致QD发光,构建了多种放射性照射量子点光学成像,对活体动物进行MR-RLI,进一步丰富了内照射共振能量转移显像理论。Boschi等[36]以发射纯β射线32P-ATP为供体和QD为受体,研究了放射性核素与量子点之间的相互作用机制,结果显示,放射性核素衰变产生的β射线和切伦科夫光都能够激发QD,实现了QD的双重激发,证实了β射线激发QD过程中也存在BRET中易忽视的自由激发光产生荧光(FUEL)机理。大多QD-CRRET系统是基于CL源和QD间的随机相互作用,会导致CL源和QD生物分布间的不匹配。可在QD内掺杂CL源制成自发光64Cu-CdSe/ZnS纳米探针,用于荷瘤模型正电子发射断层(PET)-CRRET双模式显像。基于QD在某些实体瘤中具有高通透性和滞留效应(EPR),64Cu-CdSe/ZnS探针可被动靶向肿瘤组织而被高摄取[8]。为克服QD纳米探针潜在毒性的缺陷,Guo等[37]制成了低毒性QD纳米探针64Cu-CuInS/ZnS,用于荷瘤模型CRRETI,取得了预期效果。为提高QD探针的特异性,Li等[38]制备了靶向整合素受体多功能蛋白质微球(MS)探针64Cu-QD-MS-cRGD,已成功用于动物动脉粥样硬化斑PET和CRRETI显像。为了研制高性能、低毒和良好生物相溶性的RRETI探针,近红外放射性谷胱甘肽包被金纳米粒(GS-198Au-AuNPs)[39]、放射发光198Au掺杂金纳米笼(198Au-AuNCs)[40]和自发光64Cu掺杂金纳米团簇(64Cu-AuNCs)[41]已研制成功,并用于活体动物和荷瘤动物模型PET(或SPECT)和CR-RETI双模式显像,荷瘤组织表现良好金纳米探针摄取。稀土纳米粒也已经用于RETI。Sun等[32]制备了油酸包被Ba0.55Y0.3F2:Eu3+和PEG包被Ba0.55Y0.3F2:Eu3+纳米探针,以X射线为能量供体和Eu3+荧光纳米探针为能量受体,构建了X射线辐射致发光成像,已用于荷瘤模型X-RLI。另外,以18F-FDG为能量供体和Eu3+荧光纳米探针为能量受体,首次建立了18F-FDG激发Eu3+荧光显像方法,实现了荷瘤模型内照射共振能量转移显像。Hu等[35]在此基础上设计和构建了放射性药物(18F-FDG)激发Eu3+荧光显像方法,成功完成了荷瘤模型PET和RRET双模式显像。但该方法利用的是18F-FDG和氧化铕(EO)纳米粒混合探针,实用性有限。Zhan等[34]设计合成了89Zr-Gd2O2S:Eu@PEG纳米探针,以89Zr为能量供体和Gd2O2S:Eu为能量受体,建立了γ-射线辐射致发光成像,成功实现淋巴结定位PET和GR-RLI双模式显像。切伦科夫发光纳米粒猝灭剂也可用于肿瘤PET和CRRETI双模式显像[42],进一步丰富了内照射共振能量转移显像理论。
3 小结与展望
共振能量转移分子显像是分子显像研究的热点领域之一。与传统OI比较,可显著提高OI光信号强度和组织穿透能力,从而可对一定的深度组织实现分子显像,并在生物功能大分子间相互作用研究以及分子显像导向治疗的可视化精准诊疗方面发挥独特作用。但是,FRETI需要外部射线或光源激发,而BRETI、CRETI和RRETI可弥补FRETI不足。BRETI和CRETI也具有一定局限性,其探针系统相对较为复杂,BRETI的能量受体需要结合或修饰发光酶,CRETI的能量受体需要结合或修饰化学发光底物。虽然RRETI涉及放射性,但是最有潜力转化为临床应用的较为简单的RETI技术,且可实现核医学和光学双模式分子显像。目前,以124I和Cy5-C dots分别作为能量供体和能量受体,构建了124I标记含染料Cy5超微无机杂交C点纳米探针124I-cRGDY-PEG-C dots,已用于肿瘤患者PET和光学双模式分子显像,显示出较好的临床应用前景[43]。该工作的完成为相关RETI临床转化应用奠定了基础。
光信号强度、组织穿透性和纳米探针毒性是制约RETI发展和临床转化的关键因素。目前,FRETI外部激发源的选择多样性和新型供体染料的发展,BRETI新型能量供体发光酶和CRETI新型供体化学发光底物的研制,以及RRETI多种优良特性的放射性核素和放射性药物[44]的选择和利用,为提高RETI光信号强度和组织穿透性提供了重要保障。另外,RETI使用的能量受体大多数为纳米材料,随着新型有机染料、低毒QD、AuNPs、石墨烯和稀土金属等纳米材料的出现和发展,有望研发出较为理想的能量受体以及低毒性、良好光信号强度和组织穿透性的新型纳米探针,加快RETI的临床转化应用。
共振能量转化分子显像是RETI发展的必然趋势。光声成像(PAI)是一种在脉冲激光照射下由光能转化为热能再转化为机械能并激发产生光声信号的共振能量转化分子显像技术,可显著改善RETI的光信号强度和组织穿透性,是目前分子影像学最前沿研究领域之一,已用于肿瘤早期检测和治疗监控研究[45]。但PAI需要外部脉冲激光源的激发,研发内部源激发的新型共振能量转化分子显像具有广阔的发展前景。
[1] Liu X, Qiu J. Recent advances in energy transfer in bulk and nanoscale luminescent materials: from spectroscopy to applications[J]. Chem Soc Rev, 2015, 44: 8 714-8 746.
[2] So M K, Xu C, Loening A M, et al. Self-illuminating quantum dot conjugates for in vivo imaging[J]. Nat Biotech, 2006, 24(3): 339-343.
[3] Zhang N, Francis K P, Prakash A, et al. Enhanced detection of myeloperoxidase activity in deep tissues through luminescent excitation of near-infrared nanoparticles[J]. Nat Med, 2013, 19(4): 500-505.
[4] Li P, Liu L, Xiao H, et al. A new polymer nanoprobe based on chemiluminescence resonance energy transfer for ultrasensitive imaging of intrinsic superoxide anion in mice[J]. J Am Chem Soc, 2016, 138: 2 893-2 896.
[5] Geiβler D, Hildebrandt N. Recent developments in forster resonance energy transfer (FRET) diagnostics using quantum dots[J]. Anal Bioanal Chem, 2016, 408(17): 4 475-4 483.
[6] Chou K F, Dennis A M. Forster resonance energy transfer between quantum dot donors and quantum dot acceptors[J]. Sensors, 2015, 15: 13 288-13 325.
[7] Shamirian A, Ghai A, Snee P T. QD-Based FRET Probes at a Glance[J]. Sensors, 2015, 15: 13 028-13 051.
[8] Sun X, Huang X, Guo J, et al. Self-illuminating64Cu-doped CdSe/ZnS nanocrystals for in vivo tumor imaging[J]. J Am Chem Soc, 2014, 136: 1 706-1 709.
[9] Hu H, Huang P, Weiss O J, et al. PET and NIR optical imaging using self-illuminating64Cu-doped chelator-free gold nanoclusters[J]. Biomaterials, 2014, 35: 9 868-9 876.
[10]Dothager R S, Goiffon R J, Jackson E, et al. Cerenkov radiation energy transfer (CRET) imaging: A novel method for optical imaging of PET isotopes in biological systems[J]. PLoS ONE, 2010, 5(10): e13 300.
[11]Axelsson J, Davis S C, Gladstone D J, et al. Cerenkov emission induced by external beam radiation stimulates molecular fluorescence[J]. Med Phys, 2011, 38(7): 4 127-4 132.
[12]Alvarez-Curto E, Pediani J D, Milligan G. Applications of fluorescence and bioluminescence resonance energy transfer to drug discovery at G protein coupled receptors[J]. Anal Bioanal Chem, 2010, 398: 167-180.
[13]Liu X, Qiu J. Recent advances in energy transfer in bulk and nanoscale luminescent materials: from spectroscopy to applications[J]. Chem Soc Rev, 2015, 44: 8 714-8 746.
[14]Peng H Q, Niu L Y, Chen Y Z, et al. Biological applications of supramolecular assemblies designed for excitation energy transfer[J]. Chem Rev, 2015, 115: 7 502-7 542.
[15]张顺超, 沈国励,李合松. 共振能量转移技术在生命科学中的应用研究新进展[J]. 分析科学学报,2015,31(4):560-566.
Zhang Shunchao, Shen Guoli, Li Hesong. Recent advances of application and study on resonance energy transfer technology in life science[J]. J Analyt Sci, 2015, 31(4): 560-566(in Chinese).
[16]Bouccara S, Sitbon G, Fragola A, et al. Enhancing fluorescence in vivo imaging using inorganic nanoprobes[J]. Curr Opinion Biotech, 2015, 34: 65-72.
[17]Zou P, Chen H, Paholak H J,et al. Noninvasive fluorescence resonance energy transfer imaging of in vivo premature drug release from polymeric nanoparticles[J]. Mol Pharmaceutics, 2013, 10: 4 185-4 194.
[18]Zhang R, Yang J, Radford D C, et al. FRET Imaging of enzyme-responsive HPMA copolymer conjugate[J]. Macromol Biosci, 2016, DOI: 10.1002/mabi.201600125.
[19]Bouchaala R, Mercier L, Andreiuk B, et al. Integrity of lipid nanocarriers in bloodstream and tumor quantified by near-infrared ratiometric FRET imaging in living mice[J]. J Control Release, 2016, 236: 57-67.
[20]Li X, Deng D, Xue J,et al. Quantum dots based molecular beacons for in vitro and in vivo detection of MMP-2 on tumor[J]. Biosens Bioelectron, 2014, 61: 512-518.
[21]Dragulescu-Andrasi A, Chana C T, Deb A, et al. Bioluminescence resonance energy transfer (BRET) imaging of protein-protein interactions within deep tissues of living subjects[J]. PNAS, 2011, 108(29): 12 060-12 065.
[22]De A, Ray P, Loening A M, et al. BRET3: a red-shifted bioluminescence resonance energy transfer (BRET)-based integrated platform for imaging protein-protein interactions from single live cells and living animals[J]. FASEB J, 2009, 23: 2 702-2 709.
[23]Kamkaew A, Sun H, England C G,et al. Quantum dot-NanoLuc bioluminescence resonance energy transfer enables tumor imaging and lymph node mapping in vivo[J]. Chem Commun, 2016, 52: 6 997-7 000.
[24]Hsu C, Chen C, Yu H, et al. Bioluminescence resonance energy transfer using luciferase-immobilized quantum dots for self-illuminated photodynamic therapy[J]. Biomaterials, 2013, 34: 1 204-1 212.
[25]Shuhendler A J, Pu K, Cui L, et al. Real-time imaging of oxidative and nitrosative stress in the liver of live animals for drug-toxicity testing[J]. Nat Biotech, 2014, 32(4): 373-380.
[26]Zhen X, Zhang C, Xie C, et al. Intraparticle energy level alignment of semiconducting polymer nanoparticles to amplify chemiluminescence for ultrasensitive in vivo imaging of reactive oxygen species[J]. ACS Nano, 2016, 10: 6 400-6 409
[27]Li P, Liu L, Xiao H, et al. A new polymer nanoprobe based on chemiluminescence resonance energy transfer for ultrasensitive imaging of intrinsic superoxide anion in mice[J]. J Am Chem Soc, 2016, 138: 2 893-2 896.
[28]Huang X, Li L, Qian H, Dong C, Ren J. A resonance energy transfer between chemiluminescent donors and luminescent quantum-dots as acceptors (CRET)[J]. Angew Chem Int Ed, 2006, 45: 5 140-5 143.
[29]Zhang N, Francis K P, Prakash A, et al. Enhanced detection of myeloperoxidase activity in deep tissues through luminescent excitation of near-infrared nanoparticles[J]. Nat Med, 2013, 19(4): 500-505.
[30]Lee E S, Deepagan V G, You D G,et al. Nanoparticles based on quantum dots and a luminol derivative: implications for in vivo imaging of hydrogen peroxide by chemiluminescence resonance energy transfer[J]. Chem Commun, 2016, 52: 4 132-4 135.
[31]Naczynski D J, Sun C, Tuurkcan S, et al. X-ray-induced shortwave infrared biomedical imaging using rare-earth nanoprobes[J]. Nano Lett, 2015, 15: 96-102.
[32]Sun C, Pratx G, Carpenter C M, et al. Synthesis and radioluminescence of PEGylated Eu3+-doped nanophosphors as bioimaging probes[J]. Adv Mater, 2011, 23(24): 195-199.
[33]Liu H, Zhang X, Xing B, et al. Radiation-luminescence-excited quantum dots for in vivo multiplexed optical imaging[J]. Small, 2010, 6(10): 1 087-1 091.
[34]Zhan Y, Ai F, Chen F, et al. Intrinsically Zirconium-89 labeled Gd2O2S:Eu nanoprobes for in vivo positron emission tomography and gamma-ray-induced radioluminescence imaging[J]. Small, 2016, 12(21): 2 872-2 876.
[35]Hu Z, Qu Y, Wang K, et al. In vivo nanoparticle-mediated radiopharmaceutical excited fluorescence molecular imaging[J]. Nat Commun, 2015, 6: 7 560.
[36]Boschi F, Spinelli A E. Quantum dots excitation using pure beta minus radioisotopes emitting Cerenkov radiation[J]. RSC Adv, 2012, 2(2): 11 049-11 052.
[37]Guo W, Sun X, Jacobson O, et al. Intrinsically radioactive [64Cu]CuInS/ZnS quantum dots for PET and optical imaging: improved radiochemical stability and controllable cerenkov luminescence[J]. ASC Nano, 2015, 9(1): 488-495.
[38]Li J, Dobrucki L W, Marjanovic M, et al. Enhancement and wavelength-shifted emission of Cerenkov luminescence using multifunctional microspheres[J]. Phys Med Biol, 2015, 60: 727-739.
[39]Zhou C, Hao G, Thomas P,et al. Near-infrared emitting radioactive gold nanoparticles with molecular pharmacokinetics[J]. Angew Chem Int Ed, 2012, 51: 10 118-10 122.
[40]Wang Y, Liu Y, Luehmann H, et al. Radioluminescent gold nanocages with controlled radioactivity for real-time in vivo imaging[J]. Nano Lett, 2013, 13: 581-585.
[41]Hu H, Huang P, Weiss O J, et al. PET and NIR optical imaging using self-illuminating64Cu-doped chelator-free gold nanoclusters[J]. Biomaterials, 2014, 35: 9 868-9 876.
[42]Thorek D L J, Das S, Jan Grimm J. Molecular imaging using nanoparticle quenchers of cerenkov luminescence[J]. Small, 2014, 10(18): 3 729-3 734.
[43]Phillips E, Penate-Medina O, Zanzonico P B, et al. Clinical translation of an ultrasmall inorganic optical-PET imaging nanoparticle probe[J]. Sci Transl Med, 2014, 6(260): 1-9.
[44]聂大红,唐刚华. 肿瘤氨基酸代谢PET显像研究进展[J]. 同位素,2015,28(4):215-224.
Nie Dahong, Tang Ganghua. Research progress of amino acid metabolism PET imaging in tumor[J]. J Isot, 2015, 28(4): 215-224(in Chinese).
[45]Nie L, Chen X. Structural and functional photoacoustic molecular tomography aided by emerging contrast agents[J]. Chem Soc Rev, 2014, 43(20): 7 132-7 170.
Resonance Energy Transfer Molecular Imaging Application in Biomedicine
NIE Da-hong1,2, TANG Gang-hua1,3
(1.GuangdongEngineeringCenterforTranslationalApplicationsofRadiopharmaceuticals,TheFirstAffiliatedHospital,SunYat-SenUniversity,Guangzhou510080,China; 2.DepartmentofRadiotherapy,TheFirstAffiliatedHospital,SunYat-SenUniversity,Guangzhou510080,China;3.DepartmentofNuclearMedicine,TheFirstAffiliatedHospital,SunYat-SenUniversity,Guangzhou510080,China)
Resonance energy transfer molecular imaging (RETI) can markedly improve signal intensity and tissue penetrating capacity of optical imaging, and have huge potential application in the deep-tissue optical imaging in vivo. Resonance energy transfer (RET) is an energy transition from the donor to an acceptor that is in close proximity, including non-radiative resonance energy transfer and radiative resonance energy transfer. RETI is an optical imaging technology that is based on RET. RETI mainly contains fluorescence resonance energy transfer imaging (FRETI), bioluminescence resonance energy transfer imaging (BRETI), chemiluminescence resonance energy transfer imaging (CRETI), and radiative resonance energy transfer imaging (RRETI). RETI is the hot field of molecular imaging research and has been widely used in the fields of biology and medicine. This review mainly focuses on RETI principle and application in biomedicine.
resonance energy transfer imaging; fluorescence resonance energy transfer; bioluminescence resonance energy transfer; chemiluminescence resonance energy transfer; radiative resonance energy transfer
2016-07-13;
2016-08-09
R817.4
A
1000-7512(2016)04-0248-09
10.7538/tws.2016.29.04.0248
