基于加速器质谱测量的41Ca植物示踪样品制备方法研究
2016-11-18赵庆章姜萍萍林德雨杨宪林庞义俊王小明杨旭冉武绍勇高东升孙科鹏董克君
赵庆章,姜萍萍,林德雨,杨宪林,窦 亮,庞义俊,王小明,张 慧,5,杨旭冉,武绍勇,高东升,李 玲,王 雷,孙科鹏,周 君,董克君,何 明
(1.中国原子能科学研究院,北京 102413;2.山东农业大学,山东 泰安 271018;3.中国核电工程有限公司,北京 100840;4.中核控制系统工程有限公司,北京 100176;5.黑龙江科学院 技术物理研究所,黑龙江 哈尔滨 150086)
基于加速器质谱测量的41Ca植物示踪样品制备方法研究
赵庆章1,姜萍萍3,林德雨4,杨宪林1,窦 亮1,庞义俊1,王小明1,张 慧1,5,杨旭冉1,武绍勇1,高东升2,李 玲2,王 雷2,孙科鹏2,周 君2,董克君1,何 明1
(1.中国原子能科学研究院,北京 102413;2.山东农业大学,山东 泰安 271018;3.中国核电工程有限公司,北京 100840;4.中核控制系统工程有限公司,北京 100176;5.黑龙江科学院 技术物理研究所,黑龙江 哈尔滨 150086)
基于加速器质谱测量方法研究41Ca植物示踪样品的制备。41Ca是宇宙成因核素,半衰期较长,且对植物的代谢具有重要的作用。加速器质谱应用长寿命核素,检测方法具有灵敏度高、放射性剂量小、精度高、测量区间大、示踪周期长等优点。离子源引出束流是衡量加速器质谱灵敏度的重要参数,而较高束流强度的引出束流可以提高加速器质谱的灵敏度。为了获得较高的束流强度,本工作系统研究了41Ca植物示踪样品的湿法、干法、以及湿法和干法相结合的二次氟化法,以建立41Ca植物示踪样品制备流程,确定最高束流强度引出时的最优化41Ca植物示踪样品制备参数,为41Ca植物示踪样品广泛应用提供实验基础。
植物41Ca制备;方法优化;加速器质谱;束流强度
钙参与植物组织中大量的代谢活动。当植物中某些激素分泌紊乱或其他因素影响时,植物组织中钙含量会发生变化,从而导致植物产生各种疾病,对植物中钙代谢研究成为关注的热点[1-4]。41Ca的半衰期(T1/2=1.0×105年)[5]较长,适合钙代谢的长期示踪研究。它是通过电子俘获衰变到41K的基态,放出软X射线和俄歇电子的能量约3 keV,常用衰变计数法无法测量,但可用高灵敏度的加速器质谱法进行分析。
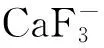
离子源引出束流是衡量加速器质谱灵敏度的重要参数。一般而言,较高束流强度的引出可以提高加速器质谱的灵敏度。本文拟对41Ca植物示踪样品的湿法、干法、以及湿法和干法相结合的二次氟化法进行研究,以建立41Ca植物示踪样品制备流程,确定较高束流强度引出时的最优化的41Ca植物示踪样品制备参数,为41Ca植物示踪的广泛应用提供实验基础。
1 主要仪器与试剂
5840R冰冻离心机:德国,Eppendorf;反应腔体:真空室,真空泵, YZ-60型压力真空表; GSL1300型真空管式高温炉:配备Ar气供气装置(罐),连接管道;强酸性阳离子交换树脂:Dowex50W-X8,400目;1 mm的铝合金靶锥:NEC,美国高压公司生产。
2 实验条件
2.1 束流引出条件
采用加速器质谱测量41Ca实验中,典型的离子源参数列于表1。采用铯溅射强流离子源,注入负一价离子能量115.0 keV,引出电压为15.0 kV,离子源温度约100 ℃。

表1 采用加速器质谱测量41Ca实验中典型的离子源参数Table 1 Typical parameters of ion sources in the 41Ca experiment by accelerator mass spectrometry
2.2 植物样品制备
2.2.1 草酸钙样品制备
取桃树植物样品500 g经过80 ℃烘干后,在玛瑙研钵内研碎。将研碎后的植物组织样品置于瓷坩埚内,在马弗炉中900 ℃灼烧灰化3 h。冷却后用体积比为4∶1的硝酸和双氧水混合溶液消解,蒸发接近干,用去离子水稀释至15 mL。加入等体积饱和草酸铵,加入氨水调节pH约为10,混匀后静置3 h。以3 600 r/min转速离心5 min,倾去上清液,用2 mL 2.5%的草酸胺和2 mL去离子水分别洗涤沉淀3次。
2.2.2 湿法制备CaF2
将制备的草酸钙样品加2 mL 4 mol/L浓盐酸溶解沉淀,用去离子水稀释至15 mL。过阳离子交换(内径6 cm,树脂层高8 cm,事先用10 mL 4 mol/L 盐酸,6 mL 0.08 mol/L盐酸和10 mL去离子水平衡) ,流速控制在1.0~1.5 mL/min。先用15 mL 0.8 mol/L 盐酸洗脱杂质离子,再用4 mol/L Ca2+,收集4.5 mL流出液于15 mL离心管中,加等体积去离子水。加6 mL 氢氟酸,隔夜放置。3 600 r/min离心10 min,用1 mL去离子水洗涤氟化钙沉淀两次,100 ℃烘烤24 h后备用。使用离子交换法进一步排除K+的干扰,有利于进一步提高测量灵敏度,适合CaF-离子的引出[9]。
2.2.3 干法制备CaF2
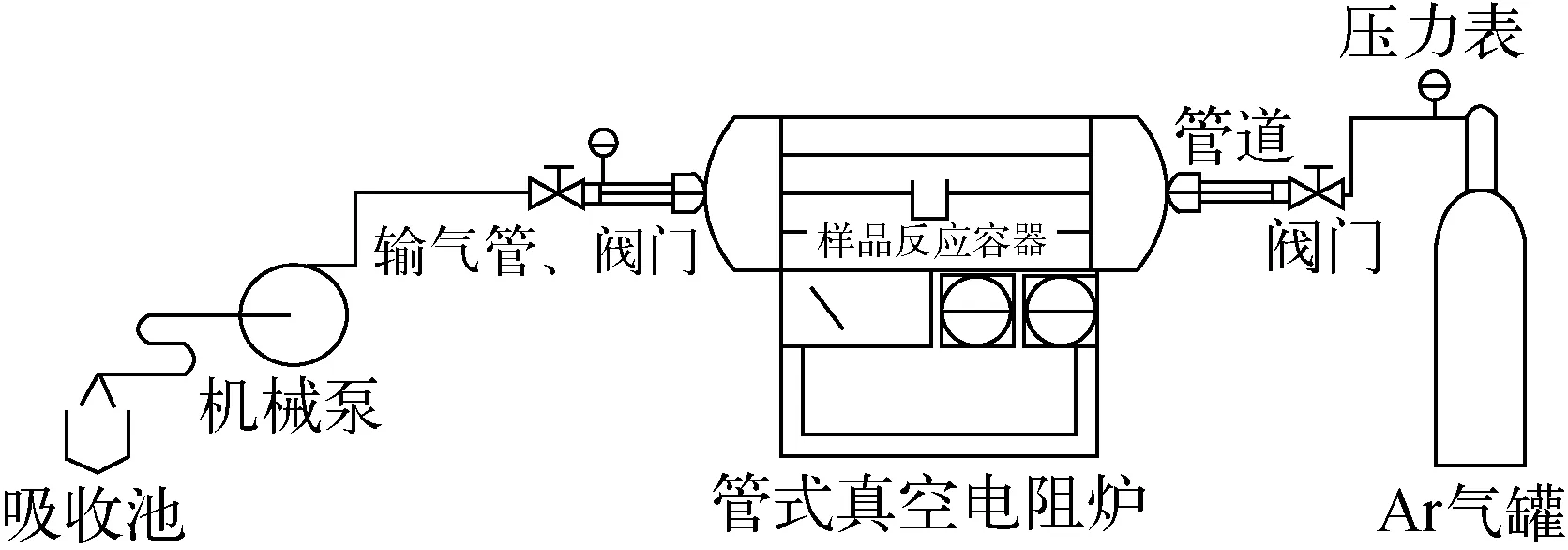
图1 干法反应系统Fig.1 Dry reaction system
将制备的草酸钙样品与过量氟化氢胺样品装入料盒中,固定在支架放入真空炉内(图1);密封真空炉,启动机械泵。抽真空后再充氩气,重复三次后充少量氩气,关闭两端阀门,停真空泵,升温至200 ℃,常压,保温反应4 h后抽真空并缓慢通入氩气,维持系统在缓慢的流气状态;将温度升到250 ℃,分离过量的氟化氢铵和副反应产物氟化铵,在250 ℃温度状态下进行2 h,停止加热,降温;待炉内温度降低后小心取出,立即称重,置于充氩气的干燥皿中备用。
2.2.4 湿法与干法相结合二次氟化法
将炉管进行严格清洗并烘干;将聚四氟乙烯反应小料盒及支架先用硝酸再用氢氟酸各浸泡24 h后,用去离子水冲洗三次以上,烘干备用;加2 mL 4 mol/L浓盐酸溶解湿法制备的草酸钙沉淀,用去离子水稀释至15 mL。取少量上述酸化溶液于离心管中,使用氨水调节pH;静置24 h后,以3 600 r/min的转速离心10 min;即先湿法制得氟化钙,中间省去离子交换过程,简化了制备流程。向制得的氟化钙中加入适量浓氢氟酸,将混合物放入聚四氟乙烯料盒中,固定在支架上放入真空炉内,采用干法设备在氩气浴中90 ℃反应4 h,后升温至150 ℃烘干2 h,停止加热,降温。待炉内温度降低后小心取出,立即称重,置于充氩气的干燥皿中备用。
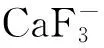

表2 不同CaF2样品的氟氧比Table 2 The ratio of fluorine-oxygen in different CaF2 samples
3 结果与讨论
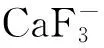
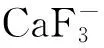
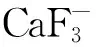
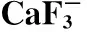
表3 不同条件下束流的引出强度Table 3 The strength of beam current extraction in different conditions
4 结论
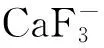
本研究在国内首次建立了基于加速器质谱测量的植物41Ca示踪样品制备的方法,为国内加速器质谱测定植物示踪样品提供实验依据。采用湿法和干法相结合的二次氟化法制备植物组织中41Ca示踪样品,可抵消铯束聚焦不正等问题,有利于引出束流的稳定。
致谢:感谢中国原子能科学研究院北京串列加速器核物理国家实验室的运行工作人员的辛勤劳动。
[1] 谢玉明,易干军,张秋明. 钙在果树生理代谢中的作用[J]. 果树学报,2003,20(5):369-373.
Xie Yuming, Yi Ganjun, Zhang Qiumin. Efects of Calcium in Physiology and M etabolism of Fruit Crops[J]. Journ al of Fruit Science, 2003, 20(5): 369-373(in Chinese).
[2] 车玉红. 钙肥对红富士苹果果实品质及生理生化特性影响的研究[D]. 杨凌:西北农林科技大学,2015.
[3] 陈见晖,周卫. 苹果缺钙对果实钙组分、亚细胞分布与超微结构的影响[J]. 中国农业科学,2014,37(4):572-576.
Chen Jianhui, Zhou Wei. Efect of Calcium Deficiency in Apple (Malus pumila) Fruits on Calcium Fractions, Subcelluar Distribution and Ultrastructure of Pulp Cells[J]. Scientia Agricultura Sinica, 2014, 37(4): 572-576(in Chinese).
[4] 王玲利,刘超,黄艳花,等. ‘黄冠’梨采后热处理和钙处理对其钙形态及细胞壁物质代谢的影响[J]. 园艺学报,2014,41(2):249-258.
Wang Lingli, Liu Chao, Huang Yanhua, et al. Effects of Postharvest Heat and Calcium Treatments on Calcium Fractions and Cell Wall Metabolism of ‘Huangguan’ Pear Fruit[J]. Acta Horticulturae Sinica, 2014, 41(2): 249-258(in Chinese).
[5] Mabuchi H, Takahashi H, Inorg J. The half-life of41Ca[J]. Jour Inor Nucl Chem, 1974, 36: 1687.
[6] Dong K J, He M, Wu S Y, et al. Application of41Ca tracer and its AMS measurement in CIAE[J]. Journal of Chinese Mass Spectrometry Society, 2004, 23(4): 316-318.
[7] Li S H, Jiang S, He M, et al. Measurements of41Ca in biological samples by accelerator mass spectrometry using CaF2target[J]. High Energ Phys and Nucl Phys, 2005, 29(12): 1 210-1 213.
[8] He M, Ruan X, Wu S, et al.41Ca analysis using CaF-in CIAE-AMS system[J]. Nucl Instr Meth B, 2010, 268: 804-806.
[9] 吴绍雷,何明,姜山,等. 加速器质谱测量41Ca 方法改进[J]. 质谱学报,2008(增刊):35-36.
Wu Shaolei, He Ming, Jiang Shan, et al, The Improvement of41Ca Accelerator Mass Spectrometry Analytical Method[J]. Journal of Chinese Mass Spectrometry Society, 2008(suppl.): 35-36(in Chinese).
[10]窦亮.41Ca 标记内源钙库法测量大鼠钙吸收率的方法研究[D]. 北京:中国原子能科学研究院,2014.
[11]Zhao X L, Litherland A E, Eliades J, et al. Studies of sputtered anions I: Survey of MFn.[J]. Nucl Instrum Methods B, 2010, 268: 807-811.
[12]窦亮,何明,董克君,等. 加速器质谱测量岩石样品中41Ca的初步研究[J]. 原子能科学技术,2013,47(12):2 322-2 326.
Dou Liang, HE Ming, Dong Kejun, et al. Preliminary Study of41Ca-AMS Measurement in Rock Samples[J]. Atomic Energy Science and Technology, 2013, 47(12): 2 322-2 326(in Chinese).
Preparation of Plant41Ca Tracer Samples for Accelerator Mass Spectrometry
ZHAO Qing-zhang1, JANG Ping-ping3, LIN De-yu4, YANG Xian-lin1, DOU Liang1, PANG Yi-jun1, WANG Xiao-ming1, ZHANG Hui1,5, YANG Xu-ran1, WU Shao-yong1, GAO Dong-sheng2, LI Ling2, WANG Lei2, SUN Ke-peng2, ZHOU Jun2, DONG Ke-jun1, HE Ming1
(1.ChinaInstituteofAtomicEnergy,Beijing102413,China; 2.ShandongAgriculturalUniversity,Tai’an271018,China; 3.ChinaNuclearPowerEngineeringCO.LTD.,Beijing100840,China; 4.ChinaNuclearControlSystemEngineeringCO.LTD.,Beijing100176,China; 5.TechnicalPhysicsInstituteofHeilongjiangAcademyofSciences,Harbin150086,China)
Calcium plays an important role in the metabolism of plants and animals. In this paper, the preparation method of plant41Ca for accelerator mass spectrometry (AMS) measurement was developed for the first time in China. AMS, with its advantages of high sensitivity, small dose of radioactivity, high accuracy, large measuring range, and long tracer cycle, can be used to measure cosmogenic nuclide41Ca , which has long half-life. The intensity of the beam in ion source is an important parameter for the sensitivity of AMS measurement. The high beam current can improve the sensitivity of AMS. The preparation methods of plant samples of41Ca tracer were systematically studied to obtain high beam current using wet, dry and a combining method with wet and dry re-fluoride. A reliable preparation procedure of plant samples for41Ca tracer and its optimization parameters were determined by testing beam currents of various samples and lay a foundation for the41Ca-AMS technology at plant tracer applications.
plant41Ca; optimization parameters; accelerator mass spectrometry; beam intensity
2016-02-03;
2016-02-28
TL364.5
A
1000-7512(2016)04-0193-05
10.7538/tws.2016.29.04.0193
