软骨脱细胞基质-Ⅱ型胶原纳米支架复合BMSC修复兔关节软骨缺损的实验研究
2016-11-18蒋婷杨泽龙李小兵
蒋婷 杨泽龙 李小兵
软骨脱细胞基质-Ⅱ型胶原纳米支架复合BMSC修复兔关节软骨缺损的实验研究
蒋婷杨泽龙李小兵
目的观察软骨脱细胞基质(Cartilage acellular extracellularmatrix,CAEM)-Ⅱ型胶原(CollagenⅡ,COLⅡ)纳米支架,复合骨髓基质干细胞(B onemarrow stem cells,BMSCs)修复兔关节软骨缺损的效果。方法CAEM和COLⅡ按质量比1∶1混合,通过静电纺丝技术制备组织工程纳米支架。将第二代BMSCs种植到该支架上,培养箱内静置2 h。12只日本大耳白兔随机分为实验组和对照组,将细胞支架复合物植入实验组兔膝关节软骨缺损处,对照组仅行膝关节软骨缺损建模。12周后实验动物取材,大体观察修复效果,并行HE染色、Ⅱ型胶原染色观察。结果大体观察见实验组软骨缺损修复良好,对照组软骨缺损处由肉芽样组织充填。HE染色显示,实验组关节软骨缺损处可见软骨陷窝形成,对照组关节软骨缺损处仅有纤维组织充填。实验组修复区Ⅱ型胶原染色为阳性,对照组为阴性。结论CAEM-COLⅡ纳米支架复合BMSC,对兔关节软骨缺损具有较好的修复能力,具有潜在的临床应用价值。
组织工程Ⅱ型胶原软骨脱细胞基质软骨缺损骨髓基质干细胞
关节软骨缺损的修复一直是临床的难题。目前常用的修复方法主要包括软骨组织移植、骨膜或软骨膜移植、软骨细胞注射移植、组织工程软骨及干细胞移植等,但没有一种理想的修复方法能广泛地应用于临床。种子细胞、支架及诱导因子是组织工程的三大关键因素。本研究以软骨脱细胞基质-Ⅱ型胶原为原料,通过静电纺丝技术制备组织工程软骨纳米支架,再将BMSCs种植于支架上并移植于兔膝关节软骨缺损处,观察该支架细胞复合物修复关节软骨的效果。
1 材料与方法
1.1主要实验动物、试剂及仪器
成年日本大耳兔12只,1周龄日本大耳兔2只,由川北医学院实验动物中心提供。所用动物实验方案均通过川北医学院动物实验管理委员会批准。
三氟乙醇(成都贝斯特试剂有限公司),Trition X-100(北京化学试剂公司),胃蛋白酶(上海蓝季科技发展有限公司),Tris-HCl、高压电源(天津东文公司),恒流注射泵(保定兰格公司),乙二胺四乙酸(EDTA)、碳化二亚胺、DNase、RNase、盐酸胍(Sigma公司,美国)。
扫描电镜(Hitachi公司,日本),CO2培养箱(Thermo公司,美国),真空干燥箱(上海一恒科技有限公司),FD-1冷冻干燥机(北京博医康),Biofuge Primo R低温离心机(Thermo Scientific,美国)。
1.2方法
1.2.1脱细胞基质及支架材料的制备
[1]的方法进行支架制备,将获得的支架剪成直径5 mm圆形,环氧乙烷消毒备用(图1)。
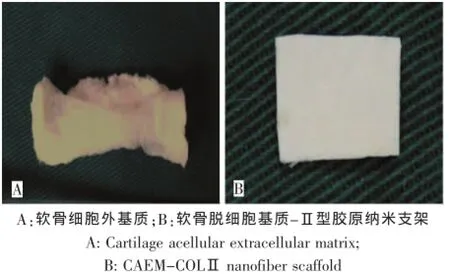
图1 软骨外基质的提取物及纳米支架材料Fig.1 Cartilage acellular extracellular matrix and nanofiber scaffold
1.2.2BMSCs的分离培养
10 m L注射器吸入含肝素的生理盐水2m L,于实验兔股骨髁处穿刺入股骨髓腔,反复缓慢轻揉冲洗髓腔,获取含BMSCs的混悬液。按BMSCs常规分离培养方法,获得第2代BMSCs备用。
1.2.3细胞-材料复合物移植修复关节软骨缺损
将0.5 m L细胞密度为2×106cells/mL的BMSCs接种于一个支架材料上,CO2培养箱培养2 h。12只实验兔随机分为实验组和对照组。麻醉后,膝关节消毒,膝关节外侧髌骨外缘作3 cm切口,分离至关节囊,纵行切开关节囊,将髌骨向内侧脱位,屈曲膝关节,显露股骨髁关节面。于股骨髁间处用电钻作直径5 mm、深度为3mm大小的圆形全层关节软骨缺损,肉眼见缺损处软骨下层微出血及无软骨组织残余即可。实验组将细胞支架复合物移植于关节软骨缺损处。对照组行关节钻孔后缝合伤口即可。术后连续3 d肌注青霉素200万单位预防感染,每天2次,分笼饲养,自由活动。于术后12周取材检测(图2)。
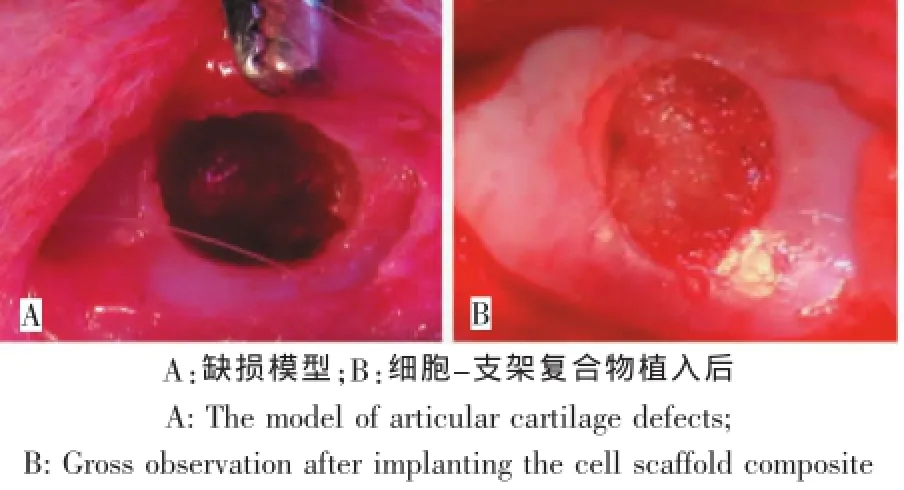
图2 修复缺损模型Fig.2 Repair defectsmodel
取材时,截取股骨远端,观察关节缺损修复情况。4%多聚甲醛将标本固定24 h,脱钙液脱钙2周,每周更换脱钙液2次。常规脱水、石蜡包埋、切片,分别行HE、CollagenⅡ免疫组化染色,观察修复效果。
2 结果
2.1大体观察
对照组兔膝关节软骨缺损处可见少量肉芽组织充填,肉芽组织增生水肿,缺损未完全充填;实验组关节软骨缺损经修复后关节面光滑平整,缺损处由软骨样组织完全覆盖,修复组织的色泽接近正常关节软骨面,软骨缺损处完全被充填,塑形良好(图3)。
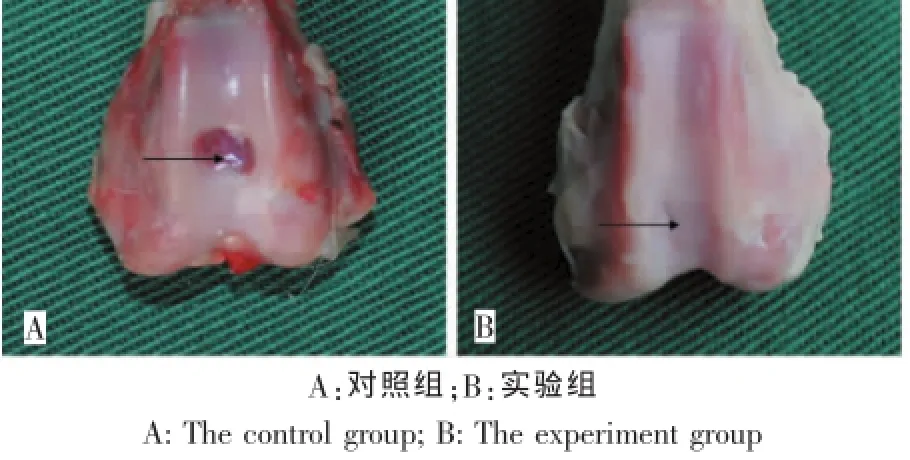
图3 软骨缺损修复(箭头处)大体观察Fig.3 Gross observation of the defect area(the arrow)
2.2HE染色
对照组软骨缺损区被新生组织充填,以纤维结缔组织,结构紊乱不清,无软骨样组织形成;实验组缺损区域被新生软骨样组织充填,缺损处修复较平整,其间可见散在软骨样细胞分布,软骨陷凹形成明显,基本达到组织学修复(图4)。
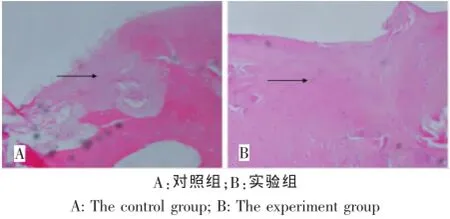
图4 缺损修复区域(箭头处)HE染色(100×)Fig.4 HE Staining of the defect area(the arrow,100×)
2.3CollagenⅡ免疫组化染色
对照组修复组织中CollagenⅡ免疫组化染色不明显,周围正常组织区域CollagenⅡ免疫组化染色呈阳性。实验组缺损修复较平整,缺损区域被修复组织充填,修复组织区域CollagenⅡ免疫组化染色阳性,染色均匀,接近周围正常软骨区域,其间有散在的软骨陷凹形成及软骨细胞分布,与正常的关节软骨相似(图5)。
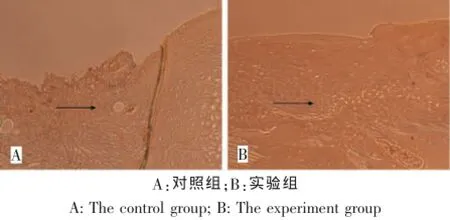
图5 缺损修复区域(箭头处)CollagenⅡ免疫组化染色(100×)Fig.5 Collagen II imm unohistochem ical staining of the defect area(the arrow,100×)
3 讨论
由于正常软骨没有神经血管组织,主要依靠周围组织渗透或从分泌的滑液中摄取营养。软骨细胞代谢缓慢,在正常成熟软骨中几乎不能见到其有丝分裂。软骨缺损不超过钙化层时,其修复主要依靠周围软骨细胞的增殖,其增殖速度非常缓慢且有限,其最终结局为缺损长期存在,或由于磨损使缺损越来越大。一旦缺损超过钙化层,会导致软骨下骨质被损伤,其下方松质骨内存在的未分化的骨髓间充质干细胞进入缺损区域增殖分化,逐渐形成纤维及软骨混合组织修复缺损区域。但这种机制不能使软骨缺损完全修复,尤其当缺损直径超过4mm时,将导致永久性病变[2]。
3.1种子细胞
目前组织工程软骨重建常用的种子细胞有BMSC、ADSC、软骨细胞等,由于软骨细胞自身取材问题,用于组织工程关节软骨缺损的修复受到明显的限制。而其他干细胞,如ADSC,可以通过诱导因子或共培养的方式向软骨表型细胞分化增殖[3],已有用于软骨缺损修复获得成功的报道[4-6],但需通过抽吸、手术等方式获取。我们选择BMSC作为种子细胞,是因为:①BMSC研究相对较多,培养技术成熟;②自体取材方便,可以避免排斥反应,临床应用可能性大;③BMSC相对易于诱导成软骨样细胞,对软骨缺损的修复比较可靠[7-9]。本研究的结果提示,通过软骨脱细胞基质、Ⅱ型胶原制备的支架及关节局部的微环境,将缺损处移植的BMSC成功地诱导成软骨样细胞,并能长期维持其表型,使其分泌特异性的软骨细胞外基质,成功修复了关节软骨缺损。
3.2支架
支架不仅是种子细胞代谢的场所,还决定着重建组织器官的基本形态和功能。目前,组织工程支架主要分为天然生物材料、人工合成材料及两者的混合材料。应用人工合成材料,如PGA、PLA、PLGA等复合种子细胞修复关节缺损获得成功[10-12]。这些材料的生物学性能可通过化学、物理修饰进行调节,具备良好的机械强度。不过其缺乏细胞生长黏附的表面性状,在体内降解后产生的一些低聚物和小分子片段会对细胞造成不同程度的损伤,并具有一定的细胞毒性[13-14],而且降解速度与组织工程化软骨的形成时间难以良好匹配,如聚乙酸和聚-α-羟基酯是高亲水的聚合物,在5周内就有明显的降解;PLGA具备良好的机械性能,但其是疏水材料,降解速度缓慢,在体内3年后仍有残留[15]。以天然原料制备的组织工程支架,具有很高的亲水性、良好的三维立体纤维结构和特有的表面物质,利于软骨细胞的黏附和增殖。细胞外基质中的透明质酸和氨基聚糖及其衍生物材料具有良好的生物相容性,能支持软骨细胞黏附定植,并表达软骨特异性蛋白,保持组织工程软骨结构的完整性。蒋婷等[16]利用Ⅱ型胶原、透明质酸、软骨细胞外基质,通过低温冷冻干燥法制备的组织工程支架,具有良好的理化及生物学性能。本研究所采用的软骨脱细胞基质及Ⅱ型胶原,较完整地保留了软骨细胞外基质的生物学信息,能为BMSC向软骨样细胞方向诱导及表型的维持,提供良好的细胞外环境。通过静电纺丝技术制备的纳米支架,相对其他制备方法而言,更符合软骨细胞外基质的形态学构架,为细胞黏附及增殖提供更加广泛的接触面积,其细胞载荷能力显著提高。实验结果证实,该支架能有效地诱导及维持软骨细胞表型,具有一定的应用价值。但是该支架的机械性能相对不足,需要在以后的研究中进一步改进。
4 结论
CAEM-COLⅡ纳米支架在兔膝关节缺损处能有效地诱导BMSC向软骨样细胞分化,并能较长时间维持其表型,使诱导后的细胞能形成软骨陷凹。该支架复合BMSC对兔关节软骨缺损具有较好的修复能力,在组织工程软骨缺损修复中具有潜在的应用价值。
[1]蒋婷,杨泽龙,李小兵,等.软骨脱细胞基质-Ⅱ型胶原制备组织工程软骨纳米支架的实验研究[J].西部医学,2016,28(8):1056-1059.
[2]窦晓丽,段晓琴,夏玲.骨关节炎:关节软骨退变的相关研究与进展[J].中国组织工程研究与临床康复,2011,1(20):3763-3766.
[3]蒋婷,杨泽龙,刘康,等.体外共培养诱导脂肪干细胞向软骨表型细胞分化及鉴定的实验研究[J].川北医学院学报,2013,28(2): 99-102.
[4]Wang ZJ,An RZ,Zhao JY,et al.Repair of articular cartilage defects by tissue-engineered cartilage constructed with adiposederived stem cells and acellular cartilaginous matrix in rabbits [J].GenetMol Res,2014,13(2):4599-4606.
[5]MehrabaniD,Babazadeh M,Tanideh N,etal.The healing effect of adipose-derived mesenchymal stem cells in full-thickness femoral articular cartilage defects of rabbit[J].Int J Organ TransplantMed,2015,6(4):165-175.
[6]Koh YG,Kwon OR,Kim YS,et al.Adipose-derivedmesenchymal stem cells with microfracture versusmicrofracture alone:2-year follow-up of a prospective randomized trial[J].Arthroscopy,2016, 32(1):97-109.
[7]Araki S,Imai S,Ishigaki H,et al.Improved quality of cartilage repair by bone marrow mesenchymal stem cells for treatment of an osteochondral defect in a cynomolgusmacaquemodel[J].Acta Orthop,2015,86(1):119-126.
[8]李新江,方艳伟,张爱民,等.骨髓间充质干细胞-生物蛋白胶复合物修复兔膝关节软骨缺损[J].中华创伤杂志,2015,31(6):563-567.
[9]王岩,李德华.骨髓间充质干细胞复合多肽凝胶及成软骨生成因子修复兔关节软骨缺损[J].中国组织工程研究,2015,19(1):30-36.
[10]Chang NJ,Lin CC,Shie MY,et al.Positive effects of cell-free porous PLGA implants and early loading exercise on hyaline cartilage regeneration in rabbits[J].Acta Biomater,2015,28:128-137.
[11]Zhang K,Zhang Y,Yan S,et al.Repair of an articular cartilage defect using adipose-derived stem cells loaded on a polyelectrolyte complex scaffold based on poly(l-glutamic acid)and chitosan[J].Acta Biomater,2013,9(7):7276-7288.
[12]熊高鑫,查振刚,谭文成,等.PLGA复合Ⅱ型胶原和生长因子诱导组织工程软骨修复兔关节软骨缺损[J].中山大学学报,2010, 31(3):315-320.
[13]LiWJ,Richard T,Chukwuka O.A three-dimensional nanofibrous scaffold for cartilage tissue engineering using humanmesenchymal stem cells[J].Biomaterials,2005,26(6):599-609.
[14]Liao J,Guo X,Grande-Allen KJ,et al.Bioactive polymer/extracellularmatrix scaffolds fabricated with a flow perfusion bioreactor for cartilage tissue engineering[J].Biomaterials,2010,31(34): 8911-8920.
[15]Chung C,Burdick JA.Engineering cartilage tissue[J].Adv Drug Deliv Rev,2008,60(2):243-262.
[16]蒋婷,杨泽龙,李凌云,等.Ⅱ型胶原-透明质酸-软骨脱细胞基质制备组织工程软骨支架的实验研究[J].西部医学,2013,25(8): 1132-1135.
CAEM-COLⅡN anofibe r Scaffolds Com posite w ith BM SCs in Repairing Ar ticular Car tilage Defect of Rabbits
JIANG Ting1,YANG Zelong2,LIXiaobin1.1 Department of Burn and Plastic Surgery;2 Department of Orthopaedic Surgery, Nanchong Central Hospital,The Second Clinical College of North Sichuan Medical College,Nanchong 637000,China.
Objective To observe the effect of CAEM-COLⅡnanofiber scaffolds composite with BMSCs in repairing articular cartilage defectof rabbits.Methods Cartilage acellular extracellularmatrix(CAEM)and collagenⅡ(COLⅡ)were mixed according to the ratio of 1∶1,nanofiber scaffolds were prepared by electrostatic spinning for cartilage tissue engineering.The second generations of bonemarrow stem cells(BMSCs)were inoculated onto the scaffolds.The cell scaffold composite was placed in the incubator for two hours.12 Japanese white rabbitswere randomly divided into the experimental group and the control group.In the experimental group,the cell scaffold composite was implanted into the articular cartilage defects of rabbits.In the control group,only the knee joint cartilage defects weremade.After 12 weeks,the animals were sacrificed and the repair effect was observed by gross appearance,HE staining and collagen typeⅡstaining.Resu lts General shape observation showed that cartilage defects in the experimental group were repaired well,and were filled with granulation tissue in the control group.HE staining showed that cartilage cavities formed in articular cartilage defects in the experimental group,and fibrous tissues were filled in the control group.In the repair area,collagen typeⅡstaining was positive in the experimental group,and negative in the control group.Conclusion The CAEM-COLⅡnanofiber scaffolds composite with BMSCs could well repair the articular cartilage defects of rabbits,and have potential of application in tissue engineering cartilage.
Tissue engineering;CollagenⅡ;Mixing cartilage acellular extracellularmatrix;Cartilage defect; Bonemarrow stem cells
Q813.1+2
A
1673-0364(2016)05-0281-04
10.3969/j.issn.1673-0364.2016.05.003
国家自然科学基金青年基金(81301568);川北医学院博士科研启动基金(CBY15-QD03)。
637000四川省南充市南充市中心医院,川北医学院第二临床学院烧伤整形美容外科(蒋婷,李小兵),骨科(杨泽龙)。
(2016年4月12日;
2016年5月29日)
