双层细菌纤维素基组织工程尿道支架的设计与初步构建
2016-11-18李喆吕向国王宝秀冯超陈仕艳颜志勇王华平
李喆 吕向国 王宝秀 冯超 陈仕艳 颜志勇 王华平
双层细菌纤维素基组织工程尿道支架的设计与初步构建
李喆吕向国王宝秀冯超陈仕艳颜志勇王华平
目的设计并构筑具有模拟尿道组织微环境的三维微/纳支架材料。方法通过对尿道脱细胞基质多尺度结构分析,设计仿尿道组织的双层细菌纤维素(Baterial cellulose,BC)基微/纳组织工程尿道支架。采用模板合成法,以明胶多孔支架为模板,在其上静态培养制备兼具微米多孔与纳米纤维的双层BC基微/纳支架材料。结果双层BC基微/纳支架材料的致密层为细菌纤维素膜,疏松层为相互连通的多孔结构,平均孔径为(167±56)μm,同时在其微米级孔壁表面修饰着模拟天然细胞外基质(Extracellularmatrix,ECM)结构的纳米纤维网络,纳米纤维直径为(20~40)nm。结论采用模板合成法,成功构建出了兼具宏观双层结构、微米级多孔和纳米级纤维的双层BC微/纳组织工程尿道支架。
尿道组织工程脱细胞基质细菌纤维素多尺度结构
组织工程支架的设计初衷就是模拟细胞的体内微环境,包括介观尺度、微米尺度以及纳米尺度的物理结构和化学组成,能够影响细胞的生长[1]。由天然组织经脱细胞处理得到的脱细胞基质是由相互交错的纳米纤维构成的兼具微米多孔与纳米纤维的网络结构,这一微/纳结构能够支持细胞并且影响细胞行为,持续影响细胞形成组织及器官[2-4]。因此,从结构角度出发,模拟细胞体内微环境,选择合适的材料构建从纳米尺度到微观尺度可控的,具有三维微/纳多孔结构的支架材料,是组织工程支架发展的趋势[5]。
我们通过模拟尿道组织微环境,系统研究了尿道脱细胞基质的多尺度结构,进一步设计、构建了仿尿道组织结构的双层微/纳组织工程尿道支架。以多孔明胶支架材料为骨架,复合能够模拟细胞外基质三维纳米网络结构的细菌纤维素(Bacterial Cellulose,BC),最终形成“上致密下疏松”的双层BC基微/纳支架。
1 材料与方法
1.1实验试剂和仪器
木葡糖酸醋杆菌1.1812(中国科学院微生物研究所);葡萄糖,蛋白胨,柠檬酸,磷酸氢二钠,磷酸二氢钾,酵母膏,氢氧化钠,戊二醛(国药集团化学试剂有限公司);明胶,氢氧化铵,Triton X-100(Sigma公司,美国)。
超纯水制备系统(Siemens公司,德国);场发射扫描电镜(Hitachi公司,日本)。
1.2尿道脱细胞基质的制备
从阴茎全切手术中获得正常人体的球部尿道标本1例,尿道组织浸泡在含有1%Triton X-100和0.1%氢氧化铵的脱细胞液中,37℃下震荡14 d,每3天换1次液。然后用超纯水清洗震荡5 d,放入-20℃冰箱冷冻12 h,将样品冷冻干燥24 h,得到尿道脱细胞基质。
1.3双层微/纳组织工程尿道支架的制备
菌种:木葡糖酸醋杆菌(Gluconacetobacterxylinus)1.1812;发酵培养基:葡萄糖5%,蛋白胨0.5%,柠檬酸0.1%,磷酸氢二钠0.2%,磷酸二氢钾0.1%,酵母膏0.5%,氢氧化钠调至pH 5.0,并在121℃、0.1MPa下灭菌30 min[6]。多孔明胶支架:由2%明胶溶液经冷冻干燥,戊二醛(2%)交联得到。
将多孔明胶支架浸入75%乙醇中,室温消毒1 h,然后用发酵培养液清洗3次。平头镊子缓慢挤压明胶模板,并将压出的培养液用无菌滤纸吸取。将多孔明胶支架放入方型培养皿中,取40 mL含有G.xylinus菌种的发酵培养液缓慢滴加在明胶模板上,然后将方型培养皿放入恒温培养箱中,30℃发酵培养7 d,灭菌、清洗去除复合物中的残余培养基和细菌残骸,得到双层BC基组织工程尿道支架(BC-Gel/ BC)。
1.4评价方法
样品的微观形貌结构采用Hitachi S-4800场发射扫描电镜(FE-SEM)进行观察。将冷冻干燥后的测试样品表面经离子溅射仪喷金镀膜后,用FESEM观察样品上、下表面及截面结构。用图像处理软件Image J测量FE-SEM照片中微孔孔径与纳米纤维直径,并用Origin软件统计、分析平均微孔孔径、孔径分布、纳米纤维直径及直径分布(n=200)。
采用液体排除法测量孔隙率。将冷冻干燥后的样品浸入超纯水中48 h,用公式P(%)=(W2-W1)/ (ρ×V)计算样品的孔隙率。其中W 1为浸水前干燥样品重量,W 2为浸水后重量,V为样品体积,ρ为超纯水密度。
2 结果
2.1尿道脱细胞基质微/纳结构分析
首先对尿道脱细胞基质的形貌和结构进行了大体观察。尿道组织为中空管状,由内到外依次为尿道腔、黏膜层和海绵体层,其中上皮层与海绵体层之间存在着黏膜下层(基底层),整个尿道组织被浆膜层所包裹(图1A)。尿道组织经脱细胞处理后得到尿道脱细胞基质,其宏观形状为中空管状体,内部呈多孔海绵状(图1B)。进一步通过FE-SEM观察发现,尿道脱细胞基质的管壁厚度为(3.5±0.8)mm,较薄处厚度仅为(2~3)mm,较厚处达(4~5)mm。管壁主要为疏松多孔结构(组织结构主要为海绵体层),其孔径在(100~300)μm,内侧管壁为致密结构(上皮层)。

图1 尿道组织结构示意图(A)及尿道脱细胞基质大体形貌(B)、FE-SEM图像(C)Fig.1 Schem atic structure of urethral tissue(A),digital photographs(B)and FE-SEM(C)images of urethral acellularmatrix
对于尿道脱细胞基质的多孔疏松区域形貌分析,在微米尺度上,我们发现其截面均为多孔海绵结构,整个多孔海绵结构是由微米级的大孔,孔孔连接而成(图2)。孔壁上有一定的粗糙感,并且在孔孔连接处及部分孔壁处观察到细小纤维状结构。通过分析得出微米级孔洞的平均孔径为(146±30)μm。进一步观察其超微米级结构(图3 A1-A3),我们发现上述的细小纤维状结构均是由细胞外基质的纳米级纤维构成的。同时,对微米级多孔的孔壁进一步观察也可看到相对致密的纳米纤维(图3 B1-B3)。也就是说,尿道脱细胞基质的多孔疏松层完全是在纳米网状纤维基础上组装而成的微米级多孔结构,经测量其纳米纤维平均直径为(30.2±6.6)nm(表1)。
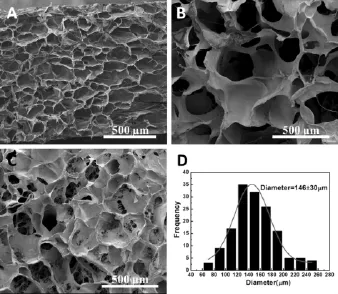
图2 尿道脱细胞基质多孔疏松区的FE-SEM图像(A-C)及微孔孔径分布(D)Fig.2 FE-SEM images(A-C)and themicropore diameter distribution(D)of urethral acellular matrix in porous section
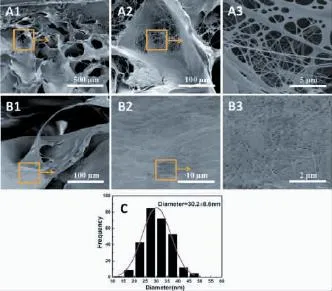
图3 尿道脱细胞基质多孔疏松区不同倍率的FE-SEM图像(A 1-3,B1-3)及纳米纤维直径分布(C)Fig.3 FE-SEM im ages of urethral acellular m atrix in porous section with differentmagnifications(A1-3,B1-3)and the nanofiber diameter distribution(C)
对尿道脱细胞基质内侧管壁的致密结构(上皮层)进行观察(图4),发现内侧管壁的微米级结构较为平整、光滑,未观察到类似疏松层的细小纤维状结构,厚度约为20μm左右。对致密层结构分级放大观察,最终发现尿道脱细胞基质内侧管壁也是由平均直径为(24.6±5.0)nm的纳米纤维密集交错排列而形成的,且纳米纤维密度非常高,纤维与纤维之间几乎看不到微孔,其最大孔洞低于50 nm(表1)。
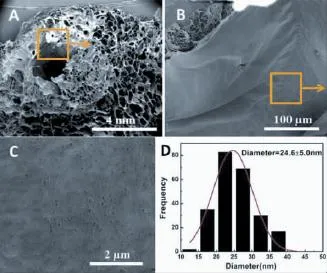
图4 尿道脱细胞基质致密层的FE-SEM图像(A-C)与纳米纤维直径分布(D)Fig.4 FE-SEM images(A-C)and the nanofiber diameter distribution(D)of urethralacellularmatrix in com pactsurface
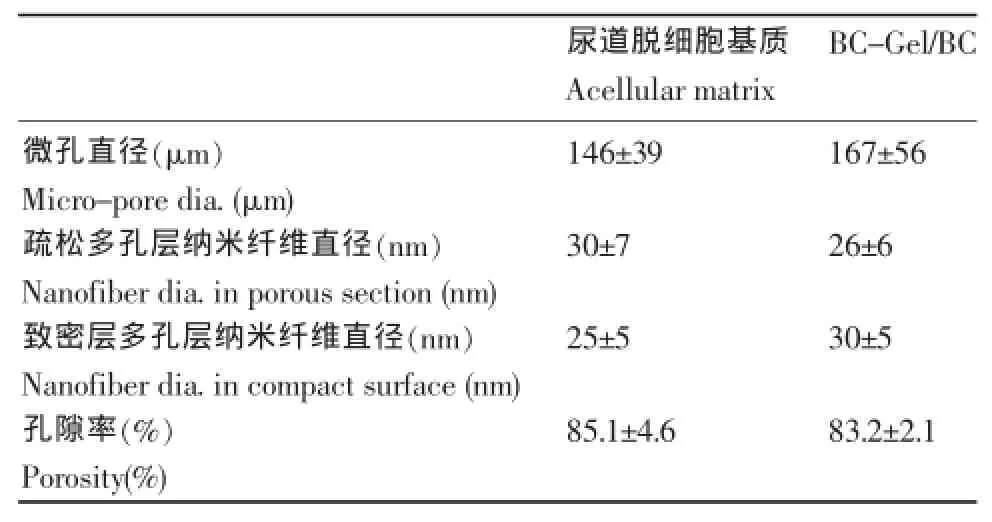
表1 双层BC-Gel/BC支架和尿道脱细胞基质的结构分析Table 1 Structure analysis of BC-Gel/BC bilayer scaffolds and urethral acellularmatrix
2.2双层细菌纤维素微/纳组织工程尿道支架制备
采用模板合成法,选择平均孔径为(179±69)μm、孔隙率为84.5%的明胶多孔支架为模板。将5 mm厚度明胶多孔支架放置在培养皿中,培养7 d,最终得到具有“上致密下疏松”结构的双层BC微/纳支架(BC-Gel/BC)。支架截面FE-SEM图像可以清楚观察到,其上表面有一层平均厚度为(985±141)μm的BC纳米纤维膜,并且形貌与单纯BC膜形貌相似,都是由纤维素的纳米纤维网层层堆积而成的多层形貌,说明形成了较为致密的BC纤维层(图5A1-A3),孔隙率约为83%,略低于明胶模板和尿道脱细胞基质的孔隙率,这可能是致密层较厚引起的。进一步观察双层支架的多孔疏松层,发现在明胶多孔支架的孔壁上均匀分布着BC纳米纤维。观察BC-Gel/ BC支架大孔中BC纳米纤维的形貌发现(图5B1-B3),其纳米纤维结构与单纯BC相似,是由较高长径比纳米纤维随意交织形成类似天然ECM的三维纳米网络结构,其平均纳米纤维直径为(20~40)nm。

图5 双层BC微/纳支架致密层(A1-A3)和疏松多孔层(B1-B3)的截面FE-SEM图像Fig.5 FE-SEM images of BC-Gel/BC bilayer scaffolds in dense layer(A 1-A3)and porous layer(B1-B3)
3 讨论
构筑具有模拟尿道组织微环境的支架材料,是尿道组织工程支架材料的主要设计出发点[7-8]。为了更好地了解尿道组织中各细胞生长所在的微环境,我们首先将正常尿道组织进行了脱细胞处理,采用FE-SEM观察,并系统分析了脱细胞基质的微/纳结构。由此得知,尿道脱细胞基质为非对称双层结构,其内壁为厚20μm左右的黏膜层,由较高密度纳米纤维组成,纳米纤维平均直径为(24.6±5.0)nm;外壁为纳米网状纤维组装而成的微米级多孔结构,孔径为(146±30)μm,组成其微米级大孔的纳米纤维平均直径为(30.2±6.6)nm;尿道脱细胞基质的整体壁厚为(4~5)mm,孔隙率为85%。同时,我们研究发现,尿道脱细胞基质的微观结构的基本微/纳结构尺度变化不大。
理想的组织工程支架除需要具备搭载细胞、提供力学支撑等作用外,还需要高度拟合不同组织的细胞外基质特定的空间结构,并拥有能够选择性促进细胞黏附、影响细胞增殖与分化、引导细胞定向爬行和促进组织快速血管化的作用。在组织工程尿道重建中,通常采用卷管尿道成形术,将片状材料卷绕在硅胶导尿管上形成管状以达到组织修复的目的。因此,对于组织工程尿道支架,需要构筑高度拟合尿道脱细胞基质所特有的致密-多孔疏松的微/纳结构,制备双层片状材料:在微米尺度的整体结构设计上必须尽可能与尿道实际组织学结构相近,其致密层(Dense layer)需要设计较小孔径的纳米纤维层,以达到承载上皮细胞并担当尿液屏障的功能;而多孔疏松层(Porous layer)的海绵体结构,应当设计兼具表面纳米纤维与微米多孔的三维微/纳结构,具有足够的微米级孔径以保证细胞、氧分、代谢产物和生物活性因子的渗透,同时表面黏附的纳米纤维能够提高表面蛋白吸附能力,从而促进细胞黏附、增殖并引导细胞进入支架内部,促进血管化形成,即双层微/纳结构支架(图6)。
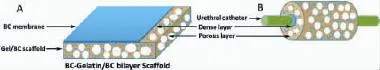
图6 双层BC微/纳组织工程支架(A)及材料卷绕于导尿管的示意图(B)Fig.6 Schematic illustration of BC-Gel/BC bilayer scaffolds for tissue-engineeing urethra(A)and the bilayer scaffold tubularized by suturing an urethral catheter(B)
前期研究中,我们通过模板合成法,以多孔支架材料为骨架,使菌种在其上进行自组装,形成BC纳米纤维网络,最终形成兼具三维多孔及纳米纤维网络的三维BC微/纳支架[9]。制备的BC微/纳支架(Gel/ BC支架)兼具三维微米级多孔和纳米纤维网络结构,并可对其微米级尺度、纳米级尺度结构进行调控,从而进一步促进细胞黏附、影响细胞增殖、引导细胞定向爬行以及促进组织快速血管化。微米尺度上,多孔模板可以根据需要对宏观形貌、孔径大小、孔径分布等结构进行制备;纳米尺度上,BC纳米纤维网络结构、纤维直径与尿道脱细胞基质中的纤维非常接近,并且可以通过发酵培养条件,调节BC纤维直径密度与形貌。因此,为了制备双层BC微/纳组织工程尿道支架,我们设计将Gel/BC支架作为双层组织工程支架的多孔疏松层;同时利用单纯BC相对致密的结构特点,将单纯BC作为双层组织工程支架的致密层。最终设计的双层组织工程支架(图6A),上层为致密层,由单纯BC膜构成;下层为多孔疏松层,以明胶多孔支架为模板,制备兼具三维多孔及纳米纤维网络的三维BC微/纳支架(Gel/BC)。在组织修复中,可将双层支架卷绕在导尿管上,形成类似于尿道脱细胞基质的管状结构(图6-B)。所设计的组织工程尿道支架材料是由单纯BC膜作为致密层,其厚度约为50μm(最佳为20μm左右),组成其结构的BC纳米纤维直径应在(20~40)nm;明胶多孔支架为模板,制备Gel/BC微/纳支架作为多孔疏松层,其中明胶模板平均孔径150μm左右,BC纳米纤维直径30 nm左右;整体支架厚度5 mm左右。
采用模板合成法,选择平均孔径(179±69)μm,孔隙率84.5%的明胶多孔支架为模板。将5mm厚度明胶多孔支架放置在培养皿中,培养时间为7 d,最终得到具有“上致密下疏松”结构的双层BC微/纳支架(BC-Gel/BC)。致密层为纳米纤维构成的BC膜,疏松层为兼具微米多孔及纳米纤维网络的多孔Gel/BC支架,其中微孔孔径为(167±56)μm,纳米纤维直径为(20~40)nm。这种微/纳结构,能够提高明胶孔壁的比表面积与表面粗糙度,将有效提升支架材料的生物学性能。研究证实,纳米级纤维与多孔结构能够显著影响细胞与材料之间的相互作用,从而进一步影响细胞行为[10-11]。下一步我们将尝试对双层支架的致密层厚度进行调控,使其控制在50μm左右,并进一步对支架的力学性能、细胞相容性、增殖情况等进行评估,以期最终应用于尿道组织的修复与重建中。
[1]StevensMM,George JH.Exploringand engineering the cellsurface interface[J].Science,2005,310(5751):1135-1138.
[2]Alves NM,Pashkuleva I,Reis RL,etal.Controlling cell behavior through the design of polymer surfaces[J].Small,2010,6(20): 2208-2220.
[3]Khang D,Carpenter J,Chun YW,et al.Nanotechnology for regenerative medicine[J].Biomedical Microdevices,2010,12(4):575-587.
[4]Andersson AS,Bäckhed F,Von Euler A,et al.Nanoscale features influence epithelial cellmorphology and cytokine production[J]. Biomaterials,2003,24(20):3427-3436.
[5]Zhang Z,Hu J,Ma PX.Nanofiber-based delivery of bioactive agentsand stem cells to bone sites[J].Adv Drug Deliv Rev,2012, 64(12):1129-1141.
[6]Li Z,Wang L,Chen S,et al.Facilely green synthesis of silver nanoparticles into bacterial cellulose[J].Cellulose,2015,22(1): 373-383.
[7]Wang J,Valmikinathan CM,Liu W,et al.Spiral-structured, nanofibrous,3D scaffolds for bone tissue engineering[J].J Biomed Mater Res A,2010,93(2):753-762.
[8]Wang X,Ding B,LiB.Biomimetic electrospun nanofibrous structures for tissue engineering[J].MaterToday,2013,16(6):229-241.
[9]Huang JW,Lv XG,Li Z,et al.Urethral reconstruction with a 3D porous bacterial cellulose scaffold seeded with lingual keratinocytes in a rabbitmodel[J].Biomed Mater,2015,10(5):055005.
[10]Song J,Tang A,Liu T,et al.Fast and continuous preparation of high polymerization degree cellulose nanofibrils and their threedimensionalmacroporous scaffold fabrication[J].Nanoscale,2013, 5(6):2482-2490.
[11]Alamein MA,Liu Q,Stephens S,et al.Nanospiderwebs:artificial 3D extracellular matrix from nanofibers by novel clinical grade electrospinning for stem cell delivery[J].Adv Healthc Mater, 2013,2(5):702-717.
Design and Fabrication of Abacterial Cellulose Bilayer Scaffold for Urethral Tissue Engineering
LI Zhe1,2,LV Xiangguo3,WANG Baoxiu1,FENG Chao3,CHEN Shiyan1,YAN Zhiyong2,WANG Huaping1.1 State Key Laboratory for Modification of Chem ical Fibers and Polymer Materials,College of Materials Science and Engineering,Donghua University, Shanghai 201620,China;2 Materials and Textile Engineering College,Jiaxing University,Jiaxing 314001,China;3 Department of Urology,Affiliated Sixth Peop le's Hospital,Shanghai Jiaotong University,Shanghai 201620,China. Corresponding author:WANG Huaping(E-mail:wanghp@dhu.edu.cn).
Objective To design and fabrication of the 3D scaffolds that exhibit biomimetic multi-scale structures composed ofmicroporous structure with nanofibers for urethral tissue.Methods By analyzing themulti-scale structures of urethral acellularmatrix,a bilayer scaffold composed ofmicroporous section and nanofibrous dense section to biomimetic urethral tissue was designed.Template biosynthesis was used to fabricate 3D microporous nanofibrous gelatin/BC bilayer scaffolds(BC-Gel/BC)by stationary cultivation usingmicroporous gelatin scaffold as a template.Results The BC-Gel/BC bilayer scaffold composed of dense section of BC nanofibrils network and microporous section of Gel/BC.Themicroporous section with highly interconnected micropore(167±56)μm and surface decorated on themicropore wall by BC nanofibers (20-40)nm were fabricated,which were remarkably similar structure to the native extracellularmatrix(ECM).Conclusion Using the template biosynthesis method,the BC-Gel/BC bilayer scaffold for urethral tissue engineering can be successfully constructed,which has the bilayer structure,m icro porous and nanofibrous network to biom imetic urethral tissue.
Urethral tissue engineering;Acellularmatrix;Bacterial cellulose;Multi-scale structure
Q813.1+2
A
1673-0364(2016)05-0276-05
10.3969/j.issn.1673-0364.2016.05.002
博士创新基金(CUSF-DH-D-2015029);国家自然科学基金(51573024)。
201620上海市东华大学材料学与工程学院纤维材料改性国家重点实验室(李喆,王宝秀,陈仕艳,王华平);314001浙江省嘉兴市嘉兴学院材料与纺织工程学院(李喆,颜志勇);200233上海市上海交通大学附属第六人民医院泌尿外科(吕向国,冯超)。
王华平(E-mail:wanghp@dhu.edu.cn)。
(2016年5月20日;
2016年7月2日)
