野生和配合饲料养殖大黄鱼品质的比较研究*
2016-11-17孟玉琼申屠基康张文兵麦康森
孟玉琼, 马 睿, 申屠基康, 张文兵**, 麦康森
(1.中国海洋大学 水产学院, 农业部水产动物营养与饲料重点实验室,海水养殖教育部重点实验室,山东 青岛 266003;2.青海大学 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016; 3.宁波市海洋与渔业研究院,浙江 宁波 315010)
野生和配合饲料养殖大黄鱼品质的比较研究*
孟玉琼1, 马 睿2, 申屠基康3, 张文兵1**, 麦康森1
(1.中国海洋大学 水产学院, 农业部水产动物营养与饲料重点实验室,海水养殖教育部重点实验室,山东 青岛 266003;2.青海大学 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016; 3.宁波市海洋与渔业研究院,浙江 宁波 315010)
为研究野生大黄鱼与配合饲料养殖大黄鱼之间主要品质指标的差异,以鱼粉和双低菜粕为主要蛋白源配制蛋白质含量为40.0%、脂肪含量为11.8%的配合饲料,在海上浮式网箱中养殖大黄鱼12周,比较分析了养殖大黄鱼和野生大黄鱼的肥满度、体色、肉色、肉质、肌肉常规成分、肌肉脂肪酸和氨基酸组成。研究表明:在体型方面,饲料养殖大黄鱼有显著高的肥满度(P<0.05);在体色和肉色方面,野生大黄鱼皮肤有较高的背部黄色值、腹部红色值、黄色值及肌肉红色值,但具有较低的肌肉亮度值和黄色值(P<0.05)。在肉质方面,野生大黄鱼肌肉具有显著高的黏附性、内聚性、弹性、咀嚼性、pH及碱不溶性羟脯氨酸含量(P<0.05)。饲料养殖大黄鱼肌肉具有显著高的汁液流失率、失水率、失脂率、水溶性蛋白及碱溶性羟脯氨酸含量(P<0.05)。在营养价值方面,野生大黄鱼肌肉具有显著高的水分和蛋白质含量(P<0.05),而饲料养殖大黄鱼肌肉具有显著高的脂肪含量(P<0.05)。饲料养殖大黄鱼的肌肉含有显著高的各类脂肪酸含量及PUFA/SFA的比值(P<0.05),但n-3/n-6值显著低(P<0.05)。根据人类对必需氨基酸的需求,饲料养殖大黄鱼肌肉必需氨基酸的组成和总量与野生大黄鱼无显著差异(P>0.05)。研究结果表明,与野生大黄鱼相比,配合饲料养殖大黄鱼在体型﹑体色﹑肉色和肉质方面存在差异,但从作为食用鱼的营养价值角度来看,配合饲料养殖大黄鱼与野生大黄鱼之间无显著区别。
大黄鱼;肌肉;体色;品质;配合饲料
随着经济的发展和生活水平的提高,食品质量成为农业发展的主要关注点之一。水产养殖作为全球肉类食品增长最快的板块[1],水产品品质的研究亦成为公众瞩目的热点。鱼类的品质是一个复杂的概念,对于消费者而言,除了保证水产品的质量安全外,品质还包括感官品质以及鱼肉作为健康食品所具有的营养价值等。然而养殖鱼类与野生鱼类品质上的巨大差异成为了水产养殖面临的巨大挑战之一[2]。
大黄鱼(Larimichthyscrocea)隶属于硬骨鱼纲(Osteichthyes)鲈形目(Perciformes)石首鱼科(Sciaenidae)黄鱼属(Larimichthys),是中国四大海水鱼之一,享有“海水国鱼”之美誉。经过快速发展,养殖大黄鱼在2014年的产量突破了12万t,成为中国产量最高的海水养殖鱼类[3]。野生大黄鱼以其朱唇金鳞、形体优美、肉质鲜美备受国人青睐。目前,大黄鱼的养殖主要还是依赖于投喂冰鲜鱼。与野生大黄鱼相比,养殖大黄鱼出现了体色退化、肉质松软、风味下降等品质退化的特征,严重影响了养殖大黄鱼的市场接受度,也对大黄鱼养殖的可持续发展造成了不利影响。因此,养殖大黄鱼的品质问题越来越受到研究者的关注。现有关于大黄鱼品质的研究,主要集中在不同养殖模式下[4-5]或不同家系[6-7]大黄鱼品质的差异。在虹鳟(Oncorhynchusmykiss)和大西洋鲑(Salmosalar)等鱼类的研究表明,肌肉中的化学物质组成在衡量品质中起着至关重要的作用,其不仅容易受到鱼类自身特性、环境、健康等因素的影响,还与饲料中的营养物质密切相关[8-9]。通过对饲料配方的优化能够提高养殖鱼类的品质[10-12]。
本研究根据大黄鱼的营养需求参数,配制配合饲料养殖大黄鱼,并与野生大黄鱼的品质进行比较,分析配合饲料养殖大黄鱼与野生大黄鱼在品质指标上的主要差异,为通过优化营养以投喂配合饲料的途径改善养殖大黄鱼的品质提供基础数据。
1 材料和方法
1.1 实验饲料
以鱼粉和双低菜粕为主要蛋白源,鱼油和卵磷脂为主要脂肪源配制蛋白含量为40.0%,脂肪含量为11.8%的配合饲料,饲料配方及营养成分组成见表 1。实验饲料由F(Ⅱ)26型双螺杆挤条机(华南理工大学,广州)加工成5mm×5mm的颗粒,于55 ℃条件下烘干,用塑料袋装好于-20 ℃冰箱保存备用。

表1 饲料配方和主要营养成分分析
注:1鱼粉和双低菜粕均购于青岛七好生物科技有限公司,主要营养成分分别为(干重):粗蛋白:72.84%和43.84%;粗脂肪:9.25%和2.05%。2维生素混合物(mg or g/kg diet):维生素B1,25 mg;核黄素,45 mg;维生素B6,20 mg;维生素B12,0.1 mg;维生素K3,10 mg;肌醇,800 mg;维生素B3,60 mg;烟酸,2 000 mg;叶酸,20 mg;生物素,1.2 mg;维生素A ,32 mg;维生素 D3,5 mg;维生素E,120 mg;维生素C,2 000 mg;氯化胆碱,2 000 mg。3无机盐混合物(mg or g/kg diet):氟化钠,2 mg;碘化钾,0.8 mg;氯化钴(1%),50 mg;硫酸铜,10 mg;硫酸铁,80 mg;硫酸锌,50 mg;硫酸锰,60 mg;硫酸镁,1 200 mg;磷酸二氢钙,3 000 mg ;氯化钠,100 mg;沸石粉,15.45 g。4诱食剂:甘氨酸:甜菜碱=1∶2。5防霉剂:富马酸:丙酸钙=1∶1。6ARA: 二十碳四烯酸。7EPA: 二十碳五烯酸。8DHA: 二十二碳六烯酸。9SFA: 饱和脂肪酸。10PUFA: 多不饱和脂肪酸。11n-3: n-3脂肪酸。12n-6: n-6脂肪酸。
Note:1Fish meal and canola meal were obtained from Qingdao Great Seven Bio-tech Ltd (Shandong, China). Crude proteins (dry matter) were 72.84% and 43.84%, respectively. Crude lipids (dry matter) were 9.25% and 2.05%, respectively.2Mineral premix(mg or g / kg diet):NaF, 2 mg; KI, 0.8 mg; CoCl2(1%), 50 mg; CuSO4·5H2O, 10 mg; FeSO4·H2O, 80 mg; ZnSO4·H2O, 50 mg; MnSO4·H2O, 60 mg; MgSO4·7H2O, 1200 mg; Ca(H2PO4)2·H2O, 3000 mg; NaCl, 100 mg; Zoelite, 15.45 g.3Vitamin premix(mg or g / kg diet):thiamin, 25 mg; riboflavin, 45 mg; pyridoxine-HCL, 20 mg; vitaminB12, 0.1 mg; vitaminK3, 10 mg; inositol, 800 mg; pantothenic acid, 60 mg; niacin acid, 200 mg; folic acid, 20 mg; biotin, 1.20 mg; retinol acetate, 32 mg; cholecalciferol, 5mg; alpha tocopherol, 120 mg; ascorbic acid, 2000 mg; choline chloride, 200 mg; microcrystalline, 14.52g.4Attractant: glycine: betaine = 1∶2.5Mold inhibitor: fumaric acid: calcium propionate = 1∶1.6ARA: arachidonic acid.7EPA: eicosapentaenoic acid.8DHA: docosahexaenoic acid.9SFA: saturated fatty acids.10PUFA: polyunsaturated fatty acids.11n-3: n-3 fatty acids.12n-6: n-6 fatty acids.
1.2 实验用大黄鱼
自福建宁德富发水产有限公司购买初始体质量为(135.38±1.02)g的大黄鱼,用本研究配制的配合饲料,在宁德市大湾海区浮式网箱(2 m×2 m×2.5 m)中养殖大黄鱼12周。养殖结束后,随机挑选9尾大黄鱼(体质量:(248.50±8.18)g)作为品质指标检测所需样品。同时,取9尾同期捕捞所得的野生大黄鱼(体质量:(296.15±6.55) g)作为对照检测样品。每尾鱼在测量体长、体质量和体色后去内脏去皮,从胸鳍基部到背鳍最后一根鳍条止,沿前后轴的方向分别剖取左右两整片肌肉。为避免肌肉的异质性,分装肌肉特定部位进行不同品质指标的测定,不同指标的测定部位如图 1所示。解剖后于48 h内完成肌肉质地、持水力和pH等品质指标的测定,置于-80 ℃冰箱中保存并用于后续指标的测定。
1.3 品质指标的检测
1.3.1 肥满度、体色和肉色的测定 根据体重和体长数据,计算肥满度如下:
肥满度=体重/体长3×100 %。
采用柯尼卡-美能达CR-400型色彩色差计测定体色和肉色,并采用国际发光照明委员会(CIE)的标准由L*(亮度值),a*(红色值-绿色值轴),b*(黄色值-蓝色值轴)表示[13]。选用背鳍前缘下方及侧线上方之间的区域、腹鳍到臀鳍之间的区域分别为背部和腹部的体色测定区域;选择去皮后背鳍下方侧线上方区域为肉色测定部位。每个部位测3个相邻点作为重复。

(A:检测肉色、质地、羟脯氨酸、胶原蛋白交联吡啶啉和水/盐溶性蛋白;B:检测汁液流失率,失水率和失脂率;C:检测肌肉pH;D:检测水分、脂肪、脂肪酸、粗蛋白和氨基酸。 A:Segment was used to assay muscle color, texture, hydroxyproline, pyridinoline crosslink and water/salt soluble protein; B:Segment was used to assay liquid losses, water losses, fat losses. C:Segment was used to assay muscle pH; D:Segment was used to assay moisture, lipid content, fatty acids, crude protein, amino acids composition.)
图1 肌肉品质指标测定区域分布图
Fig.1 Sampling segments for measurements of the quality parameters in muscle of large yellow croaker
1.3.2 肌肉质地的测定 在图1所示肌肉A区域选择3个点,采用食品物性分析仪(TMS-PRO,FTC,美国)的TPA模式进行肌肉质地的测定。参数设置为:直径8 mm的圆柱形探头;起始力为0.1 N;量程为25 N的力量感应元;检测速度为30 mm/min;形变量为60%。测定肌肉的硬度、弹性、黏附性﹑内聚性和咀嚼性。分析完后的肌肉分装放入-80 ℃冰箱中保存,用于测定肌肉化学成分。
1.3.3 肌肉持水力和pH的测定 参考Comez-Guilien等的方法[14],在图1所示肌肉B区域分别选择3个点,测定肌肉汁液流失率、失水率和失脂率。参考Fuentes等的方法[15],使用pH计(PB-10,赛多利斯,德国)测定肌肉pH值。
1.3.4 肌肉成分分析
1.3.4.1 水分、蛋白和脂肪的测定 采用AOAC标准方法[16]测定肌肉水分和蛋白质含量。其中,将肌肉在105℃烘箱中烘至恒重以测定水分含量;通过凯式定氮法(2300-自动凯氏定氮仪,FOSS,丹麦)测定粗蛋白含量。
1.3.4.2 肌肉脂肪和脂肪酸的测定 称取10 g左右的肌肉,采用冷冻干燥机(ALPHA 1-4 LD,克莱斯特,德国)冻干后,测定脂肪和脂肪酸含量。
脂肪含量的测定方法:称取0.1 g肌肉冻干粉,参照Folch等的氯仿甲醇提取法测定[17]。
脂肪酸含量的测定方法:称取0.1 g肌肉冻干粉于15mL试管中,加入1 mol/L的KOH-甲醇溶液3mL,在80℃水浴中加热20min;冷却后,加入2mol/L的HCL-甲醇溶液3mL,80℃水浴中加热20min;冷却后,加正己烷2mL,震荡萃取,静置分层;取1mL上清液在3 500g条件下离心5min(Legend RT离心机,索福,德国);离心后取上清液450μL加入进样瓶,同时加入50μL浓度为1mg/mL的十七烷酸甲酯(Sigma)作为内标,在气相色谱-质谱联用仪(GCMS-QP2010,岛津,日本)上检测脂肪酸的组成和含量。
气相色谱-质谱联用仪的参数设定:①气相条件。色谱柱:Rxi-1MS毛细管柱(30m×0.25mm,0.25μm);升温程序:初始温度150℃,以15 ℃/min的速度升至200 ℃,再以2 ℃/min升至250 ℃;进样口温度:250 ℃;载气(He)流量:1mL/min;自动进样,进样体积1μL,分流比为20∶1;溶剂切除时间为2.5min。②质谱条件。电子轰击离子源,离子源温度230℃,接口温度280℃,电子能量70 eV,质量扫描范围45~500m/z。
色谱数据处理:①定性处理。通过NIST08.LIB谱库进行检索,匹配度高于80%以确定脂肪酸组成。②定量处理。根据内标的浓度以及目标脂肪酸与内标的峰面积之比,分别求得各脂肪酸的绝对含量。
1.3.4.3 肌肉水/盐溶性蛋白的测定 参照Sigholt等的方法[18]分离肌肉样品中的水溶性蛋白和盐溶性蛋白。具体操作如下:称取1g肌肉,加入预冷的磷酸缓冲液20mL,匀浆1min;而后在4℃,8000g条件下离心20min(Legend RT离心机,索福,德国),分离出上清液和沉淀。取含有水溶性蛋白的上清液至25mL容量瓶中,并用磷酸缓冲液定容,4℃条件下保存待测。另一方面,在沉淀中加入20mL预冷的含0.6mol/L氯化钾的磷酸缓冲液,匀浆1min后在同样条件下离心20min,取含有盐溶性蛋白的上清液至25 mL容量瓶中,并用含0.6mol/L氯化钾的磷酸缓冲液定容, 4 ℃条件下保存待测。采用考马斯亮蓝法蛋白定量测试盒(南京建成生物工程研究所,中国)测定水溶性和盐溶性蛋白含量。
1.3.4.4 肌肉羟脯氨酸、胶原蛋白交联吡啶啉含量的测定 首先,参照Li等的方法[19]分离肌肉中碱溶性和碱不溶性羟脯氨酸。具体操作如下:在1g肌肉样品中加入预冷的蒸馏水9mL,4℃条件下匀浆1min;加入预冷的0.2mol/L的氢氧化钠溶液10mL,而后将样品放在摇床上4℃条件下振荡4 h;在4℃,10000g条件下离心(CR21GII超速离心机,日立,日本)30min,分离出上清液和沉淀。取1mL上清液(碱溶性羟脯氨酸)4℃条件下保存待测;将沉淀(碱不溶性羟脯氨酸)转入安瓿瓶中,加入3mL 6mol/L的盐酸,并用酒精喷灯封口,在110℃烘箱中水解20h。水解后将液体定容至10mL容量瓶,取1mL上清液待测。将分离好的上清液进行羟脯氨酸含量检测,检测方法参照Zhang等的分光光度计法[20]。本实验使用紫外分光光度计(UV-2401PC,岛津,日本)在560nm波长下测定。采用ELISA试剂盒(上海越研生物科技有限公司,中国)测定肌肉中胶原蛋白交联吡啶啉的含量。
1.3.4.5 肌肉氨基酸组成的测定 将肌肉样品用6N HCl在110℃条件下水解22~24h,而后采用全自动氨基酸分析仪(L-8900,日立,日本)测定肌肉的氨基酸组成。
1.4 统计分析
使用SPSS 17.0分析软件,对所得数据进行统计分析。采用T-检验(t-test)比较野生组和配合饲料组大黄鱼品质指标之间的差异。当P<0.05时,认为差异显著。
2 实验结果
2.1 肥满度、体色和肉色
野生大黄鱼与配合饲料养殖大黄鱼的肥满度、体色和肉色方面的参数值见表2。野生大黄鱼的肥满度为1.26%,显著低于饲料养殖大黄鱼(1.71%,P<0.05)。在体色方面,野生大黄鱼背部皮肤的黄色值(b*)、腹部的红色值(a*)及黄色值(b*)显著高于饲料养殖大黄鱼(P<0.05)。在肉色方面,配合饲料养殖大黄鱼的肌肉亮度值(L*)和黄色值(b*)显著高于野生大黄鱼,而红色值(a*)显著低于野生大黄鱼(P<0.05)。
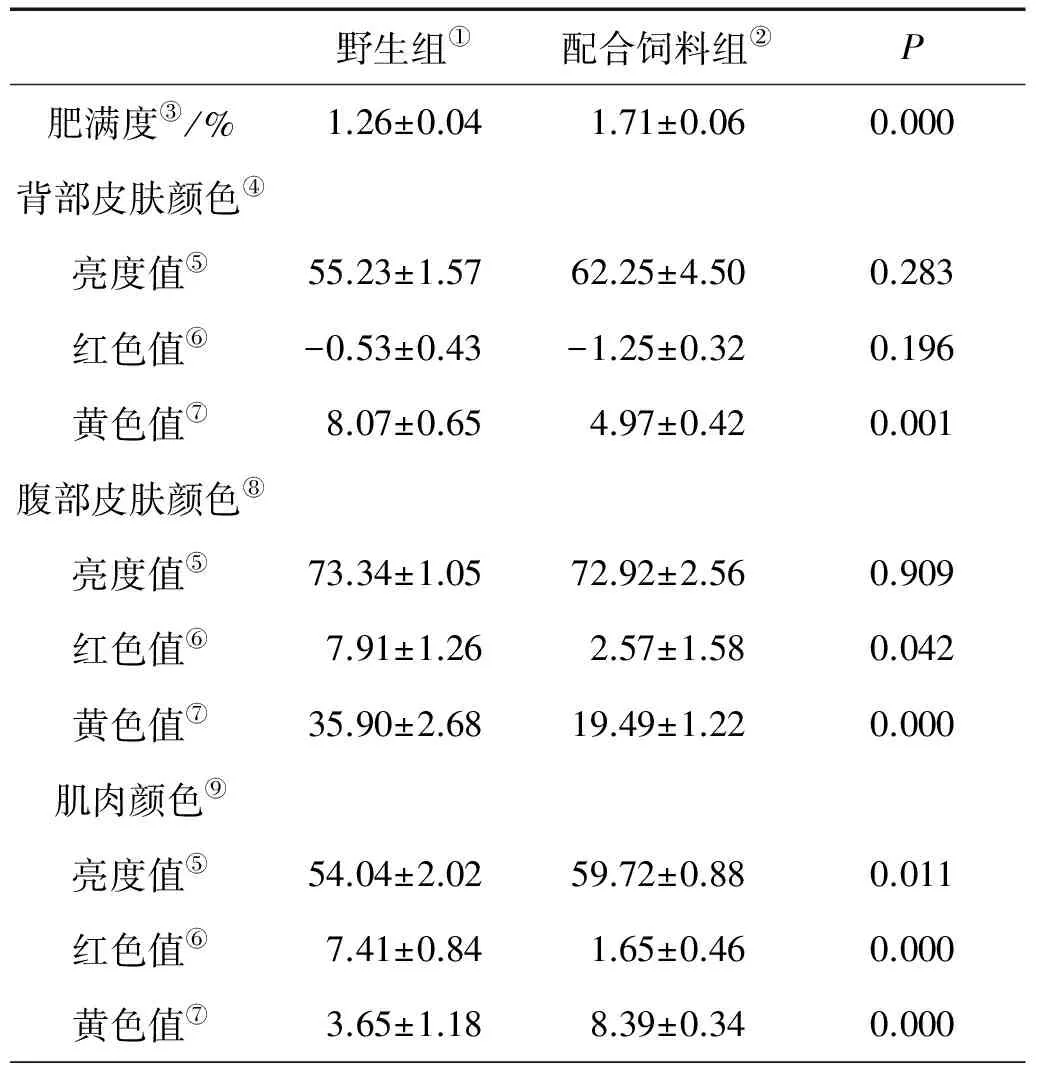
表2 野生和饲料养殖大黄鱼肥满度、体色和肉色(平均值±标准误,n=9)
注:1肥满度=体重/体长3×100%。Condition factor = Body weight/Body length3×100%.
①Wild fish;②Formulated diet-fed fish;③Condition factor;④Dorsal skin color;⑤Lightness (L*);⑥Redness (a*);⑦Yellowness (b*);⑧Abdomen Skin color ;⑨Muscle color.
2.2 肌肉质地、持水力、pH和胶原蛋白
如表 3所示,除肌肉硬度外,野生大黄鱼肌肉的黏附性、内聚性、弹性和咀嚼性等质地指标均显著高于饲料养殖大黄鱼(P<0.05)。在持水力方面,饲料养殖大黄鱼肌肉的汁液流失率、失水率和失脂率均显著高于野生大黄鱼(P<0.05)。野生大黄鱼肌肉pH显著高于饲料养殖大黄鱼(P<0.05)。野生大黄鱼肌肉具有较高的碱不溶性羟脯氨酸含量(0.34 g/kg),并显著高于饲料养殖大黄鱼(0.25 g/kg,P<0.05),而饲料养殖大黄鱼肌肉含有显著高的水溶性蛋白含量(5.89%)和碱溶性羟脯氨酸含量(0.09 g/kg,P<0.05)。野生大黄鱼和饲料养殖大黄鱼的肌肉盐溶性蛋白含量、胶原蛋白含量(总羟脯氨酸含量),以及胶原蛋白交联吡啶啉含量无显著差异(P>0.05)。

表3 野生和饲料养殖大黄鱼肉质和肌肉常规成分(平均值±标准误,n=9)
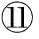
2.3 肌肉蛋白质、氨基酸、脂肪和脂肪酸
如表3所示,野生大黄鱼肌肉具有显著高的水分和蛋白质含量(P<0.05),分别为77.61%和19.09%(湿重),而饲料养殖大黄鱼肌肉具有显著高的脂肪含量(P<0.05),为10.78%(湿重)。
野生大黄鱼与饲料养殖大黄鱼在肌肉脂肪酸组成方面的差异如表 4所示。与野生大黄鱼相比,饲料养殖大黄鱼的肌肉具有显著高的饱和脂肪酸(SFA,25.49mg/g,湿重)、单不饱和脂肪酸(MUFA,29.80mg/g,湿重)、多不饱和脂肪酸(PUFA,27.39mg/g,湿重)、n-3系列脂肪酸(n-3,16.74mg/g,湿重)、n-6系列脂肪酸(n-6,9.57mg/g,湿重)和总脂肪酸含量(TFA,82.69mg/g,湿重)及PUFA/SFA的比值(1.08),但具有显著低的n-3/n-6(1.75)、二十二碳六烯酸/二十碳五烯酸(DHA/EPA,1.77)以及二十碳四烯酸/二十碳五烯酸(ARA/EPA,0.18)的比值(P<0.05)。
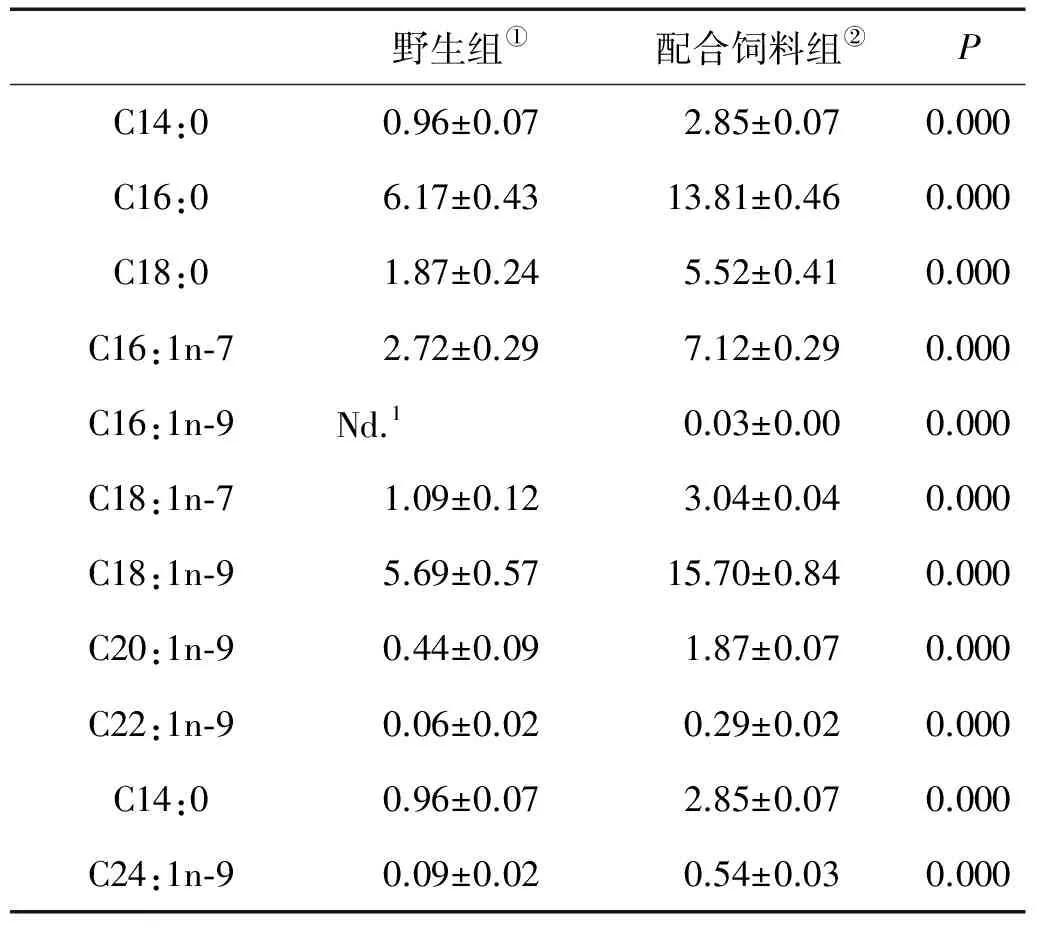
表4 野生和饲料养殖大黄鱼肌肉脂肪酸组成(湿重,平均值±标准误,n=9)
续表4
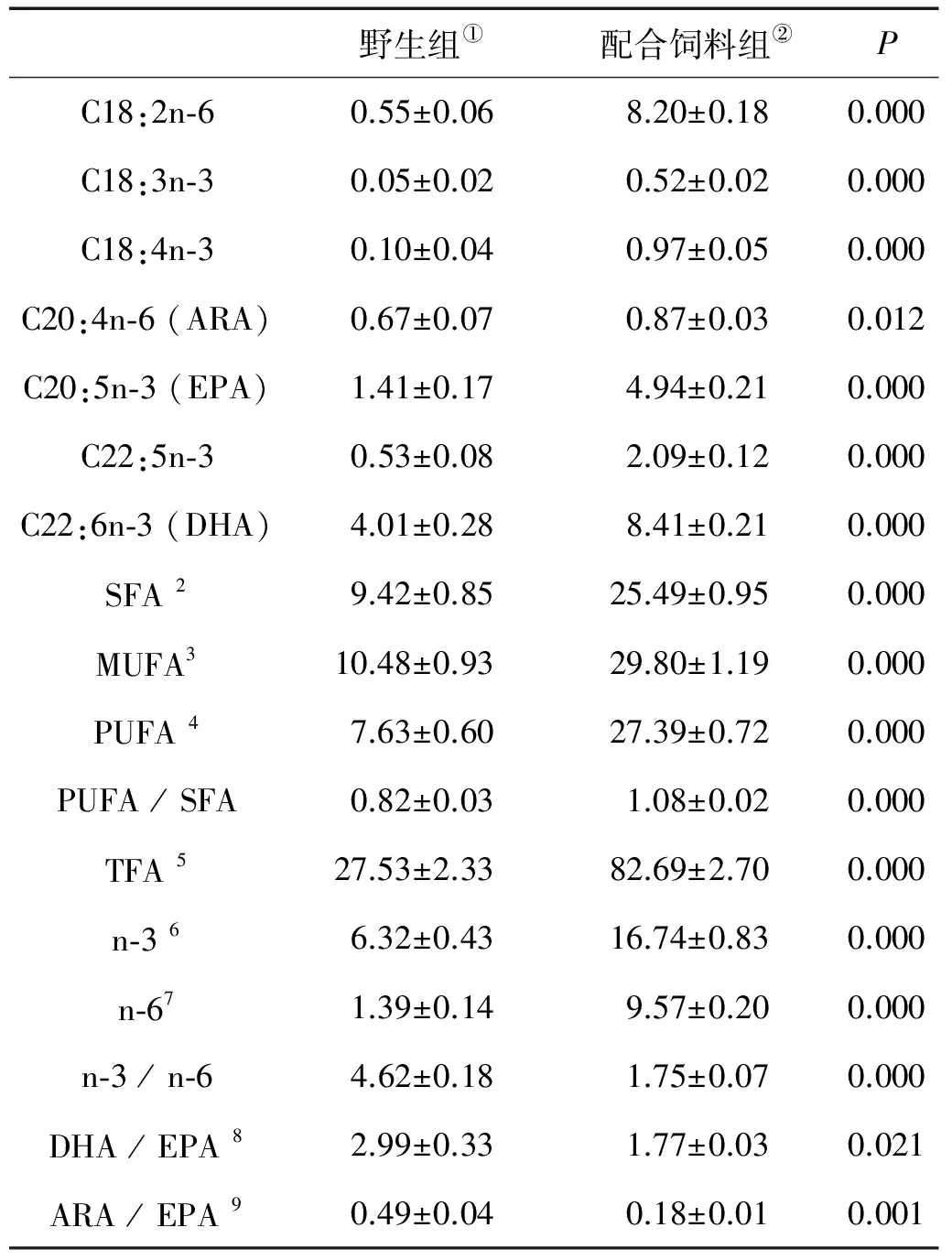
野生组①配合饲料组②PC18:2n⁃60.55±0.068.20±0.180.000C18:3n⁃30.05±0.020.52±0.020.000C18:4n⁃30.10±0.040.97±0.050.000C20:4n⁃6(ARA)0.67±0.070.87±0.030.012C20:5n⁃3(EPA)1.41±0.174.94±0.210.000C22:5n⁃30.53±0.082.09±0.120.000C22:6n⁃3(DHA)4.01±0.288.41±0.210.000SFA29.42±0.8525.49±0.950.000MUFA310.48±0.9329.80±1.190.000PUFA47.63±0.6027.39±0.720.000PUFA/SFA0.82±0.031.08±0.020.000TFA527.53±2.3382.69±2.700.000n⁃366.32±0.4316.74±0.830.000n⁃671.39±0.149.57±0.200.000n⁃3/n⁃64.62±0.181.75±0.070.000DHA/EPA82.99±0.331.77±0.030.021ARA/EPA90.49±0.040.18±0.010.001
注:1Nd.: 没有检测出;2SFA: 饱和脂肪酸;3MUFA: 单不饱和脂肪酸;4PUFA: 多不饱和脂肪酸;5TFA: 总脂肪酸;6n-3: n-3系列脂肪酸;7n-6: n-6系列脂肪酸;8DHA/EPA:二十二碳六烯酸/二十碳五烯酸;9ARA/EPA:二十碳四烯酸/二十碳五烯酸。
Note:1Nd.: Not detected.2SFA: Saturated fatty acids.3MUFA: Mono-unsaturated fatty acids.4PUFA: Poly-unsaturated fatty acids.5TFA: Total fatty acids.6n-3: n-3 fatty acids.7n-6: n-6 fatty acids.8DHA/EPA: Docosahexaenoic acid/eicosapentaenoic acid.9ARA/EPA:Arachidonic acid/eicosapentaenoic acid.
①Wild fish;②Formulated diet-fed fish
野生大黄鱼与饲料养殖大黄鱼在肌肉氨基酸组成方面的差异见表 5。与野生大黄鱼相比,饲料养殖大黄鱼具有显著低的肌肉甘氨酸含量(0.64% 湿重,P<0.05)。其他各种氨基酸含量、必需氨基酸总量、非必需氨基酸总量及总氨基酸含量在2组之间无显著差异(P<0.05)。
3 讨论
肥满度是衡量鱼体体型的重要指标,也可以反映鱼类的营养水平和生活史[10]。本研究发现野生大黄鱼的肥满度显著低于养殖大黄鱼,而养殖大黄鱼肌肉脂肪含量是野生鱼的6.7倍。这与在其他鱼如金头鲷(Sparusaurata)[21],欧洲鲈鱼(Dicentrarchuslabrax)[21]和大西洋鲑(Salmosalar)[22]中的研究结果类似。野生大黄鱼一般生活在深海区,需要主动摄食,因此能量消耗较大且食物供应不稳定。而养殖大黄鱼运动空间狭窄,且有充足的饵料,其能量消耗较少,容易积累较多脂肪[23]。同时,本研究所用配合饲料的脂肪含量接近12%,高于野生大黄鱼自然条件下摄食鱼虾的平均脂肪含量,这也是造成养殖大黄鱼脂肪含量高于野生大黄鱼的可能原因之一。养殖大黄鱼摄食的总体营养水平较高并且能量消耗较少,导致体内蓄积了大量脂肪,从而也导致较高的肥满度。
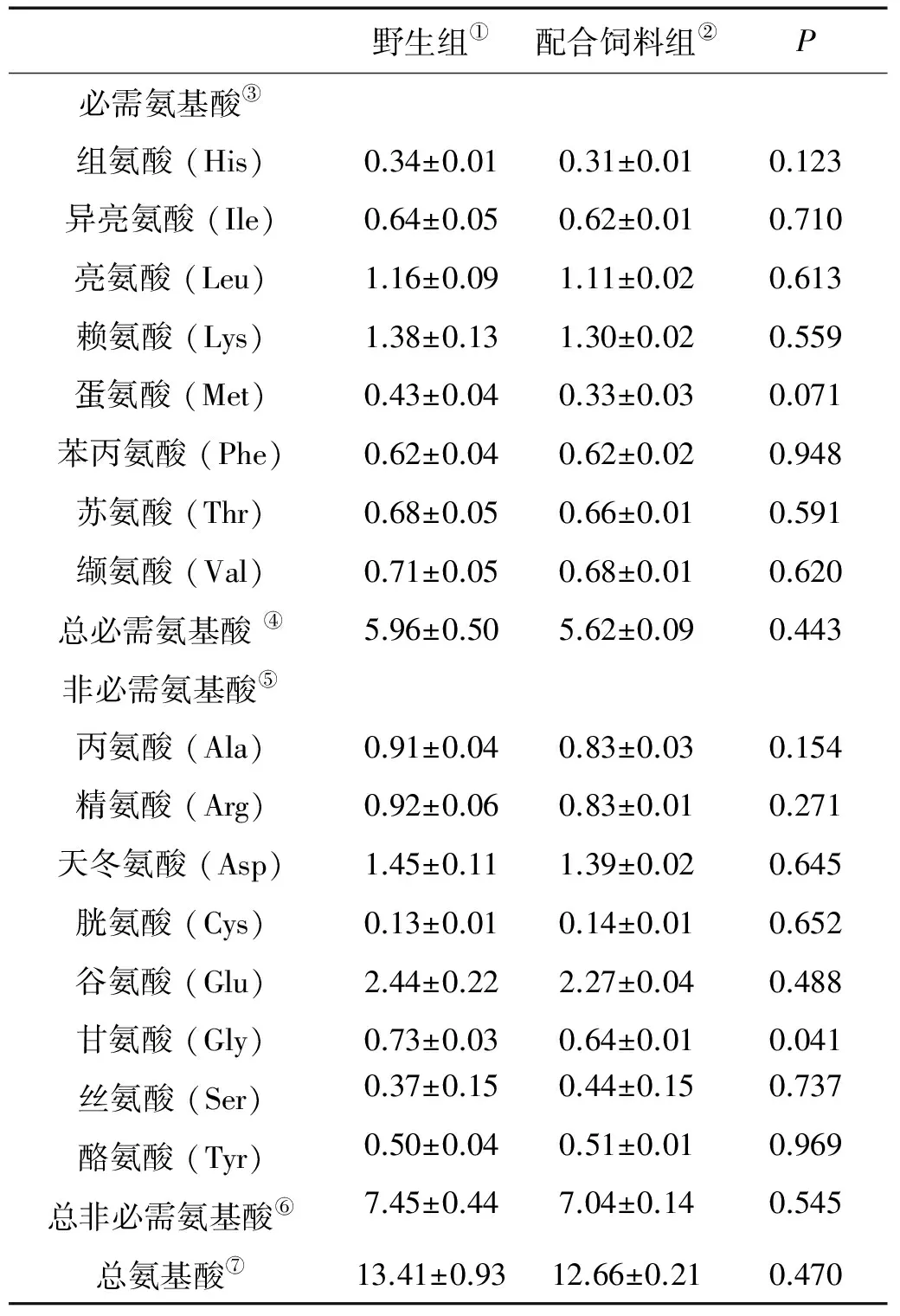
表5 野生和饲料养殖大黄鱼肌肉氨基酸组成(%,湿重,平均值±标准误,n=9)
Note:①Wild fish;②Formulated diet-fed fish;③Essential amino acids (EAA);④Total essential amino acids;⑤Non-essential amino acids (NEAA);⑥Total non-essential amino acids;⑦Total amino acids.
大黄鱼“金鳞朱唇”的体色深受消费者喜爱[24],因此体色是衡量大黄鱼品质最为重要的指标之一。在本研究中,野生大黄鱼背部和腹部的黄色值(b*值)显著高于饲料养殖大黄鱼,这一结果与大黄鱼其他研究一致[25]。自然条件下,野生大黄鱼可以摄食到甲壳类和藻类,而这样的食物富含色素。Yi等研究表明,饲料中添加类胡萝卜素可显著提高大黄鱼的体色[26]。因此,为保证养殖大黄鱼有较好的体色特征,需在饲料中添加一定量的类胡萝卜素。此外,本研究表明野生大黄鱼肌肉红色值(a*值)显著高于养殖大黄鱼。这可能与野生鱼长期运动导致肌肉中红肌含量高、肌肉脂肪沉积、血管分布、肌肉黑色素沉积以及酪氨酸的酶促反应有关[2, 27]。
通常,肌肉是鱼类养殖的最终产品,同时消费者偏爱坚实的质地[28]。在其他鱼类的研究结果表明,野生鱼具有较高的肌肉硬度或坚实度[15, 22, 29-30]。在本研究中,虽然肌肉硬度在野生鱼和养殖鱼之间无显著差异,但其他质地指标如黏附性、弹性、内聚性和咀嚼性在野生大黄鱼中都显著高。缪伏荣等通过感官评价实验比较不同养殖模式下大黄鱼的肌肉品质,也发现野生大黄鱼肌肉嫩度和总体可接受性最佳[25]。除了生活史上的差异外,造成上述差异的原因还可能与肌肉pH、肌肉脂肪、肌肉胶原蛋白和肌肉持水力有关。首先,关于肌肉pH。研究表明鱼体死后肌肉pH的迅速降低与肌肉变软有关[31]。在本研究中,养殖大黄鱼的肌肉pH值显著低于野生大黄鱼,类似的结果在其他鱼类中也有发现[15, 29]。养殖大黄鱼肌肉pH值比野生鱼低的原因可能是养殖鱼类营养条件好,肌肉中糖原沉积多,鱼死后糖原分解产生大量乳酸导致pH降低[29]。其次,关于肌肉脂肪。之前的研究表明鱼肉的质地与肌肉脂肪含量呈负相关关系[22, 32]。相似的结果也在本研究中发现。另外,关于肌肉胶原蛋白。胶原蛋白是细胞基质的主要成分,之前的研究表明胶原蛋白含量、成熟度以及交联水平与肌肉硬度呈正相关[33-34]。在本研究中,养殖大黄鱼和野生大黄鱼之间虽然胶原蛋白含量和交联水平没有显著差异,但养殖大黄鱼主要以年轻的胶原蛋白为主(碱溶性羟脯氨酸含量较高),野生大黄鱼主要以成熟的胶原蛋白为主(碱不溶性羟脯氨酸含量较高)。这可能与养殖大黄鱼营养水平较高,生长速度较快有关。最后,关于肌肉持水力。肌肉持水力是指肌肉组织保持水分等的能力,而肌肉中大量的水分与蛋白质的极性基团结合形成水合离子而储留在蛋白质的空间结构中,影响肌肉的硬度与嫩度[35]。在本研究中,野生大黄鱼具有较高的水分含量和较低的汁液流失率,从而影响了肌肉质地。
作为人类食物的养殖鱼类,营养价值主要包括蛋白质含量、脂肪含量、脂肪酸组成和必需脂肪酸含量、氨基酸组成和必需氨基酸含量等。在本研究中,野生大黄鱼肌肉蛋白质含量显著高于养殖大黄鱼。关于肌肉氨基酸组成和必需氨基酸含量的研究表明,野生大黄鱼肌肉必需氨基酸以及总氨基酸含量要高于养殖大黄鱼[36-37]。而本研究表明,野生大黄鱼与养殖大黄鱼肌肉必需氨基酸以及总氨基酸含量都无显著差异。出现结果不一致的原因与养殖大黄鱼投喂的饵料有关。之前发表的研究均以冰鲜杂鱼作为养殖大黄鱼的饵料,而本研究以营养均衡的配合饲料养殖大黄鱼。饲料投喂的养殖大黄鱼肌肉必需氨基酸和总氨基酸含量与野生大黄鱼没有显著差异,但都显著高于用冰鲜杂鱼投喂的养殖大黄鱼[23]。因此,投喂营养均衡的配合饲料可以提高养殖大黄鱼的氨基酸营养价值。
此外,在本研究中,饲料的脂肪含量为11.8%,是大黄鱼生长最快的饲料脂肪水平[26]。但同时本研究发现,养殖大黄鱼肌肉脂肪含量显著高于野生大黄鱼。养殖鱼类更容易蓄积脂肪这一现象在大黄鱼其他相关研究中[7, 23, 36]以及其他鱼类中[2, 8, 15]也有报道。由此可见,在现有的养殖模式下,需降低饲料脂肪含量来减少养殖大黄鱼脂肪蓄积造成品质下降的现象。如何权衡大黄鱼生长和品质之间的关系需要进一步研究。此外有研究表明,DHA和EPA对人体健康具有重要作用,而鱼类肌肉不饱和脂肪酸的含量及组成受到饲料中脂肪酸的含量及组成和环境因素直接影响[37]。本研究结果表明养殖大黄鱼肌肉DHA﹑EPA及其他脂肪酸的绝对含量均显著高于野生大黄鱼,这可能与配合饲料中丰富的DHA和EPA组成(分别为0.19和0.13 mg/g)及充足的食物供应有关。同时养殖大黄鱼肌肉脂肪含量是野生大黄鱼的6.7倍,也使得养殖大黄鱼脂肪酸的绝对含量高于野生大黄鱼。但是野生大黄鱼的n-3/n-6的比值显著高于养殖大黄鱼。同时,本研究发现肌肉的脂肪酸组成和饲料脂肪酸组成有着密切的关系,养殖大黄鱼肌肉n-3/n-6的比值(1.75)与饲料中n-3/n-6的比值(1.68)接近。因此,野生大黄鱼肌肉n-3/n-6的比值较高的原因可能与其经常摄食富含n-3脂肪酸的食物有关。衡量鱼肉脂肪酸的营养价值,主要关注必需脂肪酸的含量以及n-3/n-6的比值。本研究使用配合饲料养殖大黄鱼后,肌肉必需脂肪酸含量优于野生大黄鱼,同时n-3/n-6的比值也符合人类膳食脂肪酸摄入量模式[38]。
4 结论
与野生大黄鱼相比,配合饲料养殖大黄鱼在体型、体色、肉色和肉质方面存在差异,但其仍然具有较高的营养价值。品质指标的变化与大黄鱼摄食的饲料营养有着密切关系。以提高养殖大黄鱼的品质为目的,可以在以下几个方面对配合饲料进行改进:(1)适当降低饲料配方中脂肪等能量物质的含量,能够达到降低养殖大黄鱼的肥满度,同时改善肌肉质地的作用,但需要注意肌肉脂肪含量与脂肪酸组成的密切关系;(2)可以通过在饲料中适量添加虾青素等类胡萝卜素改善养殖大黄鱼的体色;(3)饲料中均衡的氨基酸组成能够提高大黄鱼肌肉的氨基酸含量,改善其组成。
[1] FAO. World Aquaculture 2010 [M]. Viale delle Terme dicaracalla 00153. Room Italy: Food and Agriculture Organization of the United Nations, 2011.
[2] Gonzalez S, Flick G J, O′ Keefe S F, et al. Composition of farmed and wild yellow perch (Percaflavescens) [J]. Journal of Food Composition & Analysis, 2006, 19(6): 720-6.
[3] 农业部渔业渔政管理局.中国渔业统计年鉴 [M]. 北京:中国农业出版社, 2015:28.
Fishery Bureau, Ministry of Agriculture. China fishery statistical yearbook [M]. Beijing: China Agriculture Press, 2015: 28.
[4] 段青源, 麦康森, 申徒基康, 等. 养殖与野生大黄鱼的品质比较[C]. 青岛: 世界华人鱼虾营养学术研讨会, 2006.
Duan Q, Mai K, Shentu J, et al. Comparison of Flesh Quality of Farmed and Wild Large Yellow CroakerPseudosciaenacrocea; [C]. Qingdao: Symposium of World’s Chinese Scientists on Nutrition and Feeding of Finfish and Shellfish, 2006.
[5] 缪伏荣. 不同养殖模式大黄鱼品质的比较研究 [D].北京: 中国农业科学院, 2008.
Miu F. A Comparative Study on Quality ofPseudosciaenacroceaUnder Different Culture Mode[D]. Beijing: Chinese Academy of Agricultural Sciences, 2008.
[6] 林利民, 王秋荣, 王志勇, 等. 不同家系大黄鱼肌肉营养成分的比较 [J]. 中国水产科学, 2006, 13(2): 286-91.
Lin L, Wang Q, Wang Z, et al. Comparison of biochemical compositions of muscle among three stocks and wild caught large yellow croakerPseudosciaenacrocea[J]. Journal of Fishery Sciences of China, 2006, 13(2): 286-91.
[7] 徐继林, 严小军, 罗瑜萍, 等. 岱衢族野生大黄鱼与养殖大黄鱼肌肉脂类和脂肪酸组成的比较研究 [J]. 中国食品学报, 2008, 8(1): 108-114.
Xu J, Yan X, Luo Y, et al. Comparison of lipids and fatty acids composition in muscle between wild and farmedPseudosciaenacroceafrom Tai-chu Race. [J]. Journal of Chinese Institue of Food Science and Technology, 2008, 8(1): 108-114.
[8] Grigorakis K. Compositional and organoleptic quality of farmed and wild gilthead sea bream (Sparusaurata) and sea bass (Dicentrarchuslabrax) and factors affecting it: A review [J]. Aquaculture, 2007, 272(1-4): 55-75.
[9] Larsson T, Krasnov A, Lerfall J, et al. Fillet quality and gene transcriptome profiling of heart tissue of Atlantic salmon with pancreas disease (PD) [J]. Aquaculture, 2012, 330-333: 82-91.
[10] Larsson T, Koppang E O, Espe M, et al. Fillet quality and health of Atlantic salmon (SalmosalarL.) fed a diet supplemented with glutamate [J]. Aquaculture, 2014, 426-427: 288-295.
[11] Deng Y P, Jiang W D, Liu Y, et al. Dietary leucine improves flesh quality and alters mRNA expressions of Nrf2-mediated antioxidant enzymes in the muscle of grass carp (Ctenopharyngodonidella) [J]. Aquaculture, 2015, 452(8): 380-387.
[12] Duan Q, Mai K, Shentu J, et al. Replacement of dietary fish oil with vegetable oils improves the growth and flesh quality of large yellow croaker (Larmichthyscrocea) [J]. Journal of Ocean University of China, 2013, 13(3): 445-452.
[13] Mclaren K. XIII-The Development of the CIE 1976 (L* a* b*) Uniform Colour Space and Colour‐difference Formula [J]. Journal of the Society of Dyers & Colourists, 1976, 92(9): 338-341.
[14] Gómez-Guillén M C, Montero P, Hurtado O, et al. Biological characteristics affect the quality of farmed atlantic salmon and smoked muscle [J]. Journal of Food Science, 2000, 65(1): 53-60.
[15] Fuentes A, Fernández-Segovia I, Serra J A, et al. Comparison of wild and cultured sea bass (Dicentrarchuslabrax) quality [J]. Food Chemistry, 2010, 119(4): 1514-1518.
[16] AOAC. Official Methods of Analysis, 16th edn. Association of official analytical chemists, arlington, VA, USA [J]. 1995, 6(11): 382-383.
[17] Folch J, Lees M, Sloane-Stanley G. A simple method for the isolation and purification of total lipids from animal tissues [J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[18] Sigholt T, Erikson U, Rustad T, et al. Handling stress and storage temperature affect meat quality of farmed-raised atlantic salmon (SalmoSalar) [J]. Journal of Food Science, 2006, 62(4): 898-905.
[19] Li X, Ralph B, Emma L, et al. Hydroxylysyl pyridinoline cross-link concentration affects the textural properties of fresh and smoked Atlantic salmon (SalmosalarL.) flesh [J]. Journal of Agricultural and Food Chemistry, 2005, 53(17): 6844-6850.
[20] Zhang K, Ai Q, Mai K, et al. Effects of dietary hydroxyproline on growth performance, body composition, hydroxyproline and collagen concentrations in tissues in relation to prolyl 4-hydroxylase α(I) gene expression of juvenile turbot,ScophthalmusmaximusL. fed high plant protein [J]. Aquaculture, 2013 (404-405): 77-84.
[21] Arechavala-Lopez P, Sanchez-Jerez P, Bayle-Sempere J T, et al. Morphological differences between wild and farmed Mediterranean fish [J]. Hydrobiologia, 2012, 679(1): 217-231.
[22] Johnston I A, Li X, Vieira V L A, et al. Muscle and flesh quality traits in wild and farmed Atlantic salmon [J]. Aquaculture, 2006, 256(1-4): 323-336.
[23] 周飘苹, 金敏, 吴文俊, 等. 不同养殖模式、投喂不同饵料及不同品系大黄鱼营养成分比较 [J]. 动物营养学报, 2014(4): 969-980.
Zhou P, Jin M, Wu W, et al. Comparison of nutrient components of large yellow croaker (Pseudosciaenacrocea) cultured in different modes, fed different feeds and from different strains. [J]. Chinese Journal of Animal Nutrition, 2014(4): 969-980.
[24] Yi X W, Li J, Xu W, et al. Effects of dietary xanthophylls/astaxanthin ratios on the growth and skin pigmentation of large yellow croakerLarimichthyscrocea(Richardson, 1846) [J]. Journal of Applied Ichthyology, 2015, 31(4): 780-786.
[25] 缪伏荣, 刘景, 王淡华, 等. 不同养殖模式大黄鱼肉质性状的分析研究 [J]. 福建农业学报, 2007, 22(4): 372-377.
Miu F, Liu J, Wang D, et al. Meat quality ofPseudosciaenacroceacultivated by different methods. [J]. Fujian Journal of Agricultural Sciences, 2007, 22(4): 372-377.
[26] Yi X, Zhang F, Xu W, et al. Effects of dietary lipid content on growth, body composition and pigmentation of large yellow croakerLarimichthyscroceus[J]. Aquaculture, 2014, 434(3): 55-61.
[27] Grigorakis K, Taylor K D A, Alexis M N. Seasonal patterns of spoilage of ice-stored cultured gilthead sea bream (Sparusaurata) [J]. Food Chemistry, 2003, 81(2): 263-268.
[29] Periago M J, Ayala M D, López-Albors O, et al. Muscle cellularity and flesh quality of wild and farmed sea bass,DicentrarchuslabraxL [J]. Aquaculture, 2005, 249(1-4): 175-188.
[30] González S, Flick G, O’keefe S, et al. Composition of farmed and wild yellow perch (Percaflavescens) [J]. Journal of Food Composition and Analysis, 2006, 19(6): 720-726.
[31] Torgersen J S, Erling Olaf K, Stien L H, et al. Soft texture of atlantic salmon fillets is associated with glycogen accumulation [J]. Plos One, 2014, 9(1): e85551.
[32] Morkore T, Hansen A A, Unander E, et al. Composition, liquid leakage, and mechanical properties of farmed rainbow trout: Variation between fillet sections and the impact of ice and frozen storage [J]. Journal of Food Science, 2002, 67(5): 1933-1938.
[33] Li X J, Bickerdike R, Lindsay E, et al. Hydroxylysyl pyridinoline cross-link concentration affects the textural properties of fresh and smoked Atlantic salmon (SalmosalarL.) flesh [J]. Journal of Agricultural and Food Chemistry, 2005, 53(17): 6844-6850.
[34] Moreno H M, Montero M P, Gomez-Guillen M C, et al. Collagen characteristics of farmed Atlantic salmon with firm and soft fillet texture [J]. Food Chemistry, 2012, 134(2): 678-685.
[35] 刘丽, 余红心, 肖维, 等. 鱼肉品质的研究进展 [J]. 当代水产, 2008, 33(8): 9-12.
Liu L, Yu H, Xiao W, et al. Advances in fish quality [J]. Current Fisheries, 2008, 33(8): 9-12.
[36] 段青源, 钟惠英,斯列钢,等. 网箱养殖大黄鱼与天然大黄鱼营养成分的比较分析 [J]. 浙江海洋学院学报(自然科学版), 2000, 19(2): 125-128.
Duan Q, Zhong H, Si L, et al. Comparative analyses of biochemical composition in net cultured and wildPseudosciaenacrocea(Richardson) [J]. Journal of Zhejiang Ocean University (Natural Science), 2000, 19 (2): 125-128.
[37] 颜孙安, 姚清华, 林香信, 等. 不同养殖模式大黄鱼肌肉营养成分比较 [J]. 福建农业学报, 2015(8): 736-744.
Yan S, Yao Q, Lin X, et al. Nutrient profile of Large yellow croakers (PseudosciaenacroceaRichardson) grown under different aquacultural settings [J]. Fujian Journal of Agricultural Sciences, 2015(8): 736-744.
[38] Rebole A, Velasco S, Rodriguez M L, et al. Nutrient content in the muscle and skin of fillets from farmed rainbow trout (Oncorhynchusmykiss) [J]. Food Chemistry, 2015, 174: 614-620.
责任编辑 朱宝象
Comparative Studies on the Quality of Wild and Formulated Diet-Fed Large Yellow Croaker (Larimichthyscrocea)
MENG Yu-Qiong1, MA Rui2, SHENTU Ji-Kang3, ZHANG Wen-Bing1, MAI Kang-Sen1
(1.The Key Laboratory of Aquaculture Nutrition and Feed, Ministry of Agriculture; The Key Laboratory of Mariculture, Ministry of Education,College of Fisheries, Ocean University of China, Qingdao 266003, China; 2.State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University, Xining 810016, China; 3.Ningbo Ocean and Fisheries Research Institute, Ningbo 315010, China)
The present study was conducted to compare the fish quality difference between wild ((296.15±6.55) g) and formulated diet-fed large yellow croaker. The experimental diet containing 40.0% of crude protein and 11.8% of crude lipid was fed to large yellow croaker (initial weight: (135.38±1.02) g) to apparent satiation in sea cages for 12 weeks. The final body weight of the formulated diet-fed large yellow croaker was 248.50±8.18 g. Then following quality parameters were analyzed: condition factor, skin color, muscle color, flesh quality, muscle crude compositions, muscle fatty acids and amino acids compositions. Results showed that compared with wild large yellow croaker, formulated diet-fed fish had significantly higher value of condition factor (1.71%,P<0.05). In regard to the skin color, wild large yellow croaker had significantly higher value of yellowness (8.07) of dorsal skin, redness (7.91) and yellowness (35.90) of abdomen skin (P<0.05). For the muscle color, significant higher value of lightness (59.72), yellowness (8.39) and lower value of redness (1.65) were observed in the formulated diet-fed large yellow croaker (P<0.05). In the flesh quality aspect, compared with the wild, significantly lower value of adhesiveness (14.42 g·mm), cohesiveness (0.24), springiness (2.35 mm), chewiness (213.45 g·mm) as well as higher values of liquid loss (24.21%), water loss (20.10%) and fat loss (4.11%) were observed in formulated diet-fed group (P<0.05). Wild fish had relatively higher muscle pH (7.13) and alkaline-insoluble hydroxyproline (0.34 g/kg wet basis,P<0.05), while fish from formulated diet-fed group had significantly higher content of water soluble protein (5.89% wet basis) and alkaline-soluble hydroxyproline (0.09 g/kg,P<0.05). In the nutritional value aspect, wild fish had higher content of moisture (77.61%) and protein (19.09%,P<0.05), while formulated diet-fed fish had higher value of lipid content (10.78%,P<0.05). Formulated diet-fed group had higher content of saturated fatty acids (SFA, 25.49 mg/g wet basis), mono-unsaturated fatty acids (MUFA, 29.80 mg/g wet basis), poly-unsaturated fatty acids (PUFA, 27.39 mg/g wet basis), n-3 fatty acids (n-3, 16.74 mg/g wet basis), n-6 fatty acids (n-6, 9.57 mg/g wet basis), total fatty acids (TFA, 82.69 mg/g wet basis) and higher value of PUFA/SFA (1.08), but they had lower value of n-3/n-6 (1.75,P<0.05). According to the indispensable amino acids requirement of human being, no significant difference in amount and composition of indispensable amino acids in large yellow croaker were observed between two groups (P>0.05). Except that glycine content was significantly lower in formulated diet-fed fish (0.64% wet basis,P<0.05), content of all other dispensable amino acids (7.04%, wet basis) and total amino acids (12.66%, wet basis) were not significantly influenced by formulated diet (P>0.05). It was concluded that compared with the wild, the formulated diet-fed fish had significant quality differences in body shape, skin color, muscle color and texture. However, from the human beings’ consumption aspect, the nutritional value of large yellow croaker fed with formulated diet had no significant difference from the wild.
large yellow croaker; muscle; skin color; quality; formulated diet
国家自然科学基金项目(31372542);国家星火计划项目(2014GA701001)资助
2016-04-15;
2016-05-19
孟玉琼(1987-),女,博士,专业方向:水生动物营养与饲料学。
** 通讯作者:E-mail:wzhang@ouc.edu.cn
S963.72
A
1672-5174(2016)11-108-09
10.16441/j.cnki.hdxb.20160130
孟玉琼, 马睿, 申屠基康, 等. 野生和配合饲料养殖大黄鱼品质的比较研究[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 108-116.
MENG Yu-Qiong, MA Rui, SHENTU Ji-Kang, et al. Comparative studies on the quality of wild and formulated diet-fed large yellow croaker (Larimichthyscrocea)[J]. Periodical of Ocean University of China, 2016, 46(11): 108-116.
Supported by the National Natural Science Foundation of China (31372542); The State Spark-Program China (2014GA701001)
