漆酶转化对氨基苯胂酸的研究
2016-11-16师元元季跃飞陆隽鹤
师元元,季跃飞,陆隽鹤
(南京农业大学资源与环境科学学院,南京 210095)
漆酶转化对氨基苯胂酸的研究
师元元,季跃飞,陆隽鹤*
(南京农业大学资源与环境科学学院,南京210095)
为全面了解对氨基苯胂酸(ARS)在环境中的归趋,研究了ARS在漆酶与邻苯二酚或丁香酸两种腐植酸模型化合物共同存在时的转化过程及产物鉴定。结果发现在漆酶-ARS单一体系中,漆酶并不能降解ARS;当体系中加入邻苯二酚或者丁香酸时,ARS的降解效果显著,且漆酶-邻苯二酚体系中ARS的转化更加彻底。在反应过程中,邻苯二酚和丁香酸首先在漆酶的作用下氧化成为1,2-醌和1,4-醌,然后分别和ARS发生亲核加成反应,形成聚合物,产物中均没有发现砷酸基团的脱落,始终以有机胂形态存在。
对氨基苯胂酸;漆酶;邻苯二酚;丁香酸;亲核加成
师元元,季跃飞,陆隽鹤,等.漆酶转化对氨基苯胂酸的研究[J].农业环境科学学报,2016,35(4):706-710.
SHI Yuan-yuan,JI Yue-fei,LU Jun-he,et al.Transformation of p-arsanilic acid by laccase catalyzed oxidative processes[J].Journal of Agro-Environment Science,2016,35(4):706-710.
对氨基苯胂酸(p-arsanilic,ARS)是一种饲料添加剂,具有良好的促生长和广谱杀菌作用,被广泛应用于畜禽养殖业[1]。ARS不易在动物体内累积,80%~90%的ARS几乎以药物原型随粪便排出体外[2]。这些ARS通过粪便施肥进入土壤,可以被植物吸收;也可以通过吸附、淋溶等途径在环境中发生迁移,进入到地表水和地下水;还可以在物理、化学和微生物等因素的作用下发生转化,转变为迁移能力更强、毒性更大的三价和五价的无机砷化合物[3],对环境造成严重污染。王付民等[4]对广东省长期使用ARS为饲料添加剂的15个大型猪场的周围环境进行了调查,结果表明,周边长期使用猪粪为肥料的甘薯地土壤的砷含量高达25.83~55.51 mg·kg-1,远远大于自然界砷的背景值,而甘薯根内的总砷含量高达国家规定的最高检出限0.5 mg·kg-1的3~6倍。
近用来,氧化耦合反应对环境中有机污染物归趋的研究日益引起学术界的关注。氧化耦合反应是指带有酚或者苯胺官能团的化合物被氧化形成自由基或者醌类中间体,再通过共价键相互聚合[5]。这类反应一般由某些天然金属氧化物以及由植物或真菌分泌的体外氧化酶催化。氧化耦合反应被认为在土壤腐殖化过程中起着重要作用,是土壤有机质生成的主要机制之一[6]。过氧化物酶和酚氧化酶是最重要的两大类能够催化氧化耦合反应的细胞体外酶。漆酶(Laccase)是一种常见的含铜多酚氧化酶,主要由漆树或真菌分泌产生,它以氧气作为电子受体,能催化氧化酚类、苯胺类等底物[7]。漆酶在废水处理、生物漂白、有机污染控制等方面都具有重要的应用[8]。
在漆酶作用下环境中苯胺类污染物可与腐植酸分子通过共价键形成结合态残留[9]。在此过程中,漆酶首先氧化腐植酸分子中的苯酚结构单元,将其转化为醌类中间体,后者和苯胺类污染物发生亲核加成反应。根据加成位点的不同,又可分为1,2-加成和1,4-加成两种途径[10-11]。例如,邻苯二醌中间体倾向于和苯胺通过1,4-加成进行聚合[11],而对苯醌倾向于和苯胺类物质发生1,2-加成[9,12],然后进一步脱水生成Shiff碱。ARS也是苯胺类化合物,因此可以推测,ARS进入土壤后可能在酶或者金属氧化物作用下,与土壤有机质发生反应,本研究正是建立在这一假设的基础之上。故选取邻苯二酚和丁香酸模拟腐植酸的反应活性,分别研究它们在漆酶存在下与ARS相互反应的可能性,并结合质谱(MS)和红外光谱(FTIR)分析技术,对反应的主要产物进行分析鉴定,探讨反应机理。本研究对探明ARS在环境中的归趋具有重要意义,同时可为基于漆酶催化氧化的污染修复技术提供依据。
1 材料与方法
1.1试剂与仪器
主要实验试剂:Trametes versicolor菌漆酶(Sigma-Aldrich)、ARS(Sigma-Aldrich)、邻苯二酚与丁香酸均购自国药化学试剂公司、2-2’-连氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)(Sigma-Aldrich),甲醇为进口色谱纯。所有溶液均用超纯水(>18.2 M赘)配置。
主要实验仪器:日立L-2000型高效液相色谱仪;安捷伦G6410B型质谱仪;布鲁克-傅立叶红外光谱仪(德国);Varian Cary50紫外-可见分光光度计;SL1002N型电子天平(上海民桥精密科学仪器有限公司);UP-10A型纯水机(南京前沿仪器设备有限公司)。
1.2试验方法
1.2.1酶活性的测定
采用紫外分光光度法以ABTS为底物测定漆酶活性[13]。分别取3 mL 0.3 mmol·L-1ABTS溶液(pH 3.8)和0.01 mL漆酶溶液加入1 cm比色皿中,配成混合溶液,检测其在420 nm下吸光度的变化速率,重复3次,取平均值。漆酶酶活力单位(Act)定义为每分钟氧化1 mol ABTS所需要的酶量,unit·mL-1。酶活性根据下式计算,其中r表示漆酶催化氧化ABTS产物在波长420 nm处的吸光度的变化速率,0.036为ABTS氧化产物的摩尔吸光系数。
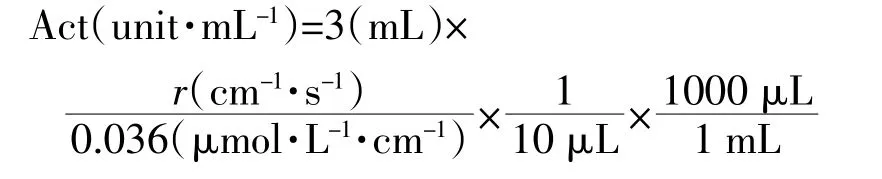
1.2.2反应设计
反应在30 mL玻璃瓶中进行,反应液中含有ARS和一种腐植酸模型化合物(邻苯二酚或丁香酸),ARS初始浓度为10滋mol·L-1,漆酶浓度1 unit·mL-1,加入0.01 mol·L-1柠檬酸-磷酸盐缓冲液控制pH为6.8。反应在室温下进行,反应过程中通过磁力搅拌器不断搅拌来保证反应所需氧气。待反应2 h后取样0.5 mL,迅速用0.5 mL甲醇混合,使酶失活,终止反应,利用高效液相色谱仪分析样品中ARS的含量,每组样品均设置未加酶液的底物溶液作为空白对照。并通过改变邻苯二酚或丁香酸的浓度,分别考查它们对ARS转化的影响。选择6个不同邻苯二酚和丁香酸浓度,分别为5、10、20、30、40、50滋mol·L-1,并分别在10、20、30、40、50、60 min后取样分析。
1.3ARS的定量分析
样品中ARS浓度采用高效液相色谱仪进行分析。采用C18反相色谱柱(Hitachi Lachrom,5滋m×250 mm),流动相采用V甲醇(1%乙酸)颐V水(1%乙酸)=20颐80等梯度洗脱,流速为1.0 mL·min-1,进样量为10滋L,紫外检测器进行检测。
1.3.1反应产物MS分析
反应在150 mL三角瓶中进行,ARS的初始浓度设为10滋mol·L-1,邻苯二酚或丁香酸浓度为10滋mol· L-1,漆酶为1 unit·mL-1,待反应30 min后,向反应液中滴加3 mol·L-1的H2SO4溶液,将反应液pH调节至2以下。再利用C18固相萃取柱(SPE)进行萃取,最后加入3 mL甲醇洗脱。设置未加入酶液的底物溶液作为空白对照。经SPE萃取得到的样品利用安捷伦G6410B型质谱仪进行分析。质谱入件为:电喷雾离子源(ESI)负离子模式检测,利用氮气作干燥气,流速保持在10 L·min-1,干燥气温度350益。
1.3.2产物的FTIR分析
此反应液准备同上,最后将反应30 min的样品经冷冻干燥48 h后,利用傅里叶红外光谱仪鉴定,测定入件为:波数范围400~4000 cm-1,分辨率4 cm-1,光阑8 mm,扫描时间16 s。进行背景扫描后,将样品KBr片放入样品架,再放入样品腔进行扫描,得到红外光谱图。
2 结果与讨论
2.1ARS在漆酶催化作用下的转化
ARS具有苯胺结构,理论上可作为漆酶底物。但是当1 unit·mL-1的漆酶和10滋mol·L-1的ARS溶液混合后,在1 h内溶液中ARS浓度并未发生变化,如图1所示,两者之间的反应并不明显。当溶液中加入50滋mol·L-1的邻苯二酚或丁香酸时,ARS浓度迅速降低,反应10 min后,ARS的浓度由初始的10滋mol· L-1分别降低到2.6、1.1滋mol·L-1左右。而预实验表明不加漆酶的溶液中ARS并没有和邻苯二酚或丁香酸发生反应。由此可以推测,邻苯二酚或丁香酸和漆酶反应生成的氧化产物对ARS的转化起到了关键作用。图2所示为ARS在含有不同浓度的邻苯二酚或丁香酸溶液中的转化。ARS的转化率随着共存的邻苯二酚或丁香酸浓度的增加而增加,当两者浓度比达到1颐5时,ARS的转化可达95%以上。对比邻苯二酚和丁香酸,显然后者对ARS的转化更有效,在浓度比为1颐1时,邻苯二酚溶液中ARS转化率接近80%,而丁香酸溶液中的ARS转化率仅为32%。
另外,在反应过程中溶液的颜色发生了明显变化,如图3所示。邻苯二酚存在时,反应液由无色渐渐转变成浅粉色;丁香酸存在时,反应液则由无色逐渐转变成米黄色。溶液颜色的变化表明反应产生了显色的官能团。由此推断,反应导致了ARS和邻苯二酚或者丁香酸通过某种方式结合,生成了具有共轭结构的产物。
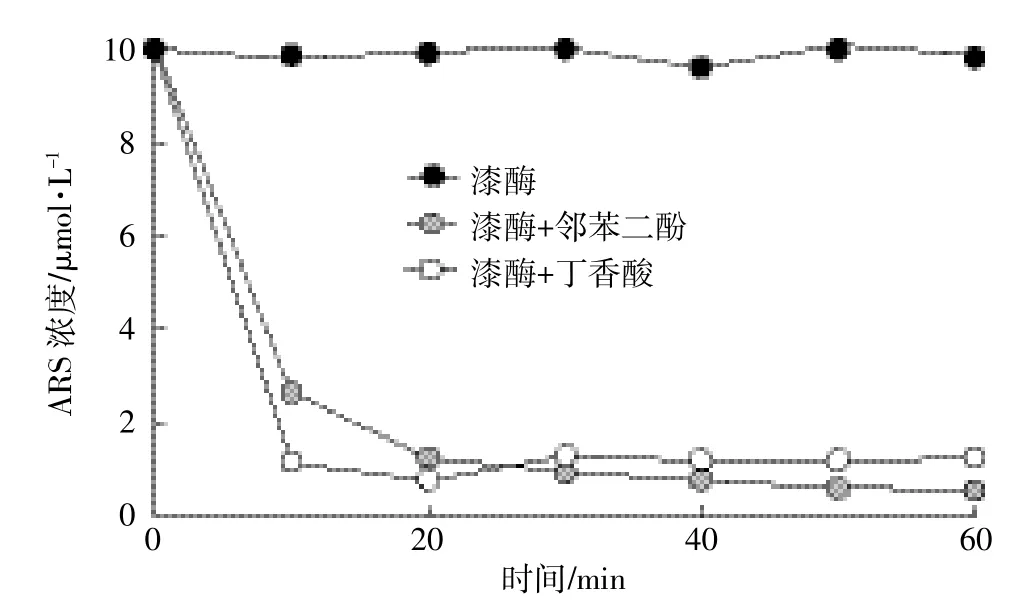
图1 漆酶、邻苯二酚和丁香酸对ARS转化的影响Figure 1 Effects of catechool and syringic acid on ARS removals
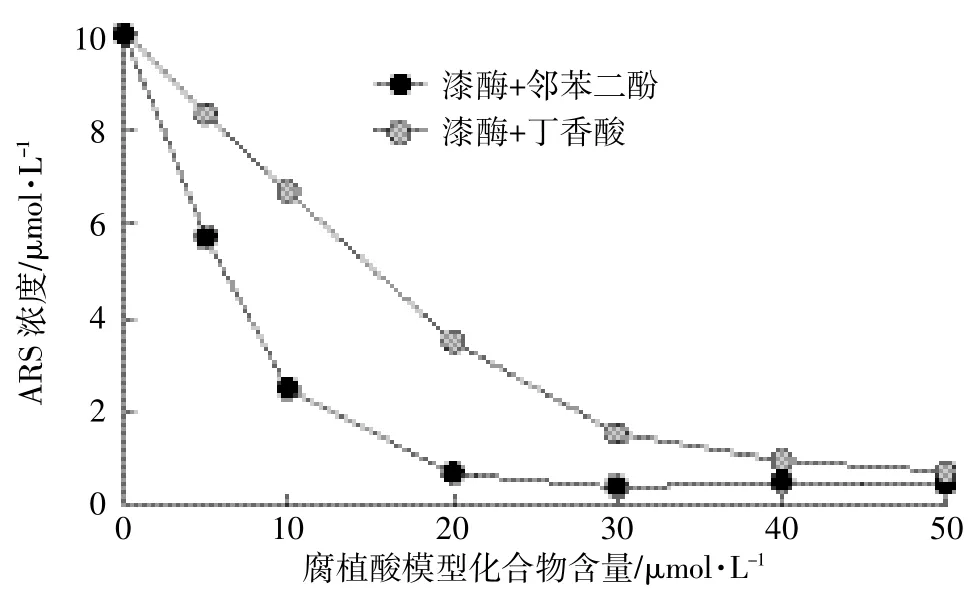
图2 不同浓度的腐植酸模型化合物对ARS的影响Figure 2 Transformation of ARS at different concentrations of humic constituents

图3 不同体系的颜色变化Figure 3 Changes of color after reaction
2.2产物分析
首先,本实验利用FTIR对ARS的产物结构进行了初步分析,采用全透射模式测定,结果如图4所示(图4a是ARS、邻苯二酚及产物的红外图谱;图4b为ARS、丁香酸及产物的红外图谱)。由图4a可以看出,邻苯二酚和ARS的产物在1720 cm-1处出现了较强的吸收峰,对应于C=O伸缩振动;同时,邻苯二酚的两个较尖的O-H伸缩振动峰(3200~3450 cm-1)消失,而且ARS中-NH2伸缩振动峰在3400 cm-1处有所偏移。由此可推测产物中具有肿胺基团,因而反应发生在ARS的氨基上。根据新生成的碳氮键及碳氧双键,可以推断ARS与邻苯二酚氧化生成的醌之间生成了共价键。
丁香酸和ARS的产物在波数为1110、1643、1743 cm-1处同样出现了较强的伸缩振动峰(图4b),分别对应于-OCH3、C=N、C=O的伸缩振动。不同于邻苯二酚的是,产物出现了C=N双键特征峰(1643 cm-1),表明可能生成了Shiff碱,同时产物中-COOH官能团的特征峰消失。由此推断,丁香酸在漆酶的作用下氧化脱羧反应形成了醌,后者和ARS的氨基反应生成Shiff碱。
为了进一步明确产物结构,本实验利用ESI/MS对ARS的产物进行分析,采用负离子模式,结果如图5所示。图5a为邻苯二酚、ARS和漆酶混合溶液的质谱,图中出现了m/z 321.8的产物峰,与之对应的物质的分子量为323,为奇数。由此推测,该物质含有N原子,而N原子来源于ARS。因此可以判断,m/z 321.8由ARS的转化产物所产生。结合该产物的分子量,以及FTIR图谱显示含有的仲胺基团以及羰基这一特征,可推测此化合物是由ARS和邻苯二醌发生亲核加成的产物。邻苯二酚被漆酶氧化形成了邻苯二醌,然后ARS分子中的氨基进攻羰基的茁碳原子,发生1,4-加成,反应过程如图6a所示。
丁香酸、ARS和漆酶反应混合液的质谱如图5b所示,和对照相比,MS图出现了新峰m/z 366.2,其对应化合物的分子量为367。同样结合该产物的分子量与红外图谱显示的C=N双键,可以确定产物是一个Shiff碱。由ARS和一个羰基化合物缩合而成,后者由丁香酸在漆酶氧化脱羧生成。该反应为1,2-亲核加成,其过程如图6b所示。
目前,我国还没有禁止ARS的使用,排放到环境中的ARS是相当可观的,而且它的降解途径的研究局限于微生物降解和光降解[14-15]。
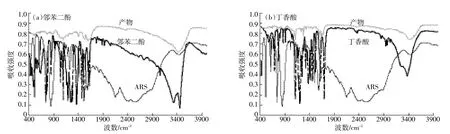
图4 ARS与腐植酸模型化合物产物的傅里叶红外光谱图Figure 4 ATR-FTIR spectra of reaction products of ARS in presence of model humics
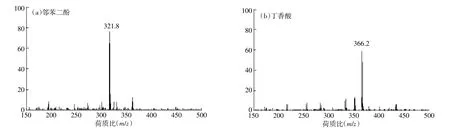
图5 腐植酸模型化合物存在时ARS的反应产物Figure 5 MS of reaction products of ARS in presence of model humic
3 结论
在漆酶的作用下,ARS可以和邻苯二酚或丁香酸通过共价键耦合形成聚合物。这一过程中邻苯二酚或丁香酸首先在漆酶氧化下转化为醌,产生缺电子碳位,随后和ARS分子中的氨基发生亲核加成反应。由于类似邻苯二酚或丁香酸的结构单元在土壤有机质分子中十分常见,而漆酶以及具有类似作用的过氧化物酶或者金属氧化物在自然界中也普遍存在,通过共价键和土壤有机质生成结合态残留可能是ARS在土壤环境中的一个重要转化途径。
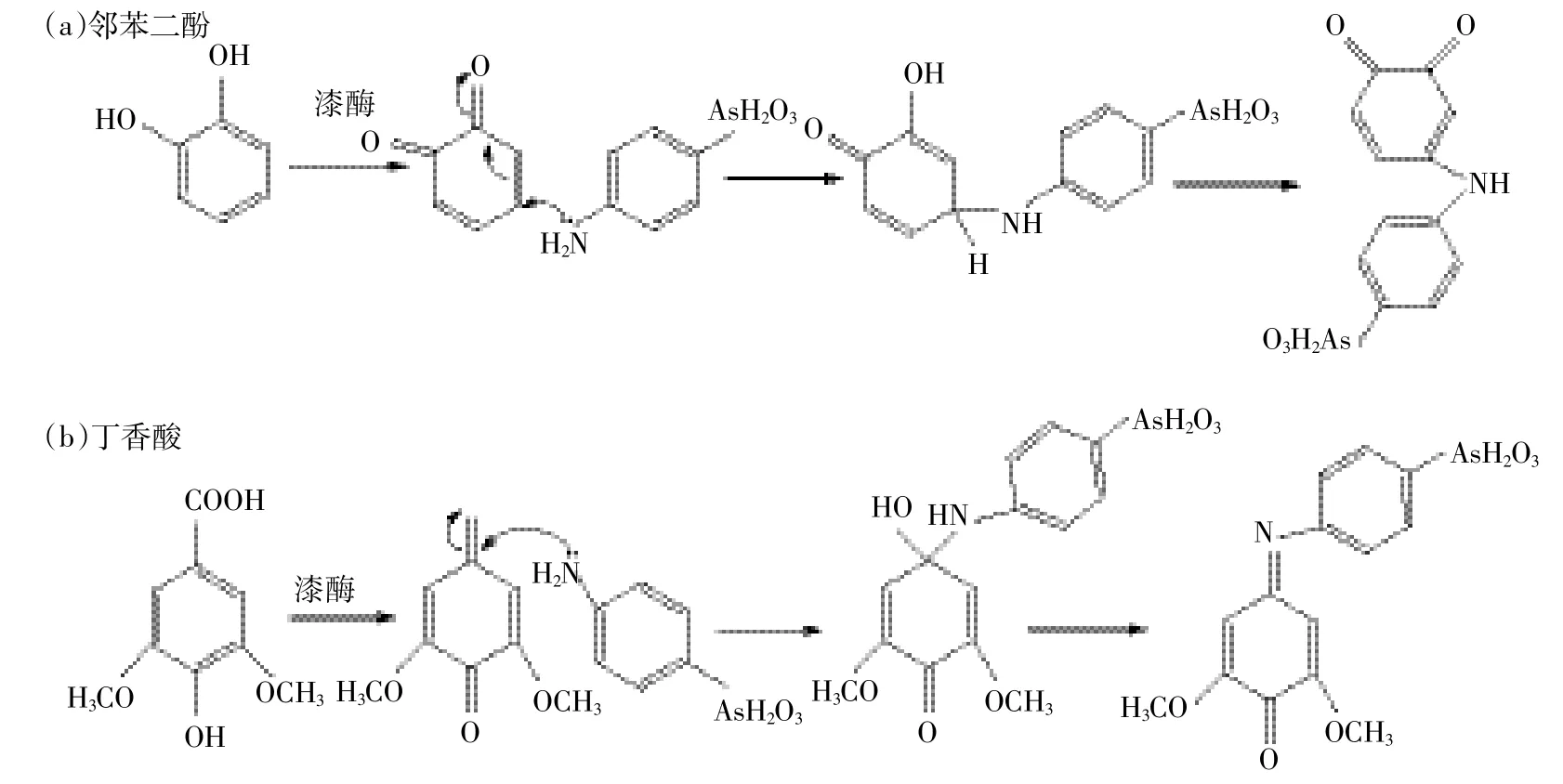
图6 漆酶-腐植酸模型化合物体系催化氧化ARS的反应机制Figure 6 Reaction pathway of ARS in laccase-model humic catalyzed treatment processes
[1]周杰,檀其梅.阿散酸对夏季肉用仔鸡生产性能的影响[J].粮食与饲料工业,1996(12):20-21.
ZHOU Jie,TAN Qi-mei.Effect of feeling the diets with aranili acid in summer on broiler production performance[J].Food and Feed Industry,1996(12):20-21.
[2]张草,白玲,郭瑞子,等.洛克沙胂暴露对土壤微生物碳代谢功能多样性的影响[J].华南农业大学学报,2014,35(5):8-13.
ZHANG Cao,BAI Ling,GUO Rui-zi,et al.Effect of roxarsone expo to carbon-soure metabolic capacity and functional diversity of soil microbial communities[J].Journal of South China Agricultural University,2014,35(5):8-13.
[3]李铁军.有机胂制剂对单胃动物营养作用的研究进展[J].中国畜牧杂志,1996,32(3):59-61.
LI Tie-jun.Research progress of the effect of the single stomach animal nutrition with organoarsenics[J].Chinese Journal of Animal Science,1996,32(3):59-61.
[4]王付民,陈杖榴,孙永学,等.有机胂饲料添加剂对猪场周围及农田环境污染的调查研究[J].生态学报,2006,26(1):154-162.
WANG Fu-min,CHEN Zhang-liu,SUN Yong-xue,et al.Investigation on the pollution of organoarsenical additives to animal feed in the surroundings and farmland near hog farms[J].Acta Ecologica Sinica,2006,26(1):154-162.
[5]Dec J,Bollag J M.Phenoloxidase-mediated interactions of phenols and anilines with humic materials[J].Journal of Environmental Quality,2000,29(3):665-676.
[6]Bollag J M,Loll M J.Incorporation of xenobiotics into soil humus[J].Experientia,1983,39(11):1221-1232.
[7]缪静,姜竹茂.漆酶的最新研究进展[J].烟台师范学院学报(自然科学版),2001,17(2):146-150.
MIU Jing,JIANG Zhu-mao.Research progress of laccase[J].Yantai Normal University Journal(Natural Science Edition),2001,17(2):146-150.
[8]魏华丽,史安石,石淑兰.漆酶及其应用[J].生物技术,2004,22(6):79-81.
WEI Hua-li,SHI An-shi,SHI Shu-lan.Advances in laccase and its applications[J].Biotechnology Bulletin,2004,22(6):79-81.
[9]Bialk H M,Simpson A J,Pedersen J A.Cross-coupling of sulfonamide antimicrobial agents with model humic constituents[J].Environmental Science and Technology,2005,39(12):4463-4473.
[10]Thorn K A,Pettigrew P J,Goldenberg W S.Covalent binding of aniline to humic substances.2.15N NMR studies of nucleophilic addition reactions[J].Environmental Science and Technology,1996,30(9):2764-2775.
[11]Gulkowska A,Krauss M,Rentsch D,et al.Reactions of a sulfonamide antimicrobial with model humic constituents:Assessing pathways and stability of covalent bonding[J].Environmental Science&Technology,2012,46(4):2102-2111.
[12]Nonhebel D C,Walton J C.Free-radical chemistry:Structure and mechanism[M].London:Cambridge University Press,1974.
[13]Park J W,Dec J,Kim J E,et al.Effect of humic constituents on the transformation of chlorinated phenols and anilines in the presence of oxidoreductive enzymes or birnessite[J].Environmental Science and Technology,1999,33(12):2028-2034.
[14]Sun R G,Wang D Y,Zhang Y T,et al.Photo-degradation of monmethylmerury in the presence of chloride ion[J].Chemosphere,2013,91(11):1471-1476.
[15]Cortinas Lopez I.Microbial transformation of arsenic and organoarsenic compounds in anaerobic environments[D].Tucson:University of Arizona,2007.
Transformation of p+arsanilic acid by laccase catalyzed oxidation process
SHI Yuan-yuan,JI Yue-fei,LU Jun-he*
(1.College of Resources and Environmental Sciences,Nanjing Agricultural University,Nanjing 210095,China)
p-Arsanilic acid(ARS),a veterinary feed additive promoting growth,may contaminate the environment.In the present study,transformation of ARS by laccase catalyzed oxidation process was investigated in the presence of catechol and syringic acid as representative humic constituents.Laccase alone could not decompose ARS.However,the presence of catechol or syringic acid facilitated ARS transformation.Fourier transform infred spectra(FTIR)and mass spectra(MS)analysis revealed that ARS was degraded via the formation of covalent bonds with quinone intermediates upon oxidation of catechol and syringic acid by laccase.In general,the reaction was a nucleophilic addition process with the aniline N acting as necleophile attacking the琢-carbon of the carbonyl group in the quinone molecules.The present findings suggest a transformation pathway of ARS in environment in addition to biodegradation and photolysis.
p-arsanilic;laccase;catechol;syringic acid;necleuphilic addition
X53
A
1672-2043(2016)04-0706-05
10.11654/jaes.2016.04.014
2015-11-15
江苏高校±势学科建设工程资助项目(PAPD)
师元元(1990—),女,河北保定人,硕士研究生,从事水污染控制研究。E-mail:2014103040@njau.edu.cn
陆隽鹤E-mail:jhlu@njau.edu.cn
