酸化来理对猪场原水和沼液存储过程中气体排放的影响
2016-11-16李路路董红敏朱志平王悦
李路路,董红敏,朱志平,王悦
(农业部设施农业节能与废弃物处理重点实验室,中国农业科学院农业环境与可持续发展研究所,北京 100081)
酸化来理对猪场原水和沼液存储过程中气体排放的影响
李路路,董红敏,朱志平*,王悦
(农业部设施农业节能与废弃物处理重点实验室,中国农业科学院农业环境与可持续发展研究所,北京100081)
为探索酸化处理对猪场原水和沼液存储过程中温室气体(CH4、N2O、CO2)以及NH3排放的影响,采用浓硫酸酸化处理猪场污水,利用动态箱法在线监测存储75 d内各气体排放通量。试验分别设置一个对照组和两个酸化处理组:原水对照组pH为6.5(RCK),加酸处理后pH分别为5.1(RT1)和5.7(RT2);沼液对照组pH为7.8(BCK),加酸处理后pH分别为5.7(BT1)和6.5(BT2)。对于原水组,RCK、RT1、RT2的CH4排放通量分别为32.2、2.37、3.10 g·m-3·d-1,N2O排放通量分别为336.45、23.36、29.79 mg·m-3·d-1,NH3排放通量分别为1.01、0.82、1.63 g·m-3·d-1,CO2排放通量分别为109.14、99.66、110.55 g·m-3·d-1,酸化处理显著降低原水CH4和N2O排放量;对于沼液组,BCK、BT1、BT2的CH4排放通量分别为0.24、0.86、0.63 g·m-3·d-1,N2O排放通量分别为2.54、73.43、268.66 mg·m-3·d-1,NH3排放通量分别为8.02、1.35、1.51 g·m-3·d-1,CO2排放通量分别为48.9、44.3、44.0 g·m-3·d-1,酸化沼液显著增加CH4和N2O排放通量,但NH3排放可显著降低81%~83%,同时酸化组内氨氮含量较对照组增加40%~54%。根据CH4和N2O在100用尺度上的全球增温潜势计算各组的综合温室效应,猪场原水酸化后CO2-eq降低91%~92%,沼液酸化后温室气体增加5~11倍。结果表明:酸化处理原水能够有效降低温室气体排放,而酸化处理沼液则一定程度上增加了温室气体排放,但可有效降低NH3排放,同时保留沼液中氮养分。
酸化处理;猪场原水;猪场沼液;温室气体;氨气
李路路,董红敏,朱志平,等.酸化处理对猪场原水和沼液存储过程中气体排放的影响[J].农业环境科学学报,2016,35(4):774-784.
LI Lu-lu,DONG Hong-min,ZHU Zhi-ping,et al.Effects of acidification on gas emissions from raw pig slurry and biogas liquid during storage[J].Journal of Agro-Environment Science,2016,35(5):774-784.
畜禽粪便是重要的温室气体排放源之一,根据《中华人民共和国气候变化第二次国家信息通报》,2005用动物粪便管理过程排放的N2O、CH4分别为26.6万t、286.4万t,分别占农业N2O、CH4排放量的28.4%和11.4%[1]。在动物粪便管理过程中,除了产生CH4、CO2、N2O等温室气体外,还会产生NH3等有害气体,同时NH3也是N2O的前体物质,结合有机质后分解可产生N2O,从而间接影响温室气体的产生与排放[2]。目前畜禽粪便管理过程中温室气体和氨气排放已引起了各国的广泛重视[3]。
国内外针对粪污存储过程中气体减排措施主要有酸化处理、改变存储方式,如固液分离[4]、施用添加剂[5]及表面覆盖[6]等。Gioelli等[4]报道了沼液经固液分离储存后可使排放的CO2-eq减少58.5%;Sakamoto等[6]报道了采用疏水性粉粒覆盖牛场粪污可使NH3和CH4排放量分别降低97%、86%。畜禽粪污酸化处理起初主要是用来减排NH3[7-9],降低粪污存储过程的氮损失,保持有机肥中氮含量,随后研究发现,酸化处理粪污不仅能够使NH3排放量降低,同时可有效降低甲烷排放[10-17]。Peterson等[10]报道了酸化牛场粪污pH为5.5时,可使CH4排放量降低67%~87%,同时可降低95%的NH3排放;Ottosen等[17]研究发现浓硫酸酸化猪场粪污使CH4排放量降低50%,同时可有效降低NH3排放量;Berg等[18]研究发现乳酸酸化粪污后,除了有效降低CH4排放外,也可有效降低N2O排放。这表明畜禽粪污管理过程中具有很大的减排潜力。
尽管国外有关酸化处理畜禽养殖污水研究相对较多,但大部分文献只是针对NH3和CH4气体排放进行的相关研究[10,11,15],针对污水酸化处理后NH3、CO2、CH4、N2O四种气体同时进行测定,以及同时比较酸化对贮存原水和沼液的气体排放影响的对比研究鲜有报道。为了探讨酸化处理对不同粪污存储过程中气体排放的影响,本试验参考国内外酸化处理方法,将畜禽粪污酸化至pH为5.5、6.5[12,15,17],选择浓硫酸酸化处理猪场原水和沼液对存储过程中气体排放影响进行研究,为原水和沼液贮存过程中选择可能的气体减排技术提供参数依据。
1 试验与方法
1.1材料与方法
试验所用污水为北京顺义某猪场排出的污水原水和厌氧发酵后的新鲜沼液。污水取回后,在中国农业科学院昌平南口中试基地进行本试验研究。
将原水、新鲜沼液分别存储于有机玻璃桶内,其直径0.4 m,高度1.25 m,污水存储高度均设置为1 m,污水存储体积为125.6 L。原水对照组pH为6.5(RCK),沼液对照组pH为7.8(BCK)。用浓硫酸将原水pH分别酸化至5.1(RT1)、5.7(RT2),沼液酸化至5.7(BT1)、6.5(BT2)。由于受多通道气体采样器通道数量限制,所有处理组和RCK设置4个重复,BCK设置3个重复,共计23个存储桶。将20个桶放置于人工气候箱内,温度控制为25益;BCK的3个桶放置于人工气候箱外,采用水浴加热,加热温度为25益。
试验中采用动态箱法在线监测贮存过程中气体排放,动态箱监测示意图见图1。试验中采用空气压缩机进行供气,通过质量流量计记录总的气体流量,空气经过气体分配器和转子流量计平均分配到各个存储桶中。设置进入存储桶的气体流量值为6L·min-1,每小时换气11~12次,出气口通过特氟龙管路连接到多通道气体采样仪和INNOVA多功能气体测定仪,实现污水存储过程中气体浓度在线监测。试验时间2014用12月1日至2015用2月13日,共计75 d。
试验过程中采用热电偶对温度进行在线监控,温度探头均设置在贮存液体的中部位置,每小时观测1次读数,以便及时进行温度调整(控制在25益左右)。
1.2样品采集与分析
1.2.1气体样品采集与分析
利用两套INNOVA多功能气体测定仪和多通道采样仪进行气体监测,每隔2 min采样一次,每桶重复5次,前4次气样用于仪器稳定,取最后一次气体分析值为测试数据。两套INNOVA气体分析仪使用前采用同一标准气体(NH3、CO2、CH4、N2O,中国计量科学研究院)进行标定,数据准确性控制在5%的误差范围内。气体监测24 h连续运行,实现对各个试验桶排放的CH4、N2O、NH3、CO2循环在线监测。
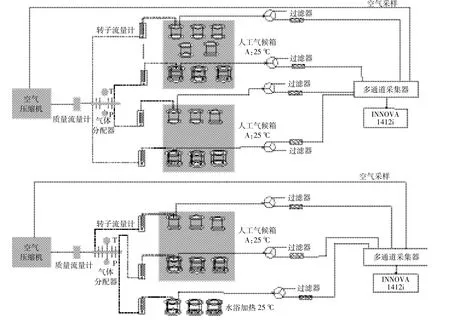
图1 动态箱监测示意图Figure 1 Schematic diagram of dynamic monitoring
根据进气口和出气口气体浓度差、进气流量和液体存储体积,计算单位体积原水和沼液的气体排放通量,公式如下:
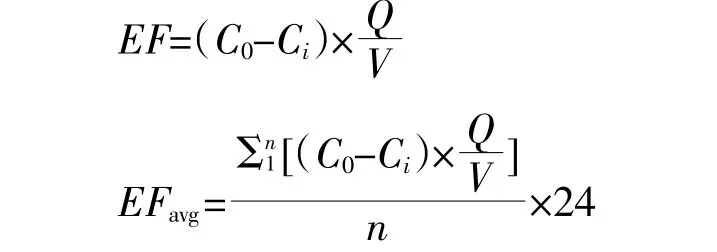
式中:EF为单位体积气体瞬时排放通量,mg·m-3·h-1;EFavg为单位体积气体日平均排放通量,mg·m-3·d-1;C0和Ci分别为出气口和进气口气体浓度,mg·m-3;Q为进入存储桶的气体流量,m3·h-1;n为1 d内各个采样桶测定的次数;V为存储体积,m3。
1.2.2液体样品采集与分析
试验开始前和结束后分别将污水充分搅拌混匀后进行采样,带回实验室分析水样的化学需氧量(COD)、溶解性有机碳(DOC)、氨氮()、总固体含量(TS)、挥发性固体含量(VS)以及pH。
污水水质分析参照《水和废水监测分析方法》[19]。COD测定采用重铬酸钾法;采用水杨酸-次氯酸盐光度法;TS采用恒重法测试,在105益烘箱中烘烤24 h,冷却后测定;DOC采用红外线检测法;pH采用便携式pH计法。VS采用恒重法测定(GB 5009.4—2010),将称量后的样品在550益马弗炉灼烧3 h,冷却后测定[20]。
1.3统计分析
采用Microsoft Excel 2010软件和SAS 9.2软件进行ANOVA方差分析,数据平均值在P<0.05水平上具有显著差异。
2 结果与讨论
2.1原水和沼液水质特性
污水的理化性质是影响污水存储过程气体排放的重要因素。试验中沼液和原水存储前后的各项指标变化见表1。
沼液和原水pH变化如图2所示,整体上均呈现渐进式升高趋势,通过测定pH发现:酸化处理原水存储75 d后pH分别从5.14、5.75上升至6.44、7.21;沼液酸化后pH分别从5.76、6.53上升到7.97、8.12。存储过程中pH值的变化情况跟黄丹丹[21]研究结果基本一致,Wang等[15]研究中沼液pH亦呈现类似的变化规律。根据化学平衡[CO2-3+H+葑HCO-3,HCO-3+H+葑CO2(aq)+ H2O(l),CO2(aq)葑CO2(g)]可知,由于存储过程中CO2释放,动态平衡向右,污水的碱度和H+浓度均会降低,所以导致pH逐渐上升[22]。
原水和沼液酸化后的初始COD浓度高于对照组,是由于酸化处理后改变了粪污理化特性。Sommer等[23]发现,浓硫酸酸化后较低的pH能够改变粪污中的颗粒物大小、胶体粒子、无机成分和溶解性物质的数量;Hjorth等[24]也报道了酸化粪污pH降至5.5时改变了粪污化学性质以及微生物的特性,酸化后的粪污包含更大尺寸的颗粒物以及更多的有机和无机溶解性物质。同时发现,BT1的COD降解最快,降解率达到37.5%,BT2中COD降解率为33.1%,BCK中COD降解率最低,只有29.5%,因为酸化沼液使得难溶性有机物溶解,可溶性COD容易被微生物利用,容易降解。试验结束后BCK和BT1、BT2中COD浓度出现显著性差异(P<0.05),但BT1、BT2之间没有显著性差异(P>0.05)。
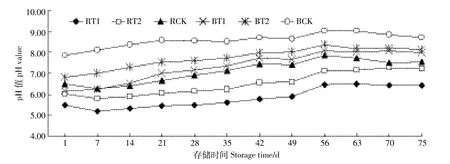
图2 原水和沼液存储过程中pH值Figure 2 pH values of raw pig slurry and biogas liquid during storage

表1 原水和沼液存储初期和末期水质指标Table 1 Characteristics of raw pig slurry and biogas liquid before and after storage
存储75 d之后,RT1氨氮含量增加了0.8%,RT2和RCK的氨氮含量则分别降低了4.5%、3.0%,而Popovic等[25]研究温度对猪场原水存储过程中氨氮含量影响时发现,25益下氨氮浓度下降显著,与本试验RCK得到的结论有一定的差异性,可能是由于粪污特性不同引起的。BT1、BT2中氨氮含量分别降低25.4%、32.1%,而BCK中氨氮含量则降低了51.1%,三个组别之间存在显著性差异(P<0.05)。原水和沼液氨氮变化呈现不同的模式,由于原水存储过程中不仅有氨气排放,可降低氨氮浓度,同时含有较高浓度的有机物,厌氧发酵过程使得一部分其他形态的氮转化成氨氮,增加氨氮浓度;而沼液中氨氮变化主要以氨气损失形式体现,Wang等[26]也报道了沼液氨氮浓度变化大于原水,与本试验类似。
试验结束后,RT1的DOC出现上升,酸化后低pH使难溶性物质溶解,而微生物活性受抑制程度高,DOC分解慢;其他处理组由于微生物活性受抑制程度相对较低,对DOC的分解作用影响较小,随着pH值的逐渐升高,微生物活性抑制减弱,DOC最终均出现下降。
2.2温度
如图3所示,采用人工气候箱加热的存储桶,前3 d有一定的升温过程,而水浴层加热的存储桶短时间内即可加热到25益。监测整个存储过程温度变化情况,RT1、RT2、RCK、BT1、BT2、BCK温度分别为(24.2依0.2)益、(24.6依0.1)益、(24.6依0.2)益、(24.7依 0.2)益、(24.7依0.1)益、(24.3依0.2)益,完全满足控制温度25益的要求。整个存储期内室内温度(RT)为(12.8依5.2)益。
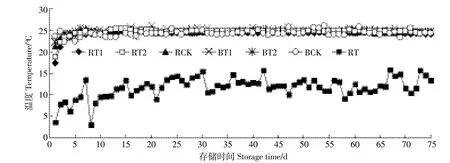
图3 存储过程中液体温度及室温变化Figure 3 Changes of temperature in liquid and room during storage
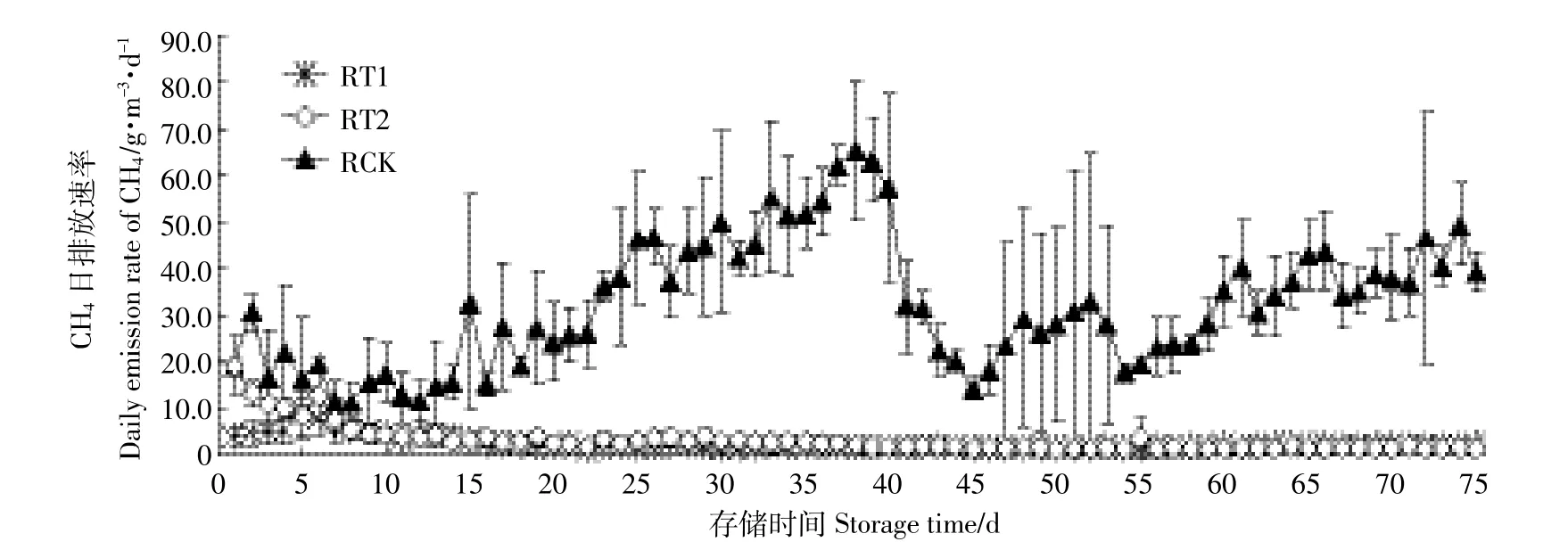
图4 不同pH下原水CH4排放Figure 4 Emissions of CH4in raw pig slurry at different pH levels
2.3气体排放特征
2.3.1CH4排放
酸化处理会改变污水中微生物群落组成与活性,CH4产生与产甲烷菌息息相关,过低的pH值将影响产甲烷菌活性,从而影响CH4产生与排放[17]。
本研究中,原水pH和CH4排放呈现极显著正相关性(r=0.878 2,P=0.000 2)。试验开始前,RCK中CH4日排放速率高于酸化处理组,第9 d开始上升,在第38 d达到排放顶峰,为(65.26依14.91)g·m-3·d-1(图4)。由于存储第8 d开始RCK表面出现结壳,且随着存储时间增加结壳变厚,形成相对厌氧环境,导致CH4日排放速率急剧增加。通过测定该阶段原水中部位置DO(溶解氧)变化,发现第10 d到21 d RCK的DO从2.45 mg·L-1降至1.14 mg·L-1。RCK组CH4第38 d后日排放速率出现短暂下降,第45 d后重新上升,整个存储期间明显高于处理组。RT2组CH4日排放速率在第1 d最高,达到(18.95依6.21)g·m-3·d-1,然后以较低速率排放;而RT1组CH4始终保持较低的排放速率。试验结束后,RT1、RT2及RCK的CH4累积排放量分别为0.16、0.23、2.14 kg·m-3。RT1、RT2的CH4累积排放量均显著低于RCK(P<0.05),对应的减排效率分别可以达到92.5%和89.3%,与Petersen等[12]酸化处理粪污可减排90%基本一致,同时处理组之间并没有显著性差异(P>0.05)。
沼液pH和CH4排放呈现极显著负相关性(r= 0.918 2,P<0.000 1)。BT1、BT2中CH4日排放速率普遍高于BCK,BT2第3 d排放速率最高,可以达到(3.51依0.30)g·m-3·d-1,随后排放速率逐渐下降。当存储时间达到16 d时,BT1的CH4排放速率开始高于BT2,出现明显上升趋势,第20 d排放速率最高,达到(2.04依0.17)g·m-3·d-1。由于该阶段BT1中DO水平从第13 d的1.40 mg·L-1降至第21 d的0.64 mg·L-1,O2消耗量明显增加,导致产甲烷菌活性增加,随后BT1排放速率开始逐渐下降(图5)。试验结束后BT1、BT2及BCK的CH4累积排放量分别为65.66、47.29、18.30 g·m-3,BT1、BT2中CH4累积排放量显著高于BCK(P<0.05),分别增加了2.59、1.58倍,BT1组CH4累积排放量也明显高于BT2组(P<0.05)。
试验中沼液pH越低,CH4排放量越高。这与Wang等[15]得出酸化处理沼液能够减排CH4的结论完全相反,可能和沼液特性与存储温度(25益vs 22~35益)不同相关,并且Wang等实验中所使用的沼液发酵不完全,仍含有较高浓度的有机物(COD:3159 mg· L-1vs 3777 mg·L-1)。Weiland等[27]报道CH4产生主要在一个相对狭窄的pH范围内(6.5~8.5),而产生CH4的最佳pH范围为7.0~8.0,如果pH低于6.0或高于8.5就会抑制CH4产生。张相锋等[28]也指出,pH值范围为6~8均可以产生CH4,适宜产甲烷菌最佳pH值范围为6.7~7.5,接近于中性入件。本试验中BCK的pH在第10 d升至8.22,然后一直处于较高的范围,产甲烷菌活性可能被抑制,故CH4产生量最低,而酸化处理后沼液pH处在产甲烷菌适宜生长的环境中,所以处理组CH4排放量高于对照组。
整个存储过程中原水的CH4排放量均高于沼液组,与Amon等[29]报道的奶牛场粪污存储气体排放特征一致。这是由于原水组中COD含量明显高于沼液组(表1),可生化性较强,为厌氧发酵提供了充足的碳源,故具有较高的CH4排放速率;Wang等[26]也报道原水的CH4排放明显高于沼液组(COD:5290 mg·L-1vs 1053 mg·L-1),与本试验具有一定的可比性。
2.3.2CO2排放
试验开始后,原水的CO2日排放速率在前6 d较高,第8 d至30 d时,RCK排放速率高于处理组,随着存储时间增加,CO2日排放速率开始下降,并慢慢趋于平缓,但存储后期RT2会略高于其他两个组(图6)。试验结束后,RT1、RT2及RCK的CO2累积排放量分别达到6.76、8.29、8.16 kg·m-3,RT1的CO2累积排放量显著低于RCK(P<0.05),RT2和RCK没有显著性差异(P>0.05)。
酸化处理沼液后,BT1组CO2排放速率在前3 d明显高于对照组,由于沼液中存在较高浓度的缓冲物质()[30-31],结合H+可产生较多的CO2,其最高排放速率达到371.7 g·m-3·d-1,且BT1中提供的H+更多,所以BT1前期排放速率也比BT2高。随着存储时间增加,CO2排放速率均趋于平缓,但BCK高于两个处理组(图7)。试验结束后,BT1、BT2以及BCK的CO2累积排放量分别为3.32、3.30、3.27 kg·m-3,三个实验组的CO2累积排放量没有显著性差异(P>0.05)。
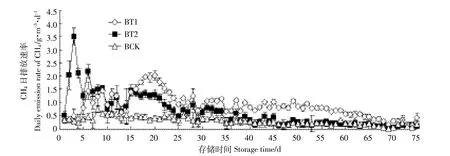
图5 不同pH下沼液CH4排放Figure 5 Emissions of CH4in biogas liquid at different pH levels
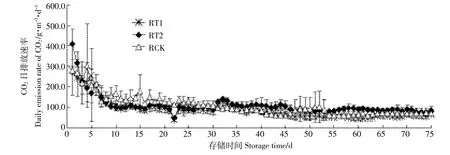
图6 不同pH下原水CO2排放Figure 6 Emissions of CO2in raw pig slurry at different pH levels
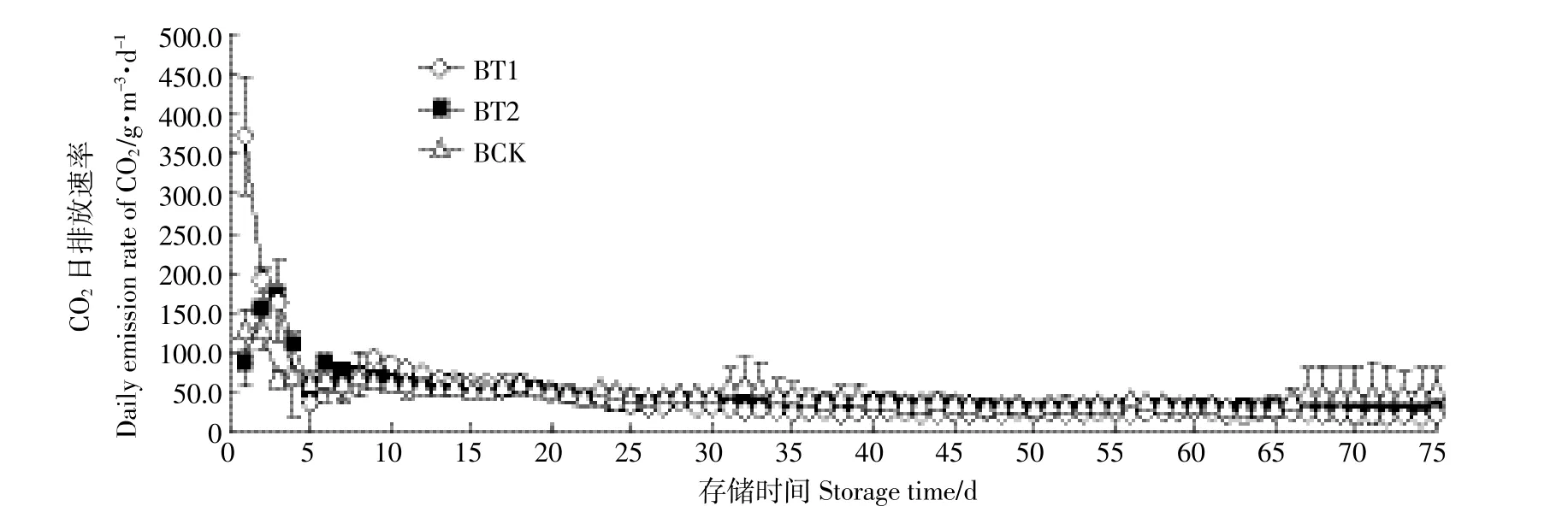
图7 不同pH下沼液CO2排放Figure 7 Emissions of CO2in biogas liquid at different pH levels
原水组CO2累积排放量显著高于沼液组(P<0.05),通过分析发现CO2排放量和COD呈现极显著正相关性(r=0.934 1,P<0.001),而原水组COD含量明显高于沼液组(表1),并且CO2排放量和CH4呈现极显著相关性(r=0.551 1,P<0.001)。李娜等[32]也报道了CO2和CH4排放呈现类似的相关性。
2.3.3N2O排放
原水的pH和N2O排放呈现极显著正相关性(r= 0.836 8,P=0.001 3)。试验开始前期,RT1、RT2与RCK组N2O的日排放速率均较低,随着存储时间的增加,第14 d后RCK的N2O排放速率出现明显上升,在第41 d达到排放顶峰,随后出现一定程度的下降,但变化幅度较小(图8)。之前研究表明,表面结壳后会引起硝化细菌和反硝化细菌增长,进而影响氧化亚氮的排放量[33-34]。Peterson等[34]和Dinuccio等[35]均报道了液体表面无结壳时,N2O的排放量基本上为0或者很少。由于处理组出现结壳较少,N2O以较低速率排放,并且没有出现明显波动。试验结束后,RT1、RT2及RCK中单位体积原水的N2O累积排放量分别为1.74、 2.23、25.23 g·m-3。RCK的N2O累积排放量明显高于处理组(P<0.05),RT1、RT2的N2O减排效率分别可以达到93.10%和91.2%,两个处理组之间没有显著差异(P>0.05)。
酸化处理沼液后随着存储时间的增加,BT1、BT2中N2O日排放速率均逐渐增加,第26 d时BT2开始高于BT1(图9)。试验结束后,BT1、BT2和BCK的N2O累积排放量分别为5.50、20.15、0.19 g·m-3。酸化处理后沼液N2O累积排放量显著增加(P<0.05),并且BT2的N2O累计排放量显著高于BT1(P<0.05)。
RCK中N2O累积排放量均明显高于沼液组(P<0.05)。Wang等[26]报道了沼液中N2O排放量远高于原水,与本试验结论相反,可能跟沼液储存高度(1 m vs 0.4 m)、存储温度(25益vs 30益)、氨氮浓度差异有关(BCK:1945 mg·L-1vs 614 mg·L-1),存储高度不同,氧化还原环境存在差异,高度越高,越容易形成厌氧环境,抑制硝化过程;同时两个试验中沼液和原水的初始pH差异也较大(RCK:6.5 vs 7.7,BCK:7.8 vs 8.2)。相关性分析发现,N2O排放和氨氮浓度呈现极显著负相关性(r=0.974 3,P=0.002),氨氮浓度越低,N2O排放量越高。
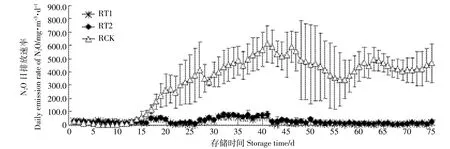
图8 不同pH下原水N2O排放Figure 8 Emissions of N2O in raw pig slurry at different pH levels
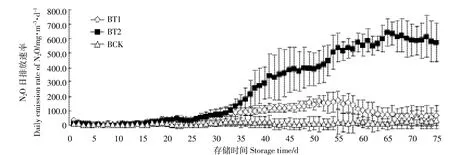
图9 不同pH下沼液N2O排放Figure 9 Emissions of NH3in biogas liquid at different pH levels
2.3.4NH3排放
就酸化减排NH3的原理而言,主要是在酸性入件下,H+浓度较高会引起NH3的动态平衡向左转移(NH+4葑NH3+H+),从而使NH3的排放量降低。
RT1、RT2中NH3日排放速率前期出现上升趋势,后期排放无明显规律;而RCK的排放速率上升到(1.80依0.21)g·m-3·d-1后出现一定程度下降,第42 d之后开始重新上升(图10)。存储75 d之后,RT1、RT2及RCK单位体积原水NH3累积排放量分别为47.28、122.07、75.50g·m-3,处理组和RCK差异显著(P<0.05),RT1的NH3减排效率达到37.4%,但RT2的NH3排放量增加了61.7%。该结果与Kai等[11]研究得出酸化能够有效降低原水中NH3排放量结论相反,可能是由于本实验中RCK结壳较厚抑制了NH3排放,故监测到的NH3排放量低。而RT2的结壳厚度明显小于RCK,故其NH3排放量高于RCK,所以RT2没有呈现减排效果;RT1中结壳最少,故结合H+后减排NH3。Smith等[36]研究了奶牛粪污存储过程中自然结壳可使NH3减排效率达到60%;Misselbrook等[37]也报道了奶牛粪污存储过程中自然结壳状态下NH3减排效率接近50%。
酸化处理沼液后,BCK中NH3在75 d存储期间内一直保持较高的排放速率(图11),并且排放速率稳定,这与初始状态下沼液中较高的氨氮含量有关。存储前期BT2的NH3日排放速率高于BT1,当存储时间增加到36 d时,BT1开始高于BT2。试验结束后,BT1、BT2和BCK单位体积内NH3的累积排放量分别可以达到102.22、113.23、580.62 g·m-3,BT1、BT2的NH3减排效率分别为82.4%、80.5%,BCK单位体积NH3累积排放量明显高于处理组(P<0.05),而BT1与BT2之间没有显著性差异(P>0.05)。由于BT1、BT2中H+浓度较高,NH3产生量降低,有效地保证了沼液中氨氮的含量,减少了氮损失。
BCK的NH3排放量明显高于RCK,进行相关性分析后发现:NH3排放和氨氮浓度呈现极显著正相关性(r=0.999 0,P<0.001),初始沼液氨氮浓度高,其NH3排放量大,Dinuccio等[35]研究中也出现相同的排放规律;同时本研究中NH3和N2O气体排放呈现极显著负相关性(r=0.958 5,P<0.001)。
2.3.5气体排放结果分析
pH是影响NH3等气体排放的重要因素。pH不同的沼液和原水,气体排放结果具有一定的差异性,如表2所示。原水组中CO2排放通量没有显著性差异(P>0.05),BT1、BT2和BCK之间CH4、CO2排放通量无显著性差异(P>0.05);RCK中N2O和CH4排放通量明显高于其他组,而BCK中NH3排放通量明显高于其他组(P<0.05)。原水中RCK的N2O的排放通量最高,沼液组中BT2的N2O排放通量最高,但是两者之间也存在显著性差异(P<0.05)。
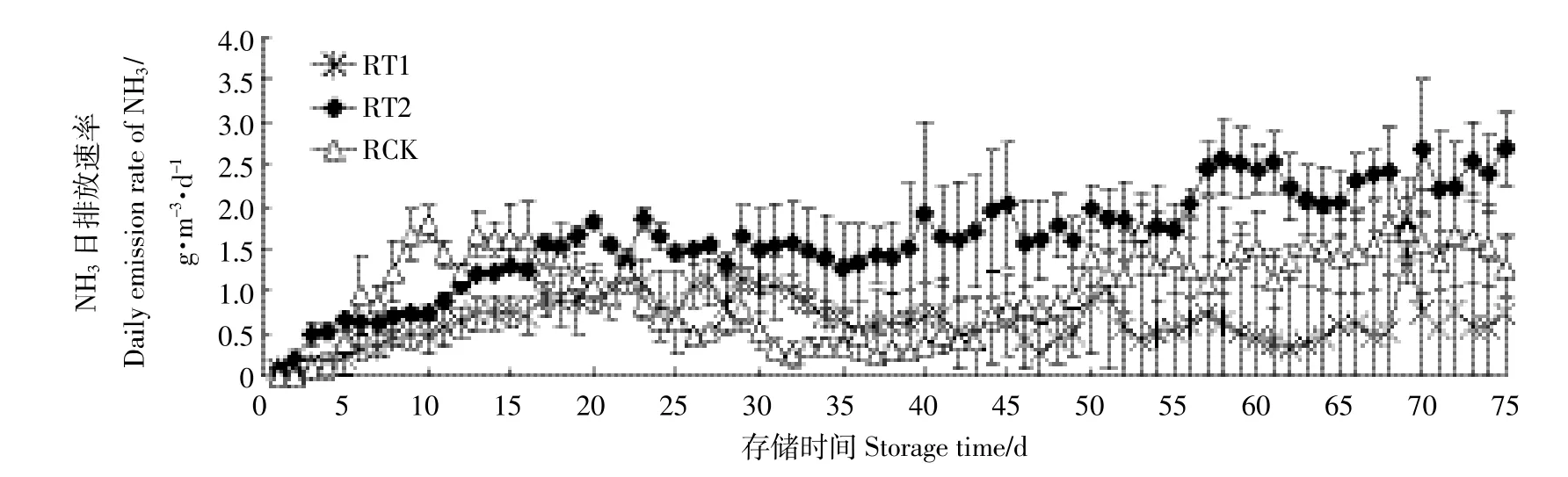
图10 不同pH下原水NH3排放Figure 10 Emissions of NH3in raw pig slurry at different pH levels

图11 不同pH下沼液NH3排放Figure 11 Emissions of NH3in biogas liquid at different pH levels
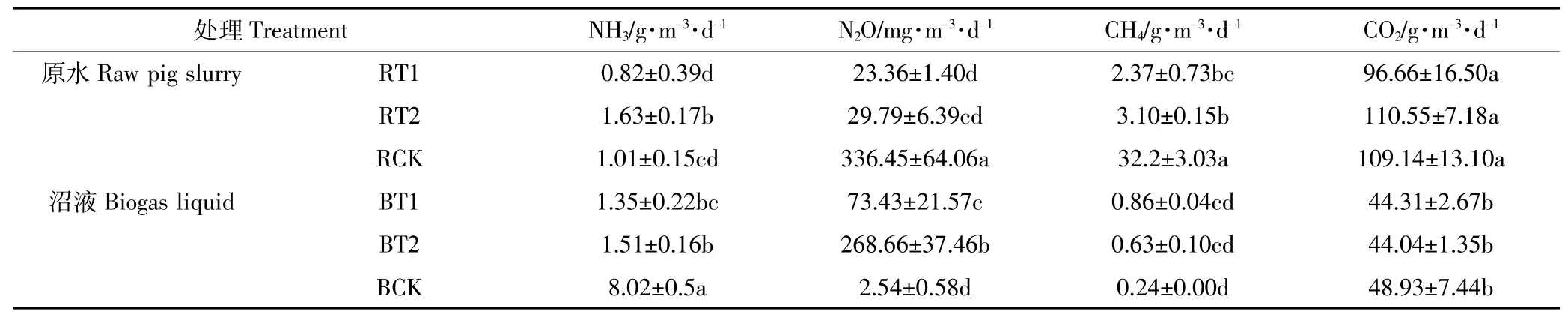
表2 不同来理组气体排放通量Table 2 Fluxes of gas emissions at different treatments(mean依sd)
2.4温室气体排放贡献分析
根据IPCC第五次评估报告,CH4和N2O的全球增温潜势(GWP)分别为CO2的28倍和265倍(100用尺度)[38],将CH4和N2O转化为二氧化碳当量(CO2-eq)可计算得出原水和沼液经过不同处理(RT1、RT2、RCK、BT1、BT2、BCK)存储75d后排放的CO2-eq(表3)。
显著性分析可知:酸化处理原水后,RT1、RT2排放的CO2-eq没有显著性差异(P>0.05),但是和对照组相比均出现显著性差异(P<0.05),酸化处理原水能够有效地降低温室气体排放,RT1、RT2减排效率分别可以达到92.3%、90.5%。而浓硫酸酸化处理沼液后,BT1和BCK排放的CO2-eq无显著性差异(P>0.05),BT2排放的CO2-eq高于BT1,但两者没有显著性差异(P>0.05),BT1、BT2排放的CO2-eq分别增加了4.9、10.8倍。结果表明,在该实验入件下,酸化处理沼液并没有减少温室气体排放,反而一定程度上增加了温室气体排放。
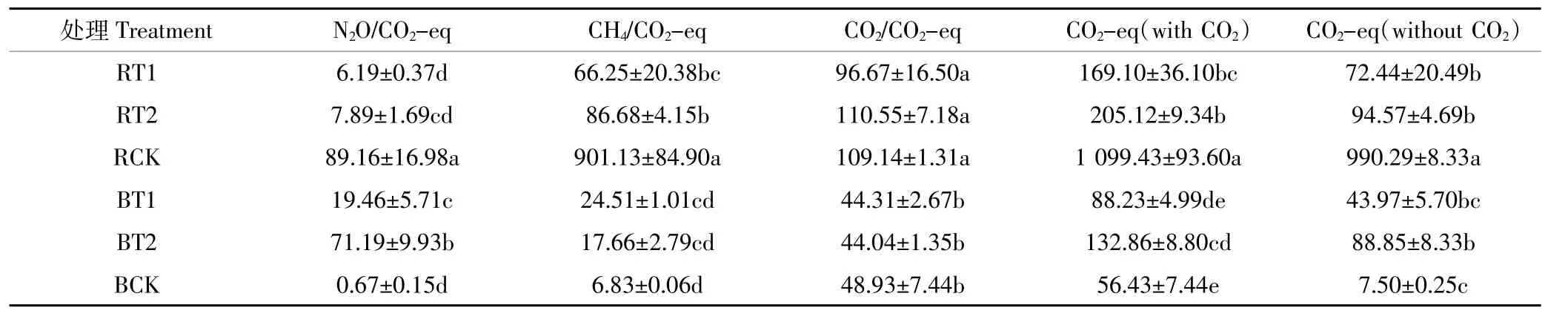
表3 不同来理下猪场原水和沼液存储过程中温室气体日排放量(g·m-3·d-1)Table 3 Daily greenhouse gas emissions from raw pig slurry and biogas liquid under different treatments during storage(g·m-3·d-1)
3 结论
本实验结果表明:两组酸化处理原水均能够显著地降低温室气体的排放,但是对于NH3减排效果有一定的差异性。
两组酸化处理沼液一定程度上能够增加温室气体的排放,主要增加了CH4、N2O的排放,但有效降低了NH3的排放量;同时酸化处理有利于保留沼液的氮养分,有效保证了作为有机肥的氮含量。
由于酸化处理原水能够有效减少温室气体排放,建议在后续研究中探讨酸化粪污后微生物群落对气体排放的影响机制,同时加强酸化后的粪污在农田利用中对土壤的影响以及田间温室气体排放特征研究。
[1]国家发展和改革委员会.中华人民共和国气候变化第二次国家信息通报[R].北京:中国经济出版社,2013:57-81.
National Development and Reform Commission of PRC.Second national communication on climate change of the People忆s Republic of China[R]. Beijing:China Economic Publishing Company,2013:57-81.
[2]谢军飞,李玉娥,董红敏,等.密闭箱处理蛋鸡粪的氧化亚氮氨气排放研究[J].农业环境保护,2002,21(6):524-526.
XIE Jun-fei,LI Yu-e,DONG Hong-min,et al.Emission of nitrous oxide and ammonia from closed composting bins containing layer-hen manure[J].Agro-environmental Protection,2002,21(6):524-526.
[3]高新星,赵立欣.养殖场蓄粪池甲烷排放研究进展及对CDM项目贡献分析[J].可再生能源,2007(6):73-77.
GAO Xin-xing,ZHAO Li-xin.Research status of methane emission from animal manure lagoon of livestock farm and analysis on its contribution to CDM project[J].Renewable Energy,2007(6):73-77.
[4]Gioelli F,Dinuccio E,Balsari P.Residual biogas potential from the storage tanks of non-separated digestate and digested liquid fraction[J]. Bioresource Technology,2011,102(22):10248-10251.
[5]McCrory D,Hobbs P.Additives to reduce ammonia and odor emissions from livestock wastes[J].Journal of Environmental Quality,2001,30(2):345-355.
[6]Sakamoto N,Tani M,Navarrete I,et al.Covering dairy slurry stores with hydrophobic fertilisers reduces greenhouse gases and other polluting gas emissions[J].Animal Production Science,2008,48(2):202-207.
[7]Eriksen J,S覬rensen P,Elsgaard L.The fate of sulfate in acidified pig slurry during storage and following application to cropped soil[J].Journal of Environmental Quality,2008,37(1):280-286.
[8]Stevens R,Laughlin R,Frost J.Effect of acidification with sulphuric acid on the volatilization of ammonia from cow and pig slurries[J].The Journal of Agricultural Science,1989,113(3):389-395.
[9]Husted S,Jensen L,J覬rgensen S.Reducing ammonia loss from cattle slurry by the use of acidifying additives:The role of the buffer system[J]. Journal of the Science of Food and Agriculture,1991,57(3):335-349.
[10]Petersen S,Andersen A,Eriksen J.Effects of cattle slurry acidification on ammonia and methane evolution during storage[J].Journal of Environmental Quality,2012,41(1):88-94.
[11]Kai P,Pedersen P,Jensen J,et al.A whole-farm assessment of the efficacy of slurry acidification in reducing ammonia emissions[J].European Journal of Agronomy,2008,28(2):148-154.
[12]Petersen S,Hojberg O,Poulsen M,et al.Methanogenic community changes,and emissions of methane and other gases,during storage of acidified and untreated pig slurry[J].Journal of Applied Microbiology,2014,117(1):160-172.
[13]Frost J P,Stevens R J,Laughlin R J.Effect of separation and acidification of cattle slurry on ammonia volatilization and on the efficiency of slurry nitrogen for herbage production[J].Journal of Agricultural Science,1990,115(1):49-56.
[14]Robert V,Joachim C.Studies on the relationship between slurry pH,volatilization processes and the influence of acidifying additives[J]. Nutrient Cyclingin Agroecosystems,1996,47(2):157-165
[15]Wang K Y,Huang D D,Ying H C,et al.Effects of acidification during storage on emissions of methane,ammonia,and hydrogen sulfide fromdigested pig slurry[J].Biosystems Engineering,2014,122:23-30.
[16]Dai X,Blanes V.Emissions of ammonia,carbon dioxide,and hydrogen sulfide from swine wastewater during and after acidification treatment:Effect of pH,mixing and aeration[J].Journal of Environmental Management,2013,115(30):147-154.
[17]Ottosen L,Poulsen H,Nielsen D,et al.Observations on microbial activity in acidified pig slurry[J].Biosystems Engineering,2009,102(3):291-297.
[18]Berg W,Brunsch R,Pazsiczki I.Greenhouse gas emissions from covered slurry compared with uncovered during storage[J].Agriculture,E-cosystems and Environment,2006,112(3):129-134.
[19]国家环境保护总局.水和废水监测分析方法[M].四版.北京:中国环境科学出版社,2002:211-281.
State Environmental Protection Administration.Methods for the monitoring and analysis of water and wastewater[M].4th Edition.Beijing:China Environmental Science Press,2002:211-281.
[20]卫生部.GB 5009.4—2010食品安全国家标准食品中灰分的测定[S].北京:中国标准出版社,2010.
Ministry of Health of PRC.GB 5009.4—2010 National food safety standard:Determination of ash in foods[S].Beijing:China Standards Press,2010.
[21]黄丹丹.猪场沼液贮存中的气体排放研究[D].杭州:浙江大学,2013:32-33.
HUANG Dan-dan.Study on gases emissions from pig digested slurry[D].Hangzhou:Zhejiang University,2013:32-33.
[22]Lei X,Sugiura N,Feng C,et al.Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification[J].Journal of Hazardous Materials,2007,145(3):391-397.
[23]Sommer G,Hjorth M,Leahy J,et al.Pig slurry characteristics,nutrient balance and biogas production as affected by separation and acidification[J].Journal of Agricultural Science,2015,153(1):177-191.
[24]Hjorth M,Cocolo G,Jonassen K,et al.Continuous in-house acidification affecting animal slurry composition[J].Biosystems Engineering,2015,132:56-60.
[25]Popovic O,Jensen S.Storage temperature affects distribution of carbon,VFA,ammonia,phosphorus,copper and zinc in raw pig slurry and its separated liquid fraction[J].Water Research,2012,46(12):3849-3858.
[26]Wang Y,Dong H M,Zhu Z P,et al.Comparison of air emissions from raw liquid pig manure and biogas digester effluent storages[J].Transactions of the ASABE,2014,5(2):635-645.
[27]Weiland P.Biogas production:Current state and perspectives[J].Applied Microbiology and Biotechnology,2010,85(4):849-860.
[28]张相锋,肖学智,何毅,等.垃圾填埋场的甲烷释放及其减排[J].中国沼气,2006,24(1):3-5.
ZHANG Xiang-feng,XIAO Xue-zhi,He Yi,et al.CH4emission and its reduction from MSW landfill[J].ChinaBiogas,2006,24(1):3-5.
[29]Amon B,Kryvoruchko V,Amon T,et al.Methane,nitrous oxide,and ammonia emissions during storage and after application of dairy cattle slurry and influence of slurry treatment[J].Agriculture,Ecosytems and Environment,2006,112(2):153-162.
[30]Sommer G,Husted S.The chemical buffer system in raw and digested animal slurry[J].Journal of Agricultural Science,1995,124(1):45-53.
[31]S覬ren H,Jensen S,J覬rgensen S.Reducing ammonia loss from cattle slurry by the use of acidifying additives:The role of the buffer system[J].Journal Science Agricultural,1991,57(3):335-349.
[32]李娜,董红敏,朱志平,等.夏季猪场污水贮存过程中CO2、CH4排放试验[J].农业工程学报,2008,24(9):234-238.
LI Na,DONG Hong-min,ZHU Zhi-ping,et al.Carbon dioxide and methane emission from slurry storage of swine farm in summer[J].Transactions of the CSAE,2008,24(9):234-238.
[33]Sommer G,Petersen O,S覬egaard T.Greenhouse gas emission from stored livestock slurry[J].Environmental Quality,2000,29(3):744-750.
[34]Petersen S,Dorno N,Lindholst S,et al.Emissions of CH4,N2O,NH3and odorants from pig slurry during winter and summer storage[J].Nutrient Cyclingin Agroecosystems,2013,95(1):103-113.
[35]Dinuccio E,Berg W,Balsari P.Gaseous emissions from the storage of untreated slurries and the fractions obtained after mechanical separation[J].Atmospheric Environment,2008,42(10):2448-2459.
[36]Smith K,Cumby J,Lapworth T,et al.Natural crusting of slurry storage as an abatement measure for ammonia emissions on dairy farms[J]. Biosystems Engineering,2007,97(4):464-471.
[37]Misselbrook T,Brookman S,Smith K,et al.Crusting of stored dairy slurry to abate ammonia emissions[J].Journal of Environmental Quality,2005,34(2):411-419.
[38]IPCC.Climate Change 2013:The physical science basis.Contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change[R].New York:Cambridge University Press,2013.
Effects of acidification on gas emissions from raw pig slurry and biogas liquid during storage
LI Lu-lu,DONG Hong-min,ZHU Zhi-ping*,WANG Yue
(Key Laboratory of Energy Conservation and Waste Management of Agricultural Structures,Ministry of agriculture,Institute of Environment& Sustainable Development in Agriculture,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
This study aimed to investigate the emissions of greenhouse gases(CH4,N2O and CO2)and ammonia from acidified raw pig slurry and biogas liquid during their storages.Dynamic flux chamber method was used to continuously monitor gaseous emissions during a 75-day storage period.One control and two treatment groups were tested.For raw pig slurry,its pH was 6.5 in control group(RCK)while 5.1(RT1)and 5.7(RT2)in the treatment groups.For biogas liquid,pH in control was 7.8(BCK),but 5.7(BT1)and 6.5(BT2)in two treatments.The average daily gas emission rates in RCK,RT1,and RT2 were 32.2,2.37,and 3.10 g CH4·m-3·d-1,336.45,23.36,and 29.79 mg N2O·m-3·d-1,1.01,0.82,and 1.63 g NH3·m-3·d-1,109.14,99.66,and 110.55 g CO2·m-3·d-1,respectively.Those of BCK,BT1,and BT2 were 0.24,0.86,and 0.63 g CH4·m-3·d-1,2.54,73.43,and 268.66 mg N2O·m-3·d-1,8.02,1.35,and 1.51 g NH3·m-3·d-1,48.9,44.3,and 44.0 g CO2·m-3·d-1,respectively.For biogas liquid,acidification significantly increased CH4and N2O emissions,but reduced NH3emissions by 81%to 83%,while increased NH+4by 40%to 54%,compared with the control.Based on 100-year global warming potentials(GWPs)of CH4and N2O,to-tal GHG(GHGs=CH4+N2O)emissions were reduced by 91%to 92%by acidifying raw pig slurry,whereas acidification increased total GHG emissions by 5 to 11 times for biogas liquid.These results show that the acidification significantly reduces GHG emissions from raw slurry,but increases GHG emissions from biogas liquid to some extent,whereas acidification significantly alleviates NH3emissions and conserves the N content in biogas liquid.
acidification;pig slurry;biogas liquid;greenhouse gas;ammonia
X713
A
1672-2043(2016)04-0774-11
10.11654/jaes.2016.04.023
2015-11-09
公益性行业科研专项(201103039,201303091);973课题(2012CB417104)
李路路(1988—),男,硕士研究生,主要研究方向为农业生物环境工程。E-mail:lilulu2014@126.com
朱志平E-mail:zhuzhiping@caas.cn
