电子鼻检测和定量表达分析相结合对烟草香气突变体进行鉴定
2016-11-16焦禹顺向小华吴新儒曹鹏云屈旭程亚增侯烁郭璇刘贯山王元英
焦禹顺,向小华,吴新儒,曹鹏云,屈旭,程亚增,侯烁,郭璇,刘贯山,王元英
1中国农业科学院烟草研究所/烟草遗传改良与生物技术重点开放实验室,青岛 266101;2 青岛中烟种子有限责任公司,青岛 266101
电子鼻检测和定量表达分析相结合对烟草香气突变体进行鉴定
焦禹顺1,向小华1,吴新儒1,曹鹏云1,屈旭2,程亚增1,侯烁1,郭璇1,刘贯山1,王元英1
1中国农业科学院烟草研究所/烟草遗传改良与生物技术重点开放实验室,青岛 266101;2 青岛中烟种子有限责任公司,青岛 266101
香气对烟草品质具有决定性的作用。我国的烟草品种普遍存在香气量不足的问题,对现有种质进行创新很有必要。诱变育种是创制新的种质资源的有力工具。本研究使用甲基磺酸乙酯(EMS)诱导中烟100产生突变,从中筛选获得5个香气突变体fgr1-fgr5。与中烟100相比,这5个突变体表现出不同的成熟性状和较高的腺毛密度。为进一步鉴定突变体的香气性状,采用PEN3型电子鼻检测了突变体和中烟100的新鲜烟叶和烤后烟叶的挥发性香气成分,并对电子鼻响应值进行主成分分析和聚类分析。结果显示,可将突变体分为两种类型:“晾晒烟类型”和“烤烟类型”,这两种类型的突变体具有不同的香气指纹图谱。对香气代谢途径中5个关键酶基因进行荧光定量表达分析,发现两种类型的突变体在基因表达水平上具有较大差异,表明它们在香气代谢相关途径中具有不同的基因表达调控机制。
烟草;突变体;香气;电子鼻;荧光定量
烟草(Nicotiana tabacum L.)是世界上重要的经济作物,而烟叶香气对其品质具有决定性作用。从烟叶中已分离出大约3000种化学成分[1],其中约有1/3与烟叶的香味有不同程度的联系。这些香气成分可分为四类:类异戊二烯、生物碱、类黄酮、花青素及其衍生物[2],这些成分在烟叶香味和品质方面具有重要作用。烟草的萜烯类和多酚类香气成分主要通过两种次级代谢途径产生:类异戊二烯途径和类黄酮途径[2]。类异戊二烯途径起始于异戊烯基焦磷酸(isopentenyl pyrophosphate, IPP),最初认为IPP是由甲羟戊酸(mevalonic acid, MVA)途径合成[3],后来发现另一条不依赖甲羟戊酸的MEP (2C-methyl-D-erythriol 4-phosphate)途径也可以合成IPP[4]。MVA途径的限速酶是3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl-glutaryl-coenzyme A reductase,HMGR),它负责将3-羟基-3-甲基戊二酰辅酶A还原为甲羟戊酸;MEP途径的关键酶是5-磷酸脱氧木酮糖还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase, DXR),它将5-磷酸脱氧木酮糖转换为4-磷酸甲基赤藓糖醇[5-6]。IPP可缩合成牻牛儿基牻牛儿基焦磷酸(geranyl-geranyl pyrophosphate,GGPP),并在八氢番茄红素合成酶(phytoene synthase, PSY)的催化下合成八氢番茄红素,继而合成类胡萝卜素[7-8]。类黄酮途径的产物是多酚类物质,其上游是苯丙烷途径,它们的关键酶分别是查尔酮合成酶(chalcone synthase, CHS)和苯丙氨酸解氨酶(phenylalnine ammonialyase, PAL),两者分别催化查尔酮的合成与苯丙氨酸的脱氨反应[9-10]。上述5个关键酶控制着烟草萜烯类和多酚类物质的合成,对烟草香气具有重要影响。腺毛与烟叶香气具有密切关系,腺毛密度与烟叶香气及品质呈正相关。作为烟草最早被观察到的解剖学特征之一,腺毛可分为两种类型:分泌型和非分泌型腺毛[11]。分泌型腺毛可以合成西柏三烯二醇,后者对烟叶香气和吃味具有积极作用;而腺头是主要的,甚至可能是唯一的西柏三烯二醇生物合成部位[12-13]。
电子鼻是一种智能嗅觉识别系统,一般由传感器阵列、模式识别系统和计算机组成,已用于食物和饮料安全性检测[14-16]、环境检测[17-18]和植物疾病诊断[19-20]等领域。当气味分子吸附在电子鼻的传感器上,导致传感器的信号发生变化,经过模数转换和运算后得到识别结果。与传统的气相色谱-质谱联用(GCMS)技术相比,电子鼻具有便于携带、检测时间短、费用低、易操作等优点[21]。电子鼻在烟草卷烟检验和识别[22]、不同烟区不同等级烟叶识别[23]、烟丝加香质量评价[24]等方面已有应用,但这些研究主要以卷烟和烤后烟叶为检测材料,应用电子鼻研究新鲜烟叶的挥发性香气成分未见报道,因此探索电子鼻在烟草香气性状鉴定中的作用显得很有意义。
诱变育种是利用物理化学因素诱发基因水平上的变异,再通过人工选择育成新品种的方法,它在创造或改变育种资源方面具有独特的优势。中烟100是中国农业科学院烟草研究所培育的优质烤烟品种,适宜全国主要烟区种植[25]。本研究使用化学诱变剂对中烟100进行诱变,创制了5个香气突变体,使用电子鼻检测突变体的新鲜烟叶和烤后烟叶的挥发性香气成分,并对突变体的香气相关的重要基因进行了表达分析,以期对突变体的香气性状和主要香气成分进行鉴定。
1 材料与方法
1.1 植物材料来源及样品制备
根据Wu等[26]的方法,2010年和2011年使用浓度为0.5%的甲基磺酸乙酯(EMS)浸泡中烟100种子16小时,再用pH=6.5、浓度为0.01 mol/L的磷酸缓冲液和自来水清洗,最后将这些经诱变的种子(M1)播种于中国农业科学院烟草研究所温室和诸城基地育苗大棚。八周后,幼苗移栽到中国农业科学院烟草研究所即墨和诸城试验基地的大田,植株现蕾时套袋自交获得M2种子,两年共获得M2种子10万份并进行系统编号与长期保存。2011年在诸城安排种植1016个M2株系共10497株,由嗅觉灵敏的闻香人员在盛花期对M2单株进行人工闻香筛选,获得48个香气突变体,收获M3种子;2012年对这些M3香气突变体进行田间闻香鉴定,获得3个闻香性状稳定或基本稳定的突变体,收获M4种子并分别命名为fgr1(fragrance1;系统编号2012MZE40003713)、fgr2(2012MZE40049222)和fgr3(2012MZE40101912);2013年继续对这3个香气突变体进行田间闻香和电子鼻检测鉴定。2012年在诸城同时大规模安排种植4502个M2株系共55065株,由闻香人员筛选获得50个香气突变体,收获M3种子;2013年对这些M3香气突变体进行田间闻香鉴定,获得2个不同于fgr1-3的香气突变体,分别命名为fgr4(2012MZE3681683)和fgr5(2012MZE3030172),并进行电子鼻检测。2014年将香气突变体fgr1、fgr2、fgr3、fgr4和fgr5以及中烟100以随机区组设计的方式种植于诸城实验基地,重复3次,每个小区15株。分别在旺长期(移栽后50天),现蕾期(移栽后60天),盛花期(移栽后70天),成熟早期(打顶后10天),成熟晚期(打顶后30天)5个时期取样。取样时每个株系每个小区选1棵长势好、无病害的烟株,分别取其上部叶和中部叶用于RNA提取和腺毛观察。
1.2 腺毛观察和密度统计
参考杨铁钊等[27]的方法并加以改进进行腺毛观察,从大田采集完全伸展的中部叶,在背面靠近主脉两侧,分别自叶尖(按叶长等分为3份,距叶尖1/3处)、叶中部及叶基部(距叶基1/3处),用镊子分别撕下一片鲜叶下表皮,立即置于载玻片上,加一滴清水展平。然后在Nikon eclipse 80i显微镜下观察并统计腺毛密度,每片表皮扫描2个视野,在放大40倍条件下观察腺毛(单个视野面积4.9151 mm2)。统计每个视野中腺毛的数量,并计算每个材料的腺毛密度平均值。
1.3 电子鼻检测挥发性香气成分
使用德国AIRSENSE公司生产的PEN3型便携式电子鼻系统对挥发性香气成分进行检测。PEN3型电子鼻由一个化学传感器阵列和一个模式识别系统组成。它的传感器阵列由10个金属氧化物半导体(metal oxide semiconductor, MOS)传感器组成,每个传感器可能对一种类型的化学成分检测更为有效,其性能见表1。每个MOS传感器含有一个金属氧化物半导体薄膜,一般由锡、锌、钨等的氧化物组成。空气中的氧气吸附在半导体薄膜表面,传感器的电阻就稳定在背景水平,此时电导率是G0;在电子鼻检测时,挥发性物质吸附在薄膜上并与其中的氧发生化学反应,进而引起传感器电阻变化,此时的电导率是G。电子鼻的响应值即G与G0的比值[28]。
使用PEN3型便携式电子鼻系统对新鲜烟叶挥发性香气成分进行检测。每个香气突变体株系选取3个长势一致的烟株,在叶片成熟后期,在常温条件(室外温度约25℃)下对试验材料进行整株套袋,设置空的塑料袋为对照,密封4小时后用电子鼻检测。设定电子鼻系统清洗时间100 s,测定时间60 s,进气量300 mL/min,对袋内的挥发性成分进行检测。根据PEN3型电子鼻对烟叶挥发性成分的响应曲线(见图2),电子鼻的响应值在30 s后基本稳定,所以取稳定后45~55 s的信号作为分析的时间点,利用自带的软件WinMuster采用主成分分析法(principal component analysis, PCA)对电子鼻检测数据进行处理,并用统计分析软件SAS进行平均距离法聚类分析(cluster analysis, CA)。
分别取试验材料的成熟叶片进行三段式烘烤,取上、中、下三个部位的烟叶混合后作为烤后烟测试样品。用切丝机分别将样品切丝,控制烟丝宽度为0.8~1.0 mm。采用静态顶空采样法,取5 g烟丝样品放在400 mL烧杯中,在室温条件(室内温度约20 ℃)下用封口膜密封4小时后用电子鼻进行检测。每个样品重复3次。设定电子鼻系统清洗时间100 s,测定时间60 s,进气量300 mL/min,对烧杯内的挥发性成分进行检测。取45~55 s的信号作为分析的时间点,取三个重复的平均值进行分析。

表1 PEN3型电子鼻的传感器及其性能Tab.1 Sensors used in PEN3 and their applications
1.4 cDNA合成与实时荧光定量PCR分析
分别取各个时期突变体和中烟100上部叶,提取总RNA,总RNA的提取步骤按照Invitrogen公司的TRIzol说明书进行。总RNA提取物用RNasefree DNase I (Invitrogen)处理去除基因组DNA。以2 μg总RNA起始用MMLV反转录酶(Invitrogen)进行第一链cDNA合成。根据PAL、CHS、HMGR、DXR和PSY等5个香气合成关键酶基因的cDNA序列合成引物(表2),用SYBR Premix Ex Taq reagent(TaKaRa)试剂盒,在7500 Real-Time PCR System(Applied Biosystems)上进行实时荧光定量PCR分析。以Ntubc2 (泛素连接酶E2, GenBank登录号AB026056)为内参基因,用2-ΔΔCt法对这5个基因的表达进行相对定量。相对表达量差异两倍以上时定为显著性差异。

表2 香气合成关键酶基因及其引物序列Tab. 2 Fragrance related key enzyme genes and their primer sequences
2 结果与分析
2.1 香气突变体表型观察和腺毛密度统计
通过对香气突变体表型观察和人工田间闻香,发现突变体fgr2和fgr3长相与晾晒烟相似,叶片难以正常落黄成熟和烘烤,具有类似于香料烟的萨姆逊香;突变体fgr1、fgr4及fgr5长相与中烟100相似,叶片可以正常落黄成熟和烘烤,具有怡人的清香。
分别选取5个香气突变体和中烟100的5个生长时期中部叶样品用于观察腺毛密度,腺毛密度是12个重复(2个视野 × 2个重复 × 3个小区)的平均值(图1)。从图1可以看出,香气突变体fgr1的腺毛密度除了在现蕾期与中烟100没有显著差异外,其他4个时期都显著地高于中烟100。香气突变体fgr2的腺毛密度与中烟100没有明显差异。香气突变体fgr3的腺毛密度在5个生长时期都明显高于中烟100。香气突变体fgr4的腺毛密度除了在成熟前期与中烟100没有显著差异外,在其他4个生长时期都显著地高于中烟100。香气突变体fgr5的腺毛密度在前三个生长时期明显高于中烟100,而在后两个时期与中烟100没有显著差异。由于烟草腺毛中合成的西柏烷类和赖百当类成分对烟草香气有重要作用[13,29],所以腺毛密度较高的突变体fgr1、fgr3、fgr4及fgr5可能具有较高的香气成分含量。

图1 不同生育期香气突变体与中烟100的腺毛密度Fig.1 Trichome density calculation of different fragrant mutants and Zhongyan-100
2.2 中烟100及其香气突变体挥发性香气成分的电子鼻检测
2.2.1 PEN3型电子鼻对烟叶挥发性香气成分的响应
PEN3型电子鼻系统对烟叶挥发性香气成分检测的典型响应曲线见图2。从图上可以看出,电子鼻的响应值G/G0刚开始时接近1,随着挥发性成分进入电子鼻检测系统,传感器的电导率迅速升高并在30秒后基本稳定。另外,PEN3型电子鼻对新鲜烟叶挥发性成分的响应最高的传感器是W7,向下依次是W2、W9、W6、W8(图2a);对烤后烟叶挥发性成分的响应最高的三个传感器依次是W7、W9、W2(图2b)。可以看出,传感器W6和W8对新鲜烟叶的挥发性成分响应较高,而对烤后烟叶的响应很低,说明新鲜烟叶和烤后烟叶的挥发性香气成分存在较大差异。

图2 电子鼻10个传感器对中烟100新鲜烟叶和烤后烟叶挥发性香气成分的典型相应曲线Fig. 2 Typical response curves of 10 sensors to volatile components from fresh leaves and fl ue-cured leaves of tobacco Zhongyan-100
2.2.2 电子鼻对香气突变体的挥发性香气成分的检测
使用PEN3型电子鼻分别对5个香气突变体及中烟100、革新三号的新鲜烟叶和烤后烟叶进行挥发性成分的检测。分别取稳定后的45~55秒的信号作为分析的时间点,取三个重复的平均值减去对照的平均值做雷达图进行分析(图3)。从图3可以看出,电子鼻对不同材料的新鲜烟叶的挥发性成分具有不同的响应值和响应模式,每个材料都有特异的指纹图谱(图3a)。香气突变体fgr2和fgr3在传感器W2上的响应值明显比其他材料大,而突变体fgr4和fgr5在传感器W6、W8上的响应值显著高于其他材料。但在烤后烟叶的挥发性成分检测中,这些材料之间的差异不显著(图3b)。烤后烟叶的挥发性成分的响应以W7、W9、W2的值较高,且几个材料之间的差别非常小。
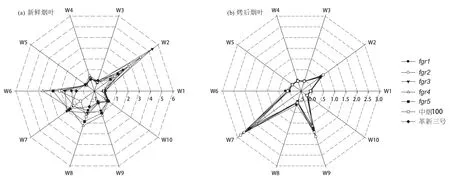
图3 电子鼻对香气突变体新鲜烟叶和烤后烟叶挥发性香气成分的雷达响应图Fig. 3 Radar response areas of e-nose to fresh leaves and fl ue-cured leaves of different fragrant mutants
2.2.3 新鲜烟叶挥发性香气成分的主成分分析与聚类分析
为了进一步明确各香气突变体的挥发性香气成分与中烟100的差别,对各试验材料的电子鼻响应值进行了主成分分析(PCA)和聚类分析(CA),聚类分析使用SAS软件的平均距离法进行距离判断(图4和5)。主成分分析的前两个主成分PC1和PC2的累计方差贡献率达到98.44%,可以代表10个传感器响应值的总体情况。从主成分分析图可以看出,除了fgr1与革新三号之间有部分重叠以外,其它材料之间都可以有效地区分开。fgr5与中烟100的距离较近,它们可能具有相似的香气成分。进一步的聚类分析验证了主成分分析的结果,fgr1和革新三号聚在一类;fgr5与中烟100聚在一起,两者又与fgr4聚为一类;fgr2和fgr3聚为一类。
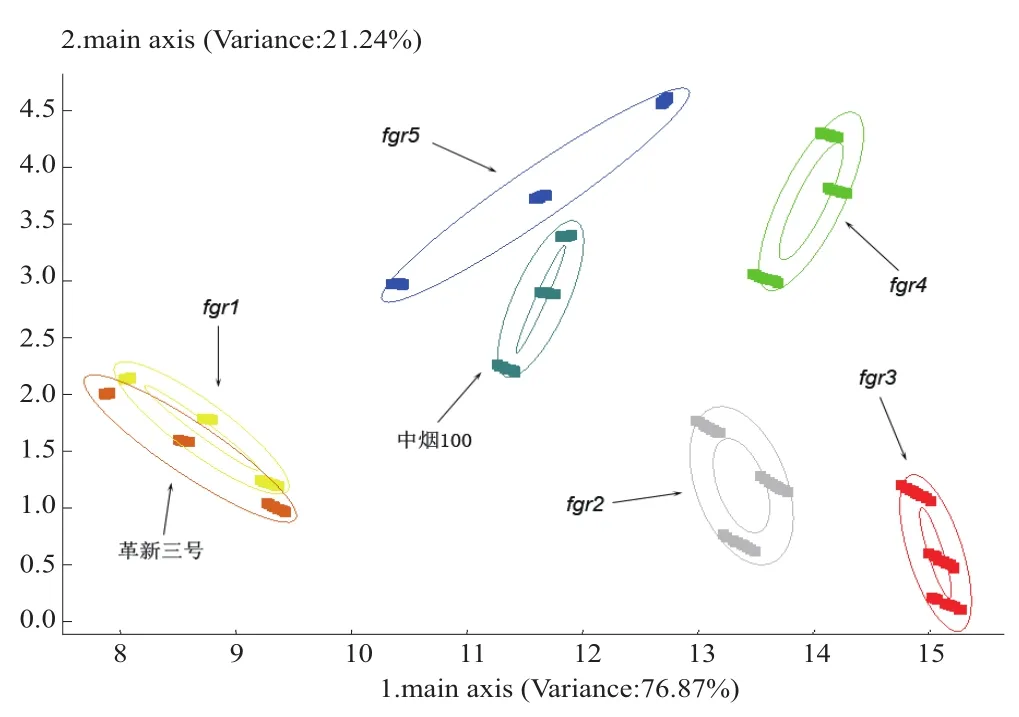
图4 中烟100及其香气突变体的新鲜烟叶挥发性香气成分的主成分分析Fig. 4 Principal component analysis of fresh leaf volatile components of Zhongyan-100 and its fragrant mutants

图5 中烟100及其香气突变体的新鲜烟叶挥发性香气成分的聚类分析Fig.5 Cluster analysis of fresh leaf volatile components of Zhongyan-100 and its fragrant mutants
2.3 实时荧光定量表达分析
腺毛密度观察结果发现,香气突变体fgr3和fgr4的腺毛密度明显高于中烟100,而且聚类分析的结果将fgr3和fgr4分为两类,雷达图表明电子鼻对fgr3和fgr4的新鲜烟叶具有不同的响应模式,所以可将fgr3和fgr4作为两种类型的代表研究香气相关基因的表达。从香气物质代谢网络中挑选5个与香气代谢相关的关键酶PAL、CHS、HMGR、DXR和PSY基因,通过实时荧光定量PCR研究它们在香气突变体fgr3、fgr4和中烟100中的表达。这些基因在3个材料5个生长时期共15个样品中的相对表达量如图6所示。从图6可以看出,PAL在5个生长时期的香气突变体fgr3中的表达量与中烟100没有显著差异,但是在现蕾期和盛花期的fgr4中的表达量显著地高于fgr3。CHS在现蕾期的fgr3和fgr4中的表达量明显高于中烟100,在盛花期和成熟后期的fgr3中的表达显著低于中烟100和fgr4。HMGR的表达量在香气突变体和中烟100之间的差异没有达到2倍以上的显著水平,但是它的表达模式与另外几个基因明显不同,即前面4个时期的表达量都较低,只在成熟后期的表达量升高。DXR在前3个时期的fgr3中表达量很高,显著高于中烟100,尤其是在现蕾期,DXR在fgr3中的表达量是中烟100的8倍,在后两个时期的香气突变体和中烟100中没有显著差异。PSY在现蕾期和盛花期的fgr4中的表达量明显高于中烟100,而在成熟后期的fgr4中表达量明显低于fgr3。
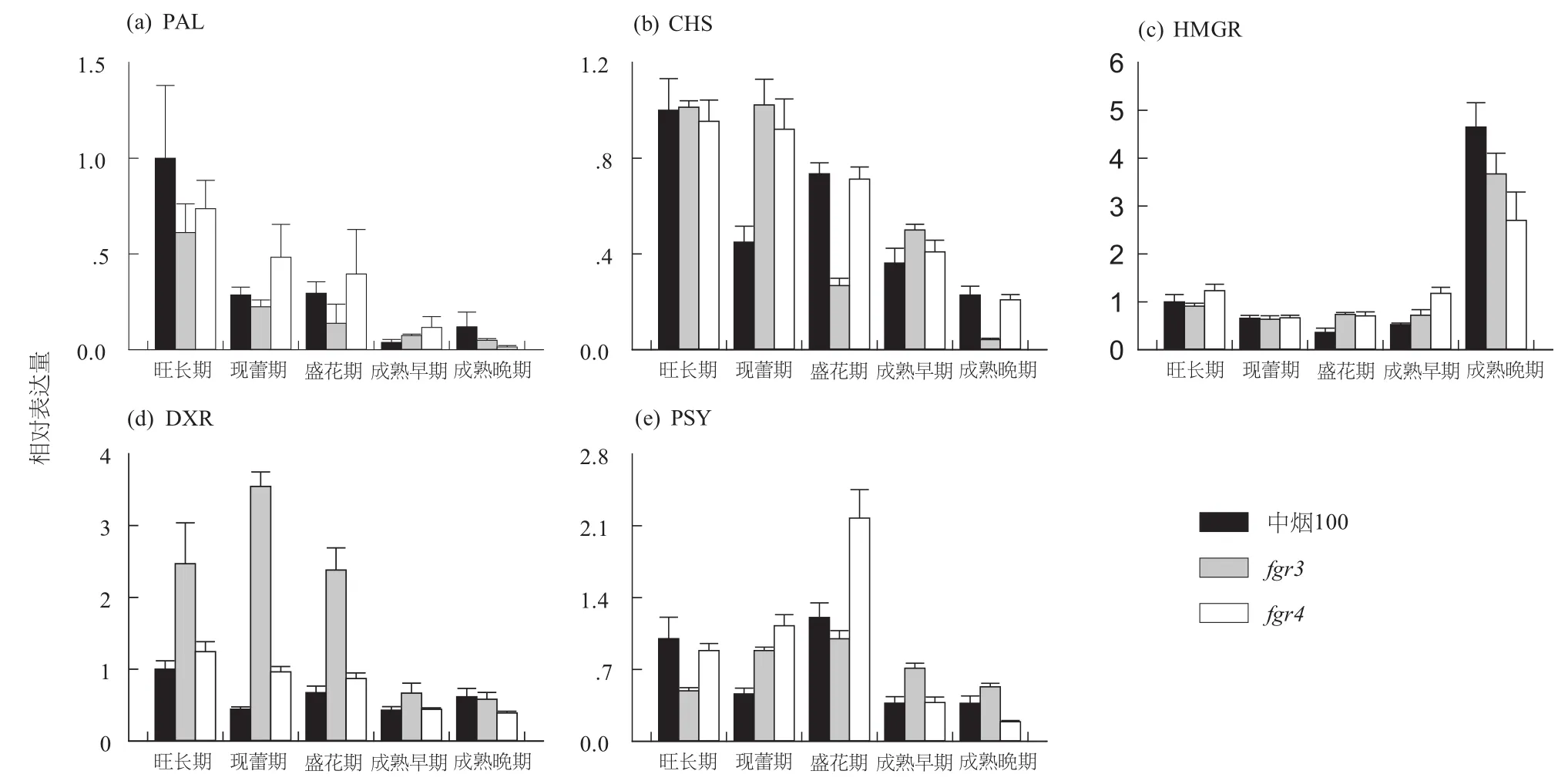
图6香气代谢相关途径的关键酶的实时荧光定量分析Fig. 6 Real-time quantitative analysis of key enzymes of fragrance-related metabolic pathways
3 讨论
3.1 香气突变体的腺毛密度高于中烟100
比较5个香气突变体与中烟100的腺毛密度发现,除了fgr2与中烟100的腺毛密度没有明显差异外,其他香气突变体的腺毛密度都比中烟100高,尤其是fgr3和fgr4的最高(图1)。据薛晓明等[30]报道,不同品种烤烟的下表皮腺毛密度在618-968根/cm2,与本研究的结果相似。在晾晒烟中,香料烟的腺毛密度(3300-6820根/cm2)明显高于烤烟[31],香气突变体fgr3的长相与晾晒烟相似,并且fgr3的腺毛密度明显高于中烟100,因此推测突变体fgr3发生突变的位点可能与植株长相和腺毛密度有关。
3.2 不同香气突变体可以分为2种类型
通过对电子鼻响应值的主成分分析和聚类分析(图4和图5)发现,fgr2和fgr3聚为一类,fgr4、fgr5与中烟100聚为一类。实际上,fgr2和fgr3的表型与晾晒烟类似,叶片不能正常落黄,难以烘烤,把这类突变体归为“晾晒烟类型”;fgr4和fgr5的表型与中烟100类似,到成熟期叶片可以正常落黄,易烘烤,把这类突变体归为“烤烟类型”。从新鲜烟叶挥发性成分的电子鼻响应图(图3a)上看,“晾晒烟类型”香气突变体在传感器W2上的响应值较高,“烤烟类型”香气突变体在W6和W8上的响应值较高,两类突变体具有不同的香气指纹图谱。
3.3 两种类型的香气突变体在代谢途径上存在差异
“晾晒烟类型”香气突变体以fgr3为代表,“烤烟类型”突变体以fgr4为代表,以fgr3、fgr4和中烟100为试验材料对5个关键基因进行了荧光定量PCR分析(图6)。DXR是MEP途径的关键酶,DXR在fgr3的前3个时期表达量非常高,暗示MEP途径对fgr3的香气合成有重要贡献。类胡萝卜素途径的关键酶PSY在fgr4的现蕾期和盛花期的表达量显著高于中烟100,表明类胡萝卜素途径在fgr4中具有重要作用。类胡萝卜素降解可产生巨豆三烯酮、大马酮、β-紫罗兰酮等香气成分,据王能如等[32]研究发现,大马酮、巨豆三烯酮含量越高,烤烟的香味品质越好,所以两者的前体物类胡萝卜素的含量对烤烟的香味品质也有重要影响。
3.4 两种类型的香气突变体可能具有不同的基因表达调控机制
fgr3和fgr4的关键酶基因具有不同的表达模式。PAL和PSY在fgr3中的表达水平随生长时期的变化相对缓和,而在fgr4中的盛花期与成熟前期的变化较大。DXR在fgr4中的表达量在各生长时期的变化较小,而在fgr3的成熟前期剧烈降低。CHS在fgr4中的表达量随生长时期缓慢下降,而在fgr3中的盛花期和成熟后期有2次剧烈的下降。这些基因在2个香气突变体中表达水平上具有明显差异,表明了2种类型的香气突变体在香气代谢的相关途径中具有不同的基因表达调控机制。
4 结论
本研究通过对中烟100进行诱变创制了5个香气突变体,通过观察香气突变体腺毛确认其具有高密度腺毛特征,应用PEN3型电子鼻检测香气突变体新鲜烟叶和烤后烟叶的挥发性香气成分,将香气突变体分为两种类型:“晾晒烟类型”与“烤烟类型”,明确了两种类型突变体具有不同的香气指纹图谱。对香气代谢途径的5个关键酶基因的荧光定量PCR分析发现,MEP途径对fgr3的香气成分贡献较大,而类胡萝卜素途径在突变体fgr4中具有重要作用;2个香气突变体表达水平上的差异表明它们在香气代谢相关途径中具有不同的基因表达调控机制。未来可以利用抑制性差减杂交、转录组测序、代谢组测序等技术手段进一步研究2种不同类型的香气突变体在基因表达和香气成分之间的差异。
[1] Layten Davis D, Nielsen M T. Tobacco: production,chemistry and technology [M]. Oxford: Blackwell Science Ltd, 1999: 265-284.
[2] Nugroho L, Verpoorte R. Secondary metabolism in tobacco[J]. Plant Cell, Tissue and Organ Culture, 2002, 68(2): 105-125.
[3] Chappell J. The biochemistry and molecular biology of isoprenoid metabolism [J]. Plant Physiology, 1995, 107(1):1-6.
[4] Lichtenthaler H K. The 1-deoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants [J]. Annual Review of Plant Physiology and Plant Molecular Biology,1999, 50(1): 47-65.
[5] Hemmerlin A, Hoeffler J F, Meyer O, et al. Cross-talk between the cytosolic mevalonate and the plastidial methylerythritol phosphate pathways in tobacco bright yellow-2 cells [J]. The Journal of Biological Chemistry,2003, 278(29): 26666-26676.
[6] Pulido P, Perello C, Rodriguez-Concepcion M. New insights into plant isoprenoid metabolism [J]. Molecular Plant, 2012,5(5): 964-967.
[7] Hirschberg J. Carotenoid biosynthesis in flowering plants[J]. Current Opinion in Plant Biology, 2001, 4(3): 210-218.
[8] Cunningham F X, Gantt E. Genes and enzymes of carotenoid biosynthesis in plants [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1998,49(1):557-583.
[9] Grotewold E. The science of flavonoids [M]. New York:Springer, 2006: 71-80.
[10] Noel J P, Austin M B, Bomati E K. Structure-function relationships in plant phenylpropanoid biosynthesis [J].Current Opinion in Plant Biology, 2005, 8(3): 249-253.
[11] Wagner G J, Wang E, Shepherd R W. New approaches for studying and exploiting an old protuberance, the plant trichome [J]. Annals of Botany, 2004, 93(1): 3-11.
[12] Wang E, Wagner G J. Elucidation of the functions of genes central to diterpene metabolism in tobacco trichomes using posttranscriptional gene silencing [J]. Planta, 2003,216(4):686-691.
[13] Keene C K, Wagner G J. Direct demonstration of duvatrienediol biosynthesis in glandular heads of tobacco trichomes [J]. Plant Physiology, 1985, 79(4): 1026-1032.
[14] Macías M M, Manso A G, Orellana C J, ea al. Acetic acid detection threshold in synthetic wine samples of a portable electronic nose [J]. Sensors, 2012, 13(1): 208-220.
[15] Tian Xiu-ying, Cai Qiang, Zhang Yong-ming. Rapid classification of hairtail fish and pork freshness using an electronic nose based on the PCA method [J]. Sensors,2011, 12(1): 260-277.
[16] Wang Yongwei, Wang Jun, Zhou Bo, et al. Monitoring storage time and quality attribute of egg based on electronic nose [J]. Analytica Chimica Acta, 2009, 650(2): 183-188.
[17] 卜凡阳, 文晓刚, 万梅, 等. 电子鼻检测污染土壤中挥发性氯代烃的适用性研究. [J] 环境科学, 2011, 32(12):3641-3646.Bu Fanyang, Wen Xiaogang, Wan Mei, et al. Applicability of an electronic nose for detection of volatile chlorinated hydrocarbons in soil [J]. Environmental Science, 2011,32(12): 3641-3646. (in Chinese)
[18] Dentoni L, Capelli L, Sironi S, et al. Development of an electronic nose for environmental odour monitoring [J].Sensors, 2012, 12(11): 14363-14381.
[19] Baietto M, Wilson A D, Bassi D, et al. Evaluation of three electronic noses for detecting incipient wood decay [J].Sensors, 2010, 10(2): 1062-1092.
[20] Blasioli S, Biondi E, Braschi I, et al. Electronic nose as an innovative tool for the diagnosis of grapevine crown gall [J].Analytica Chimica Acta, 2010, 672(1): 20-24.
[21] Chiu Shih-wen, Tang Kea-tiong. Towards a chemiresistive sensor-integrated electronic nose: a review [J]. Sensors,2013, 13(10): 14214-14247.
[22] 朱先约, 宗永立, 李炎强, 等. 电子鼻技术及其在烟草行业中的应用 [J]. 中国烟草学报, 2008, 14(4): 66-70.Zhu Xianyue, Zong Yongli, Li Yanqiang, et al. Electronic nose and its application in the tobacco industry [J]. Acta Tabacaria Sinica, 2008, 14(4): 66-70. (in Chinese)
[23] 毛友安, 刘巍, 黄建国, 等. 用电子鼻技术评价烟叶挥发性组分的研究 [J]. 化学传感器, 2006, 26(2): 23-28.Mao Youan, Liu Wei, Huang Jianguo, et al. Evaluation of volatile components in tobacco by electronic nose [J].Chemical Sensors, 2006, 26(2): 23-28. (in Chinese)
[24] 于宏晓, 徐海涛, 马强, 等. 电子鼻气味指纹数据对烟丝加香质量的评价 [J]. 中国烟草科学, 2010, 31(2): 63-66.Yu Hongxiao, Xu Haitao, Ma Qiang, et al. Quality evaluation of flavored cut tobacco using sensor array fingerprint technology of electronic nose [J]. Chinese Tobacco Science, 2010, 31(2): 63-66. (in Chinese)
[25] 贾兴华, 王元英, 佟道儒, 等. 烤烟新品种中烟100(CF965)的选育及其应用评价 [J]. 中国烟草学报,2006, 12(2): 20-24, 25.Jia Xinghua, Wang Yuanying, Tong Daoru, et al.Development of a new flue-cured tobacco variety Zhongyan-100(CF965) and its application evaluation [J].Acta Tabacaria Sinica, 2006, 12(2): 20-24, 25. (in Chinese)
[26] Wu Qingzhang, Wu Xinru, Zhang Xuefeng, et al. Mapping of two white stem genes in tetraploid common tobacco(Nicotiana tabacumL.) [J]. Molecular Breeding, 2014,34(3): 1065-1074.
[27] 杨铁钊, 李伟, 李钦奎, 等. 烤烟叶面腺毛密度及其分泌物变化动态的相关分析 [J]. 中国烟草科学, 2005, 26(1):43-46.Yang Tiezhao, Li Wei, Li Qinkui, et al. Analysis of the varying trends and correlation of the density of glandular trichome and leaf surface exudate of fl ue-cured tobacco [J].Chinese Tobacco Science, 2005, 26(1): 43-46. (in Chinese)
[28] Ampuero S, Bosset J. The electronic nose applied to dairy products: a review [J]. Sensors and Actuators B: Chemical,2003, 94(1): 1-12.
[29] Weeks W W, Sisson V, Chaplin J. Differences in aroma,chemistry, solubilities, and smoking quality of cured fl uecured tobaccos with aglandular and glandular trichomes [J].Journal of Agricultural and Food Chemistry, 1992, 40(10):1911-1916.
[30] 薛晓明, 侯森林, 于丽杰. 10个烤烟品种间的腺毛密度比较研究 [J]. 安徽农业大学学报, 2014, 41(6): 1012-1016.Xue Xiaoming, Hou Senlin, Yu Lijie. Difference in the glandular hair density in 10 fl ue-cured tobaccos [J]. Journal of Anhui Agricultural University, 2014, 41(6): 1012-1016.(in Chinese)
[31] 杨志新, 罗建蓉, 陈学军, 等. 几个香料烟品种及其子代的腺毛密度差异比较 [J]. 福建农林大学学报(自然科学版), 2012, 31(2): 118-121.Yang Zhixin, Luo Jianrong, Chen Xuejun, et al. Comparison of trichome density among oriental tobacco germplasms and their fi lial generations [J]. Journal of Fujian Agricultere and Forestry University (Natural Science Edition), 2012, 31(2):118-121. (in Chinese)
[32] 王能如, 李章海, 王东胜, 等. 我国烤烟主体香味成分研究初报[J]. 中国烟草科学, 2009, 30(3): 1-6.Wang Nengru, Li Zhanghai, Wang Dongsheng, et al.Preliminary study on principal aroma and fl avor constituents of flue-cured tobacco in China [J]. Chinese Tobacco Science, 2009, 30(3): 1-6. (in Chinese)
Identi fi cation of fl avoring mutants in Nicotiana tabacum using electronic nose combined with qRT-PCR
JIAO Yushun1,XIANG Xiaohua1,WU Xinru1,CAO Pengyun1,QU Xu2,CHENG Yazeng1,HOU Shuo1,GUO Xuan1,LIU Guanshan1,WANG Yuanying1
1 Tobacco Research Institute, Chinese Academy of Agricultural Sciences / Key Laboratory for Tobacco Gene Resources,Qingdao 266101, China;2 Qingdao Tobacco Seed Co., Ltd., Qingdao 266101, China
Flavor is one of the most important factors determining the quality of tobacco (Nicotiana tabacum) leaves. Mutation breeding is a useful method to create new germplasm. This study identi fi ed fi ve fl avoring mutants (fgr1-fgr5) through ethyl methane sulfonate (EMS)mutagenesis of Zhongyan100, an elite tobacco cultivar. Fully-expanding middle leaves of Zhongyan-100 and the mutants were obtained to calculate trichome densities at fi ve di ff erent development stages. At late-ripening stage, a portable electronic nose PEN3 was used to detect fl avoring compounds of fresh leaves of Zhongyan-100 and the mutants. Principal component analysis and cluster analysis were performed with the response value of the e-nose. Compared with Zhongyan-100, these fi ve mutants showed distinct patterns of leaf maturity and higher glandular trichome densities of leaf surface, both of which were thought to contribute greatly to tobacco fl avor. According to results of principal component analysis and cluster analysis, the mutants can be divided into two groups: "air-cured tobacco" and "flue-cured tobacco". "Air-cured tobacco" had a high response value on sensor W2, while " fl ue-cured tobacco" had a high response value on sensor W6 and W8. The di ff erent patterns of gene expression between these two mutants indicated that they might have di ff erent mechanisms of regulating fl avoring related genes.
tobacco; mutant; fl avoring; electronic nose; quantitative real-time PCR
焦禹顺,向小华,吴新儒,等. 电子鼻检测和定量表达分析相结合对烟草香气突变体进行鉴定[J]. 中国烟草学报,2016,22(2)
国家烟草专卖局烟草基因组计划重大专项项目(110201301005(JY-05))
焦禹顺(1988—),硕士研究生,专业方向:作物遗传育种,Email:ysjiao11@126.com
王元英(1963—),研究员,博士生导师,研究方向:烟草遗传育种,Email:wangyuanying@caas.cn
2015-03-11
: JIAO Yushun,XIANG Xiaohua,WU Xinru, et al. Identi fi cation of fl avoring mutants in Nicotiana tabacum using electronic nose combined with qRT-PCR [J]. Acta Tabacaria Sinica, 2016, 22(2)
