超声和酶解除杂质法测定烟草中总细胞壁物质含量
2016-11-16杨蕾陶自伟潘纯祥李赛群李菁菁郑杰毕晨曦侯英
杨蕾,陶自伟,潘纯祥,李赛群,李菁菁,郑杰,毕晨曦,侯英
1昆明理工大学,环境科学与工程学院,云南省昆明市呈贡区景明南路727号,650500;2云南瑞升烟草技术(集团)有限公司,云南省昆明市海源北路1699号,650106
超声和酶解除杂质法测定烟草中总细胞壁物质含量
杨蕾1,2,陶自伟2,潘纯祥2,李赛群2,李菁菁2,郑杰2,毕晨曦2,侯英2
1昆明理工大学,环境科学与工程学院,云南省昆明市呈贡区景明南路727号,650500;2云南瑞升烟草技术(集团)有限公司,云南省昆明市海源北路1699号,650106
为了减少高毒试剂苯的使用,消除淀粉、蛋白质、灰分对测定总细胞壁物质含量的干扰,本方法采用乙醚-乙醇混合液(乙醚:乙醇=1:15)进行超声脱脂后,加入α-高温淀粉酶,用热水提取,再用中性蛋白酶水解蛋白质,残渣在510 ℃灰化。结果表明:采用30 mL乙醚-乙醇混合液进行超声脱脂1h与常规脱脂方法一致;热水提取1 h能除去糖类、淀粉的干扰;用2mL中性蛋白酶水解30 min能除去绝大部分蛋白质;方法回收率为98.31 %~99.52 %,日内RSD为1.21 %~1.31 %,日间RSD为1.39 %。可以应用于烟草中总细胞壁物质含量的测定。
烟草;总细胞壁物质含量;除杂质;超声法;酶解法
细胞壁物质是烟草的重要组成成分,包括果胶、半纤维素、纤维素和木质素,烤烟烟叶干物质中总细胞壁物质的含量约为30 %,烟梗中的含量约为43 %[1-3]。细胞壁物质含量对烤烟烟叶的外观品质、感官品质、物理特性、化学成分有不同程度的影响[4-5]。不同产地、品种、等级的烟叶细胞壁物质含量差异明显,细胞壁物质含量高的烟叶,烟气具有强烈的刺激性、呛咳、涩口,且枯焦气和木质气重[6-7]。因此对烟草中总细胞壁物质含量的测定方法的进一步研究是十分必要的。目前,烟草中总细胞壁物质含量的测定方法主要为重量法,葛翠英等[8]采用试样经苯-醇索式提取48 h后,再用热水提取3-4次,最后干燥、称重,实验过程中需要多次更换溶剂,需要多次抽滤和清洗。于建军等[9]用改装的索式提取器和微波炉加热进行苯-醇萃取处理,再加入蒸馏水进行加热处理,抽滤、干燥、称重。廖臻等[10]将试样用尼龙滤布包裹扎紧后进行石油醚-丙酮混合溶液索氏提取48 h,将试样放入烧杯中加热至沸腾、过滤,然后干燥、称重。张强等[11]用烟叶物理指标建立回归模型预测总细胞壁物质含量的方法。
重量法测定烟草中总细胞壁物质含量的实质就是除去试样中脂类、糖类、淀粉、蛋白质、灰分等物质,现有的测定方法将试样包裹起来脱脂和热水提取,使用了高毒试剂苯,实验过程费时、耗力,测定结果含有约2 %的淀粉和约5 %的蛋白质及灰分。为了减少试剂毒害、缩短实验时间、真实反应细胞壁物质含量,本法采用了乙醚-乙醇混合液超声脱脂后,加入α-高温淀粉酶[12],用热水提取,再用中性蛋白酶水解蛋白质[13-14],整个过程试样均匀分散于萃取溶剂中,杂质容易除去,缩短了实验时间,提高了检测结果的准确性。
1 实验部分
1.1 材料和仪器
所有试剂均为分析纯级试剂,水为蒸馏水或同等纯度的水。
无水乙醇、丙酮、磷酸氢二钠、磷酸二氢钠、石英砂(AR,四川西陇化工有限公司);乙醚(AR,重庆川东集团有限公司);α-高温淀粉酶(活性100 kU/g,105 ℃,和氏璧生物技术有限公司);中性蛋白酶(活性60 kU/g,北京奥博星生物科技有限公司);纤维素 (美国Sigma-Aldrich公司)。
FT122半自动纤维素测定仪(配玻璃砂芯坩埚,FOSS)、超声清洗仪(elma)、电热鼓风干燥机(上海博讯实业有限公司);可程箱式电阻炉(上海一恒科学仪器有限公司)。
1.2 实验方法
1.2.1 超声脱脂
烟草试样粉碎后过40目筛,准确称取0.5 g于100 mL三角瓶中,加入30 mL乙醚-乙醇混合液(乙醚:乙醇=1:15),置于超声清洗仪中常温超声1h,取出后将试样液转移抽滤至装有2 g石英砂的G2玻璃砂芯坩埚中,并用乙醇洗涤三角瓶和残渣,再用5 mL丙酮洗涤。
1.2.2 热水提取
将抽滤后的玻璃砂芯坩埚安装在纤维素测定仪的热浸提单元上,加入25 mg α-高温淀粉酶和100 mL加热至90 ℃以上的热水,待溶液沸腾后,保持微沸1 h,结束后,立即开始抽滤,并用90 ℃以上的热水冲洗管壁和残渣。
1.2.3 除蛋白质
将玻璃砂芯坩埚和试样残渣放于100 mL烧杯中,加入20 mL pH7.5磷酸盐缓冲液(0.1 mol/L)和2 mL中性蛋白酶溶液(5 mg/mL),于55 ℃水浴中水解30 min后减压抽滤,用10 mL乙醇洗涤。
1.2.4 干燥和灰化
将玻璃砂芯坩埚和试样残渣放入(105±2)℃烘箱中烘干3 h至恒量。在干燥器中冷却后称量。然后将坩埚和剩余物置于马弗炉中,在(510±10)℃,灰化3 h,于干燥器中冷却后称量。
1.2.5 结果计算
烟草中总细胞壁物质含量按下式(1)计算得出:

式中:m1:试样的重量(g);m2:烘干后坩埚和试样残渣的重量(g);m3:灰化后坩埚和试样灰分的重量(g);W: 试样水分含量(%)。
2 结果与讨论
2.1 脱脂溶剂及脱脂方法选择
烟草试样脱脂方法有苯-醇索氏法[8]、石油醚索氏抽提法[8]、石油醚-丙酮索氏法[10]、苯-醇-醚加热回流法[12]等。脱脂溶剂主要有苯、乙醇、石油醚、丙酮、乙醚等,其中乙醚可溶解色素、蜡、挥发油、树脂、萜、甾等油脂物质,溶解油脂物质能力较石油醚强,石油醚不能溶解叶绿素等物质[8];苯属于高毒试剂。因此,依据YC/T 347-2010 《烟草及烟草制品中性洗涤纤维、酸性洗涤纤维、酸洗木质素的测定洗涤剂法》选择用乙醚-乙醇混合物作为脱脂溶剂,减少试剂毒害。
脱脂方法中索氏法耗费时间较长,达24 h;加热回流法需要4 h,如薄片类试样会产生爆沸现象;本法采用超声法,实验过程试样均匀分散于溶剂中,脂类物质易除去,且实验时间为1 h,实验时间明显缩短。
2.2 乙醚-乙醇混合液比例对脱脂结果的影响
称取同一试样,平行测定3次,分别加入1:5、1:10、1:15、1:20、1:25的乙醚-乙醇混合液30 mL后超声60 min,将试样液转移抽滤至装有G2玻璃砂芯坩埚中,并用乙醇洗涤三角瓶和残渣,再用5 mL丙酮洗涤。将玻璃砂芯坩埚和试样残渣放入(105±2)℃烘箱中烘干3 h至恒量,在干燥器中冷却后称量,计算脱脂剩余率,考察乙醚-乙醇混合液比例对脱脂结果的影响,结果如图1。

图1 乙醚-乙醇比例对脱脂结果的影响Fig.1 Effect of ethyl ether-ethanol ratio on degreasing
由图1可知, 乙醚-乙醇混合液比例为1:15、1:20、1:25时所对应的脱脂剩余率值基本一致,因此确定乙醚-乙醇混合液的比例为1:15。
2.3 乙醚-乙醇混合液用量对脱脂结果的影响
称取同一试样,平行测定3次,分别加入1:15的乙醚-乙醇混合液10 mL、20 mL、30 mL、40 mL、50 mL后超声60 min,将试样液转移抽滤至装有G2玻璃砂芯坩埚中,并用乙醇洗涤三角瓶和残渣,再用5 mL丙酮洗涤。将玻璃砂芯坩埚和试样残渣放入(105±2)℃烘箱中烘干3 h至恒量,在干燥器中冷却后称量,计算脱脂剩余率,考察乙醚-乙醇混合液使用量对脱脂结果的影响,结果如图2。

图2 乙醚-乙醇混合液用量对脱脂结果的影响Fig.2 Volume effect of ethyl ether-ethanol mixed solvent on degreasing
由图2可知,随着乙醚-乙醇混合液使用量的增加,脱脂剩余率值随之减少,当用量达到30 mL后,脱脂剩余率趋于平稳,因此确定乙醚-乙醇混合液使用为30 mL。
2.4 超声时间对脱脂结果的影响
称取同一试样,平行测定3次,加入溶剂后分别超声30 min、60 min、90 min、120 min,将试样液转移抽滤至装有G2玻璃砂芯坩埚中,并用乙醇洗涤三角瓶和残渣,再用5 mL丙酮洗涤。将玻璃砂芯坩埚和试样残渣放入(105±2)℃烘箱中烘干3 h至恒量。在干燥器中冷却后称量。计算脱脂剩余率,考察超声时间对脱脂结果的影响,结果如图3。

图3 超声时间对脱脂结果的影响Fig.3 Effect of ultrasonic time on degreasing
由图3可知,随着超声时间的增加,脱脂剩余率值随之减少,当超声时间超过1 h后,脱脂剩余率趋于平稳,因此确定超声脱脂时间为1 h。
2.5 不同脱脂方法对总细胞壁物质含量测定的影响
称取同一试样,分别按苯-醇索氏法、石油醚-丙酮索氏法、苯-醇-醚加热回流法、乙醚-乙醇超声法脱脂后,进行总细胞壁物质含量的测定,考察不同脱脂方法对总细胞壁物质含量测定结果的影响,结果见表1。

表1 不同脱脂方法对总细胞壁物质含量测定结果的影响Tab.1 Effect of different degreasing methods on content of total cell wall substances
由表1可知,4种脱脂方法测定的总细胞壁物质含量中,乙醚-乙醇超声法与石油醚-丙酮抽提法的结果偏差为1.16 %,偏差稍大,与苯-醇索式法、苯-醇-醚加热回流法的绝对偏差小于0.30%,因此乙醚-乙醇超声法可以用于烟草试样中总细胞壁物质含量的测定。
2.6 热水提取时间对总细胞壁物质含量的影响
试样脱脂后用热水提取除去试样中的糖类物质,同时加α-高温淀粉酶酶解试样中的淀粉。称取同一试样,平行测定3次,按本实验方法进行乙醚-乙醇超声法脱脂后加入25 mg α-高温淀粉酶和100 mL加热至90 ℃以上的热水,待溶液沸腾后,分别保持微沸30 min、60 min、90 min、120 min后,进行烘干、灰化、称量、计算总细胞壁物质含量,结果如图4。

图4 提取时间对总细胞壁物质含量的影响Fig.4 Effect of extraction time on content of total cell wall substances
由图4可知,随着提取时间的增加,总细胞壁物质含量随之减少,当提取时间超过1 h后,总细胞壁物质含量趋于平稳,因此确定热水提取时间为1 h。
2.7 中性蛋白质酶用量对除蛋白质的影响
称取同一试样,平行测定3次,按本实验方法进行热水提取后,加入20 mL pH7.5磷酸盐缓冲液后,分别加入1 mL、2 mL、3 mL、4 mL的中性蛋白酶溶液(5mg/mL),在55 ℃水浴水解30 min,减压抽滤后,试样残渣按YC/T 249-2008《烟草及烟草制品 蛋白质的测定 连续流动法》[15]进行处理和测定试样中蛋白质残留量,考察中性蛋白质酶用量对除蛋白质的影响,结果如图5。

图5 中性蛋白质酶用量对除蛋白质的影响Fig.5 Effect of neutral protein level on protein removal
由图5可知,随着中性蛋白酶用量的增加,蛋白质含量随之减少,当酶用量超过2 mL,蛋白质含量趋于平稳,说明酶用量为2 mL可以将蛋白质水解完全,因此确定中性蛋白酶的用量为2 mL。
2.8 除杂质验证实验
称取同一试样,平行测定3次,按本实验方法进行除蛋白质处理后,分别按YC/T 159-2002《烟草及烟草制品 水溶性糖的测定 连续流动法》[16]、YC/T 216-2007《烟草及烟草制品 淀粉的测定 连续流动法》[17]、YC/T 249-2008《烟草及烟草制品 蛋白质的测定 连续流动法》[15]测定残渣中水溶性糖、淀粉、蛋白质的含量。同时,取未按本实验方法处理的试样分别测定水溶性糖、淀粉、蛋白质的含量作对照。结果如表2所示,按方法处理后试样残渣中水溶性糖、淀粉、蛋白质均未检出,表明实验方法有效除去了杂质。除杂质后残渣中的蛋白质未检出,表明实验中加入的α-高温淀粉酶、中性蛋白酶,抽滤过程中已被除去,未残留在试样残渣中,不会影响检测结果。
2.9 方法的精密度
取同一试样,连续测定3天,每天测定6平行样,按本实验方法对试样进行处理与分析,进行日内重复性实验和日间重现性实验。结果如表3所示,方法的日内RSD为1.21 %~1.31 %,日间RSD为1.39 %,表明实验方法的精密度较高。

表2 试样残渣杂质含量Tab.2 Impurity level in sample residues

表3 方法精密度实验Tab.3 Method precision experiment
2.10 方法加标回收率
由于半纤维素和木质素的标准品无法获取,果胶标品加入后产生溶胀现象,难以抽滤,因此对半纤维素、木质素、果胶的加标回收率未进行考察。称取同一试样3份,按本实验方法的条件用纤维素作为标品进行加标回收率实验,结果如表4所示,方法的回收率为98.31 %~99.52 %,表明实验方法的准确度较高。

表4 方法回收率实验Tab.4 Method recovery experiment
2.11 试样测定
按现有方法(苯-醇索氏法)和本法对烤烟、再造烟叶、烟梗试样进行总细胞壁物质含量的测定,结果如表5所示。从测定结果可知,本法对不同试样的测定中表现出良好的精密度,为0.39 %~1.31 %,符合检测要求。苯-醇索氏法测定结果较本法高5.46 %~6.19 %,是因苯-醇索氏法测定结果中包含淀粉、蛋白质、灰分含量。
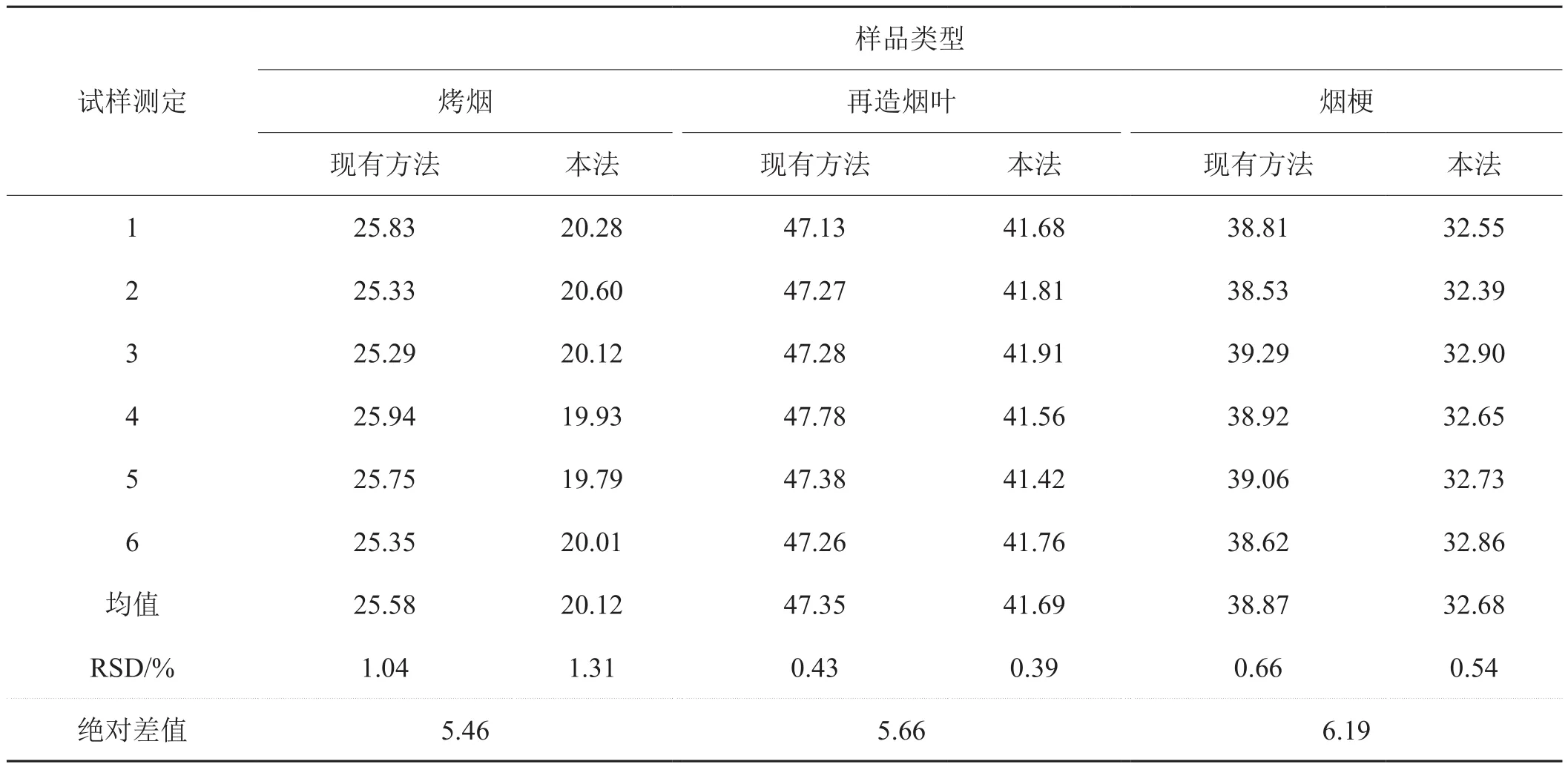
表5 不同烟草中总细胞壁物质含量测定Tab.5 Analysis of total cell wall substances in different tobacco %
3 结论
本文采用乙醚-乙醇混合液超声脱脂、热水提取除糖、α-高温淀粉酶酶解淀粉、中性蛋白酶酶解蛋白质,建立了烟草中总细胞壁物质含量的测定方法,确定了采用30 mL乙醚-乙醇混合液(乙醚:乙醇=1:15)对试样进行超声脱脂1 h,热水提取1 h,2 mL中性蛋白酶(5mg/mL)酶解30 min。按实验方法进行试样处理有效除去了试样中的脂类、糖类、淀粉、蛋白质、灰分,减少了高毒试剂使用、简化了实验操作、缩短了实验时间,检测结果真实反应了总细胞壁物质的含量,方法回收率为98.31 %~99.52 %,日内RSD为1.21 %~1.31 %,日间RSD为1.39 %。因此,本法操作简单、稳定性好、准确性高、检测周期短,可以用于烟草中总细胞壁物质含量的测定。
[1] 李兴波,闫克玉,闫洪洋,等.河南烤烟(40 级)细胞壁物质含量及规律性研究[J].郑州轻工业学院学报,1999,14(3):27-30.Li Xingbo, Yan Keyu,Yan Hongyang, et al. The Study on Relationship of Cell Wall Substances Content and tobacco leaf appearance of Henan Flue-cured Tobacco[J].Journal of ZHENGZHOU Institute of Light Industry,1999,14(3):27-30.(in Chinese)
[2] 闫克玉,闫洪洋,李兴波,等.烤烟烟叶细胞壁物质的对比分析[J].烟草科技,2005 (10):6-11 Yan Keyu,Yan Hongyang,Li Xingbo, et al.Comparative Analysis of Cell Wall Substances in Flue-cured Tobacco Leaf[J]. Tobacco Science & Technology,2005 (10):6-11. (in Chinese)
[3] 刘春奎,贾琳,王国良,等.河南烤烟标准试样中细胞壁物质总量分析[J].云南农业大学学报,2013,28(6):834-838.Liu Chunkui,Jia Lin,Wang Guoliang,et al. Analysis of Total Content of Cell Wall Substances in Flue-cured Tobacco Leaves for Standard Samples from Henan Province[J].Journal of Yunnan Agricultural University,2013,28(6) : 834-838. (in Chinese)
[4] 任晓红,陈刚,马海燕,等.烤烟细胞壁物质对烟叶质量影响研究[J].中国农学通报,2010,26(4):113-116.Ren Xiaohong, Chen Gang, Ma Haiyan,et al. Research on the Effect of Cell Wall Matter Components on the Tobacco Quality[J]. Chinese Agricultural Science Bulletin,2010,26(4):113-116(in Chinese)
[5] 陈红丽,任晓红,杨永锋,等.四川烤烟烟叶细胞壁物质含量与外观质量、感官质量的关系[J].烟草科技,2011,(1):9-12.Chen hongli, Ren xiaohong, Yang Yongfeng ,et al.Relationship Between CellWall Matter Content in Sichuan Flue-cured Tobacco and its Appearance and Sensory Quality[J].TobaccoScience& Technology,2011,(1):9-12. (in Chinese)
[6] 刘春奎,蔡佳,杨靖,等.烤烟细胞壁物质与烟叶质量的关系研究[J].广东农业科学2012 (12):33-35.Liu Chunkui, Cai Jia, Yang Jing, et al.Research on relationship between cell wall material of flue-cured tobacco leaf and tobacco quality[J].Guangdong Agricultural Sciences, 2012 (12):33-35. (in Chinese)
[7] 唐军,陈兴,华一崑,等.烟叶细胞壁物质研究进展[J].河北农业科学,2014,18(5):82-84.Tang Jun,Chen Xing,Hua Yikun,et al.Research Advancement of the Cell Wall Substances in Tobacco Leaf[J]Journal of Hebei Agricultural Sciences,2014,18(5):82-84. (in Chinese)
[8] 张槐苓,葛翠英,穆怀静,等.烟草分析与检验[M].河南科学技术出版社,1994: 103-111,239-241,254.Zhang Huailing,Ge Cuiying,Mu Huaijing,et al.Tobacco Analysis and Testing[M].Henan Science and Technology Press,1994: 103-111,239-241,254. (in Chinese)
[9] 于建军,陈刚,任晓红,等.烤烟烟叶中总细胞壁物质含量的测定方法[P].中国:CN 101216403, 2008-07-09.Yu Jianjun,Cheng Gang, Ren Xiaohong, et al. Determination of Total Cell Wall Substances in Flue-cured Tobacco[P].China:CN 101216403, 2008-07-09. (in Chinese)
[10] 廖臻,王岚,蒋次清,等.烟草中总细胞壁物质含量的测定方法[P].中国:CN 102221512 A, 2011-10-19.Liao Zhen,Wang Lan,Jiang Ciqing,et al. Determination of Total Cell Wall Substances in Tobacco[P].China:CN 102221512 A, 2011-10-19. (in Chinese)
[11] 张强,董高峰,黄韡,等.烤烟烟叶细胞壁物质含量预测[J].烟草科技,2014,(3):76-81.Zhang Qiang, Dong Gaofeng, Huang Wei, et al.Prediction of Cell Wall Matter Content in Flue-cured Tobacco Leaf[J].Tobacco Science & Technology,2014,(3):76-81. (in Chinese)
[12] YC/T 347-2010 烟草及烟草制品 中性洗涤纤维、酸性洗涤纤维、酸洗木质素的测定 洗涤剂法[S].YC/T 347-2010 Tobacco and tobacco products.Determination of neutral detergent fi ber,acid detergent fi ber and acid detergent lignin. Van Soest method. (in Chinese)
[13] 钟振声,陈钰,文锡莲.木瓜蛋白酶与中性蛋白酶水解大豆分离蛋白的研究[J].现代食品科技.2009,25(9):1039-1042.Zhong Zhensheng, Chen Yu, Wen Xilian. Hydrolysis of Soybean Protein Isolate by Papain and Neutral Protease[J].Modern Food Science and Technology. 2009,25(9):1039-1042. (in Chinese)
[14] GB/T 5009.88-2008 食品中膳食纤维的测定[S].GB/T 5009.88-2008 Determination of dietary fi ber[S]. (in Chinese)
[15] YC/T 249-2008 烟草及烟草制品 蛋白质的测定 连续流动法[S].YC/T 249-2008 Tobacco and tobacco products-Determination of protein-Continuous flow method[S]. (in Chinese)
[16] YC/T 159-2002 烟草及烟草制品 水溶性糖的测定 连续流动法[S].YC/T 159-2002 Tobacco and tobacco products-Detelrmination of water soluble sugars-Continuous flow method[S]. (in Chinese)
[17] YC/T 216-2013 烟草及烟草制品 淀粉的测定 连续流动法[S].YC/T 216-2013 Tobacco and Tobacco Products-Determination of Starch-Continuous Flow Method[S]. (in Chinese)
Determination of total cell wall substances content in leaf tobacco by ultrasonic and enzymatic impurity removal method
YANG Lei1,2, TAO Ziwei2, PAN Chunxiang2, LI Saiqun2, LI Jingjing2,ZHENG Jie2, BI Chenxi2, HOU Ying2
1 Faculty of Enviromental Science and Engineering, Kunming University of Science and Technology, Kunming 650500,China;2 Yunnan Reascend Tobacco Technology (Group) Co., Ltd, Kunming 650106, China
In order to reduce the use of highly toxic reagent benzene and to eliminate interference of starch, protein and ash in the analysis of total cell wall substances content, this study used mixed solvent (ethyl ether: ethanol =1:15) treated sample by ultrasound degreasing.Thermostable α-amylase was added and sample was extracted with hot water. Protein was hydrolyzed by neutral protein enzyme, while residue was turned to ash at 510℃. Results showed that the 30ml mixed solvent of ethanol and ethyl ether used for ultrasound degreasing was consistent with conventional degreasing method. Hot water extraction for 1h eliminated the interference of carbohydrate and starch,and hydrolysis with 2ml neutral protein enzyme for 30min removed most protein in the sample. The recovery rate was 98.31%~99.52%with intraday RSD at1.21%~1.31% and interday RSD at 1.39%, indicating that the method is reliable and accurate and can be used for analysis of total cell wall substances content in leaf tobacco.
tobacco; total content of cell wall substances; impurity removal; ultrasonic method; enzymatic method
杨蕾,陶自伟,潘纯祥,等. 超声和酶解除杂质法测定烟草中总细胞壁物质含量[J]. 中国烟草学报,2016,22(2)
杨 蕾(1983—),Tel:0871-68322467, Email:yanglei@reascend.com
陶自伟(1979—),本科,中级质量工程师,主要从事烟草分析检测研究,Tel:0871-68322467,Email: 945986649@qq.com
2015-09-01
: YANG Lei, TAO Ziwei, PAN Chunxiang, et al. Determination of total cell wall substances content in leaf tobacco by ultrasonic and enzymatic impurity removal method [J]. Acta Tabacaria Sinica, 2016,22(2)
