应用Taqman探针实时荧光定量PCR技术检测烟草靶斑病菌Rhizoctonia solani AG-3 方法的建立
2016-11-16赵艳琴吴元华赵秀香安梦楠陈建光
赵艳琴,吴元华,赵秀香,安梦楠,陈建光
1 内蒙古民族大学 / 农学院,内蒙古通辽霍林河大街 22 号 028043;2 沈阳农业大学 / 植物保护学院,辽宁沈阳市东陵路 120 号 110866
应用Taqman探针实时荧光定量PCR技术检测烟草靶斑病菌Rhizoctonia solaniAG-3 方法的建立
赵艳琴1,吴元华2,赵秀香2,安梦楠2,陈建光2
1 内蒙古民族大学 / 农学院,内蒙古通辽霍林河大街 22 号 028043;2 沈阳农业大学 / 植物保护学院,辽宁沈阳市东陵路 120 号 110866
分别基于7个烟草靶斑病菌株基因组中ITS-5.8S rDNA序列设计引物和探针; 并对引物及探针特异性进行验证; 建立检测体系并对接种烟草靶斑病菌的叶片和土壤中的烟草靶斑病菌进行检测。结果表明:所设计的引物及探针对R.solaniAG-3 具有特异性,检测体系可以检测出烟草叶片及土壤样品中的烟草靶斑病菌。接种烟草叶片的检测表明, 接种后6h就可检测到强致病力菌株YC-9,12h后能检测到弱致病力菌株LF-2;获得了烟草靶斑病菌DNA质量的对数与添加菌丝量的对数之间的回归曲线方程,对不同月份土壤样品的测定结果表明烟草靶斑病菌在土壤中呈周年动态变化趋势。
烟草靶斑病菌;AG-3;实时荧光定量PCR;烟草
烟草靶斑病(Rhizoctonia solanikühn)近年来在我国烟草旺长期和成熟期大面积发生,因其潜育期短、流行性强的特点,对烟叶的产量和品质造成严重的影响[1-2]。其病原菌R. solani是一种土壤习居菌,可以通过土壤中的菌核进行土壤传播,其有性态瓜亡隔菌(Thanatephorus cucumeris(Frank) Donk)也可以通过形成的大量担孢子进行气流传播,因此对在烟草叶片及土壤中的烟草靶斑病菌进行定量检测和监测对防治该病害具有重要意义。实时荧光PCR技术(Realtime quantitative PCR, QPCR)已经被用来快速鉴定及定量许多植物病原真菌、植物病毒及植物病原细菌。闫佳会等曾采用该技术对小麦条锈菌在田间的潜伏侵染进行了定量检测研究[3];李琼等应用Taqman探针real-time PCR技术对稻瘟病菌的侵染进行了早期检测[4];丁翠珍对兰花褐斑病菌进行了定量检测[5];康振辉对土壤中烟草根腐病菌进行了定量检测[6];周国梁和陈长军分别对油菜茎基腐病菌和油菜菌核病菌进行了定量检测研究[7-8];陶萌和王淑芳等采用该技术研究粉红粘帚霉对水稻纹枯病的田间防治效果[9-10];赵文军和朱云聪分别应用该技术检测番茄环斑病毒和番茄黄化曲叶病毒在番茄体内的动态变化情况[11-12]。R. solani作为重要的植物病原菌,可以引起多种植物病害[13-14],对其进行定量研究有利于明确病害的发生及动态变化,而传统技术多采用活体分离、土壤诱捕等措施进行研究[15-16],Lees等2000年将Real-time PCR技术首次应用于马铃薯黑痣病菌AG-3融合群在土壤中的定量检测的研究中[17];此后,Sayler等从感病水稻植株上定量检测了水稻纹枯病菌AG-1-IA融合群[18];邢楠也应用该技术研究了水稻纹枯病的周年动态变化[19];徐娜娜应用Real-time PCR技术建立了检测土壤中小麦纹枯病菌的方法[20]。但目前烟草靶斑病菌R. solaniAG-3除采用常规PCR方法对其进行检测鉴定外[21],国内外尚未见到对该病菌的定量检测研究的报道。本研究根据烟草靶斑病菌rDNA-ITS区序列设计了一对特异性引物及探针,并建立从叶片及土壤中检测烟草靶斑病菌的实时定量PCR检测体系,为实时监测烟草靶斑病菌数量,揭示其发病规律及流行动态等奠定理论基础。
1 材料与方法
1.1 供试材料
供试材料为感病烟草品种K326,烟草靶斑病菌株(R. solaniAG-3)YC-9、BKS-5、LJT-8、LF-2、DB-3、YMC-8及QYS-7,其他R. solani融合群的AG-1-IA、AG-1-IB、AG-1-IC、AG-2-1、AG-2-IV、AG-2-IIIB、AG-3、AG-4-HGI、AG-4-HGII、AG-5、AG-6-HGI、AG-6-GV、AG-8、AG-9及AG-BI菌株,常见烟草上病菌包括烟草立枯病菌YCLK、烟草茎基腐病菌YCJJF、烟草赤星病菌YCCX和烟草黑胫病菌YCHJ,各菌株按此顺序标记序号1-26,以上菌株及烟草均由沈阳农业大学烟草所鉴定保存备用。
1.2 仪器与试剂
Agilent Technologies Strategene MX3000P 实时荧光PCR仪(美国ABI 公司,ABI7500);Nanodrop-ND-1000微量紫外分光光度计;LEGEND MICRO 17R型冷冻高速离心机。
新型植物基因组DNA 提取试剂盒购自天根生化科技(北京)有限公司;土壤基因组DNA 提取试剂盒购自德国MACHEREY-NAGEL公司NucleoSpain Soil 土壤提取试剂盒,引物和探针合成及其他PCR试剂均购自宝生物工程(大连)有限公司,DNA 测序由生工生物工程(上海)股份有限公司完成。
1.3 试验方法
1.3.1 烟草接种及叶片总DNA提取
将强致病力菌株YC-9和弱致病力菌株LF-2于PDA平板上活化后,28℃培养3d后,采用3mm打孔器打取菌饼,采用离体叶片针刺接种法分别接种YC-9和LF-2菌饼于K326叶片上,第张叶片针刺接种4个菌饼,以接种空白PDA圆片为对照,分别于接种0、6、12、24、36、48及72h后用打孔器以病斑为圆心切取病斑组织,并记录测量病斑直径。
取上述接种0、6、12、24、36、48及72h的病斑组织各约300mg,加液氮迅速研磨成粉并转入1.5mL的灭菌离心管中,采用北京天根生物技术公司的植物型DNA提取试剂盒提取DNA,于-20℃下保存备用。
1.3.2 土壤接种及土壤总DNA提取
参考王淑芳等含菌丝土壤制作方法[22],制备菌丝段悬浮液并接种土壤,分别制备添加菌丝浓度为5.0×10-1mg/g、5.0×10-2mg/g、5.0×10-3mg/g、5.0×10-4mg/g和5.0×10-5mg/g的土壤样品,第份土壤样品3个重复。用于制作含菌丝土壤样品的标准曲线。
分别于2012年4月20日、5月14日、6月28日、7月17日、8月9日、8月27日、11月7日,按五点取样法采集丹东市毛甸子镇烟田(N 40°35′49″,E 124°39′26″) 0~4cm土层的土壤样品。将11月7日所采土壤样品带回试验室至于置于沈阳农业大学烟草研究所试验田中,分别于12月9日、2013年l月21日、2月26日及3月16日采样。共11份不同月份样品,第份样品3次重复。将各月土壤样品分别敲碎充分混匀,过2mm直径的筛,第个土壤样品取3个重复,于-80℃下保存备用。另取各月份土壤样品10g于80℃下烘干计算含水量。
所采集土壤样品按照采集时间月日进行标记,第个样品取3次生物重复,采用德国MACHEREYNAGEL公司NucleoSpain Soil 土壤提取试剂盒进行土壤总DNA的提取,选用SL1为裂解液,按照说明书进行土壤DNA样品提取,所获得DNA样品于-20℃下保存备用。
1.3.3 烟草靶斑病菌 ITS-5.8S rDNA特异引物和Taqman 探针的设计及合成
依据烟草靶斑病菌ITS-5.8S区序列(GeneBank登陆号:HQ827784,JQ219151- JQ219156),采用Clustal X多重比对后,采用DNAMAN 软件分别设计烟草靶斑病菌特异性引物和Taqman 探针。并对探针5’端标记报告荧光染料6-Carboy fl uorescein(FAM),3’端标记淬灭荧光染料Tetramethy1-6-carboxyrhodamine( TAMRA)。引物及探针均由大连宝生物公司合成并标记荧光。
1.3.4 引物的特异性灵敏度检测及标准曲线制作
1.3.4.1 引物的特异性检测
以1.3.1中供试样品的DNA为模板,采用1.3.3中设计的引物进行常规PCR扩增。反应体系如下:2.5μL 10×PCR buffer(TaKaRa), 1.5μL 2.5 mmol/L dNTP Mixture (TaKaRa), 1μL 10Lmol/L正反引物混合液, 0.5μL模板DNA, 0.2μL 5U/μLTaq酶, 19.3μL ddH2O。反应程序为: 94℃3 min; 94℃1 min, 65℃30 s, 72℃1 min, 35个循环; 72℃延伸7 min。PCR产物经1.5%琼脂糖凝胶电泳(100V, 30min),Goldview染色后,用Alpha Imager 2200成像系统拍照。
1.3.4.2 烟草靶斑病菌标记序列的克隆
将LJT-8菌株ITS序列片段 653 bp 的 PCR 产物,经1%的琼脂糖凝胶电泳,用上海生工凝胶回收试剂盒回收DNA片段。在T4 DNA连接酶的作用下与pMD18 -T载体连接,转入大肠杆菌DH5α,获得含ITS-5.8S序列阳性克隆。采用北京康为世纪的质粒提取试剂盒,利用NanoDrop ND-1000测定质粒的浓度和纯度,测序后获得正确插入外源片段的质粒即为标准品。
1.3.4.3 标准曲线制作及不同月份土壤样品的Realtime PCR检测
采用大连宝生物技术公司生产的Easy Dilution将质粒10倍梯度稀释,分别获得104pg/μL、103pg/μL、102pg/μL、10 pg/μL、1 pg/μL和10-1pg/μL样品,将各浓度样品各取3个重复,采用Aglient strategene MX3000P进行Real-time PCR反应,并拟合标准曲线;并以所采集的不同月份土样总DNA为模板进行Realtime PCR反应,反应体系及扩展程序如下:
Real-time PCR反应体系为: 10μL SYBR green I mixture (TaKaRa),1μL 2μmol/L正反引物混合液,0.4μL ROX,1μL模板DNA,7.6μL ddH2O。通过溶解曲线判断是否有唯一的产物峰。反应程序为: 95℃预变性2min,95℃20s,60℃30s,72℃1min,40个循环,于第2阶段的退火阶段采集荧光信号,以临界循环值Ct为纵坐标,模板数的对数值为横坐标,拟合标准曲线。
2 结果分析
2.1 引物的特异性常规PCR验证
通过对烟草靶斑病菌R. solaniAG-3、其他融合群ITS和烟草其它病原菌ITS-5.8S DNA序列比对设计引物及探针序列如下:RsTqF1:5’-ACCCTACTGATGACCTCG-3’ RsTqR4: 5’- AGAC AGAAGGGTTCAATGACTTATTATA-3’, Taqman 探针: 5’-TTTAGGCATGTGCACACCTTTCTCTTTC-3’。
采用引物对进行常规PCR扩增,由图1可知,烟草靶斑病菌YC-9、BKS-5、LJT-8、LF-2、DB-3、YMC-8、QYS-7及标准菌株AG-3都能扩增约150bp出较清晰的条带,与目的片段一致,而其他融合群标准菌株、烟草赤星病菌YCCX,烟草茎基腐病菌YYJJF,烟草立枯病菌YCLK及烟草黑胫病菌YCHJ无片段被检测出。这表明该引物针对AG-3菌株具有较强的特异性,可用于R. solaniAG-3的检测。

图1 常规PCR检测引物的特异性Fig.1 Detecting the speci fi city of primers using conventional PCR
2.2 标准曲线建立
采用所设计的引物及探针进行Real-time PCR检测,由图2可知,对含ITS-5.8S序列的靶斑病菌质粒标准品进行10倍梯度稀释后,进行Real-time PCR扩增,扩增曲线都呈“S”型,制作的标准曲线的靶斑病菌质粒标准品的DNA浓度为104pg/μL、103pg/μL、102pg/μL、10 pg/μL、1 pg/μL和10-1pg/μL的对数之间有较好的线性关系,相关系数为0.997,得出DNA浓度的对数值与Ct值的线性方程为:y=-3.312x+35.928。
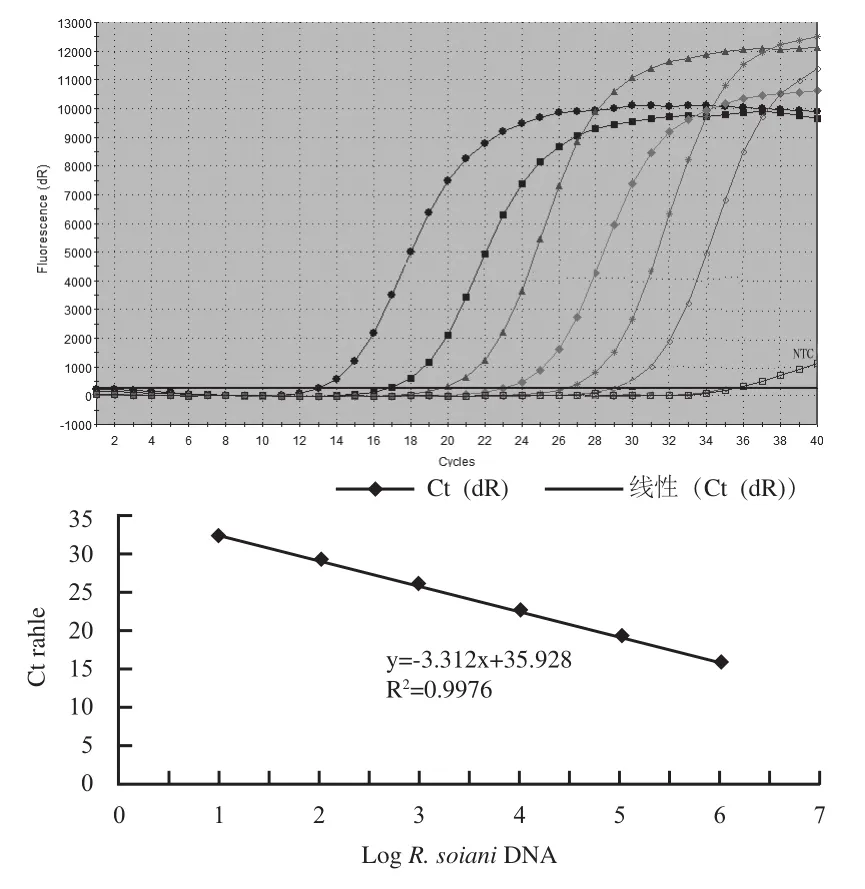
图2 Real-time PCR技术扩增质粒DNA的Ct阈值Fig. 2 Plasmid DNA dilutions measured by real-time PCR cycle threshold (Ct) value.
2.3 接种烟草靶斑病菌样品Real-time PCR检测
强致病力菌株YC-9在接种烟草K326 36h后,弱致病力菌株LF-2接种后72h出现分别出现肉眼可见约1mm直径的病斑。这表明强致病力菌株YC-9侵染速度比弱致病力菌株LF-2快。
图3所示,在接种YC-9菌株后6h的烟草样品中就检测到其DNA,而在接种LF-2菌株12h后,在烟叶样品中检测到了其DNA,并且二者均明显高出NTC背景,结果可靠。这表明该检测体系能较早的检测出叶片组织中的烟草靶斑病菌,且强致病力菌株YC-9侵入速度明显比弱致病力菌株LF-2侵入迅速。

图3 采用YC-9和LF-2接种后的其DNA在烟草离体叶片中的定量Fig. 3 Quanti fi cation of R. solani infection in detached tobacco leaves 3 days after pathogen inoculation using a strong pathotype strain (YC-9) and a weak pathotype strain (LF-2)
2.4 人工接种土壤的Real-time PCR检测标准曲线的建立
菌丝浓度为500~0.05 mg/g干土样品的Realtime PCR检测结果表明,第浓度3次重复之间的质量变化不大。各样品的浓度为均值在1.59~83785.82 pg之间。在菌丝浓度为 0.05mg/g干土时,Ct值为34.9左右,目的片段的质量为1.70~5.09 pg;而对照土壤样品中的背景质量在1.59~2.31 pg之间,Ct为36,可将其视为本底信号,将各数据转换为对数值如表1所示。

表1 烟田土壤中添加不同浓度的烟草靶斑病菌菌丝后 DNA 扩增效果及分析(P=0.05)Tab. 1 DNA amplication of R. solani added at different density in non-sterile soil(P=0.05)
以第g干土添加菌丝质量的Lg值作为 X 轴,以扣除了未添加菌丝的干土的本底后的质量平均值的Lg值作为Y轴,获得回归方程Y=1.1908X+1.6973(图4),其R2为0.9811。

图4 每克干土中菌丝添量的对数与扣除本底质量后样本均值的对数的线性关系图Fig. 4 Plot generated by plotting log of the mycelium addition in dry soil per gram versus the log of average DNA copy number
2.5 烟田土壤样品的Real-time PCR检测
对各月份土壤DNA及标准品进行Real-time PCR扩增,根据2.5方程回归方程计算出烟草靶斑病菌各月份样品中质量,并折算出0.02g干土中所含烟草靶斑病菌的质量,如表2所示:自5月中下旬土壤中烟草靶斑病菌的数量逐渐升高,到6月28日达到最高,此后开始下降;8月末烟草靶斑病菌在土壤中数量开始增加,直到1月21日达到最高;此后烟草靶斑病菌下降至4月份达到最低水平。在各月份样品检测数据中,有的月份检测三次重复数值之间差异较大,这可能是由于靶斑病菌在土壤中分布并不均匀所致。在田间烟草靶斑病在一些地块6月下旬就已经可以出现在下部叶片上了,这与本试验中6月28日的数据最高基本一致;毛甸子地区在7、8月份由于降水较多导致土壤中含水量较大,在检测样品中并没有发现预期的较大的测定数据,这可能是因为该月份所采集土壤样品中水分较大对土壤样品中的靶斑病菌的DNA提取效率造成了影响,或者是该时间段田间环境条件更加适病菌的有性态生长,产生大量担孢子,在植株地上部进行为害。尤其过多的水分造成泡田不适合菌核及菌丝的形成。此后,随着气温的下降靶斑病菌开始为度过不良环境条件形成菌核,在土壤中有所增加。进入12月以后毛甸子地区气温以零下为主,土壤中靶斑病菌变化不大。
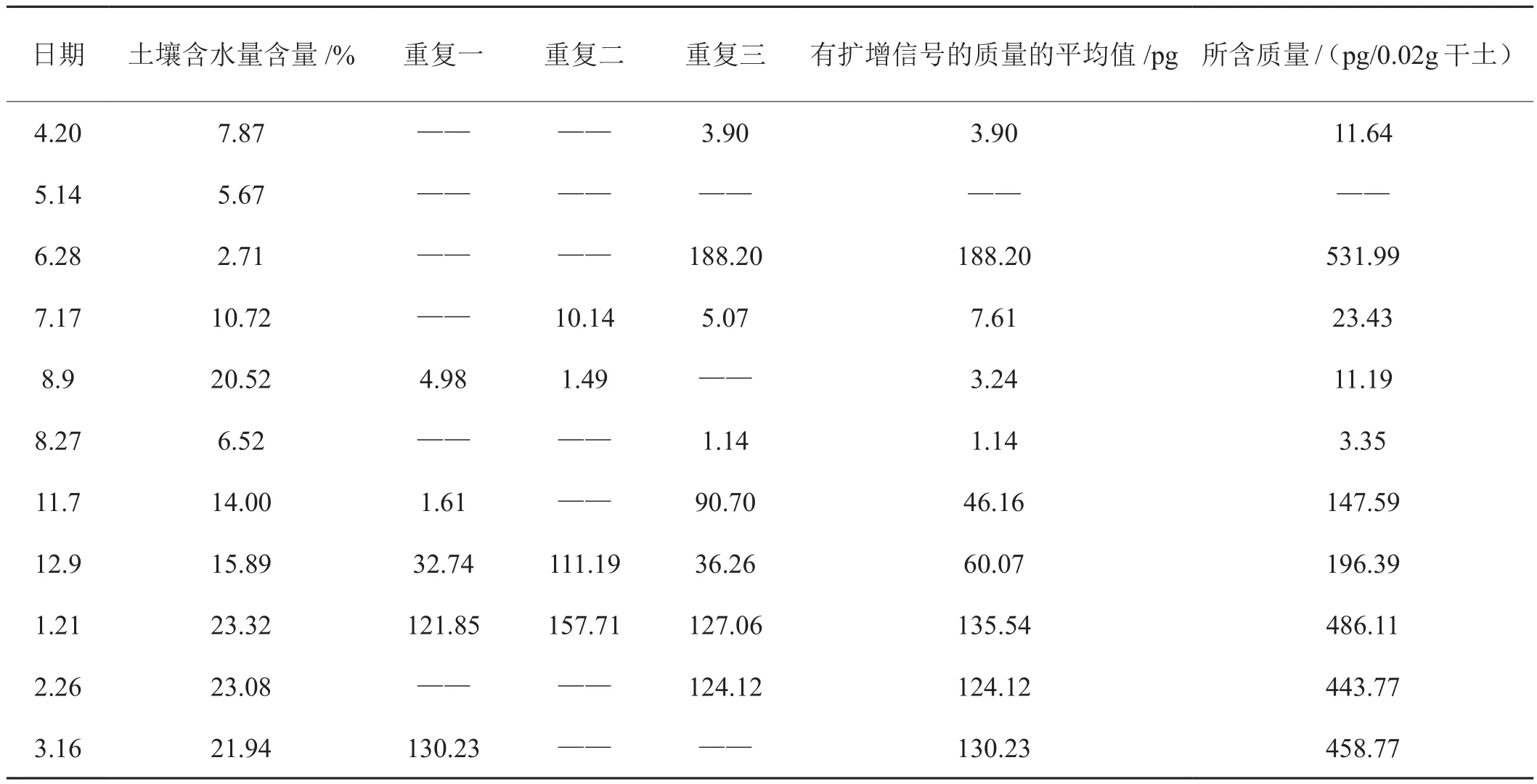
表2 各月土壤样品(3次重复)的定量结果Tab. 2 Quantitative results of soil samples collected each month (3 replicates)
3 结论与讨论
本研究通过比较烟草靶斑病菌R. solaniAG-3与其他融合群ITS序列上的差别设计了一对特异性引物及探针,对接种不同致病力烟草靶斑病菌的烟草叶片进行定量检测结果表明该引物及探针可以检测出烟草靶斑病菌,0-72h内,烟草靶斑病病菌在组织中成增加趋势,并且强致病力菌株YC-9数量增加较弱致病力菌株LF-2快,这揭示了烟草靶斑病菌菌株间存在致病力分化,强致病力菌株在致病中能更快速的增加,最终造成严重的病害;该技术尝试对烟田土壤烟草靶斑病菌进行了定量研究,研究结果揭示了烟草靶斑病菌可以在0-4cm土层中越冬,不同月份土壤中的烟草靶斑病菌呈动态变化趋势。
对于土壤及生长中的真菌的检测是很困难的,传统技术采用感病寄生诱捕、湿筛分离及直接的微观检查等技术进行R. solani定量地调查研究[16,23],这些方法都仅费时费力,很难大规模开展研究提供准确的数据,定量结果也不可信。Lees等首次尝试采用Real-time PCR检测技术分析马铃薯黑痣病菌的流行动态问题,讨论将其作为一个决策性的工具来指导该病害的防治。Lees等基于ITS区序列设计对R. solaniAG-3特异的PCR 引物及探针,应用其检测无可见症状的薯块组织和土壤中的病菌[17]。本文的研究结果与其基本一致,烟草靶斑病菌与马铃薯黑痣病菌同源性较高,参考其ITS区序列设计检测烟草靶斑病菌的AG-3引物及探针可以特异的检测出烟草叶片组织及土壤中的烟草靶斑病菌,但Lees等未研究马铃薯黑痣病菌在土壤中的周年变化情况。刑楠采用Realtime PCR技术研究了土壤中水稻纹枯病菌R. solaniAG-1的周年动态变化情况[19],本文的研究结果与其基本一致,病原菌在土壤中均呈周年动态变化。
Real-time PCR技术已被应用于土壤中植物病原物的检测与定量研究,但由于土壤样品的复杂性而必须建立以添加的病菌的土壤样品模拟自然情况的标准曲线,对土壤自身的本底信号进行扣除,以使检测的结果更为准确。Lees等通过添加菌核的土壤模拟自然情况的带菌土壤,而本文采用添加烟草靶斑病菌新鲜菌丝来建立标准曲线[17],两者对检测结果的影响有待进一步的比较。
此技术的建立对研究烟草靶斑病菌的流行动态提供了新的方法,可以对揭示R. solani在土壤中的消长情况研究提供较传统定量方法更为准确的数据。但因本文中仅仅测定了一年的动态变化的数据,还并不能说明代表了自然情况下烟田中烟草靶斑病菌的实际情况,并且由于Real-time PCR技术超级灵敏的特点,试验中的取样误差无法忽略,尽管采用了GPS定位系统,依然无法保证第次从同一地点取样。在后续试验中,可以通过增加田间取样点及检测样品的重复次数来提高检测的准确性。此外,烟草靶斑病菌在土壤中是否均匀分布等问题还需要进一步研究。
[1] Wu Y H, Zhao Y Q, Fu Y, Zhao X X, Chen J G. First Report of Target Spot of Flue-cured Tobacco Caused byRhizoctonia solaniAG-3 in China [J]. Plant Dis. 2012,96(12): 1824.
[2] 吴元华, 王左斌, 刘志恒, 赵秀香, 梁景颐. 我国烟草新病害——靶斑病[J]. 中国烟草学报, 2006, 12(6): 22-23.Wu Yuanhua , Wang Zuobin, Liu Zhiheng, et al. First report of target spot of flue-cured tobacco in China [J]. Acta Tabacaria Sinica, 2006, 12(6): 22. (in Chinese)
[3] 闫佳会, 骆勇, 潘娟娟, 王海光, 金社林, 曹世勤, 马占鸿. 应用 Real-time PCR 定量检测田间小麦条锈菌潜伏侵染的研究[J].植物病理学报, 2011, 41(6): 618-625.Yan Jiahui, Luo Yong, Pan Juanjuan, et al. Quanti fi cation of latent infection of w heat stripe rust in the fi elds using realtime PCR. Acta phtopathologica sinica, 2011, 41 (6): 618-625. (in Chinese)
[4] 李琼, 孔宝华, 范静华, 蔡红, 傅杨, 陈海如. 应用TaqMan 探针实时荧光定量PCR 技术早期检测稻瘟病[J]. 植物病理学报, 2011, 41(2): 118-123.Li Qiong, Kong Baohua, Fan Jinghua, et al. Early detection of rice blast by TaqMan real-time fl ourescence quantitative polymerase chain reaction [J]. Acta phtopathologica sinica,2011, 41(2): 118-123. (in Chinese)
[5] 丁翠珍, 赵文军, 寸东义, 陈红运, 朱水芳. 兰花褐斑病菌实时荧光PCR检测[J]. 植物病理学报, 2010, 40(3):235-241.Ding Cuizhen, Zhao Wenjun, Cun Dongyi, et al. Detection ofAcidovorax avenaesubsp .cattleyae by real-time fluorescent PCR [J]. Acta phtopathologica sinica, 2010,40(3): 235-241. (in Chinese)
[6] 康振辉, 黄俊丽. 土壤中烟草根黑腐病菌的实时定量PCR检测技术研究[J]. 植物病理学报, 2010, 40(2): 210-213.Kang Zhenhui, Huang Junli. Detection ofThielaviopsis basicolainsoil with real-time quantitative PCR [J]. Acta phtopathologica sinica, 2010, 40(2): 210-213. (in Chinese)
[7] 周国梁, 尚琳琳, 林泓, 印丽萍, 徐殿胜, 易建平. 油菜茎基溃疡病菌的实时荧光PCR检测[J]. 植物病理学报,2011, 41(1): 10-17.Zhou Guoliang, Shang Linlin, Lin Hong, et al. Detection ofLeptosphaeria maculansby real-time PCR [J]. Acta phtopathologica sinica, 2011, 41(1): 10-17. (in Chinese)
[8] 陈长军, 李俊, 赵伟, 王建新, 周国平. 利用实时荧光定量 PCR 技术检测油菜菌核病菌[J]. 植物病理学报, 2011,41(5): 516-525.Chen Changjun, Li Jun, Zhao Wei, et al. Detection of Sclerotinia sclerotiorum by a quantitative real-time PCR[J]. Acta phtopathologica sinica, 2011, 41(5): 516-525. (in Chinese)
[9] 陶萌. 土壤中粉红粘帚霉67-1荧光定量PCR检测体系的建立及应用[D]. 中国农业科学院硕士论文, 2008.Tao Meng. Development and application of Real-time PCR for quantitative detection ofGliocladium roseum67-1 in soil [D]. Chinese Academy of Agricultural Sciences Master Dissertaion. 2008. (in Chinese)
[10] 王淑芳, 马桂珍, 李世东, 孙漫红, 暴增海, 付泓润, 葛平华. 应用实时荧光定量技术评价粉红粘帚霉对水稻纹枯病的田间防治效果[J]. 植物病理学报. 2014(4): 422-427.Wang Shufang, Ma Guizhen, Li Shidong, et al. Assessment the biocontrol using Real-time fluorescent efficacy ofGliocladium roseumon rice sheath blight PCR method [J].Acta phtopathologica sinica, 2014(4): 422-427. (in Chinese)
[11] 赵文军, 陈红运, 朱水芳, 谭天伟. 杂交诱捕实时荧光PCR检测番茄环斑病毒[J]. 植物病理学报, 2007, 37(6):666-669.Zhao Wenjun, Chen Hongyun, Zhu Shuifang, et al. Tomato ring spot nepovirus detection using hy bridization capture real-timePCR [J]. Acta phtopathologica sinica, 2007, 37(6):666-669. (in Chinese)
[12] 朱云聪, 邓宇芳, 何顺, 罗来鑫, 曹永松. 基于Real-time PCR监测番茄黄化曲叶病毒在番茄植株中的动态变化[J]. 植物病理学报, 2014, 44 (4): 363-369.Zhu Yuncong, Deng Yufang, He Shun, et al. Quanti fi cation of Tomato yellow leaf curl virus in tomato plant by SYBR Green I Real-time PCR assays [J]. Acta phtopathologica sinica, 2014, 44 (4): 363-369. (in Chinese)
[13] Sumner D R, Minton N A. Crop losses in corn induced byRhizoctonia solaniAG-2-2 and nematodes [J].Phytopathology, 1989, 79(9): 934-941.
[14] Linde C C, Zala M, Paulraj R S D,et al. Population structure of the rice sheath blight pathogenRhizoctonia solaniAG-1-IA from India [J]. Eur J Plant Pathol, 2005,112: 113-121.
[15] Sneh B J,et al. Methods of revaluating inoculum density ofRhizoctonia solaninaturally infested soil [J].Phytopathology, 1966, 56: 74-78.
[16] Weinhold A R. Population ofRhizoctonia solaniin agriculture soil determined by a screening procedure [J].Phytopathology, 1977, 67: 566-569.
[17] Lees A K, Cullen D W, Sullivan L, Nicolson M J.Development of conventional and quantitative Realtime PCR assays for the detection and identification ofRhizoctonia solaniAG-3 in potato and soil [J]. Plant Pathology, 2002, 51: 293-302.
[18] Ronald J S, Yang Y N. Detection and quantification ofRhizoctonia solaniAG-1-IA, the rice sheath blight pathogen in rice using real-time PCR [J]. Plant Disease, 2007, 91:1663-1668.
[19] 邢楠. Real-time PCR Real-dime PCR用于土壤中稻纹枯病原菌的定量监测[D]. 北京:北京林业大学硕士论文,2005.Xing Nan. Real-time PCR Assay for Quantitative AssayRhizoctonia solaniAG l-IA in Soil Real-time PCR [D].Beijing: Beijing Forestry University Master Dissertation,2005. (in Chinese)
[20] 徐娜娜, 李鹏昌, 于金凤. 应用real-time PCR定量检测土壤中小麦纹枯病菌方法的建立[J]. 山东农业科学,2014, 46 ( 3 ) : 106-109.Xu Nana, Li Pengchang, Yu Jinfeng. Quantitative Detection ofRhizoctonia cerealisin Soil by Real -Time PCR [J].Shandong Agricultural Sciences, 2014, 46 ( 3 ) : 106-109.(in Chinese)
[21] 吴元华, 伏颖, 赵秀香, 穆凌霄, 赵艳琴. 烟草靶斑病菌菌丝融合群及ITS序列分析[J]. 植物病理学报, 2013,43(2): 215-218.Wu Yuanhua, Fu Ying, Zhao Xiuxiang, et al. The anastomosis groups and ITS sequence analysis ofRhizoctonia solaniisolates of tobacco target spot [J]. Acta phtopathologica sinica, 2013, 43(2): 215-218. (in Chinese)
[22] 王淑芳, 马桂珍, 钱媛媛, 陈月. 采用实时荧光定量 PCR技术比较提取土壤真菌 DNA 方法的差异[J]. 安徽农业科学, 2011, 39( 33): 20318-20321.Wang Shufang, Ma Guizhen, Qian Yuanyuan, et al.Comparison of the Di ff erence in the Fungus DNA Extracted with the Artificial Method and Kit Method [J]. Journal of Anhui Agri. Sci. 2011, 39 (33): 20318-20321. (in Chinese)
[23] Li S. D. Quantitative assay ofRhizoctonia solaniKühn AG-1 in soil. Soil Biol.Biochem, 1995, 27(3): 251-256.
Quantitative detection ofRhizoctonia solaniAG-3 in tobacco by Taqman real-time PCR
ZHAO Yanqin1, WU Yuanhua2, ZHAO Xiuxiang2, AN Mengnan2, CHEN Jianguang2
1 College of Agriculture, Inner Mongolia University for Nationalities, Tongliao 028000, Inner-Mongolia Autonomous Region, China;2 College of Plant Protection, Shenyang Agricultural University, Shenyang 110866, China
A pair of primers and probe was designed based on ITS- 5.8 S rDNA sequences of 7 strainsR. solaniAG-3 and speci fi city was certi fi cated. Detection system was established to detect DNA content of tobacco target spot pathogens from tobacco leaves and soil. Results showed that the designed probes and primers were available to detectR. solaniAG-3 from tobacco leaf and soil samples. Strong virulent strains YC-9 could be detected 6h after inoculation, while weak virulent strains LF-2 could be detected 12h after inoculation. Regression curve equation between logarithmic of DNA copy number and logarithmic of adding amount of hypha for tobacco target spot pathogen was established. Detection of soil samples of di ff erent months showed that tobacco target spot pathogen had an annual dynamic trend in soil.
Rhizoctonia solani; AG-3; quantitative real-time PCR; tobacco
赵艳琴,吴元华,赵秀香,等. 应用Taqman探针实时荧光定量PCR技术检测烟草靶斑病菌Rhizoctonia solaniAG-3 方法的建立[J]. 中国烟草学报,2016,22(1)
内蒙古民族大学校级课题[NMD1329];国家烟草专卖局科技项目(国烟办综 [2010]182号)和辽宁省烟草专卖局科技攻关项目(辽烟计[2010]86号)
赵艳琴(1978—),博士,副教授,分子植物病理学,Email:zhaoyanqin782828@qq.com
吴元华(1963—),博士,教授,植物病理学及生物农药,Email:wuyh09@vip.sina.com
2015-04-25
: ZHAO Yanqin, WU Yuanhua, ZHAO Xiuxiang, et al. Quantitative detection ofRhizoctonia solaniAG-3 in tobacco by Taqman real-time PCR [J]. Acta Tabacaria Sinica, 2016,22(1)
