烟草亲和性解钾PGPR菌株筛选及其促生效果研究
2016-11-16龚文秀曹媛媛倪海婷孙乐妮唐欣昀
龚文秀,曹媛媛,倪海婷,孙乐妮,唐欣昀
安徽农业大学生命科学学院,安徽合肥230000
烟草亲和性解钾PGPR菌株筛选及其促生效果研究
龚文秀,曹媛媛,倪海婷,孙乐妮,唐欣昀
安徽农业大学生命科学学院,安徽合肥230000
【目的】为筛选具有烟草亲和性的解钾PGPR菌株,考察PGPR对烟草生长和叶片钾含量的作用。【方法】采用解钾细菌培养基和烟草凝集素双重筛选技术,从健康烟草幼苗根际土壤中筛选具有高促生潜力的烟草亲和性解钾PGPR,测定菌株解钾能力,选取优良解钾菌株进行盆栽接种试验,调查PGPR对烟株生长影响,并测定叶片含钾量。【结果】烟草亲和性细菌占全部菌株数量的84.11%;18株PGPR的解钾能力、产IAA、产铁载体能力较强;其中7株PGPR能显著促进烟草幼苗根系生长发育,促进根系和地上部分干物质量积累,具有较大的促生长潜力。11株PGPR能促进植株对钾素的吸收,使烟草叶片含钾量显著高于施用同样水平钾肥的对照,达到施用100%钾肥处理的水平。经综合评价,TK11、TK32、TK54、TK84、TK89 共5株高效烟草亲和性菌株具有进一步研究和应用的潜力。5株高效PGPR经鉴定分属5个属,具有丰富的多样性。【结论】烟草凝集素可作为筛选高效专用PGPR的有效工具,获得的5株优良PGPR为研发烟草专用生物钾肥提供了可靠材料。
烟草;解钾能力;亲和性;PGPR;叶片钾含量
我国烤烟平均钾含量仅为1.3%[1],远低于优质烟含钾量高于2.5%的要求[2],不能满足生产高品质烟草的需求。钾素影响烟叶的生长、品质和可用性[3],烟叶含钾量与根际土壤速效钾含量极显著正相关[4]。硫酸钾和硝酸钾等化学钾肥施用促进了烟草的生产,但作物对化肥的平均利用率只有30%左右。施用硫酸钾使硫素进入土壤,过量的SO42-会抑制烟草生长[5],影响烟叶燃烧性和烤烟品质[6]。过量使用化肥导致资源、能源的浪费,并产生严重的环境污染。
植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)是一类存活在植物根际,可促进植物生长、防治病害、增加作物产量的有益菌群[7]。PGPR可以合成促进植物根系生长发育的吲哚-3-乙酸(Indole-3-acetic acid,IAA)[8,9]和具有生物防治相关性的铁载体(Siderodhore)[10,11],并能够溶解土壤中的矿物态元素[12,13]等。土壤中全钾含量很高,但作物可直接吸收利用的速效钾仅占全钾的1%~10%;钾素多以钾长石、伊利石等矿石形态存在,不能被作物直接吸收。已有一些研究利用土壤中解钾细菌制作生物肥料施到田间,增加土壤中速效钾浓度,减少钾肥的施用量。但是,由于生物肥料和目标作物之间缺乏亲和性,两者不能相互识别进而产生稳定的关系,解钾细菌不能有效地在作物根部定居,造成施用效果波动。因此,需要筛选到与目标作物具有亲和性的PGPR,以生产目标作物专用的生物肥料。凝集素(Lectin)是一种具有识别专一性的糖结合糖蛋白。植物凝集素参与细胞-细胞识别[14],可以介导植物促生细菌定殖于植物根部和抵御病原菌对植物的侵害[15]。目前为止尚没有关于对烟草具有亲和性的专用解钾细菌的研究和应用。
本研究以凝集素为介导筛选烟草亲和性解钾PGPR,考察烟草PGPR的解钾能力等促生生理活性,了解其对烟草生长和叶片钾含量的影响,以期获得具有烟草亲和性的解钾PGPR,为研究特定作物专用生物肥料、保护农业生态环境和实现农业的可持续发展提供试验依据。
1 材料与方法
1.1 供试材料
烟草样品:从烟草大田挖取健康烟草苗完整根系及根际土壤。
兔血:安徽农业大学动物科技学院提供。
烟草种子:云烟97品种,由安徽省农业科学院烟草研究所提供。
黄褐土(g·kg-1):总氮1.11,有机质21.33,有效磷(P2O5) 0.0315,速效钾(K2O) 0.154。
有机基质营养土:购于淮安市春山基质肥厂。
1.2 培养基、试剂
牛肉膏蛋白胨培养基、解钾细菌培养基[16]、细菌解钾作用试验培养基[12]、MKB培养基[10]、含0.5 g·L-1L型色氨酸的King B培养基[17]、钾长石(标准品)、CAS检测液[18]、Salkowski’s反应液[19]。
1.3 烟草凝集素提取及活性
取5 g烟草种子置于清水中室温浸泡10 h,搓种除去种皮蜡质,研磨,4 ℃条件下提取凝集素。种子中加入25 mL预冷石油醚,脱脂14 h;加50 mL预冷PBS (磷酸盐缓冲液:0.01 mol·L-1,pH 7.2,0.15 mol·L-1NaCl,下同),混匀,浸提24 h;吸取中间水相,10000 r·min-1离心20 min,上清即为粗提液;冰浴,待石油醚挥发完全后,0.2 μm微孔滤膜过滤除菌,4℃保藏备用。
按文献[20]方法用PBS配成2% 血细胞悬液,4℃保存备用。采用玻片法检测凝集素的凝血活性,在玻片凹形孔中加20 μL凝集素粗提液,再加20 μL 2%血细胞悬液,混匀,室温静置10 min,低倍镜检。用PBS代替凝集素溶液做空白对照。对有凝血活性的烟草凝集素进行凝血效价检测[21]。
1.4 烟草根际细菌筛选
称取1 g带有微量根际土壤的烟草苗幼根,加到100 mL无菌生理盐水中,加入50 μL吐温-80,120 r.min-1振荡1 h。制备解钾细菌培养基(制霉菌素终浓度30 mg.L-1),采用稀释平板法分离解钾细菌菌株,28 ℃培养72 h;挑取水滴状、透明圈较大的菌株,分离纯化,选取长势较好的菌株保藏,待进一步研究。
1.5 凝集素亲和性菌株筛选
将分离保藏的烟草根际土壤细菌接种至牛肉膏蛋白胨培养基,160 r·min-128 ℃下培养至对数期,离心收集菌体,蒸馏水洗涤后制成终浓度为108CFU·mL-1菌悬液备用。取干净载玻片,在玻片凹形孔中加20 μL凝集素粗提液,再加入等量菌悬液,混匀,室温下保湿反应30 min后自然干燥,结晶紫简单染色后镜检。烟草凝集素浸提缓冲液代替烟草凝集素粗提液做空白对照。选取烟草凝集素亲和性阳性菌株保藏备用。
1.6 烟草根际细菌促生长特性评估
参考盛下放等的试验方法[12],利用细菌解钾作用试验培养基进行摇瓶试验,过氧化氢灰化法处理发酵液,采用火焰分光光度计法测定PGPR解钾能力。参考王平等[10]方法测定烟草根际促生细菌产铁载体能力。参照文献[8]方法,利用 King B液体培养基(含0.5 g.L-1L型色氨酸)培养各菌株,采用Salkowski比色法,测定烟草根际促生细菌合成 IAA能力。
1.7 根际促生细菌对烟草幼苗的促生长作用
浸种:烟草种子用蒸馏水室温浸泡8~10 h,去掉漂浮的种子和杂质;消毒:将洗净的种子用75%乙醇处理30 s,无菌蒸馏水洗净,再置于10% H2O2中浸泡8 min,无菌蒸馏水清洗;催芽:置于28 ℃人工气候箱中光暗比16 : 8催芽至烟草种子露白。
菌液处理种子:将供试菌株接种至牛肉膏蛋白胨培养基中,28 ℃ 160 r·min-1培养至稳定期。菌液处理露白的烟草种子45 min,无菌蒸馏水清洗3次。同时取灭菌牛肉膏蛋白胨培养基同等条件处理露白烟草种子作对照。
花盆(Ø 96 mm×110 mm)中装有150 g有机基质营养土,第盆播种5~10颗种子,最终保留2株烟草苗,设3次重复;烟草置于25 ℃,光暗比16 : 8的条件下培养32 d至长出第5片真叶、根系活跃、发育较完整时取出完整植株。使用EPSON Perfection V700/750根系扫描仪扫描植株根系,采用WinRHIZO根系分析专业版软件分析实验数据;分别将地上部分和地下部分烘干至恒重,测干重。
1.8 根际促生细菌对烟草叶片钾含量的影响
采用盆栽法检测烟草PGPR对烟草叶片钾含量的影响。所有土壤施肥(g·kg-1土) CO(NH2)20.676、(NH4)2HPO40.0369,第盆装黄褐土2.5 kg,土壤含水量以田间持水量的50%计。实验设置3次重复。设置2个钾肥施用梯度(g KCl /kg土):CK1 0.134,CK2 0.267,实验组0.134,以CK2钾肥施用量为参考(100%),CK1和实验组钾肥施用量为50%。
烟草种子消毒、催芽同1.7,第盆播种5~10颗种子。实验组第盆加1 mL菌悬液(同前)处理种子,对照组第盆加1 mL灭菌牛肉膏蛋白胨培养基处理种子,覆土;3 d后出苗整齐,第盆留1株苗。盛花期打顶后,收获烟草植株,烘干至恒重。采用火焰分光光度计法[22]测烟草中部叶叶片含钾量,对数据进行单因素方差分析。
1.9 烟草根际促生菌株鉴定
据《常见细菌系统鉴定手册》[23]和《伯杰氏细菌鉴定手册》第9版[24],对筛选得到的烟草根基促生细菌菌株进行形态和生理生化鉴定。采用PCR技术扩增各菌株16S rDNA,PCR产物由生工生物工程(上海)股份有限公司测序,在NCBI核酸数据库进行BLAST比对,结合形态及生理生化特征判定种属。
2 结果与分析
2.1 菌株筛选
烟草凝集素凝集兔血细胞如图1所示,在视野范围内,实验组兔血细胞凝集成团,分布不均匀,而空白对照组兔血细胞均匀分布,结果表明烟草凝集素具有凝血活性。经检测,烟草粗凝集素提液凝集兔血细胞的最高效价为26。
烟草凝集素凝集烟草PGPR活性如图1所示,在视野范围内,部分菌株凝聚成团,呈阳性,而空白对照组细菌均匀分布。
利用解钾选择培养基从健康烟草苗根部初步筛选获得101株解钾菌。根据烟草凝集素对烟草PGPR的亲和性差异,85株对烟草凝集素呈现阳性反应,占筛选PGPR总数84.11%,这些菌株即为对烟草具有亲和性的特异性菌株。
2.2 烟草根际细菌促生长特性测定
测定85株烟草凝集素凝集反应阳性菌株的促生长特性,85株供试PGPR均有不同程度的解钾能力。挑选出18株具有较强解钾能力的菌株进行后续实验。
18株供试PGPR培养液中钾含量远高于对照组,菌株之间解钾能力存在显著差异,供试PGPR发酵液中钾含量相对增加量在36.96%~253.55%之间。不同PGPR菌株产铁载体能力和IAA能力也存在明显差异。
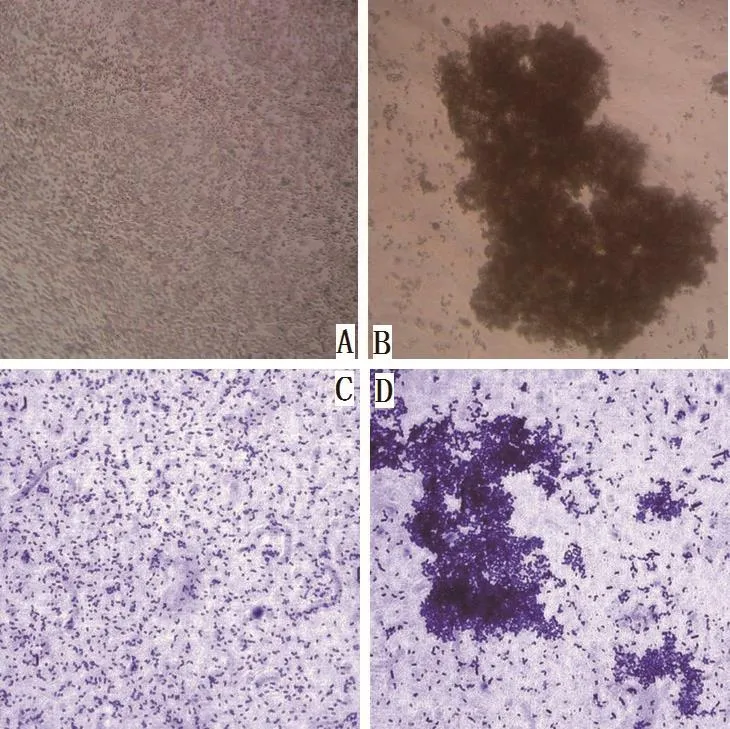
图1 烟草凝集素与兔血细胞和PGPR菌株的凝集反应Fig.1 Agglutination of tobacco lectin with rabbit blood cells and strains

表1 18株菌的促生长特性Tab.1 Plant growth-promoting traits of 18 strains

续表1
2.3 烟草根际细菌促生长研究
观察各菌株对烟草幼苗生长的影响(表2),发现13株PGPR显著促进根系干物质量积累,其中9株效果极显著;7株PGPR显著促进地上部分干物质量积累,其中2株效果极显著;7株PGPR显著促进植株总干物质量积累,其中3株效果极显著。6株PGPR显著促进根系干物质量积累,但没有显著促进地上部分干重积累;7株PGPR促生效果显著,显著促进植株根系和地上部分干物质量积累,占菌株数量的38.89%。
进一步分析试验菌株对烟草幼苗根系生长发育的影响,结果见表3。考察了PGPR菌株对根系的总表面积、总体积、总长度、平均直径、根尖数、分枝数共6个指标的影响程度,发现11株显著促进总根长增加,其中9株作用极显著;13株显著促进根系总表面积和总体积增加,其中10株作用极显著;3株显著促进根系平均直径增大,其中2株作用极显著;9株显著促进根系根尖数增加;7株显著促进根系分枝数增加,其中4株作用极显著;11株显著促进根系交叉数增加,其中7株作用极显著。12株PGPR显著促进指标达到3个及以上,占总菌株数量的66.67%。
供试菌株对烟草幼苗的根系数量的影响见表4。5株PGPR明显促进烟草根系总数量的增加,2株达到显著水平,3株达到极显著水平。进一步分析表明这种效果是表现在对根系二级侧根的影响方面,而对一级侧根数量影响不显著。
试验结果初步说明烟草PGPR能有效促进烟草根系发育,促进烟草生长和干物质量的积累。分析IAA和烟草幼苗根系之间的相关性,发现IAA与考察指标均不相关,可能是PGPR多个促生长特性同时影响植物根系的生长发育。

表2 PGPR对烟草幼苗干物质积累量的影响Tab. 2 Effects of tobacco PGPR on dry matter accumulation of tobacco seedlings
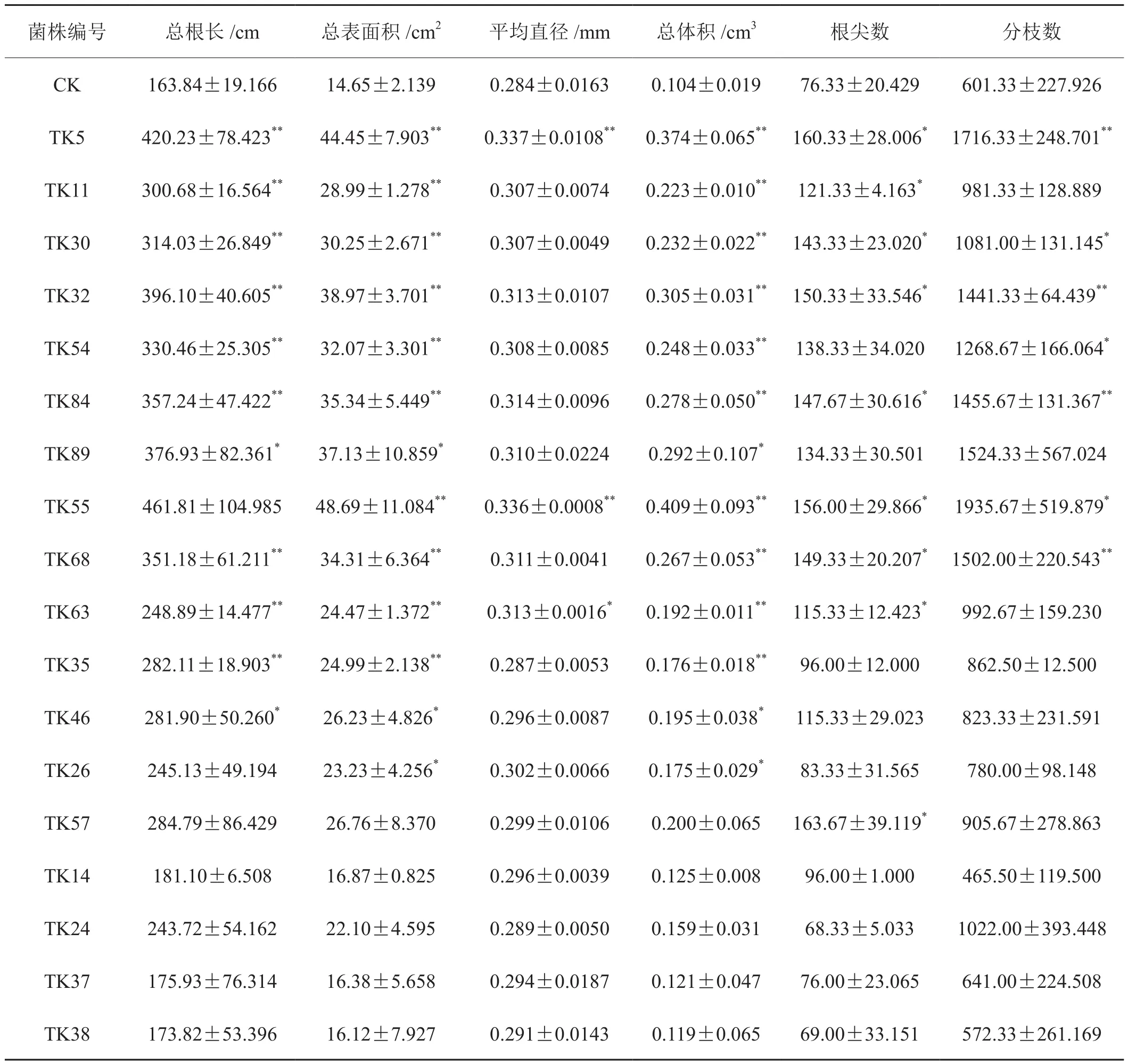
表3 PGPR对烟草幼苗根系生物量的影响Tab.3 Effects of tobacco PGPR on root parameters of tobacco seedlings

表4 PGPR对烟草幼苗根系数量的影响Tab.4 Effects of tobacco PGPR on root number of tobacco seedlings
2.4 菌株对叶片钾含量的影响
试验菌株对烟草叶片含钾量的影响见表5。PGPR处理烟草叶片含钾量高于同样施50%钾肥的CK1,其中14株效果显著,10株效果极显著;13株PGPR处理烟草叶片含钾量高于施100%钾肥的CK2,效果与CK2相当。初步说明,烟草PGPR可以代替部分钾肥提高烟草叶片含钾量。
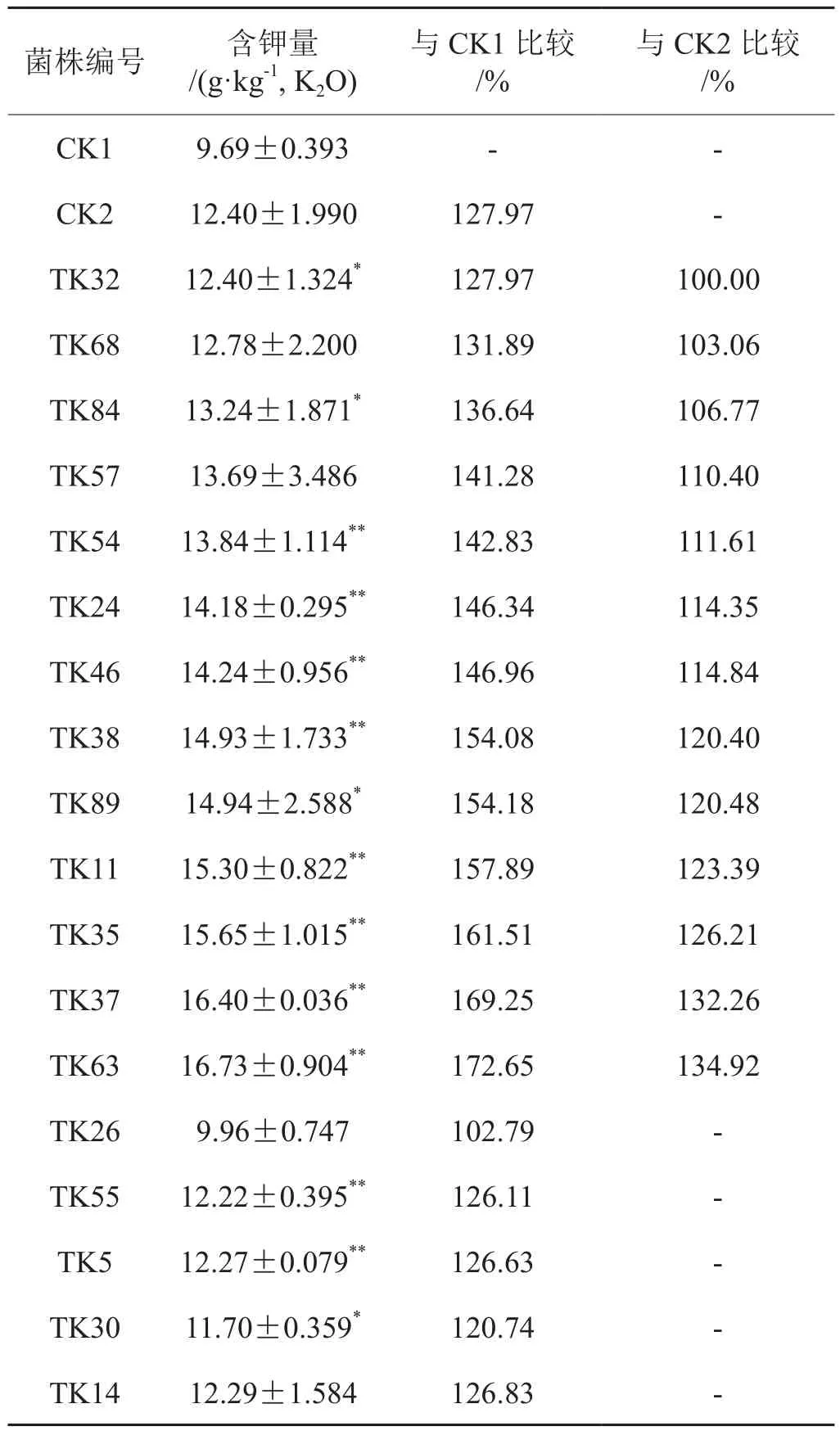
表5 烟草PGPR对烟草叶片含钾量的影响Tab.5 Effects of tobacco PGPR on potassium content of tobacco leaves
分析18株PGPR的解钾能力与烟叶含钾量之间的相关性,发现二者之间无显著相关性。解钾能力不是唯一影响烟叶含钾量和烟草根际土壤钾素营养的因素,PGPR的其他特性也影响烟草对钾素的吸收和利用。
分析分类学上相近属内菌株的解钾能力(发酵液钾素浓度)和叶片钾含量的关系,以降低PGPR其他特性对烟草叶片含钾量的影响,结果如表6所示。芽孢杆菌属和类芽孢杆菌属细菌的解钾能力与烟草叶片含钾量显著正相关(P<0.05);假单胞菌属和鞘氨醇单胞菌属细菌的解钾能力与烟草叶片含钾量中度负相关,相关系数0.5≤|r|<0.8。
2.5 亲和性菌株鉴定
18株烟草PGPR形态特征及部分生理生化特征研究及16s rDNA鉴定,结果如表7所示。18株烟草PGPR分属7个属,具有丰富的多样性。

表7 烟草PGPR鉴定结果Tab.7 Identi fi cation of tobacco PGPR
3 讨论
凝集素与微生物的根际定殖密切相关。Antonyuk等认为麦胚凝集素在固氮螺菌和植物之间的通讯中起到重要作用[25],Yegorenkova等研究发现巴西固氮螺菌(Azospirillum brasilense)在小麦根部的定殖可能涉及麦胚凝集素与细菌多糖之间的识别和交联[26]。夏觅真和齐飞飞等研究PGPR在棉花根际的定殖证实凝集素可作为筛选特异亲和性的高效PGPR菌株工具,可以筛选易于在特定植物根际定殖的PGPR菌株[27,28]。本研究利用解钾细菌培养基和烟草凝集素双重技术,从健康烟草幼苗根际初步筛选获得烟草亲和性PGPR,结果显示烟草凝集素特异亲和阳性菌株数量占初筛菌株的84.11%,获得大量烟草亲和性菌株。本研究获得18株具有解钾活性的烟草PGPR菌株,分属7个属,其中芽孢杆菌属(Bacillussp.)、类芽孢杆菌属(Paenibacillussp.)、假单胞菌属(Pseudomonassp.)为已经报道的解钾细菌类群[12,16,27-30];而微杆菌属(Microbacteriumsp.)[31]、鞘氨醇单胞菌属(Sphingomonassp.)[32]、短小杆菌属(Curtobacteriumsp.)、链霉菌属(Streptomycessp.)[33]等4属为本试验首次证明具有较强的解钾活性。本研究结果大幅度增加了解钾细菌的类群范围,说明植物根际解钾细菌资源具有丰富的多样性。因此采用烟草凝集素能够获得大批对烟草具有亲和性的可在其根际定殖的PGPR菌株。
植物根系与营养的吸收利用直接相关,在植物生长发育过程中具有重要的作用,最终影响着地上部分的生长发育。根系表面积及根尖数影响根系对土壤养分的吸收利用。PGPR可以产生植物激素(IAA、CTK、GA等),对根构型有明显调节作用,促进根尖细胞周期蛋白基因的表达、驱动侧根发生和伸长[8,9]。PGPR促进矿质元素的释放[13]、产生铁载体[11]等活性也与植物的根际营养密切相关。本试验考察了烟草PGPR菌株对根系的总表面积、总体积、总长度、平均直径、根尖数、分枝数共6个指标的影响程度,发现12株显著促进指标达到3个以上,7株烟草PGPR显著促进二级侧根数量的增加。13株PGPR显著促进根系干物质量积累,其中有7株PGPR能显著促进烟草幼苗根系、地上部分和植株总干重积累。试验获得7株具有显著促生效果的PGPR菌株,占总菌株数量的38.89%。
解钾细菌能释放土壤矿物钾,提高土壤中速效钾含量[12]。根际土壤速效钾与烟叶含钾量极显著正相关[4]。使用18株PGPR菌株接种处理的烟草叶片含钾量均高于施用50%钾肥的对照,其中14株效果显著,13株烟草PGPR处理的烟草叶片含钾量在不同程度上高于施用100%钾肥的对照,说明解钾PGPR菌株能够促进烟草对土壤钾素的吸收和利用。试验获得11株PGPR能促进植株对钾素的吸收,大幅度提高烟草叶片含钾量。
综合评价对烟草生长和叶片含钾量的影响等特性,TK11、TK32、TK54、TK84、TK89 共5株高效烟草亲和性菌株具有优良的促生生理活性和促生效果,具备在烟草栽培生产中应用的潜力。经鉴定,这5株高效PGPR分属5个属,其中芽孢杆菌属(Bacillussp.)、假单胞菌属(Pseudomonassp.)、类芽孢杆菌属(Paenibacillus sp.)是常见烟草高效解钾菌[29,30];而鞘氨醇单胞菌属(Sphingomonassp.)、短小杆菌属(Curtobacteriumsp.)等为本试验首次证明具有较强解钾活性的类群。
4 结论
采用凝集素作为介导复筛烟草PGPR的方法具有可行性,本方法可提高获得易于在目标植株根部定殖的PGPR概率,大量获得对目标作物具有专一性的优良PGPR菌株。综合评价对烟草生长和叶片含钾量的影响等特性,TK11、TK32、TK54、TK84、TK89 共5株高效烟草亲和性菌株具有进一步研究和应用的潜力。5株优良PGPR为研发烟草专用生物钾肥提供可靠材料,但不同PGPR菌株促生效果有差异,土壤差异可能会影响解钾细菌的使用效果,需要进一步考察这些菌株在田间栽培使用中的表现,以提供可靠的烟草专用解钾生物肥料菌株。
致谢
安徽农业大学农学院朱英华老师和武丽老师对本试验多次给予指导,特此致谢。
[1] 李强, 周冀衡, 何伟, 等. 中国烤烟含钾量的区域特征研究[J]. 安徽农业大学学报,2010,37(2):119-125.
[2] 石屹, 王树声, 窦玉清. 对提高我国北方烟叶含钾量的思考[A]. 跨世纪烟草农业科技展望和持续发展战略研讨会论文集[C]. 北京:中国商业出版社,1999.
[3] Tso T C. Production, physiology and biochemistry of tobacco plant[M]. Ideals, Inc., Beltsville, USA. 1991.
[4] 郑劲民, 查录云, 谢德平, 等. 河南烟区土壤供钾特性与烟叶含钾量[J]. 烟草科技,1994,5:29-32.
[5] 周冀衡. K+与伴阴离子(SO42-、Cl-)对烟草生长和有关生理代谢的影响[J]. 中国烟草学报,1994,2(2):46-53.
[6] 胡国松, 郑伟, 王震东, 等. 烤烟营养原理[M]. 北京:科学出版社,2000.
[7] 胡江春, 薛德林, 马成新, 等. 植物根际促生菌 (PGPR) 的研究与应用前景[J]. 应用生态学报,2004,15(10):1963-1966.
[8] Senthilkumar M, Madhaiyan M, Sundaram S P, et a1.Intercellular colonization and growth promoting effects of Methylobacterium sp. with plant-growth regulators on rice(Oryza sativaL. Cv CO-43)[J]. Microbiological Research, 2009,164(1): 92-104.
[9] 孙海国, 张福锁. 小麦根系生长对缺磷胁迫的反应[J]. 植物学报,2000,42(9):913-919.
[10] 王平, 董飚, 李阜棣, 等. 小麦根圈细菌铁载体的检测[J].微生物学通报,1994,21(6):323-326.
[11] Leong J. Siderophores: their biochemistry and possible role in the biocontrol of plant pathogens[J]. Annu Rev Phytopathol,1986, (24): 187-209.
[12] 盛下放, 黄为一. 硅酸盐细菌NBT菌株释钾条件的研究[J].中国农业科学,2002,35(6):673-677.
[13] Monib M, Zahra M K, Abdel, et a1. Role of silicate bacteria in releasing K and Si from biblite and orthoclase[J]. Soil Biology and Conservation of the Biosphere, 1984, 2: 733-743.
[14] Singh BK, Millard P, Whiteley AS, et al. Unravelling rhizosphere–microbial interactions: opportunities and limitations[J]. Trends Microbiol. 2004, 12(8): 386-393.
[15] De Hoff P, Brill L, Hirsch A. Plant lectins: the ties that bind in root symbiosis and plant defense[J]. Mol Genet Genomics.2009, 282(1): 1-15.
[16] 蒋宝贵, 赵斌. 解磷解钾自生固氮菌的分离筛选及鉴定[J].华中农业大学学报,2005,24(1):43-48.
[17] Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and environmental microbiology, 1995, 61(2): 793-796.
[18] Schwyn B, Neilands B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56.
[19] Gordon S A, Weber R P. Colorimetric estimation of indoleacetic acid[J]. Plant Physiol, 1951, 26(1): 192-195.
[20] Turner R H, Liener I E. The use of glutaraldehyde-treated erythrocytes for assaying the agglutinating activity of lectins[J].Analytical Biochem, 1975, 68(2): 651.
[21] 王庆忠, 张鹭, 吴耘红, 等. 14种蔬菜中凝集素的提取和生物活性研究[J]. 中国热带医学,2008,8(5):749-757.
[22] 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2005.
[23] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[24] John G H, Nobel R K, Peter H A. Bergey’s Manual of Determinative Bacteriology[M]. 9th ed. Baltimore: Williams and Wilkins Press, 1994.
[25] Antonyuk L P, Evseeva N V. Wheat lectin as a factor in plantmicrobial communication and a stress response protein[J].Microbiology, 2006, 75(4): 470-475.
[26] Yegorenkova I V, Konnoval S A, Sachuk V N, et a1.Azospirillum brasilense colonisation of wheat roots and the role of lectin-carbohydrate interactions in bacterial adsorption and root-hair deformation[J]. Plant and soil, 2001, 231(2): 275-282.
[27] 夏觅真, 马忠友, 齐飞飞, 等. 棉花根际亲和性高效促生细菌的分离筛选[J]. 微生物学通报,2008,35(11):1738-1743.
[28] 齐飞飞, 夏觅真, 唐欣昀, 等. luxAB基因标记的K2116菌株在棉花根际中的定殖[J]. 生态学杂志:2008,27(2):192-196.
[29] Liu Xiaolu, Liu Yongzhi, Yang Liuqing,et a1. Classi fi cation of Potassium-releasing Bacteria Isolated from Four Agricultural Soil Samples[J]. Journal of Pure and Applied Microbiology,2013, 7(4): 3001-3008.
[30] 张爱民, 张双凤,赵钢勇, 等. 胶冻样类芽孢杆菌CX-9菌株肥料制剂的研制及在烟草上的应用[J]. 河北大学学报,2013,33(4):387-393.
[31] 刘璇, 孔凡玉, 张成省, 等. 烟草根际解钾菌的筛选与鉴定[J].中国烟草科学,2012,33(3):28-31.
[32] Yang Suijuan, Zhang Xinghai, Cao Zhaoyun,et a1. GrowthpromotingSphingomonas paucimobilisZJSH1 associated withDendrobiumofficinalethrough phytohormone production and nitrogen fi xation[J]. Microbial Biotechnology, 2014, 7(6): 611-620.
[33] Subhashini D V. Antifungal activity ofStreptomycesspp.against different plant pathogenic fungi of tobacco[J]. Indian journal of plant protection, 2015, 43(4): 474-476.
Screening of af fi nity PGPRs from tobacco root and their growth-promotion effects on tobacco
GONG Wenxiu, CAO Yuanyuan, NI Haiting, SUN Leni, TANG Xinyun
College of Life Science, Anhui Agricultural University, Hefei 230036, China
[Objective] This paper aims to screen affinity potassium-solubilizing bacteria PGPR strains from tobacco, and to examine their e ff ects on growth and potassium content in leaf tobacco. [Method] Potassium-solubilizing bacteria culture and tobacco lectin methods were applied, and tobacco affinity potassium-solubilizing strains with a high potential for growth-promoting were selected from healthy tobacco seedlings rhizosphere soil. Strains with excellent potassium-solubilizing capability were selected by the potassium-solubilizing capability. E ff ects of the strains on growth and potassium content in leaf tobacco were investigated with pot experiment. [Result] The number of tobacco-affinity bacteria accounted for 84.11% of all isolates; 18 PGPR had strong capacity to solubilize potassium, and produced IAA and siderophore. Seven PGPR strains signi fi cantly promoted root growth and the accumulation of root and aerial parts dry matter of tobacco seedling. Eleven PGPR strains helped plant absorb more potassium, substantially increase potassium content in tobacco leaves. Potassium contents in tobacco leaves treated with these strains were much higher than those of the control with same level of potassium fertilizer dose, and even higher than those of control with 100% potassium fertilizer application. Being evaluated comprehensively with the parameters of the promotion on growth and potassium content of tobacco leaf and other characteristics, TK11, TK32, TK54, TK84 and TK89 were considered efficient affinity tobacco strains, and had the potential for further research and applications. Five efficient PGPR were identi fi ed and categorized into 5 genera.[Conclusion] Tobacco lectin can be used as an e ff ective tool for screening high-efficiency tobacco PGPR, and 5 excellent PGPR obtained provide a reliable material for the development of the tobacco-speci fi c potassium-solving fertilizer.
tobacco; potassium solving ability; affinity; PGPR; potassium content of leaf
龚文秀,曹媛媛,倪海婷,等. 烟草亲和性解钾PGPR筛选及促生效果研究[J]. 中国烟草学报,2016,22(1)
国家自然基金(No. 41401269)、安徽省高校青年基金重点项目(No. 2013SQRL015ZD)、安徽农业大学稳定和引进人才基金(No.yj2011-25)、安徽农业大学校青年科研基金(No. 2012zr006)
龚文秀(1989—),硕士,微生物生理学研究方向,Email:gong.wenxiu@163.com
曹媛媛(1980—),副教授,微生物生理学研究方向,Email:caoyy721@sina.com
2015-04-07
: GONG Wenxiu, CAO Yuanyuan, NI Haiting, et al. Screening of affinity PGPRs from tobacco root and their growth-promotion e ff ects on tobacco [J]. Acta Tabacaria Sinica, 2016,22(1)
