姜黄素类似物A13对小鼠肥大细胞瘤P815增殖及凋亡的影响
2016-11-15曹建成
曹建成 郭 璐
1.浙江省湖州市第一人民医院心内科,浙江湖州313000;2.浙江省湖州市第一人民医院药剂科,浙江湖州313000
姜黄素类似物A13对小鼠肥大细胞瘤P815增殖及凋亡的影响
曹建成1郭 璐2
1.浙江省湖州市第一人民医院心内科,浙江湖州313000;2.浙江省湖州市第一人民医院药剂科,浙江湖州313000
目的研究姜黄素(CUR)类似物A13对小鼠肥大细胞瘤P815细胞增殖及凋亡的影响,了解其在体外的抗肿瘤价值,从而为体内实验的开展提供依据。方法为检测药物对细胞的作用,将实验分为2.5、5、10 μmol/L A13组,10 μmol/L CUR组,二甲基亚砜(DMSO)对照组。P815细胞调整为6.25×103/mL、1.25×104/mL、2.5×104/mL三个细胞浓度。运用四唑盐溶液(MTT)法测定各组对三种细胞浓度P815细胞增殖的影响。流式细胞术(FCM)测定各组对细胞浓度为5×105/mL P815凋亡的影响。结果10 μmol/L A13组对6.25×103/mL、1.25×104/mL、2.5×104/mL三个细胞浓度下P815的抑制率与10 μmol/L CUR组比较差异均有高度统计学意义(P<0.01)。5 μmol/L A13组对细胞浓度为6.25×103/mL和2.5×104/mL的P815细胞的抑制率与10 μmol/L CUR组比较差异有统计学意义(P<0.05)。给药12 h后,10 μmol/L A13组早期凋亡率与DMSO对照组比较差异有统计学意义(P<0.05),与10 μmol/L CUR组比较差异无统计学意义(P>0.05)。结论CUR类似物A13体外具有良好的促凋亡和抑制细胞增殖的能力,对于体内抗肿瘤实验的开展具有更好的说服力。
姜黄素类似物A13;P815;增殖;凋亡
移植物抗宿主病(GVHD)是一种异基因造血干细胞移植后主要的并发症,是造成移植后非复发死亡的主要原因,严重威胁着患者的生存[1-2]。目前临床使用的药物都会因为抑制GVHD作用很强,而破坏移植物抗肿瘤(GVL)的作用[3],这就为我们进行新药的研究提供了一个新的方向,即降低GVHD的发生率,保留GVL作用。姜黄素(CUR)是一种从姜科植物姜黄等的根茎中提取得到的黄色色素,具有抗炎、抗肿瘤的药理作用[4],其对GVHD的治疗作用目前研究较少,但其生物利用度和水溶性较差,不利于静脉给药、观察疗效,所以本研究通过结构修饰和改造得到了生物利用度和水溶性更佳的A13。小鼠肥大细胞瘤P815作为一种白血病造模细胞,注入动物体内后,在动物的白血病模型建立中能稳定表达,造成白血病模型,所以较为常用[5]。前期笔者已验证A13的抗炎作用,所以了解A13体外对P815的作用对于进行体内的抗肿瘤实验具有很重要的意义。
1 材料与方法
1.1 化合物和细胞
CUR类似物A13由浙江省生物有机与药物化学实验室提供,相关结构见图1。P815细胞购于中国科学院上海生命科学研究院细胞资源中心。
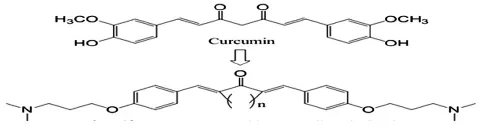
图1 A13的结构式
1.2 相关试剂
DMEM低糖培养基(Hyclone公司);胎牛血清(浙江天杭生物科技有限公司);0.1 mol/L PBS(吉诺生物医药技术有限公司);0.25%胰酶(Hyclone公司);1× 105μg/mL双抗(Hyclone公司);FITC Annexin V Apoptosis Detection Kit I(美国BD公司);四唑盐(MTT)粉末(广州斯佳科技有限公司);A13用DMSO溶解后配成50 mmol/L的贮存液置于4℃冰箱保存,实验时稀释至所需浓度。
1.3 主要仪器设备
灭菌锅(苏州江东精密仪器有限公司);细胞培养箱(上海森信公司);酶标仪(赛默飞世尔MK3杭州吉西今科学仪器有限公司);高速冷冻离心机(贝克曼J-26XP上海宽为);低温冰箱(BCD216TXD海尔公司);超低温冰箱(FORMA702杭州宝诚公司);电子天平(宇称BSA224S);超净工作台(BSC-1360IIA2哈东联电子技术开发有限公司);超滤管(Millipore公司);流式细胞仪(BD公司)。
1.4 细胞培养
P815小鼠肥大细胞瘤细胞为半悬浮生长细胞,培养于含有1.5 g/L碳酸氢钠、4.5 g/L葡萄糖、10%胎牛血清、4 mmol/L L-谷氨酰胺的DMEM培养基中,培养条件为37℃、5%CO2。当细胞生长到铺满培养瓶时进行传代。细胞传代方法:使用灭菌移液枪吸取培养基轻轻吹打细胞,使贴于细胞瓶底的细胞全部脱落,成为单个悬浮细胞后,离心除去消化液,用新鲜的完全培养基重悬细胞后,分置其他无菌培养瓶内,加入完全培养基后继续培养后进行实验。
1.5 MTT测活性
本实验使用MTT法测定CUR类似物A13抑制P815细胞生长的活性。①用含10%胎牛血清的DMEM培养基,将对数生长期的P815细胞调节至浓度为6.25×103/mL、1.25×104/mL、2.5×104/mL,接种于96孔板中,37℃、5%CO2条件下培养24 h。②24 h后,将DMSO对照组、10 μmol/L CUR组和2.5、5、10 μmol/L A13组分别加入96孔板中,每3孔为一平行组,继续培养24 h。③24 h后利用MTT试剂盒进行操作,在570 nm波长下测其OD值,绘制对应的抑制率-药物浓度柱状图。抑制率=100%-(药物组OD值-非处理组OD值)/非处理组OD值×100%。
1.6 细胞凋亡检测
本实验使用流式细胞仪法测定CUR类似物A13诱导P815细胞的凋亡率。①将对数生长期的P815细胞调节至浓度为5×105/mL,加入60 mm细胞培养皿中,10%胎牛血清的DMEM培养基,37℃、5%CO2条件下培养24 h。②24 h后,将DMSO对照组、10 μmol/L CUR组和2.5、5、10 μmol/L A13组分别加入细胞培养皿中,继续培养12 h。③12 h后利用膜联蛋白-V/碘化丙啶(FITC Annexin V)凋亡检测试剂盒进行操作,在流式细胞仪FL1和FL2波长下测其荧光强度,绘制对应的凋亡率-药物浓度曲线。
1.7 统计学方法
本研究采用SPSS 17.0软件分析,计量资料采用均数±标准差(±s)表示,采用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CUR类似物A13体外抑制P815细胞增殖
为了解A13对P815细胞体外增殖的抑制情况,与CUR比较是否抑制细胞增殖能力更强,本研究将P815细胞设定三个浓度分别为6.25×103/mL、1.25× 104/mL、2.5×104/mL进行实验,每次给药都有3个平行孔。结果以抑制率来表示药物对P815增殖能力的大小,结果数值越大,表示药物抑制增殖的能力越强。10 μmol/L A13组对6.25×103/mL、1.25×104/mL、2.5× 104/mL三个细胞浓度下P815的抑制率与10 μmol/L CUR组比较差异均有高度统计学意义(P<0.01)。5 μmol/L A13组对细胞浓度为6.25×103/mL和2.5× 104/mL的P815细胞的抑制率与10 μmol/L CUR组比较差异有统计学意义(P<0.05)。见表1、图2。
表1 三种细胞浓度下各实验组对P815细胞的抑制率(%,±s)
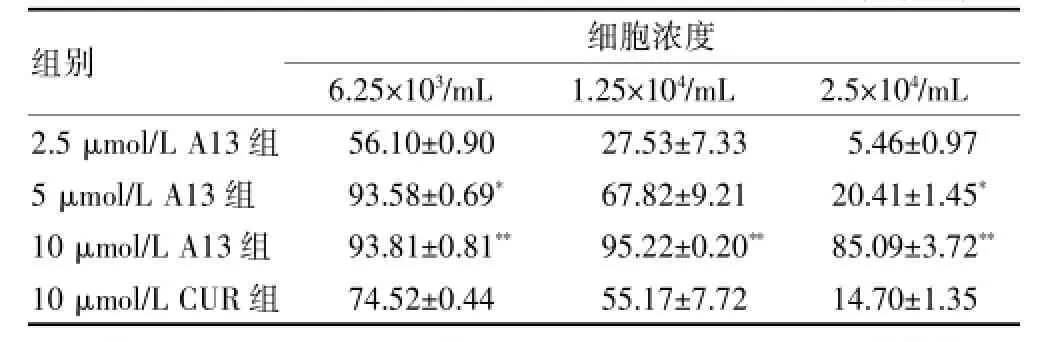
表1 三种细胞浓度下各实验组对P815细胞的抑制率(%,±s)
注:与10 μmol/L CUR组比较,*P<0.05,**P<0.01;CUR:姜黄素
组别细胞浓度6.25×103/mL1.25×104/mL2.5×104/mL 2.5 μmol/L A13组5 μmol/L A13组10 μmol/L A13组10 μmol/L CUR组56.10±0.90 93.58±0.69*93.81±0.81**74.52±0.44 27.53±7.33 67.82±9.21 95.22±0.20**55.17±7.72 5.46±0.97 20.41±1.45*85.09±3.72**14.70±1.35
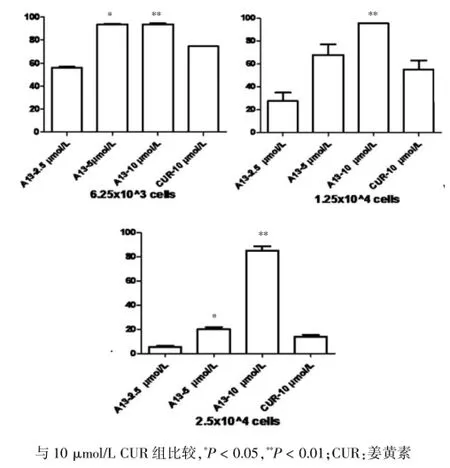
图2 三种细胞浓度下各实验组对P815细胞的抑制率
2.2 CUR类似物A13体外诱导P815细胞凋亡
凋亡实验中,CUR类似物A13对P815细胞不仅可以促进其凋亡,还存在着浓度依赖性,本研究以早期凋亡的百分率作为统计标准,给药12 h后,10 μmol/L A13组早期凋亡率与DMSO对照组比较差异有统计学意义(P<0.05),与10 μmol/L CUR组比较差异无统计学意义(P>0.05),见表2。图3中横纵坐标为流式细胞仪中代表细胞的散射光和检测通道。Annexin V单阳性细胞(Annexin V+PI-)为早期凋亡细胞,PI单阳性细胞(Annexin V-PI+)为死亡细胞,Annexin V和PI双阳性细胞(Annexin V+PI+)为晚期凋亡细胞,AnnexinV和PI双阴性细胞(AnnexinV-PI-)为正常存活细胞。
3 讨论
CUR是从姜黄中提取的一种酚类色素,是一种具有降脂、抗炎、抗氧化、清除自由基、抗微生物、抗肿瘤以及对心血管系统消化系统等多种生物活性的天然多酚[6],而其抗肿瘤作用日益引起人们的重视,它对多种肿瘤细胞的产生、增殖、转移均有抑制活性,如结肠癌、胃癌、肝癌、乳腺癌、前列腺癌、皮肤癌等[7-9],对血液系统恶性肿瘤的研究也已广泛开展[10-11]。但其存在生物利用度低、水溶性较差等缺点,使其临床应用受到限制。有文献报道,CUR被包裹为微乳时对血液肿瘤细胞同样具有抗增殖和促凋亡的作用[12]。通过改变剂型可以增加CUR的生物活性,于是笔者对CUR展开了大量的结构改造,以期能改善其生物活性及成药性,通过前期筛选得到了目标药物A13。
表2 各组对5×105/mL P815细胞给药12 h后早期凋亡率的影响(%,s)

表2 各组对5×105/mL P815细胞给药12 h后早期凋亡率的影响(%,s)
注:与DMSO对照组比较,*P<0.05;CUR:姜黄素;DMSO:二甲基亚砜
组别早期凋亡率2.5 μmol/L A13组5 μmol/L A13组10 μmol/L A13组10 μmol/L CUR组DMSO对照组5.00±2.51 6.00±0.57 10.00±1.00*4.66±1.76 3.00±1.52

图3 各组给药12 h后P815细胞凋亡流式分析
肥大细胞瘤P815细胞是一种DBA/2系小鼠来源的肿瘤细胞[13],它的抗原背景较清楚,且其中一种抗原P1A是目前已知小鼠肿瘤中仅有的一个与人类肿瘤抗原MAGE基因家族表达相似的肿瘤抗原,使其成为肿瘤免疫学特别是肿瘤疫苗领域常用的细胞系之一。而本课题正是研究当小鼠体内存在血液肿瘤时,通过骨髓移植的手段,CUR类似物A13可以减少移植物抗宿主病,保留移植物抗肿瘤作用。
通过MTT实验可知,5、10 μmol/L A13在体外都具有一定的抑制细胞增殖的能力,那它是通过影响周期还是促进细胞凋亡来抑制肿瘤细胞的生长的?有文献报道,CUR能增加成纤维细胞G2/M的比例,减少S期来抑制细胞增殖[14]。前期周期实验提示,不同浓度的A13并不影响P815细胞的生长周期,并不存在周期特异性。细胞凋亡是为适应环境变化的一种主动反应过程,存在2个核心途径,即外源性死亡受体途径和内源性线粒体途径[9],其主要受到Bcl-2家族、Caspase家族、癌基因如C-myc、抑癌基因P53等的调控。运用Annexin V-FITC试剂盒的流式细胞技术是检测细胞凋亡比较常用的手段,具有灵敏度高、可检测出早期凋亡等特点。当凋亡开始时,较早出现的凋亡特征之一是作为质膜组分的磷脂酰丝氨酸从膜内侧翻转到膜外侧而暴露于细胞表面。Annexin V分子是一种与磷脂酰丝氨酸有高亲和力的磷脂结合蛋白,可结合胞外的磷脂酰丝氨酸,由于Annexin V标记了荧光染料FITC,利用流式细胞仪便可灵敏地检测出发生凋亡的细胞[15]。在本研究中,用不同浓度的A13处理P815细胞12 h后,结果显示,随着药物浓度的升高,细胞早期凋亡率增加,且呈剂量依赖型。总之,A13作为CUR类似物提高了生物利用度和水溶性,但不具有影响细胞周期的能力,这为我们进一步探讨A13是通过哪种机制影响凋亡提供了方向。
[1]邓陶然,肖毅.慢性移植物抗宿主病的治疗进展[J].器官移植,2016,1(6):64-68.
[2]黄文发,谢玮鑫,涂三芳,等.白细胞介素17在移植物抗宿主病中的作用[J].细胞与分子免疫学杂志,2015,31(10):1421-1423.
[3]丁萍,陈黎,张铀.芳香烃受体在免疫系统及移植物抗宿主病(GVHD)中的研究进展[J].免疫学杂志,2015,1(31):74-79.
[4]赵孝金,李洪志,张春雷,等.姜黄素及其类似物治疗糖尿病的研究进展[J].牡丹江医学院学报,2016,1(37):103-105.
[5]赵建平.基于小鼠肥大细胞瘤P815细胞的肿瘤免疫学进展[J].免疫学杂志,2001,17(3):63-67.
[6]文雪.姜黄素的抗肿瘤研究进展[J].科技视界,2015(33):93.
[7]Chen QY,Zheng Y,Jiao DM,et al.Curcumin inhibits lung cancer cell migration and invasion through Rac1-dependent signaling pathway[J].J Nutr Biochem,2014,25(2):177-185.
[8]Nagaraju GP,Aliya S,Zafar SF,et al.The impact of curcumin on breast cancer[J].Integr Biol,2012,4(9):996-1007.
[9]朱国华,沈群.姜黄素抗白血病作用及其机制的研究进展[J].中成药,2015,37(10):2251-2254.
[10]Pae HO,Jeong SO,Jeong GS,et al.Curcumin induces proapoptotic endoplasmic reticulum stress in human leukemia HL-60 cells[J].Biochem Biophys Res Commun,2007,353(4):1040-1045.
[11]Liu HL,Chen Y,Gui GH,et al.Curcumin,a potent antitumor reagent,is a novel histone deacetylase inhibitor regulating B-NHL cell line Raji proliferation[J].Acta Phar Macol Sin,2005,26(5):603-609.
[12]吴红颜,耿玲玲,刘志刚,等.姜黄素微乳对人类白血病K562细胞增殖和凋亡的影响[J].白血病·淋巴瘤,2013,22(10):578-581.
[13]孙茂本,王亮,邓兰,等.Balb/c小鼠肥大细胞/白血病模型的建立[J].热带医学杂志,2011,11(3):237-239.
[14]郝小惠,郭志义,张银红,等.姜黄素对人肺成纤维细胞凋亡及细胞周期的影响[J].中国工业医学杂志,2011,24(6):411-413.
[15]王倩,赵刚.姜黄素诱导宫颈癌HeLa细胞凋亡的机制[J].中国医院药学杂志,2013,33(17):1385-1389.
Effects of curcumin analogues A13 on the proliferation and apoptosis of mastocytoma cells P815 in mice
CAO Jiancheng1GUO Lu2
1.Department of Cardiology,the First People's Hospital of Huzhou City,Zhejiang Province,Huzhou313000,China;2.Department of Pharmacy,the First People's Hospital of Huzhou City,Zhejiang Province,Huzhou313000,China
ObjectiveTostudytheeffect of curcumin(CUR)analoguesA13onthe proliferation and apoptosis of mastocytoma cells P815 in mice,to understand its advantage of anti-tumor in vitro,so as to provide a basis for the start of experiments in vivo.Methods To detect the effect of drugs on cells,the experiment was divided into 2.5,5,10 μmol/L A13 group,10 μmol/L CUR group,dimethyl sulfoxide(DMSO)control group.The P815 cells were set as 6.25×103/mL,1.25×104/mL,2.5×104/mL three different concentrations.The methyl thiazolyl tetrazolium(MTT)was used to detect the proliferation effects of all groups for three different concentrations of P815 cells.Furthermore,flow cytometry(FCM)was used to detect the apoptosis effects of all groups for 5×105/mL P815 cells.Results The inhibition rates of 10 μmol/L A13 group for 6.25×103/mL,1.25×104/mL,2.5×104/mL concentrations of P815 cells had highly statistically significant differences compared with 10 μmol/L CUR group(P<0.01),the inhibition rates of 5 μmol/L A13 group for 6.25×103/mL,2.5×104/mL concentrations of P815 cells had statistically significant differences compared with 10 μmol/L CUR group(P<0.05). After administration for 12 h,the early apoptosis rate of 10 μmol/L A13 group had a statistically significant difference compared with DMSO control group(P<0.05),which had no statistically significant difference compared with 10 μmol/L CUR group(P>0.05).Conclusion CUR analogues A13 has good advantages on promoting apoptosis and inhibiting proliferation in vitro,which has better persuasion for the experiment of anti-tumor in vivo.
Curcumin analogues A13;P815;Proliferation;Apoptosis
R285
A
1673-7210(2016)07(b)-0022-04
2016-02-13本文编辑:张瑜杰)
