图像分析软件Image J在眼表活体共聚焦显微镜检测中的应用
2016-11-15钟承双
钟承双
图像分析软件Image J在眼表活体共聚焦显微镜检测中的应用
钟承双①

目的:采用开源式图像分析软件Image J对图像进行反卷积处理,以获得符合临床诊断标准的眼表活体共聚焦显微镜(IVCM)图像。方法:使用Image J图像分析软件对IVCM采集到的图像进行处理,找到一种能够方便、快速、低成本获得清晰检测图像的方法,减少眼表活体共聚焦显微检查患者心跳或不自主运动等原因所造成的图像模糊、清晰度较差等成像质量问题。结果:在不影响分辨率的前提下,图像分析软件Image J能够获得更加清晰的图像。结论:图像分析软件Image J运用在眼表活体共聚焦显微镜检测中能提高成像质量,有助于临床诊断。
眼表活体共聚焦显微镜;Image J软件;图像处理;反卷积
[First-author’s address] Maoming Traditional Chinese Medicine Hospital, Guangdong maoming, 525000, China.
20世纪90年代,Cavanagh等[1]首次报道了利用共聚焦显微镜对猫、兔以及人体进行活体眼球断层扫描的技术,开启了眼表活体内共聚焦显微镜(in vivo confocal microscopy,IVCM)在眼科诊断中的应用时代。随着科技的不断发展,IVCM已经得到了长足的发展,更好地服务于眼科诊断的工作中[2-5]。
IVCM工作的基本原理是通过点滴有透明半固体状眼药水的目镜与局部麻醉状态的患者角膜接触,从而进行图像采集。IVCM的图像采集过程需要患者眼部肌肉保持完全静止的状态,但是在实际操作中,由于患者的呼吸、心跳或是不自主运动等原因,采集到的图像往往会非常模糊、清晰度较差,在很大程度上影响到医生对病情的判断[6]。由美国国立卫生研究院(National Institute of Health,NIH)参与研发的开源式免费图像处理软件Image J的出现则能够很好的解决上述问题[7-9]。为此,本研究在利用图像处理软件Image J对IVCM采集到的图像进行处理,旨在找到一种能够方便、快速且低成本的获得清晰IVCM图像的方法。
1 实验原理与方法
1.1 实验原理
采用眼表活体共聚焦显微镜采集到的模糊图像。在图像获取过程中,由于观测物体与镜头之间的相互移动造成的模糊图像称为运动模糊图像,而水平运动及垂直运动造成的模糊是运动模糊图像最常见的两种类型。对运动模糊图像进行恢复的过程是将图像退化过程模型化,并由此采取相反的过程以获得清晰的接近于原始状态的图像。反卷积过程是先求得图像的点扩散函数(point spread function,PSF),再通过相应算法获取的运动模糊图像和PSF得到清晰图像的过程[10-13]。
1.2 实验方法
利用图像处理软件Image J的反卷积模块对获取的模糊图像进行图像处理,并对处理前和处理后图像的模糊程度进行比较判断,以确定Image J的反卷积的效果是否能够满足正常的临床诊断标准。
1.3 实验步骤
(1)将获取的图像在图像处理软件Image J中打开,在Plugins中选取Iterative Deconvolution插件,即图像反卷积插件,其插件界面如图1所示。

图1 Image J 的反卷积插件界面图
(2)将反卷积插件打开后,跳出的窗口会显示反卷积的设置参数。在操作中需设置2个重要参数:①PSF(核心),是选择所需要的PSF参数,在正常操作中需要选择对图片进行PSF计算后的图片,但在二维图像处理中,使用目的图片本身对目的图片进行反卷积的效果佳,且操作时间短,因此在实验中选择使用图片1对图片1本身进行反卷积;②Number of Iterations(重复次数),是指进行反卷积的次数。反卷积进行的次数越多,图像处理的效果越好(如图2所示)。
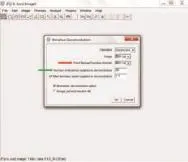
图2 反卷积的参数设置界面图
2 结果
(1)图像效果。在图像获取过程中由于患者不自主的运动产生许多细小幅度的位移,如图3所示。

图3 利用Image J 打开图像示图
(2)不同次数的反卷积处理之后的结果。在对图片分别进行15次、25次、35次和100次反卷积处理之后,图像的清晰度越来越高,大部分的细小位移恢复到正常水平。但在多次进行反卷积处理之后,图像本身的一些细节也有不同程度的丢失。因此,反卷积处理的次数是关系到图像处理结果最重要的因素,需根据不同的需求进行相应的调整(如图4所示)。
图4是对图3进行不同次数的反卷积处理之后的结果,其结果表明,经过反卷积处理之后的图像与原始图像相比,清晰度有很大提高,背景噪音有很大降低,表明利用开源式图像处理软件Image J自带的反卷积插件能够较便捷地对眼表活体共聚焦显微镜采集到的模糊图像进行清晰化处理,以满足临床诊断的需要。
(3)经100次反卷积处理后的图像。对原始图像进行100次反卷积处理后的图像进行灰度分析、对比后,能够很直观显示,经过反卷积处理之后的图像灰度分布更加密集,表明经过处理之后的图像清晰度较原始图像有很大的提高(如图5所示)。

图4 不同反卷积次数对图像处理的影响示图
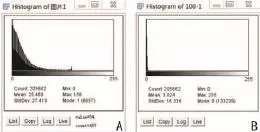
图5 进行反卷积分析前后图像的灰度分布图
3 结论
开源式图像处理软件Image J带有程式化的反卷积模块,可使得对图像处理过程和相应算法不很精通的非专业人士进行相对专业的图像处理[14-16]。使用开源式图像处理软件Image J自带的反卷积插件对眼表活体共聚焦显微镜采集到的模糊图像进行清晰化处理后,图像的清晰度有很大提升,能够满足临床诊断的需要,并会在眼表活体IVCM检测中发挥更加重要的作用[17-19]。但是,对于情况更为复杂图像的处理,如三维重构图和移动位移更大的图像,尚需进行深入的研究探讨。
[1]Cavanagh HD,Jester JV,Essepian J,et al. Confocal microscopy of the living eye[J].CLAO J,1990,16(1):65-73.
[2]梁庆丰,孙旭光,Antoine L.活体共聚焦显微镜在感染性角膜炎诊治中的应用[J].中华眼科杂志,2013,49(10):951-955.
[3]赵江月,孙琦,陆博,等.激光共聚焦显微镜观察超声乳化白内障吸出术后角膜的组织学改变[J].国际眼科杂志,2010,10(4):667-670.
[4]王丽娅,荆洋.角膜共聚焦显微镜在眼表疾病诊治中的作用[J].眼科,2011,20(3):145-147.
[5]徐建江,乐琦骅.眼表活体共聚焦显微镜[M].上海:复旦大学出版社,2009.
[6]徐建江,李一敏.眼表活体共聚焦显微镜的临床应用进展[J].中国眼耳鼻喉科杂志,2012,12(z1):447-450,454.
[7]Abràmoff MD,Magalhães PJ,Ram SJ.Image processing with ImageJ[J].Biophotonics international,2004,11(7):36-42.
[8]Collins TJ.ImageJ for microscopy[J].Biotechniques,2007,43(1 Suppl):25-30.
[9]Rasband W,Image J.Image processing and analysis in java[J].Astrophysics Source Code Library,2012,1(06013.
[10]明文华,孔晓东,屈磊,等.运动模糊图像的恢复方法研究[J].计算机工程,2004,30(7):133-135.
[11]谋炎.反卷积和信号复原[M].北京:国防工业出版社,2001.
[12]杨航.图像反卷积算法研究[D].长春:吉林大学,2012.
[13]Kirshner H,Sage D,Unser M.3D PSF models for fluorescence microscopy in Image[C].Jproceedings of the Proceedings of the Twelfth International Conference on Methods and Applications of Fluorescence Spectroscopy,Imaging and Probes,2011.
[14]Unser M.Advanced image processing and analysis using Image[C].Jproceedings of the 8th European Light Microscopy Initiative Meeting,2008.
[15]Helps SC,Thornton E,Kleinig TJ,et al.Automatic nonsubjective estimation of antigen content visualized by immunohistochemistry using color deconvolution[J].Applied Immunohistochemistry Molecular Morphology,2012,20(1):82-90.
[16]张楠,段娟,武博,等.医学图像处理课程的创新性教学研究[J].中国医学装备,2015,12(10):5-8,9.
[17]Nasse MJ,Woehl JC.Realistic modeling of the illumination point spread function in confocal scanning optical microscopy[J].J Opt Soc Am A Opt Image Sci Vis,2010,27(2):295-302.
[18]Sage D,Neumann FR,Hediger F,et al. Automatic tracking of individual fluorescence particles:application to the study of chromosome dynamics[J].Image Processing, 2005,4(9):1372-1383.
[19]Aguet F,Van De Ville D,Unser M.Model-based 2.5-D deconvolution for extended depth of field in brightfield microscopy[J].Image Processing,IEEE Transactions on,2008,17(7):1144-1153.
The application of Image J software in ocular surface examines by in vivo confocal microscopy
ZHONG Cheng-shuang// China Medical Equipment,2016,13(4):97-99.
Objective: To get in vivo confocal microscopy images which is in line with the clinical diagnostic criteria of the ocular surface by the process of using Image J. Methods: By using the image deconvolution process of open-source image analysis software Image J to obtain clear images, and reducing less clear image caused by the heart beats or involuntary movements of patients. Results: Without affecting the image resolution, the image analysis software Image J can get clearer pictures and allows doctors to have a more accurate judgments. Conclusion: Image analysis software Image J will play a more important role in ocular surface examines by in vivo confocal microscopy.
In vivo confocal microscopy; Image J software; Image processing; Deconvolution
10.3969/J.ISSN.1672-8270.2016.04.030
1672-8270(2016)04-0097-03
R197.324
A
2015-12-30
①茂名市中医院设备科 广东 茂名 525000
钟承双,男,(1982- ),本科学历,工程师。茂名市中医院设备科,从事设备维修保养工作。
