木糖醇对大豆分离蛋白结构和起泡特性的影响
2016-11-14潘明喆孟宪军
潘明喆,李 斌,孟宪军,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110161;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
木糖醇对大豆分离蛋白结构和起泡特性的影响
潘明喆1,2,李 斌1,孟宪军1,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110161;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
研究添加不同质量分数木糖醇时大豆分离蛋白的结构、溶解性、表面疏水性、内源荧光强度以及起泡特性的变化情况,以期更加深入了解木糖醇对大豆分离蛋白结构和功能特性的影响。结果表明:在木糖醇的作用下,大豆分离蛋白的溶解性增加,而表面疏水性和内源荧光强度降低,原来暴露的酪氨酸和色氨酸残基则被包裹到分子内部。同时,大豆分离蛋白的结构也发生了改变,其二级结构变得更加有序、致密。由于大豆分离蛋白结构的变化,其起泡能力受到抑制。另外,木糖醇使大豆分离蛋白溶液的表观黏度增加,有利于提高其泡沫稳定性。
大豆分离蛋白;木糖醇;蛋白质结构;起泡特性
潘明喆, 李斌, 孟宪军. 木糖醇对大豆分离蛋白结构和起泡特性的影响[J]. 食品科学, 2016, 37(15): 63-68. DOI:10.7506/ spkx1002-6630-201615011. http://www.spkx.net.cn
PAN Mingzhe, LI Bin, MENG Xianjun. Effect of xylitol on structural and foaming properties of soy protein isolate[J]. Food Science,2016, 37(15): 63-68. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615011. http://www.spkx.net.cn
大豆蛋白是一种优质廉价的动物蛋白质替代资源,随着人们对大豆蛋白功能性质及营养特征的了解不断加深,其被广泛应用于各类食品的开发中[1-2]。大豆蛋白在诸多方面的应用与其所特有的功能性质如溶解性、起泡特性、乳化稳定性和增稠性等有着紧密的联系。将大豆蛋白用于肉类食品、焙烤食品、冰淇淋、休闲食品的生产加工,可以改善和提高产品的质地和稳定性[3]。在食品中,大豆蛋白能否充分发挥其所具有的功能特性,取决于其在食品中的结构和浓度、溶解大豆蛋白的溶液组成,以及食品的生产工艺。进一步研究以上因素对大豆蛋白功能特性的影响,对提高大豆蛋白食品的品质十分有益[4-5]。
许多食品在生产过程中除了使用大豆蛋白,还会添加一些小分子水溶性的中性助溶剂,如糖和糖醇类化合物[5]。糖醇是非糖甜味剂,作为食糖的替代物能够用于食品的生产[6]。例如,木糖醇和山梨醇可以用于生产无糖和预防龋齿的食品[7-8]。许多研究表明,糖醇化合物能够改变、提高蛋白质的构型和功能特性,例如热稳定性、胶凝性、起泡特性以及乳化稳定性等[4,9],然而,这些化合物对溶液中蛋白质特性的改变,则往往与其自身的性质例如分子大小、形状以及分子间的相互作用紧密相关[10-11]。如果在蛋白质溶液中添加合适类型和浓度的糖醇化合物,则可以调整蛋白质在某一方面的功能特性。例如,Conti等[12]的研究表明添加质量分数20%的山梨醇能够显著提高蛋白质在等电点附近的溶解性。
目前,有关糖醇化合物对大豆蛋白结构和功能特性影响的研究报道并不多见。因此,本实验拟采用凯氏定氮法、8-苯胺基-1-萘磺酸钠(1-naphthalenesulfonicacid-8-(phenylamino)-sodiumsalt,ANS)荧光探针法、紫外吸收光谱、荧光光谱以及圆二色光谱(circular dichroism,CD)检测方法,研究添加不同质量分数木糖醇时大豆蛋白溶解性、疏水性、结构以及起泡能力和泡沫稳定性的变化情况,从而探究木糖醇对大豆蛋白结构和起泡特性的影响。
1 材料与方法
1.1材料与试剂
大豆东农46由东北农业大学大豆研究所提供。
ANS 美国Sigma公司;甘露醇、山梨醇、木糖醇阿拉丁试剂公司;Lowry法蛋白质含量测定试剂盒上海荔达生物公司;其他试剂均为分析纯。
1.2仪器与设备
AllegraTM64R离心机 美国Beckman公司;PHS-3C型pH计 上海雷磁公司;DU800紫外-可见分光光度计 美国Beckman公司;F4500荧光分光光度计 日本Hitachi公司;J-815圆二色光谱仪 日本Jasco公司;T18基本型分散机 德国IKA公司。
1.3方法
1.3.1大豆分离蛋白(soy protein isolate,SPI)的制备
参考Jiang Jiang等[13]的方法,略有改动:以东农46大豆种子为原料,经捣碎脱皮、去胚芽得到豆瓣。豆瓣经磨粉机粉碎后过80 目筛。在室温条件下,再按1∶4(m/V)的料液比与正己烷混合脱脂,如此重复3 次,得脱脂豆粉。将脱脂豆粉按1∶15(m/V)的料液比与去离子水混合,用2 mol/L NaOH调pH值至8.0,搅拌1.5 h后,将其悬浮液4 ℃、10 000×g离心30 min,取上清液用2 mol/L HCl调pH值至4.5。静置后4 ℃、6 000×g离心30 min。水洗沉淀2 次,取蛋白沉淀分散于水中并用 2 mol/L NaOH调pH值至7.0。最后4 ℃、10 000×g离心30 min除去少量杂质,冷冻干燥后置于4 ℃保存备用。
1.3.2SPI溶液的配制
参考Chen Haiying等[14]的方法,略有改动:在室温(22±2) ℃条件下,称取一定质量的大豆分离蛋白(SPI)冻干样品,溶解在pH 7.0、0.01 mol/L磷酸盐缓冲液中,经磁力搅拌2 h(确保充分溶解),配制成质量分数为5%的蛋白原溶液。将木糖醇溶解到缓冲溶液中,磁力搅拌30 min,配制成质量分数为40%木糖醇原溶液。然后将适量的木糖醇原液缓慢添加到SPI溶液中,再充分混匀,最终配制成含有1% SPI和不同质量分数(0%、2.5%、5%、7.5%、10%、15%、20%)木糖醇的溶液。
1.3.3溶解度的测定
参考Lee等[15]的方法,略有改动:参照1.3.2节方法制备SPI以及SPI和木糖醇溶液,20 ℃、10 000×g离心20 min后,用凯氏定氮法测定上清液(可溶部分)的蛋白含量(N含量×6.25)。上清液的蛋白含量与样品蛋白总含量的比值即为溶解度,其计算公式如下。

1.3.4蛋白质表面疏水性的测定
参考Kato等[16]的方法,略有改动:采用0.01 mol/L、pH 7.0的磷酸盐缓冲液将样品的蛋白质质量浓度稀释到0.01~0.1 mg/mL之间。取不同质量浓度的稀释样品5 mL,加入25 μL的ANS溶液(用pH 7.0、0.01 mol/L的磷酸盐缓冲液配制成8 mmol/L的溶液),振荡均匀。采用日立F4500荧光分光光度计,在激发和发射波长分别为390 nm和470 nm、激发和发射狭缝宽均为5 nm条件下,测定样品的荧光强度(fluorescence intensity,FI)。以荧光强度对蛋白质质量浓度作图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数。
1.3.5蛋白质内源荧光分析
参考Zhang Jing等[17]的方法,略有改动:采用0.01 mol/L、pH 7.0的磷酸盐缓冲液将样品的蛋白质质量浓度稀释到0.1 mg/mL。采用日立F4500荧光分光光度计,在激发波长为280 nm、激发和发射狭缝宽均为5 nm条件下,测定300~400 nm波长范围内的发射光谱。
1.3.6紫外吸收光谱扫描
参考Jiang Jiang等[13]的方法,略有改动:用0.01 mol/L、pH 7.0的磷酸盐缓冲液将样品的蛋白质质量浓度稀释到0.1 mg/mL。采用贝克曼DU800紫外-可见分光光度计进行扫描,获得样品在270~310 nm波长范围内的紫外光谱。所得的紫外光谱经Origin软件处理得到二级衍生紫外光谱。
1.3.7圆二色光谱分析
采用0.01 mol/L、pH 7.0的磷酸盐缓冲液将样品的蛋白质质量浓度稀释到0.1 mg/mL。采用Jasco-815圆二色光谱仪在25 ℃条件下测定样品在远紫外区域(190~250 nm)的CD光谱。以0.01 mol/L、pH 7.0的磷酸盐缓冲液为空白,扫描速率、间隔时间、宽度以及最小间隔度分别为100 nm/min、0.25 s、1.0 nm、0.2 nm。扫描5 次,取平均值得到最终的CD光谱,以平均残基摩尔椭圆率([θ]/(deg•cm2/dmol))表示[13]。
1.3.8起泡特性的测定
参照Flanagan等[18]的方法,略有改动:SPI的起泡能力采用泡沫膨胀率(foam expansion,FE)来表示。在室温条件下,将50 mL质量分数1%的大豆蛋白溶液置于250 mL的量筒中,采用IKA T18分散机(set=5)分散2 min。将制备的泡沫样品小心转移至预先称质量的50 mL量筒中并除去顶端多余的泡沫。称量相同体积条件下的泡沫质量。然后将称质量的泡沫放置30 min。这一期间排放出的液体小心地从量筒中转移出来,并对剩余的泡沫和量筒进行称质量。按照公式(2)、(3)计算泡沫膨胀率和泡沫稳定性(foam stability,FS)。
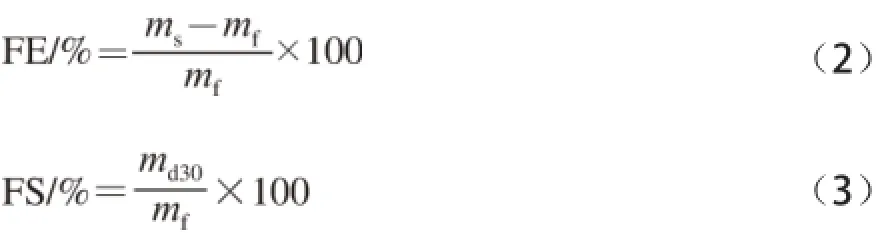
式中:ms为50 mL蛋白质溶液的质量/g;mf为50 mL泡沫的质量/g;md30为放置30 min后泡沫的质量/g。
1.4数据统计分析
实验中每组数据均重复测定3次,采用SPSS V20.0软件对数据进行差异显著性分析,采用Origin 8.0软件作图。
2 结果与分析
2.1木糖醇对大豆分离蛋白溶解性的影响
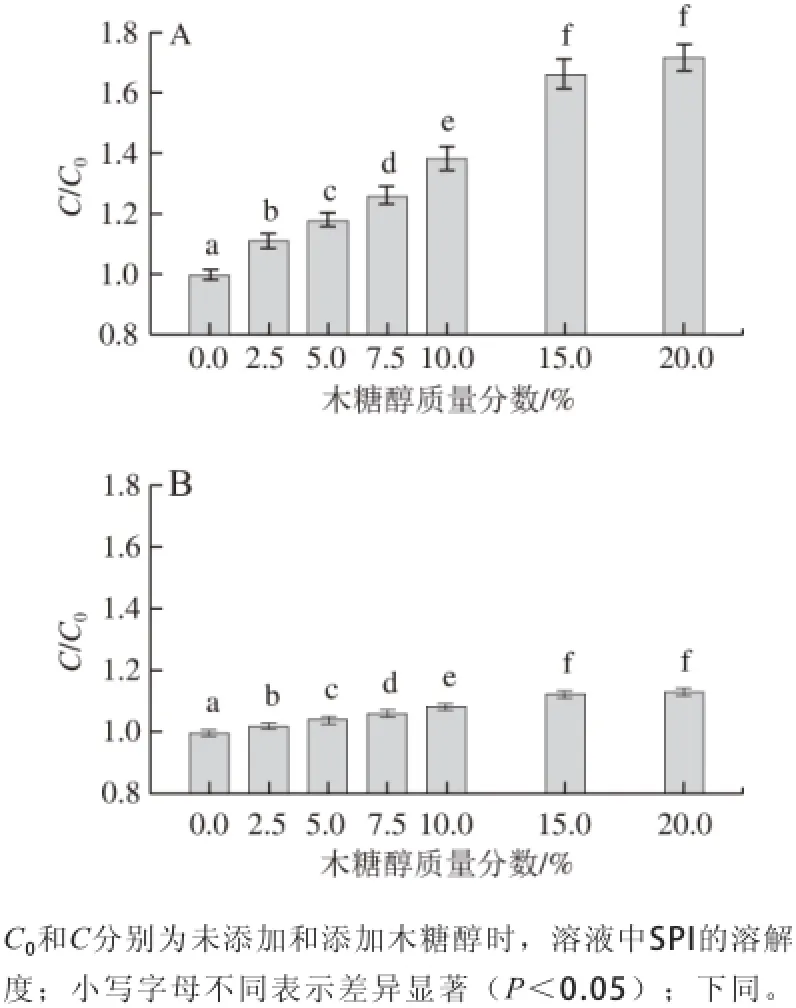
图1 不同质量分数木糖醇在pH 5.0(A)、7.0(B)时对大豆分离蛋白溶解性的影响Fig. 1 Effect of xylitol concentration on the solubility of SPI in aqueous medium at pH 5.0 (A) and 7.0 (B)
SPI的溶解性用相对值(C/C0)表示,由图1可知,15%木糖醇分别使pH 5.0和pH 7.0条件下SPI的溶解度增加了约66%和12%。如果继续增加木糖醇的质量分数,在两种pH值条件下SPI的溶解度则进一步增大,但是增加的趋势并不显著(P>0.05)。在所研究的质量分数范围内,木糖醇质量分数为20%时,SPI的溶解度最大。以上结果表明,木糖醇对SPI溶解性的影响随pH值向等电点接近程度的增大(蛋白质分子带电荷数量减少)而增大。这一结果与Antipova等[19]对蚕豆球蛋白的研究结果相似。SPI溶解性的增加可能是由于木糖醇与蛋白质分子在溶液中能直接形成多个氢键,使蛋白质分子周围形成额外的亲水层。新形成的亲水层能够增强蛋白质分子的水化作用,从而使蛋白质的溶解性增加[20]。
2.2木糖醇对大豆分离蛋白表面疏水性的影响
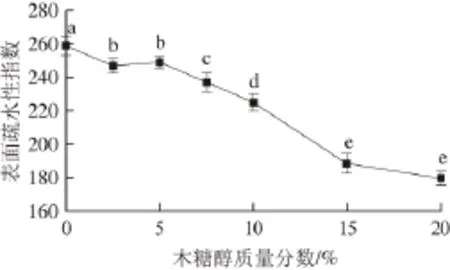
图2 不同质量分数木糖醇对大豆分离蛋白表面疏水性的影响Fig. 2 Effect of xylitol concentration on the surface hydrophobicity of SPI
不同质量分数木糖醇对SPI表面疏水性的影响如图2所示。在木糖醇的作用下,SPI的表面疏水性明显减小(P<0.05)。20%的木糖醇使SPI的表面疏水性指数由259减少到180。木糖醇质量分数为2.5%~5%时,SPI的表面疏水性变化不明显(P>0.05)。木糖醇质量分数为5%~15%时,SPI的表面疏水性则随木糖醇质量分数的增大而逐渐降低(P<0.05)。如果继续增加木糖醇质量分数至20%时,其SPI表面疏水性继续降低,但差异并不显著(P>0.05)。SPI表面疏水性的减小,一方面可能是由于木糖醇与蛋白质分子在溶液中能够直接形成多个氢键,使蛋白质分子表面形成了紧密的木糖醇分子层,这样可导致蛋白质分子的表面亲水性增加,而其表面疏水性则减少[21]。另一方面,则可能是由于在木糖醇的作用下,蛋白质分子表面结构发生重排,表面疏水区域转移到分子内部,使ANS探针的结合位点减少,从而呈现为表面疏水性降低[22-23]。这一结果则表明木糖醇可能会导致蛋白结构变得更加紧密,同时也暗示了其三级结构发生了一定程度的变化。
2.3木糖醇对大豆分离蛋白内源荧光光谱的影响
图3为SPI在不同质量分数木糖醇溶液中的内源荧光发射光谱。当激发光波长为280 nm时,反映了酪氨酸(Tyr)和色氨酸(Trp)残基的荧光发射光谱[17]。如图3所示,SPI的最大荧光发射光波长(λmax)为334 nm。在不同质量分数的木糖醇作用下,λmax从334 nm减小到333 nm,发生轻微的蓝移。同时,荧光强度(FI)呈现出减少的趋势。20%木糖醇使SPI的FI从2 097减少至1 685。此变化情况与SPI的表面疏水性变化结果(采用ANS荧光探针)基本一致。以上结果可以解释为SPI在受到木糖醇的影响后,Tyr或/和Trp残基可能被埋藏在蛋白链内部区域更加疏水的环境中[14]。
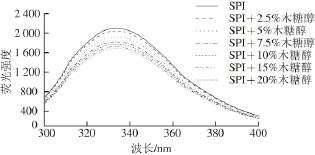
图3 添加不同质量分数木糖醇时大豆分离蛋白的荧光发射光谱Fig. 3 Fluorescence emission spectra of SPI in the presence of xylitol at different concentrations
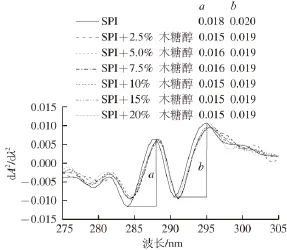
图4 添加不同质量分数木糖醇时大豆分离蛋白的紫外二阶导数光谱Fig. 4 Second-derivative UV spectra of SPI in the presence of xylitol at different concentrations
Tyr和Trp在280 nm波长附近处均有特征吸收峰。紫外吸收光谱很难分辨出叠加峰的具体特征。因此,采用紫外二阶导数光谱对蛋白质分子结构以及两种芳香族氨基酸微环境的变化进行分析[24]。如图4所示,SPI的紫外二阶导数光谱在280~300 nm波长范围内有两个最大值(289、296 nm)和两个最小值(285、291 nm)。一般认为,296 nm波长处的紫外吸收峰为Trp残基的特征吸收峰[13]。在木糖醇的作用下,SPI在296 nm波长处的特征吸收峰发生1~2 nm的红移。这一结果则表明Trp残基的微环境可能变得更加疏水[25]。此外,在紫外二阶导数光谱中峰-谷间纵向距离a和b值发生了不同的变化。随着木糖醇质量分数的增加,a值减小而b值的几乎没有变化,导致“r=a/b”呈现出减小的趋势。例如,20%木糖醇使“r”值从0.90减少到0.79,“r”值的减少则表明Tyr残基的微环境可能变得更加疏水[25]。以上结果可能是由于在木糖醇的作用下,蛋白质分子结构变得更加紧密,原来暴露的Tyr和Trp残基被包裹到了分子内部更加疏水的区域[13,25]。紫外二阶导数光谱所提供的信息与表面疏水性和内源荧光光谱的分析结果基本一致。
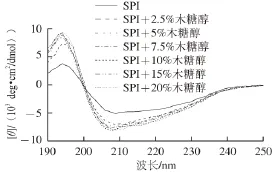
图5 添加不同质量分数木糖醇时大豆分离蛋白的远紫外圆二色光谱Fig. 5 Circular dichroism spectra in the far-UV region of SPI in the presence of xylitol at different concentrations
2.5木糖醇对大豆分离蛋白二级结构的影响图5为SPI在不同质量分数木糖醇溶液中的远紫外圆二色光谱。SPI在远紫外光区194、209 nm波长附近有一个正峰和负峰,分别代表β-折叠和α-螺旋结构[26]。这种光谱为典型α+β蛋白质的圆二色光谱[27]。在木糖醇的作用下,SPI在194 nm和209 nm波长附近正峰和负峰的摩尔椭圆率均有所增加(图5)。这表明蛋白质分子中的β-折叠和α-螺旋结构增多[28]。一般而言,蛋白质分子中的α-螺旋和β-折叠结构往往被包埋在多肽链的内部位。由于有序结构(α-螺旋+β-折叠)增加,木糖醇可能会导致蛋白质分子呈现出更加致密的结构[29]。这一结果可能是由于木糖醇与蛋白质分子在溶液中形成多个氢键,这在某种程度上使得蛋白质分子内原有的相互作用发生改变,从而导致其分子结构更加紧密[20]。
2.6木糖醇对大豆分离蛋白起泡特性的影响
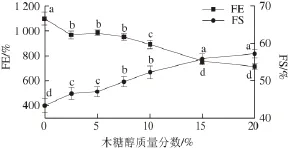
图6 不同质量分数木糖醇对大豆分离蛋白泡沫膨胀率(FE)和泡沫稳定性(FSS)的影响Fig. 6 Effect of xylitol concentration on the foam expansion (FE) and foam stability (FS) of SPI
SPI溶液的起泡特性采用泡沫膨胀率(FE)和泡沫稳定性(FE)两个指标进行表征。不同木糖醇质量分数条件下SPI溶液的FE和FS如图6所示。在木糖醇的作用下,SPI溶液的FE值呈现出明显减少的趋势(P<0.05)。木糖醇质量分数为20%时,FE值由1 099%降低至709%。这一结果表明木糖醇对SPI的起泡能力产生了不利的影响。SPI起泡能力的降低可能与蛋白质分子结构的变化有关。结构松散和柔性较高的蛋白质分子往往更容易在空气-水界面扩散和吸附,从而有利于泡沫的形成。在木糖醇的作用下,SPI的结构更加紧密、柔性减小,这样可能会对泡沫的形成产生负面的影响[30-31]。此外,较低的表面疏水性不利于蛋白质溶液表面张力的下降,使泡沫的形成受到抑制。因此,在木糖醇的作用下SPI表面疏水性的减少可能会成为导致蛋白质溶液起泡能力降低的又一个重要因素[30-31]。
此外还可以发现,在木糖醇的作用下,SPI溶液的FS值呈现明显增加趋势(P<0.05)。木糖醇质量分数为20%时,FS值由43%增加到57%。这一结果表明木糖醇对SPI溶液的泡沫稳定性产生了积极的影响。产生上述结果的原因可能是由于蛋白质溶液表观黏度的增加(数据未显示),使泡沫体系的流动性降低,减缓了液体的排放速率,从而导致蛋白质溶液的泡沫稳定性增大[32]。
3 结 论
综合上述分析结果,可以得出以下结论:在木糖醇的作用下,大豆分离蛋白的构象发生改变。其中,α-螺旋和β-折叠结构增多,大豆蛋白的二级结构变得更加有序、致密。鉴于不同木糖醇质量分数条件下大豆分离蛋白构象的改变以及表面疏水性的降低,其蛋白质溶液的起泡能力受到一定程度的抑制。同时,木糖醇能够增加大豆分离蛋白溶液的表观黏度,其泡沫的稳定性也相应增强。
[1] MIRIANI M, KEERATI-U-RAI M, CORREDIG M, et al. Denaturation of soy proteins in solution and at the oil-water interface: a fluorescence study[J]. Food Hydrocolloids, 2011, 25(4): 620-626. DOI:10.1016/j.foodhyd.2010.07.020.
[2] KEERATI M. Structural changes of soy proteins at the oil-water interface studied by fluorescence spectroscopy[J]. Colloids and Surfaces B: Biointerfaces, 2012, 93(1): 41-48. DOI:10.1016/ j.colsurfb.2011.12.002.
[3] LIU C, WANG X, MA H, et al. Functional properties of protein isolates from soybeans stored under various conditions[J]. Food Chemistry,2008, 111(1): 29-37. DOI:10.1016/j.foodchem.2008.03.040.
[4] CHANASATTRU W, DECKER E A, MCCLEMENTS D J. Modulation of thermal stability and heat-induced gelation of β-lactoglobulin by high glycerol and sorbitol levels[J]. Food Chemistry,2007, 103(2): 512-520. DOI:10.1016/j.foodchem.2006.08.020.
[5] CHANASATTRU W, DECKER E A, MCCLEMENTS D J. Impact of cosolvents (polyols) on globular protein functionality: ultrasonic velocity, density, surface tension and solubility study[J]. Food Hydrocolloids, 2008, 22(8): 1475-1484. DOI:10.1016/ j.foodhyd.2007.09.007.
[6] USHA R, RAMAN S S, SUBRAMANIAN V, et al. Role of polyols(erythritol, xylitol and sorbitol) on the structural stabilization of collagen[J]. Chemical Physics, 2006, 430(4/5/6): 391-396. DOI:10.1016/j.cplett.2006.09.023.
[7] WOLEVER T M S, PIEKARZ A, HOLLANDS M, et al. Sugar alcohols and diabetes: a review[J]. Canadian Journal of Diabetes,2002, 26(4): 356-362.
[8] M☒KINEN K K. Sugar alcohols, caries incidence, and remineralization of caries lesions: a literature review[J]. International Journal of Dentistry, 2010, 2010: 1-23. DOI:10.1155/2010/981072.
[9] MCCLEMENTS D J. Modulation of globular protein functionality by weakly interacting cosolvents[J]. Critical Reviews in Food Science and Nutrition, 2002, 42(5): 417-471. DOI:10.1080/20024091054210.
[10] TIMASHEFF S N. Control of protein stability and reactions by weakly interacting cosolvents: the simplicity of the complicated[J]. Advances in Protein Chemistry, 1998, 51(1): 355-432. DOI:10.1016/S0065-3233(08)60656-7.
[11] TIMASHEFF S N. Protein hydration, thermodynamic binding, and preferential hydration[J]. Biochemistry, 2002, 41(46): 13473-13482. DOI:10.1021/bi020316e.
[12] CONTI M, GALASSI M, BOSSI A, et al. Capillary isoelectric focusing: the problem of protein solubility[J]. Journal of Chromatography A, 1997, 757(96): 237-245. DOI:10.1016/S0021-9673(96)00666-8.
[13] JIANG J, CHEN J, XIONG Y L. Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J]. Journal of Agricultural and Food Chemistry, 2009,57(16): 7576-7583. DOI:10.1021/jf901585n.
[14] CHEN H, WU F, XIANG D, et al. Characterization of emulsions prepared by egg yolk phosvitin with pectin, glycerol and trehalose[J]. Food Hydrocolloids, 2013, 30(1): 123-129. DOI:10.1016/ j.foodhyd.2012.05.007.
[15] LEE K H, RYU H S, RHEE K C. Protein solubility characteristics of commercial soy protein products[J]. Journal of Oil & Fat Industries,2003, 80(1): 85-90. DOI:10.1007/s11746-003-0656-6.
[16] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochim Biophys Acta, 1980, 624(1): 13-20. DOI:10.1016/0005-2795(80)90220-2.
[17] ZHANG J, LIANG L, TIAN Z, et al. Preparation and in vitro evaluation of calcium-induced soy protein isolate nanoparticles and their formation mechanism study[J]. Food Chemistry, 2012, 133(2): 390-399. DOI:10.1016/j.foodchem.2012.01.049.
[18] FLANAGAN J, FITZGERALD R J. Functionality of Bacillus proteinase hydrolysates of sodium caseinate[J]. International Dairy Journal, 2002, 12(9): 737-748. DOI:10.1016/S0958-6946(02)00067-5.
[19] ANTIPOVA A S, SEMENOVA M G. Influence of sucrose on the thermodynamic properties of the 11S globulin of Vicia faba-dextranaqueous solvent system[J]. Food Hydrocolloids, 1997, 11(4): 415-421. DOI:10.1016/S0268-005X (97)80039-2.
[20] SEMENOVA M G, ANTIPOVA A S, BELYAKOVA L E. Food protein interactions in sugar solutions[J]. Current Opinion in Colloid & Interface Science, 2002, 7(5/6): 438-444. DOI:10.1016/S1359-0294(02)00079-1.
[21] GUZEY D, MCCLEMENTS D J, WEISS J. Adsorption kinetics of BSA at air-sugar solution interfaces as affected by sugar type and concentration[J]. Food Research International, 2003, 36(7): 649-660. DOI:10.1016/S0963-9969(03)00004-8.
[22] RAIBEKAS A A, MASSEY V. Glycerol-assisted restorative adjustment of flavoenzyme conformation perturbed by site-directed mutagenesis[J]. Journal of Biological Chemistry, 1997, 272(35): 22248-22252. DOI:10.1074/jbc.272.35.22248.
[23] SAHU R K, PRAKASH V. Mechanism of prevention of aggregation of proteins: a case study of aggregation of α-globulin in glycerol[J]. International Journal of Food Properties, 2008, 11(3): 613-623. DOI:10.1080/10942910701580367.
[24] ZHAO W, YANG R. The effect of pulsed electric fields on the inactivation and structure of lysozyme[J]. Food Chemistry, 2008,110(2): 334-343. DOI:10.1016/j.foodchem.2008.02.008.
[25] LANGE R, BALNY C. UV-visible derivative spectroscopy under high pressure[J]. Biochimica et Biophysica Acta, 2002, 1595(1/2): 80-93. DOI:10.1016/S0167-4838(01)00336-3.
[26] ZHAO J, DONG F, LI Y, et al. Effect of freeze-thaw cycles on the emulsion activity and structural characteristics of soy protein isolate[J]. Process Biochemistry, 2015, 50(10): 1607-1613. DOI:10.1016/ j.procbio.2015.06.021.
[27] LI Y, CHEN Z, MO H. Effects of pulsed electric fields on physicochemical properties of soybean protein isolates[J]. LWT Food Science & Technology, 2007, 40(7): 1167-1175. DOI:10.1016/ j.lwt.2006.08.015.
[28] TONG P, GAO J, CHEN H, et al. Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin[J]. Food Chemistry, 2012, 131(2): 603-610. DOI:10.1016/j.foodchem.2011.08.084.
[29] XUE F, LI C, ZHU X, et al. Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J]. Food Research International, 2013, 51(2): 490-495. DOI:10.1016/j.foodres.2013.01.012.
[30] MORO A, B☒EZ G D, BUSTI P A, et al. Effects of heat-treated β-lactoglobulin and its aggregates on foaming properties[J]. Food Hydrocolloids, 2011, 25(5): 1009-1015. DOI:10.1016/ j.foodhyd.2010.09.021.
[31] B☒EZ G D, BUSTI P A, VERDINI R, et al. Glycation of heattreated β-lactoglobulin: Effects on foaming properties[J]. Food Research International, 2013, 54(1): 902-909. DOI:10.1016/ j.foodres.2013.08.013.
[32] YANG X, FOEGEDING E A. Effects of sucrose on egg white protein and whey protein isolate foams: factors determining properties of wet and dry foams (cakes)[J]. Food Hydrocolloids, 2010, 24(2): 227-238. DOI:10.1016/j.foodhyd.2009.09.011.
Effect of Xylitol on Structural and Foaming Properties of Soy Protein Isolate
PAN Mingzhe1,2, LI Bin1, MENG Xianjun1,*
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110161, China;2. College of Food Science, Northeast Agricultural University, Harbin 150030, China)
The effect of xylitol (0%-20%) on structural and functional properties of soy protein isolate (SPI) in phosphate buffer solution was studied by assessment of solubility, surface hydrophobicity, intrinsic fluorescence intensity, secondary conformational stability and foaming properties. The results showed that xylitol increased the solubility and decreased the surface hydrophobicity and intrinsic fluorescence intensity of SPI, resulting in encasement of the tyrosine and tryptophan residues initially exposed inside the protein molecule. In the presence of added xylitol, SPI exhibited a more compact and periodical secondary structure. These structural modifications, consequently, led to impaired foamability of SPI. In addition,an increase in the viscosity of SPI could be advantageous for enhancing its foam stability.
soy protein isolate; xylitol; protein structure; foaming properties
10.7506/spkx1002-6630-201615011
TS201.2
A
1002-6630(2016)15-0063-06
2016-01-19
“十二五”国家科技支撑计划项目(2014BAD22B01)
潘明喆(1979—),男,讲师,硕士,主要从事粮食、油脂及植物蛋白研究。E-mail:pmz_1223.student@sina.com
孟宪军(1960—),男,教授,博士,主要从事果蔬深加工与功能性食品研究。E-mail:mengxjsy@126.com
引文格式:
