油菜蜂花粉中粗黄酮提取物成分分析
2016-11-15王满生曾新安熊夏宇戴求仲
王满生曾新安 熊夏宇 戴求仲
(1. 中国农业科学院麻类研究所,湖南 长沙 410205;2. 华南理工大学食品科学与工程学院,广东 广州 510640;3. 湖南省畜牧兽医研究所动物营养与饲养技术研究室,湖南 长沙 410131)
油菜蜂花粉中粗黄酮提取物成分分析
王满生1, 2曾新安2熊夏宇2戴求仲1, 3
(1. 中国农业科学院麻类研究所,湖南 长沙 410205;2. 华南理工大学食品科学与工程学院,广东 广州 510640;3. 湖南省畜牧兽医研究所动物营养与饲养技术研究室,湖南 长沙 410131)
为了明晰油菜蜂花粉中黄酮类物质的组成及脉冲电场辅助提取效果,试验采用TLC—DPPH和HPLC等方法对油菜蜂花粉的乙醇提取物及其酸解产物进行了详细的组分分析。结果表明,油菜蜂花粉的乙醇提取物中槲皮素和山奈酚因含量过低而未能检出,但该提取物经酸水解后,则会形成大量槲皮素和山奈酚,故可初步推断油菜蜂花粉中的黄酮类化合物主要以黄酮苷的形式存在。未经脉冲电场破壁处理的蜂花粉乙醇提取物的酸解物中,槲皮素含量为764.39 μg/g,山奈酚含量为1 647.97 μg/g,而经破壁处理后,槲皮素含量达867.93 μg/g,对比提高了13.55%,山奈酚含量达1 924.03 μg/g,对比提高了16.75%。该结果充分证明了脉冲电场预处理对油菜蜂花粉细胞具有良好的破壁效果。
油菜蜂花粉;黄酮类化合物;脉冲电场;薄层色谱;破壁
蜂花粉中黄酮类化合物种类繁多,含量丰富。目前在蜂花粉中发现的黄酮类化合物有:柚皮素、异鼠李素、山奈酚、槲皮素、原花青素等[1]。近年油菜蜂花粉中黄酮类物质成分研究得到了广泛关注。杨洁等[2]利用HPLC—DAD和HPLC—MS技术对从油菜蜂花粉得到的提取物进行了定性分析,证实油菜蜂花粉中黄酮类物质主要以山奈酚和槲皮素的形式存在,其余黄酮类物质含量很少[3-4]。另外,杨必成等[5]采用HPLC—UV法测定了油菜蜂花粉中各黄酮类物质含量,发现槲皮素和山奈酚含量占总黄酮含量的97.6%。
薄层色谱法[6-7](Thin layer chromatography, TLC)属于吸附薄层色谱分离法,混合物中各成分对固定相的吸附能力不同,当流动相流过固定相时,混合物中各成分在流动相和固定相中不断循环重复吸附、解吸附过程,从而实现快速分离混合物中各成分的目的。TLC—DPPH将薄层色谱法和抗氧化活性测定合二为一,是一种快速筛选生物活性物质的方法[8]。它利用薄层色谱法将混合物各成分分离,再喷洒DPPH溶液显色,薄层板上呈黄色的区域为具有清除自由基活性的部位,而呈紫色的区域为非活性部分。TLC—DPPH法具有快捷、直观、操作方便、灵敏度高等优点,广泛应用于筛选天然提取物中具有清除自由基或抗氧化活性的化合物[9]。郭金凤等[10]采用TLC—DPPH法筛选榆叶合叶子中的抗氧化活性成分,活性部位斑点呈黄色,并通过展开斑点大小比较了各成分的抗氧化活性。Chaaib F等[11]利用TLC—DPPH法确定了美国崖椒根皮的二氯甲烷提取物中的抗氧化活性成分。
目前,油菜蜂花粉中黄酮类物质均采用传统的方法进行辅助提取,例如超声波辅助提取[12]、生物酶法发酵辅助提取[13]、温差破壁辅助提取[14]等。而采用脉冲电场这一新兴技术辅助提取油菜蜂花粉中黄酮类物质还未见诸报道,其提取物中黄酮类物质成分的研究亦鲜有报道。本试验拟采用脉冲电场辅助提取黄酮类物质,通过TLC—DPPH筛选提取物中具有抗氧化活性的主要成分,并利用HPLC法定量分析油菜蜂花粉中两种主要黄酮类物质——槲皮素和山奈酚的含量,以期为油菜蜂花粉及其相关产品的开发提供依据。
1 材料与仪器
1.1 材料与试剂
油菜蜂花粉:江西省新建县汪氏蜂蜜园;
甲醇:色谱纯,RCI Labscan Co., Ltd;
无水槲皮素标准品:BR级,国药集团化学试剂有限公司;
山奈酚标准品:BR级,国药集团化学试剂有限公司;
1,1-二苯基-2-苦肼自由基(2,2-diphenyl-1-picrylhydrazyl,DPPH):美国Sigma-Aldrich公司;
无水乙醇、苯、甲酸、乙酸乙酯:分析纯,国药集团化学试剂有限公司;
硅胶板:100 mm×100 mm,青岛谱科分离材料有限公司;
聚偏氟乙烯微孔滤膜:0.45 μm,上海兴化净化材料厂。
1.2 主要仪器设备
高效液相色谱仪,主要包括二元液相泵(型号1525,新加坡Waters公司)、自动进样器(型号2707,新加坡Waters公司)、光电二极管阵列检测器(型号2998,新加坡Waters公司)和电脑控制系统;
循环式水式真空泵:SHZ-D(Ⅲ)型,巩义予华仪器有限责任公司;
旋转蒸发器:RE-2000B型,上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 样品制备
(1) 油菜蜂花粉粗黄酮提取物的制备:准确称取均匀研细的油菜蜂花粉1.00 g,加入100 mL 80%乙醇溶液,经磁力搅拌器充分搅拌得到分散均匀的油菜蜂花粉悬浊液。在前期试验的最优工艺条件下,即电场强度28 kV/cm,脉冲数508,恒温水浴回流温度82 ℃,提取油菜蜂花粉中的总黄酮类物质[15]。所得的油菜蜂花粉液经4 500 r/min离心10 min,弃沉淀,取50 mL上清液于40 ℃旋转蒸发,减压回收乙醇,直至大部分乙醇挥发,再经真空冷冻干燥后,得到油菜蜂花粉乙醇提取物,将其命名为S2。取1.00 g未经脉冲电场破壁处理的油菜花粉,在相同提取条件下提取油菜蜂花粉总黄酮类物质,离心干燥后得到乙醇提取物,将其命名为S1。
(2) 乙醇提取物样品溶液的制备:用甲醇将1.3.1(1)得到的乙醇提取物S1、S2溶解,分别转移至50 mL棕色容量瓶中,加入甲醇定容后摇匀,经孔径为0.22 μm有机系针头滤器过滤后,得到乙醇提取物样品溶液,依次命名为E1和E2,溶液置于4 ℃冰箱备用。
(3) 酸水解样品溶液的制备:将1.3.1(1)得到的乙醇提取物S1、S2分别置于100 mL圆底烧瓶中,加入5 mL体积分数为25%的盐酸溶液、30 mL甲醇,在80 ℃恒温水浴锅中水浴酸解1 h,迅速冷却至室温后将酸解液移至50 mL棕色容量瓶中,用甲醇定容后摇匀,经孔径为0.22 μm有机系针头滤器过滤后,得到酸水解样品溶液,依次命名为A1和A2,溶液置于4 ℃冰箱备用。
1.3.2 TLC—DPPH法
(1) 点样:在硅胶板(100 mm×100 mm)一端距离板边1 cm处用铅笔画一条点样线,取山奈酚和槲皮素混合标准液,乙醇提取物样品溶液和酸水解样品溶液各30 μL,分多次点在硅胶板上,点样直径不超过4 mm。点样后,用吹风机将硅胶板上样品中的溶剂吹干。
(2) 展开:以体积比为5∶4∶1的苯—乙酸乙酯—甲酸混合液为展开剂,将硅胶板放入盛有展开剂的展开缸中展开。待展开至距离硅胶板顶端5 mm时,取出硅胶板,放入通风橱中晾干。
(3) 显色:以0.2 mg/mL的DPPH甲醇溶液为显色剂,将显色剂均匀地喷洒到硅胶板上,然后把将硅胶板置于通风橱中晾干,观察。测量各显色点的迁移距离,计算各显色点的相对迁移率Rf值。
1.3.3 HPLC法测定乙醇提取物中两种黄酮类物质含量
(1) 色谱条件:参照文献[16]。色谱柱为SunFireTMC18柱(5 μm,4.6 mm×20 mm),流动相A为0.4%冰醋酸,流动相B为甲醇,按表1进行梯度洗脱,检测波长λ为368 nm,柱温30 ℃,进样量20 μL,流速为1.00 mL/min。
(2) 混合标准品溶液的制备:准确称取0.006 g山奈酚标准品和0.004 g槲皮素标准品,用甲醇溶解后,转移至25 mL棕色容量瓶中,加甲醇定容后得浓度分别为240,160 μg/mL的山奈酚和槲皮素混合标准品溶液。
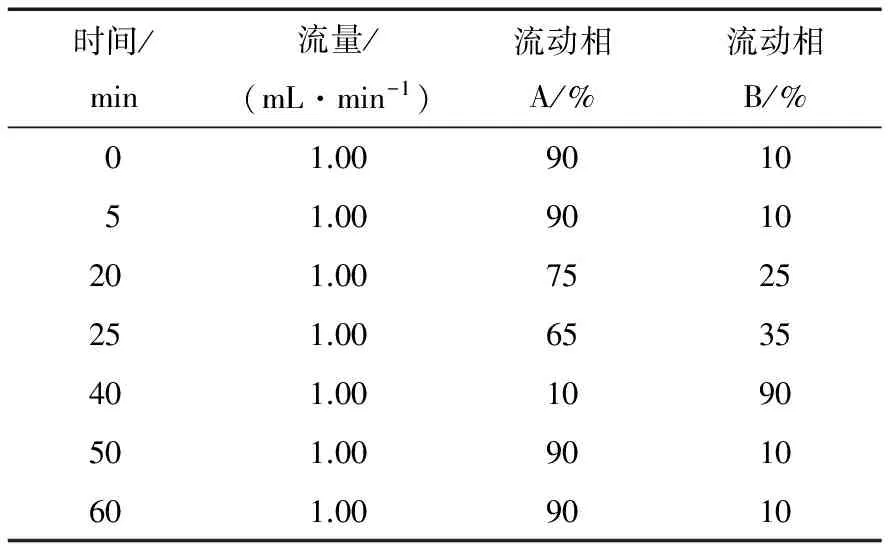
表1 流动相梯度洗脱条件
(3) 标准曲线的绘制:分别准确移取混合标准品溶液1,2,4,6,8 mL加入5个25 mL棕色容量瓶中,向每个棕色容量瓶加入甲醇定容,摇匀,经孔径为0.22 μm有机系针头滤器过滤后得到一定梯度浓度的混合标准品溶液。混合标准品溶液按1.3.3(1)所述色谱条件,依次注入高效液相色谱仪中,测定山奈酚和槲皮素的峰面积,每个样品平行测定3次,以标准品进样量为横坐标,标准品峰面积为纵坐标,绘制标准曲线。
(4) 样品中两种黄酮类化合物含量测定:将1.3.1(2)得到的乙醇提取物样品溶液和1.3.1(2)得到的酸水解样品溶液按1.3.3(1)所述色谱条件进行HPLC分析,测定山奈酚和槲皮素峰面积,对照标准曲线计算出相应黄酮类物质的含量。
1.3.4 数据处理与分析 利用Origin 8.0 和Excel 2007对数据进行处理和分析。
2 结果分析与讨论
2.1 TLC—DPPH结果分析
由图1可知,展开剂迁移距离为8.50 cm,样品M只出现两个黄色斑点:一个斑点面积大且颜色深,迁移距离为6.0 cm,Rf值为0.71;另一个斑点面积小且颜色浅,迁移距离为5.2 cm,Rf值为0.61。通常,自由基清除剂或抗氧化剂浓度越高,DPPH清除效果越好,斑点面积越大,黄色越深[17]。由于混合标准品中山奈酚浓度明显高于槲皮素浓度,因此可断定出Rf值为0.71处斑点为山奈酚,而Rf值为0.61的则是槲皮素。样品E1和E2在Rf值为0.61和0.71处均呈紫色,没有出现黄色斑点,说明未经酸水解乙醇提取物中槲皮素和山奈酚含量很低;然而,E1和E2在Rf值为0.00~0.25处均出现淡黄色条带,且E2淡黄色条带面积大于E1淡黄色条带面积,说明油菜蜂花粉乙醇提取物中含有清除DPPH自由基活性的成分,且采用脉冲电场技术辅助提取可提高油菜蜂花粉乙醇提取物中该活性成分的含量。样品A1和A2为酸解物,与E1和E2相比,Rf值为0.00~0.25处出现淡黄色条带面积减少,且在Rf值为0.61和Rf值为0.71处均出现黄色斑点,Rf值为0.71处黄色斑点面积更大,颜色更深,说明油菜蜂花粉中黄酮类物质主要以糖苷形式存在,也说明乙醇提取物经酸水解后生成了游离的槲皮素和山奈酚,且生成的山奈酚含量要高于槲皮素的含量;样品A2在Rf值为0.61和Rf值为0.71处的黄色斑点比A1的更加明亮清晰,表明脉冲电场技术辅助提取可显著提高酸解物中槲皮素和山奈酚含量。
2.2 两类黄酮类化合物含量分析
2.2.1 系统适应性分析 由图2可知,槲皮素的保留时间约为36.62 min,山奈酚的保留时间约为38.20 min,混合标准品中的槲皮素和山奈酚完全分离,这说明采用该色谱条件能有效分离样品中的槲皮素和山奈酚。

M. 混合标准品 A1. 未经脉冲电场处理得到酸解物 A2. 脉冲电场处理得到酸解物 E1. 未经脉冲电场处理的乙醇提取物 E2. 经脉冲电场处理的乙醇提取物
图1 各样品的TLC—DPPH图
Figure 1 The TLC—DPPH chromatograms of extract from rape pollen

Q. 槲皮素 K. 山奈酚
由图3可知,E1和E2在36.62 min和38.20 min处未出现明显的色谱峰,说明HPLC法未检测出油菜蜂花粉乙醇提取物中的槲皮素和山奈酚,意味着乙醇提取物中槲皮素和山奈酚含量非常低;但E1和E2在31.12 min和32.86 min均出现色谱峰,有待于检测定性。然而乙醇提取物经酸水解后得到的A1和A2,如图4所示,在36.62 min和38.20 min处都有尖锐的色谱峰,说明酸水解后A1和A2中槲皮素和山奈酚含量出现大幅提高;而A1和A2在31.12 min和32.86 min出现的色谱峰面积明显小于E1和E2在此处色谱峰面积。由此可推断出,油菜蜂花粉中的黄酮类化合物大部分以黄酮苷的形式存在,而黄酮苷类物质又以槲皮素和山奈酚为苷元,经酸水解后生成槲皮素和山奈酚。
对比图3中色谱峰,可以发现E2在31.12 min和32.86 min处色谱峰的面积大于E1色谱峰的面积,表明经脉冲电场处理后,乙醇提取物中黄酮苷类物质含量提高,这意味着脉冲电场可有效促进油菜蜂花粉中黄酮苷类物质的溶出。由于E2中黄酮苷类物质含量高于E1,经酸水解后,A2中槲皮素和山奈酚含量明显高于A1,所以在色谱图4中A2在36.62 min和38.20 min处色谱峰的面积大于A1。
2.2.2 槲皮素和山奈酚的标准曲线 对色谱峰面积与进样量进行线性回归,得到槲皮素标准曲线回归方程为:y=3 839.3x-212 027,R2=0.999 7,表明进样量在121.6~972.8 ng时,槲皮素的含量与色谱峰面积具有良好的线性关系(见图5)。山奈酚标准曲线回归方程为:y=4 400.2x-347 846,R2=0.999 4,表明进样量在208~1 664 μg时,山奈酚的含量与色谱峰面积具有良好的线性关系(见图6)。
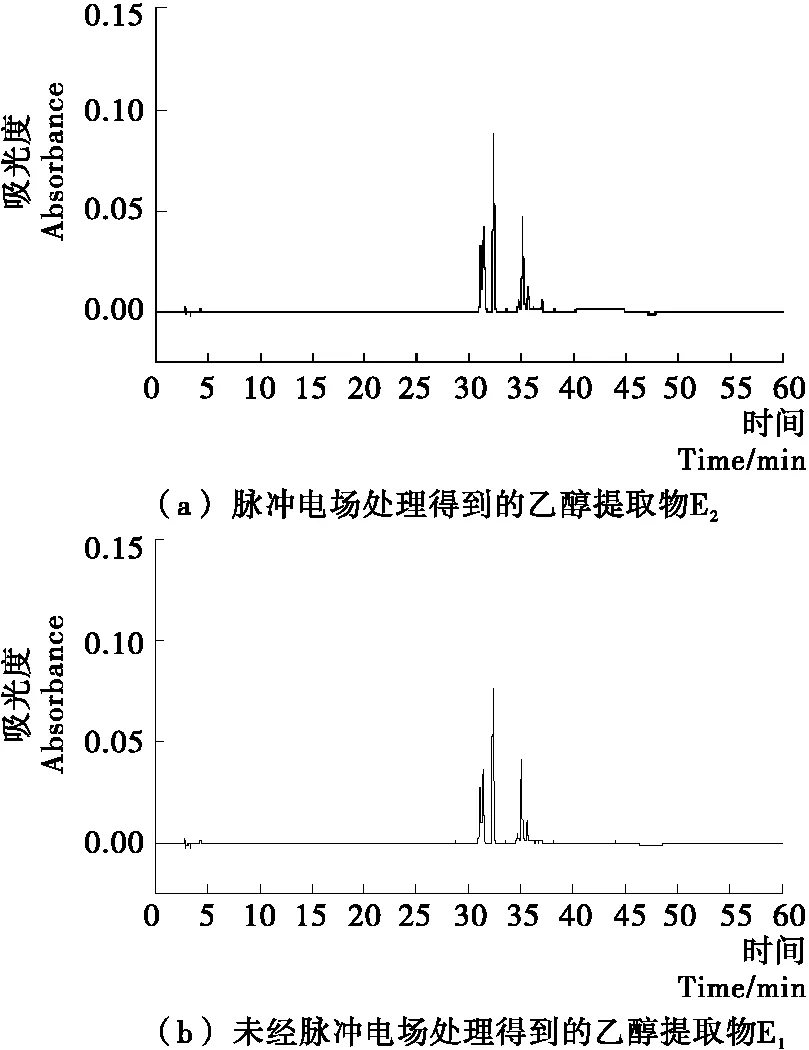
图3 油菜蜂花粉乙醇提取物未经酸水解样品溶液的HPLC色谱图
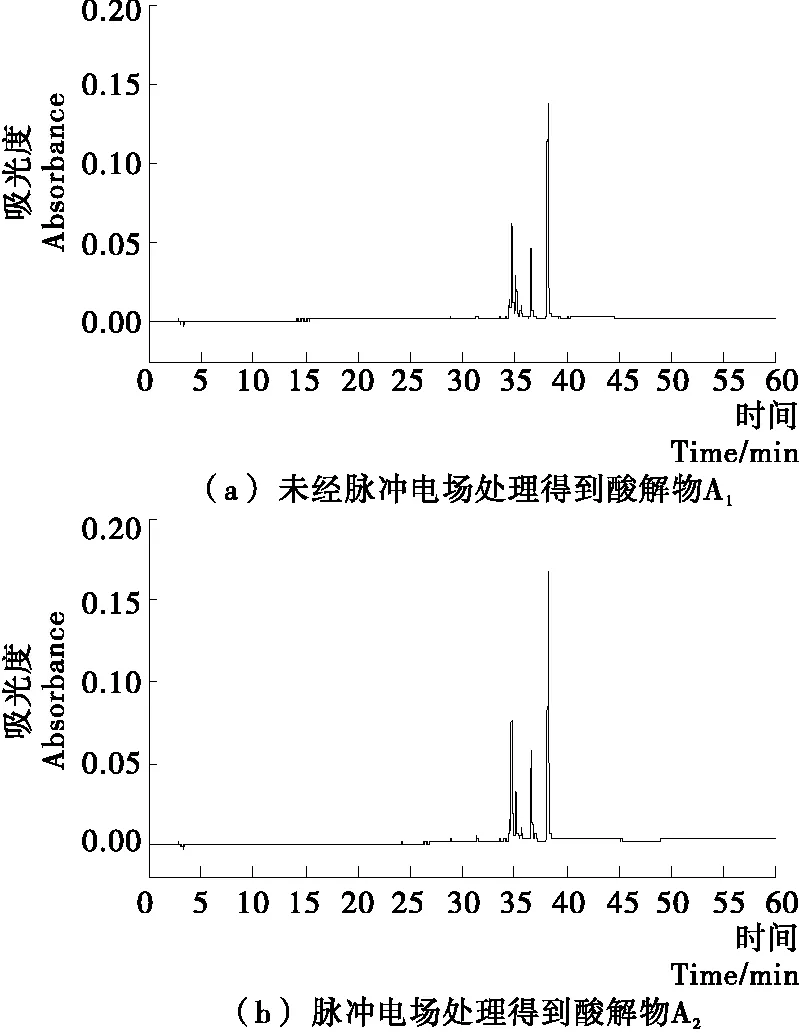
图4 油菜蜂花粉乙醇提取物酸水解样品的HPLC色谱图
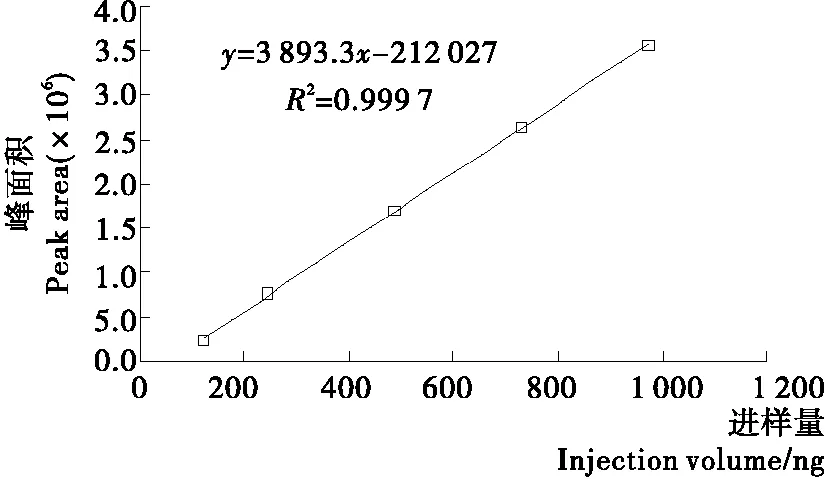
图5 槲皮素的标准曲线
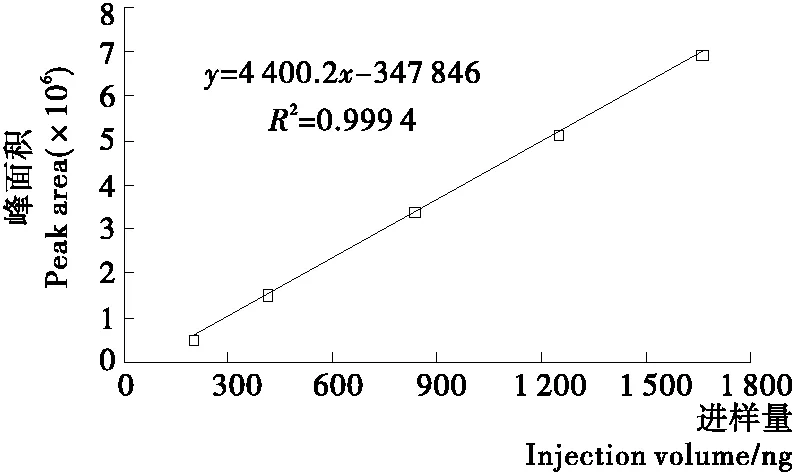
图6 山奈酚的标准曲线
2.2.3 样品中槲皮素和山奈酚含量分析 油菜蜂花粉乙醇提取物中槲皮素和山奈酚含量很低,未能通过HPLC法检出,采用脉冲电场辅助提取得到乙醇提取物,亦未能检测出槲皮素和山奈酚。由表2可知,油菜蜂花粉乙醇提取物经酸水解后,测得槲皮素含量为764.39 μg/g,山奈酚含量为1 647.97 μg/g。采用脉冲电场辅助提取得到乙醇提取物,经酸水解后,测得槲皮素含量为867.93 μg/g,对比提高13.55%,山奈酚含量为1 924.03 μg/g,对比提高16.75%。

表2 样品中槲皮素和山奈酚含量测定结果†
† A1为未经脉冲电场处理得到酸解物,A2为脉冲电场处理得到酸解物,E1为未经脉冲电场处理得到的乙醇提取物,E2为脉冲电场处理得到的乙醇提取物。
3 结论
本研究采用TLC—DPPH和HPLC等方法对油菜蜂花粉的乙醇提取物及其酸解物进行了黄酮类成分分析。研究发现,蜂花粉的乙醇提取物经过酸水解后,形成了大量以黄酮苷形式存在的槲皮素和山奈酚等黄酮类物质。另外,通过脉冲电场技术的辅助提取,可将蜂花粉乙醇提取物的酸解物中槲皮素和山奈酚的含量分别提高了13.55%和16.75%。这充分证明了脉冲电场作用对油菜蜂花粉细胞具有显著破壁效应,是一种有着广阔前景的破壁手段。接下来将深入开展脉冲电场辅助提取对花粉中黄酮类化合物生物活性的影响。
[1] 王开发, 耿越. 花粉中黄酮类研究[J]. 养蜂科技, 1997(3): 8-12.
[2] 杨洁, 陈纯, 邢建军, 等. 油菜蜂花粉中黄酮类化合物的提取与鉴定[J]. 食品科学, 2010, 31(22): 273-278.
[3] 李军, 横田正实. 油菜蜂花粉的黄酮化学成分研究[J]. 浙江省医学科学院学报, 1990(3): 14-17.
[4] SERRA B J, SOLIVA T M, CENTELLES L E. Evaluation of polyphenolic and flavonoid compounds in honeybee-collected pollen produced in Spain.[J]. Journal of Agricultural & Food Chemistry, 2001, 49(4): 1 848-1 853.
[5] 杨必成, 刘海, 杨义芳, 等. 油菜花粉中黄酮类化合物的提取与分析[J]. 中草药, 2011, 42(12): 2 451-2 455.
[6] MONTEIRO M L G, MRSICO E T, LZARO C A, et al. Thin-layer chromatography applied to foods of animal origin: a tutorial review[J]. Journal of Analytical Chemistry, 2016, 71(5): 459-470.
[7] TANG Tie-xin, XU Xin-jun, WANG Dong-mei, et al. A rapid and green limit test method for five synthetic colorants in foods using polyamide thin-layer chromatography[J]. Food Analytical Methods, 2014, 8(2): 459-466.
[9] 杨佳林, 孙丽萍, 徐响, 等. 油菜蜂花粉黄酮醇的测定及其抗氧化活性研究[J]. 食品科学, 2010, 31(3): 79-82.
[10] 郭金凤, 张俊妹, 张芳, 等. TLC-生物自显影法筛选榆叶合叶子的抗氧化活性[J]. 中国民族民间医药, 2013, 22(24): 9-10.
[11] CHAAIB F, QUEIROZ E F, NDJOKO K, et al. Antifungal and antioxidant compounds from the root bark of Fagara zanthoxyloides.[J]. Planta Medica, 2003, 69(4): 316-320.
[12] 任向楠. 超声波辅助酶法破壁油菜花粉的研究[D]. 北京: 中国农业科学院, 2010: 64-90.
[13] 王芙蓉. 油菜花粉的破壁方法及其多糖、黄酮提取纯化工艺研究[D]. 武汉: 华中农业大学, 2007: 28-29.
[14] 阮征, 胡筱波, 赖富饶, 等. 油菜花粉中黄酮类物质提取工艺的优化研究[J]. 食品科学, 2007, 28(7): 133-137.
[15] 熊夏宇, 曾新安, 王满生, 等. 响应面法优化脉冲电场辅助提取油菜花粉中黄酮类物质工艺研究[J]. 中国农业科技导报, 2015(5): 88-93.
[16] 刘玲玲, 杨辉. HPLC法同时测定银杏叶提取物两种不同剂型中黄酮类化学成分的含量[J]. 青岛医药卫生, 2011, 43(6): 404-406.
[17] 谷丽华, 侴桂新, 王峥涛. 基于ABTS自由基的薄层色谱—生物自显影新方法的建立及其在中药抗氧化活性评价中的应用[J]. 上海中医药大学学报, 2013(3): 99-104.
The study of rough flavones components extracted from the rape bee pollen
WANG Man-sheng1,2ZENGXin-an2XIONGXia-yu2DAIQiu-zhong1,3
(1.InstituteofBastFiberCrops,ChineseAcademyofAgriculturalSciences,Changsha,Hunan410205,China;2.SchoolofFoodScienceandEngineering,SouthChinaUniversityofTechnology,Guangzhou,Guangdong510640,China;3.DepartmentofAnimalNutritionandFeedingTechnology,HunanInstituteofAnimalScienceandVeterinaryMedicine,Changsha,Hunan410131,China)
In order to clarify the flavonoids compositions of rape bee pollen and evaluate the assisted extraction effect for pulsed electric field (PEF), the ethanol extract of rape bee pollen and its acidolysis component were analyzed in detail by the method of TLC—DPPH and HPLC in this paper. The results showed that the quercetin and kaempferol in the ethanol extract of rape bee pollen could not be detected for their low contents. However, a large number of quercetin and kaempferol were generated after the acidolysis of ethanol extract, and this implied that the flavonoids compositions of rape bee pollen mainly existed in the form of flavonoid glycoside. In addition, the content of quercetin and kaempferol in the acidolysis of ethanol extract were 764.39 μg/g and 1 647.97 μg/g respectively when the acidolysis materials were not treated by PEF. Nevertheless, when the acidolysis of ethanol extract was pretreated by the PEF afterwards, the content of quercetin and kaempferol reached 867.93 μg/g and 1 924.03 μg/g, increasing by 13.55% and 16.75% respectively. These results fully proved that the PEF technology pretreatment was an effective assisted extraction method and could be conducive to break the walls for the rape bee pollen cells.
Rape bee pollen; flavonoids compounds; pulsed electric field; thin-layer chromatography; wall-breaking
国家自然科学基金项目(编号:21376094,21576099);广东省科技攻关项目(编号:2015A030312001,2013B020203001,2013B091100004)
王满生,男,博士。
曾新安(1972—),男,华南理工大学教授,博士。
E-mail: xazeng@ scut.edu.cn
2016—05—18
