缺氧环境下白细胞介素8通过Akt-STAT3通路提高骨髓间充质干细胞自噬和增殖能力
2016-11-14沈雷张善强张晓东张彧婷谢立平姜杨马勇李国峰
沈雷,张善强,张晓东,张彧婷,谢立平,姜杨,马勇,李国峰
缺氧环境下白细胞介素8通过Akt-STAT3通路提高骨髓间充质干细胞自噬和增殖能力
沈雷,张善强,张晓东,张彧婷,谢立平,姜杨,马勇,李国峰
齐齐哈尔医学院解剖学教研室,黑龙江齐齐哈尔 161006
探讨缺氧环境下,白细胞介素8 (Interleukin-8, IL-8) 对人骨髓间充质干细胞 (Human bone marrow mesenchymal stem cells,hBMSC) 增殖和自噬能力的影响以及机制。在缺氧模型下,未进行刺激的hBMSC为缺氧对照组;以100 μmol/L 人IL-8蛋白刺激的MSC为IL-8组;若先添加50 μmol/L MK2206 (Akt蛋白抑制剂) 培养30 min,然后再添加100 μmol/L IL-8则为Akt抑制剂组,在正常条件下培养的MSC为正常对照组。利用EdU细胞增殖实验、TUNEL细胞凋亡实验、Western blotting或ELISA等实验分别检测各组MSC细胞EdU标记阳性细胞的数目、细胞凋亡、自噬蛋白 (LC-3) 和Akt/STAT3等蛋白的表达。相对于缺氧对照组和Akt抑制剂组,IL-8明显提高hBMSC增殖和细胞自噬,并降低hBMSC的凋亡率,IL-8组hBMSC的Akt、STAT3和VEGF等蛋白表达增高。结果表明,缺氧环境下,IL-8通过Akt-STAT3通路发挥对MSC的保护作用,对保护MSC抗缺血缺氧性损伤,促进MSC在再生医学中应用具有重要意义。
缺氧,白细胞介素8,间充质干细胞,自噬,Akt-STAT3通路
研究发现,由于动脉粥样硬化、血栓等原因导致的血管狭窄等症状,常伴随着机体组织的缺血缺氧改变,心、脑、肺等重要器官发生的缺氧性疾病已经严重威胁着人类的健康[1];缺氧问题也是从事高原工作、航天事业的重要难题[2]。如何迅速纠正组织缺氧状态,是各国医学研究者一直探索的科学课题。虽然在临床使用了高压氧、抗自由基、扩血管、增加血容量等纠正缺氧的治疗手段,但是大多数疗法都是外因性补救措施,未能彻底纠正缺氧造成的严重损伤[3]。
人体内含有大量的血管内皮细胞、间充质干细胞等重要的参与血管再生和组织修复的细胞,如果激活这些细胞积极参与抗缺氧损伤,将对逆转缺氧性伤害具有积极的、持续的作用。研究发现,间充质干细胞 (Mesenchymal stem cell,MSC) 具有多分化特性和低免疫性,是组织工程中具有广泛应用前景的种子细胞[4]。持续的缺氧环境会对MSC造成损伤,降低MSC的再生修复能力[5],如果提高MSC在缺氧环境的生存能力,将对利用MSC促进缺氧性疾病的损伤修复具有重要意义。
白细胞介素-8 (Interleukin -8,IL-8) 又称为趋化因子-8 (CXCL-8),是趋化因子家族的重要成员[6]。细菌等微生物感染导致机体炎症反应,会产生大量IL-8等细胞因子,有利于促进局部炎症灶形成病理性钙化等结果[7]。IL-8在肿瘤、炎症等疾病中也会大量表达,具有招募中性粒细胞、淋巴细胞等细胞归巢,促进组织增生和血管新生等重要作用[8]。这提示我们,如果在缺氧环境,应用IL-8可能会发挥保护MSC的作用,并对体内MSC等细胞具有重要的招募作用,对促进缺血缺氧组织的修复具有重要意义。
1 材料与方法
1.1 细胞来源
人骨髓间充质干细胞购于美国ATCC菌种保存中心。
1.2 主要试剂和实验仪器
胎牛血清 (美国Gbico公司),α-MEM培养基 (美国Hyclone公司),人IL-8重组蛋白、人VEGF、IL-6蛋白ELISA试剂盒 (均购自美国R&D公司),MK2206和3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐 (MTT) (均购自美国Sigma公司),EdU试剂盒 (广州锐博生物公司),GFP-LC3质粒 (Invivogen公司),X-treme GENE HP DNA转染试剂和TUENL细胞凋亡试剂盒 (均购自美国罗氏公司),小鼠抗人LC-3抗体 (英国Abcam公司)、HRP标记山羊抗小鼠IgG (英国Abcam公司),β-actin (英国Abcam公司),Akt和STAT3活性检测试剂盒 (美国Bio Vision公司),Emax酶标仪 (美国Molecular Devices公司),BX50型显微镜 (日本OLYMPUS公司),Nikon A1激光共聚焦显微镜 (日本尼康公司),Calibur流式细胞仪 (美国BD公司)。
1.3 方法
1.3.1 细胞培养和实验分组
hBMSC用含10%胎牛血清的α-MEM培养基进行培养。以5% CO2、92% N2和3% O2混合气体建立细胞缺氧模型。在缺氧模型下,未进行刺激的hBMSC为缺氧对照组;以100 μmol/ L IL-8刺激的hBMSC为IL-8组;先添加50 μmol/L 的Akt蛋白抑制剂 (MK2206) 培养30 min,然后再添加100 μmol/L IL-8则为Akt抑制剂组;若在95%空气和5% CO2的条件下培养hBMSC,则为正常对照组。
1.3.2 EdU法检测细胞增殖情况
在96孔板内培养1×104hBMSC,0.01 mol/ L PBS清洗3次,每孔以150 μL含1%胎牛血清的α-MEM培养基培养12 h后;按照实验分组设置,每孔加入100 μL,50 μmol/L EdU培养基孵育2 h;4%多聚甲醛固定;0.5% TritonX-100孵育10 min;Apollo®染色反应液进行染色,DAPI细胞核复染,激光共聚焦显微镜观察各组hBMSC中EdU标记阳性 (红色) 的细胞数目。
1.3.3 Western blotting实验检测LC-3等蛋白的表达情况
按照实验分组情况,培养各组5×106细胞,裂解细胞,4 ℃下12 000 r/min,离心10 min,提取蛋白液,测定蛋白浓度;取25 μg各组蛋白样品,SDS-PAGE凝胶电泳90 min (100 V);然后转至硝酸纤维素薄膜 (300 mA,40 min);蛋白膜在封闭液中封闭60 min;添加小鼠抗人LC-3抗体 (1∶200)、p-Akt (1∶250)、p-STAT3 (1∶200) 等抗体,再使用HRP标记山羊抗小鼠IgG (1∶200),室温孵育90 min;洗膜,ECL试剂等步骤检测蛋白表达,Image-Pro Plus 6.0.1软件分析各带吸光度值作定量计算,β-actin为内参对照。
1.3.4 GFP-LC3荧光强度分析
GFP-LC3质粒用X-treme GENE HP DNA试剂转染到2×106hBMSC中,按照实验分组要求,以不同的条件进行刺激12 h后,加入20 μmo/L氯喹,继续培养6 h,然后用0.25%胰蛋白酶- EDTA消化,流式细胞仪检测平均LC3-GFP荧光强度[9]。
1.3.5 VEGF、IL-6等蛋白的检测
培养6×106各组hBMSC,0.01 mol/L PBS清洗,按照实验分组情况,以含1% 胎牛血清的α-MEM培养基继续培养24 h,提取细胞上清液,0.22 μm滤器抽滤,按照VEGF、IL-6等蛋白ELISA检测试剂盒的说明进行操作。
1.3.6 细胞凋亡检测
在载玻片上培养3×104经DiL标记的各组hBMSC,0.01 mol/L PBS清洗,按照实验分组情况,以含1% 胎牛血清的α-MEM培养基继续培养24 h,利用TUNEL细胞凋亡试剂盒检测TUNEL标记阳性 (绿色) 的细胞为凋亡细胞。
1.4 统计分析
每次试验至少重复3次,实验数据采用SPSS 18.0进行统计,结果以±表示,进行检验或2检验,<0.05被认为具有统计学意义。
2 结果与分析
2.1 各组hBMSC的增殖情况
相对于正常对照组,缺氧对照组的EdU标记阳性细胞明显降低,二者相比具有显著差异 (<0.01)。在缺氧条件下,与缺氧对照组相比较,IL-8组EdU标记阳性细胞明显升高,二者相比具有显著差异 (<0.01);与IL-8组相比,Akt抑制剂组EdU阳性细胞则明显降低,二者相比具有显著差异 (<0.01),如图1所示。
2.2 各组hBMSC的细胞凋亡情况
缺氧对照组的细胞凋亡率与正常对照组相比明显升高,二者相比具有显著差异 (<0.01)。缺氧环境下,IL-8组TUNEL标记阳性的细胞凋亡率明显比缺氧对照组降低,二者相比具有显著差异 (<0.01);与IL-8组相比,Akt抑制剂组的细胞凋亡率明显升高,二者相比具有比较显著性差异 (<0.01),如图2所示。
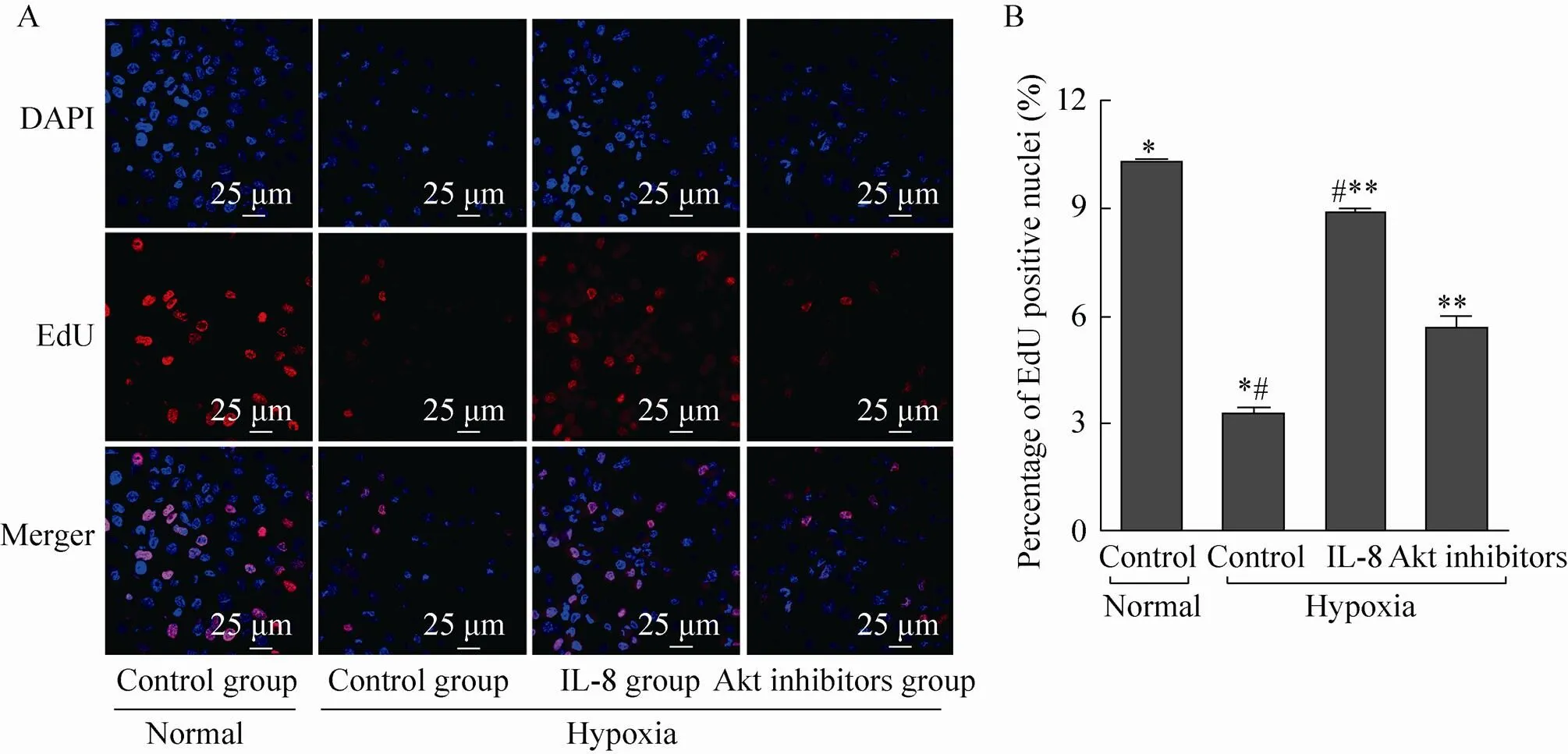
图1 IL-8对缺氧环境下hBMSC增殖的影响
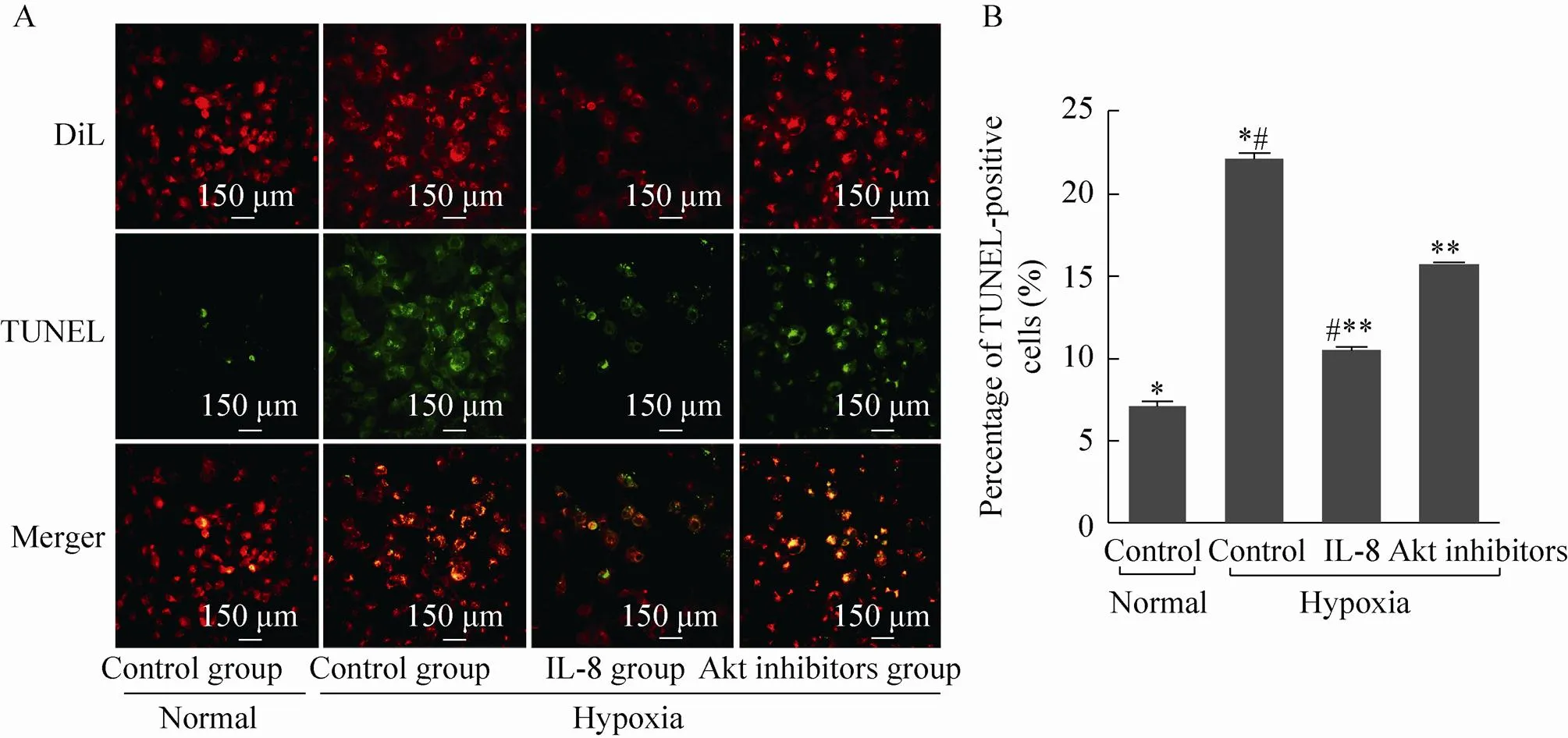
图2 IL-8对缺氧环境下hBMSC凋亡的影响
2.3 各组hBMSC的细胞自噬情况
缺氧对照组的LC-3蛋白表达比正常对照组增加,二者相比具有比较显著差异 (<0.05)。在缺氧环境下,与缺氧对照组相比,IL-8组LC-3蛋白表达较高,具有比较显著差异 (<0.01),而Akt抑制剂组LC-3蛋白的表达则比IL-8组降低,二者相比具有比较显著差异 (<0.05),如图3A、B所示。利用流式细胞技术检测GFP-LC-3也发现:与正常对照组相比,缺氧对照组的LC3的GFP荧光强度增加,二者相比具有显著差异 (<0.01)。在缺氧环境下,IL-8组细胞LC3的GFP荧光强度比缺氧对照组表达高,具有比较显著差异 (<0.01),而Akt抑制剂组细胞LC3的GFP荧光强度则比IL-8组降低,二者相比具有比较显著差异 (<0.01),如图3C、D所示。
2.4 各组hBMSC的Akt、STAT3蛋白表达
缺氧对照组的Akt、STAT3蛋白表达比正常对照组增加,二者相比具有比较显著差异 (<0.05)。在缺氧环境下,与缺氧对照组相比,IL-8组Akt、STAT3蛋白的相对密度明显升高,二者相比均具有显著差异 (<0.01);但与IL-8组相比,Akt抑制剂组Akt、STAT3蛋白表达降低,二者相比具有比较显著差异 (<0.05),如图4所示。
2.5 各组hBMSC上清液中VEGF、IL-6等蛋白表达
缺氧对照组的VEGF、IL-6蛋白含量比正常对照组增高,二者相比具有比较显著差异(<0.01)。缺氧环境下,与缺氧对照组相比,IL-8组MSC细胞上清液中VEGF、IL-6等蛋白含量明显升高,均具有显著性差异 (<0.01);相对于IL-8组,Akt抑制剂组VEGF、IL-6表达显著降低,均具有显著性差异 (<0.01),如表1所示。

图3 IL-8对缺氧环境下hBMSC自噬的影响
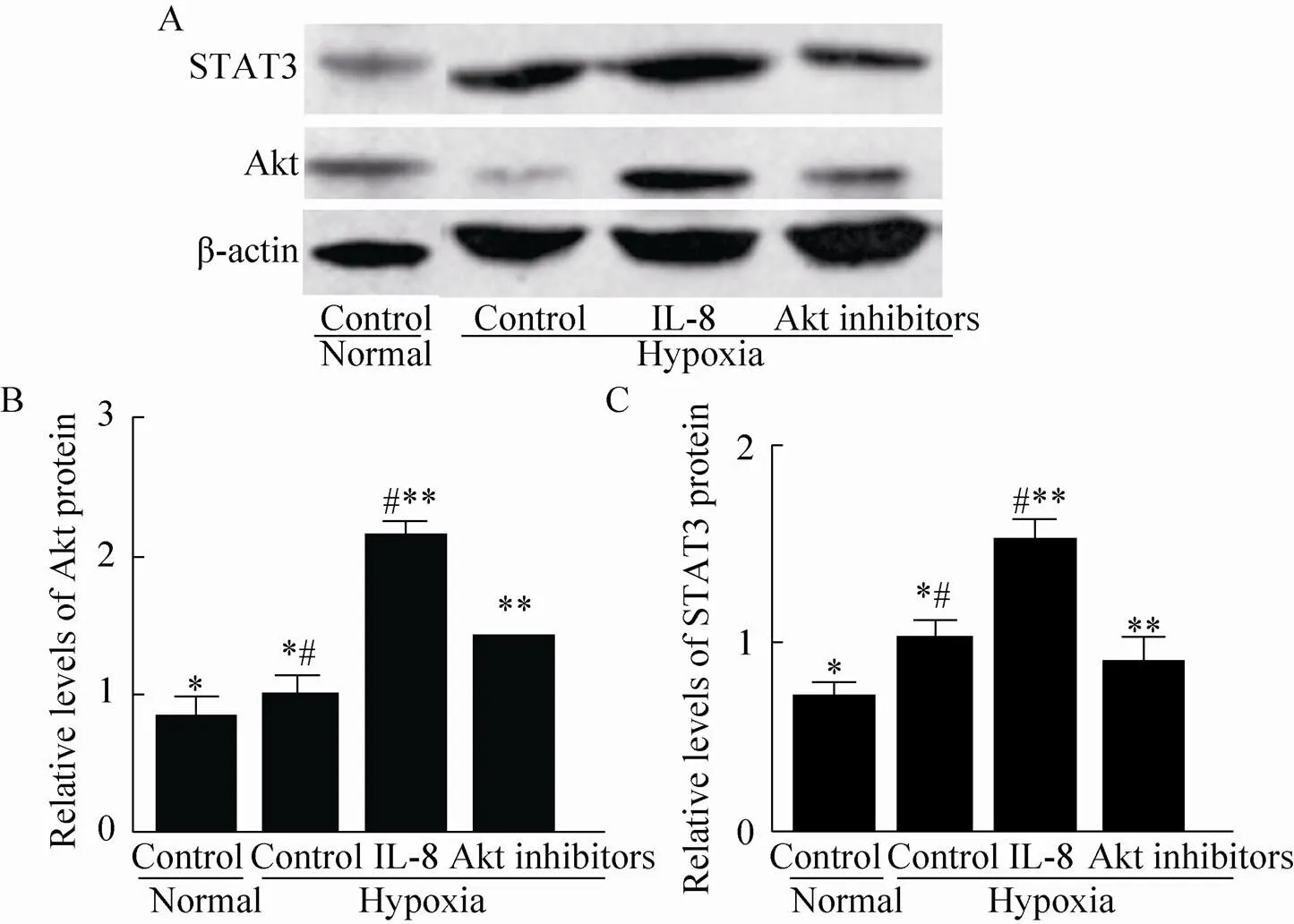
图4 缺氧环境下IL-8对hBMSC的Akt、STAT3蛋白表达的影响
表1 各组hBMSC的VEGF、IL-6含量(pg/mL,±s,n=36)
Table 1 The contents of VEGF, IL-6 of hBMSC in each group (pg/mL,, n=36)

表1 各组hBMSC的VEGF、IL-6含量(pg/mL,±s,n=36)
ItemNormalHypoxia Control groupControl groupIL-8 groupAkt inhibitors group VEGF5.08±0.14*6.32±0.16*, #16.57±0.12#, **12.59±0.24** IL-63.64±0.17△5.15±0.11△, ▲11.78±0.14▲,□7.16±0.13□
*=24.745 1,=0.000 01,#307.5,0.000 01,**=82.063 7,0.001,
△=31.638 9,0.000 01,▲=223.426 7,0.000 1,□=145.093 1,0.000 1.
3 讨论
航天医学领域经常涉及缺氧问题,缺氧给宇航员、乘客等乘坐飞行器人员带来了严重的问题,甚至威胁人员的生命安全。在临床医学中,由于缺氧而导致的心脏、脑、肺等重要器官发生严重损伤。由此可见,缺氧及其导致的并发症的治疗和预防,不仅是临床常见疾病的治疗手段,也是航天医学领域的重要攻关课题[2]。如何持续地改善缺氧症状、促进器官功能恢复是治疗缺血缺氧性疾病的研究热点。
人体含有间充质干细胞、成纤维细胞等许多细胞,这些细胞 (或干细胞) 在伤口、炎症等疾病的修复过程中发挥了重要的作用。但是由于体内缺氧,会产生大量氧自由基或活性氧,在活性氧等作用下,细胞脂质会发生过氧化作用,从而使多不饱和脂肪酸分解成丙二醛 (MDA) 等许多细胞毒性产物,导致细胞的内质网、高尔基复合体等细胞内结构破坏,细胞活性降低,影响宿主细胞功能[10]。如果动员人体宿主细胞积极参与修复人体组织,将发挥机体自身的修复机制,并能缩短治疗进程或费用。
间充质干细胞在人体骨髓、脐带、脂肪等部位大量存在,具有低免疫性、多分化等特性。糖尿病往往导致组织血管发生严重病变,眼、脑、骨等部位缺血缺氧而发生糖尿病性眼病、糖尿病性肾病等多种病变。在糖尿病性皮肤溃疡组织,移植MSC可以很好地分化为血管内皮细胞,促进血管新生而加速皮肤溃疡的愈合[11]。但是,移植的MSC仍然无法摆脱缺氧带来的损伤,如果提高MSC的抗缺氧能力将加大MSC的再生修复效果。虽然,有的学者将超氧化物歧化酶、VEGF等抗自由基的基因转染入MSC,对一些缺氧性疾病的确发挥了较好的治疗效果[12-13],但是,随着移植MSC的衰老或死亡,治疗效果逐渐降低。对于种类多样,数量庞大的宿主体内的血管内皮细胞、成纤维细胞等修复性细胞,仍然缺乏有效的动员作用。因此,我们提出:既保护MSC抗缺氧损伤,又发挥招募宿主细胞归巢,共同抗缺氧伤害的策略,将对抗缺氧状态,促进组织损伤修复具有重要意义。
在宫颈癌、恶性星形细胞瘤等肿瘤组织,随着瘤体迅速增大,肿瘤组织会出现血管匮乏,发生缺氧等改变[14]。缺氧刺激HeLa细胞高表达白细胞介素-8(IL-8),IL-8又称为趋化因子-8 (Chemokines-8,CXCL-8),IL-8会促进HeLa细胞分泌白细胞介素 (IL)-6、血管内皮生长因子 (VEGF) 等因子,调控血管内皮细胞归巢,加速血管新生而逆转肿瘤组织的缺氧环境,与肿瘤的转移和预后密切相关[14]。研究还发现,IL-8等因子在皮肤创面修复过程中可以招募MSC、成纤维细胞等细胞归巢,对促进血管新生的作用具有重要效果[15]。如果在缺氧环境下,IL-8与MSC细胞膜上的CXCR1/2 受体相作用[16],可能发挥促进细胞归巢,将对动员宿主细胞参与修复缺氧性组织损伤,加速血管新生,逆转缺氧性血管病变导致的组织损伤等具有重要意义[16],但是,在缺氧环境下CXCL-8对MSC自噬等影响,尚鲜见报道。
在本实验中,与正常对照组相比,缺氧对照组的EdU阳性细胞显著降低,TUNEL阳性细胞的凋亡率明显升高等结果与Liu等研究类似[17],说明成功建立了细胞缺氧模型。
本实验发现,IL-8组MSC上清液中VEGF、IL-6等蛋白表达增高,而Akt抑制剂组MSC上清液中VEGF、IL-6等蛋白表达降低。这可能是由于IL-8与MSC表面的CXCR1/2受体结合[18],可能通过PI3K/Akt、JAK/Stat3信号转导通路促进MSC分泌VEGF、IL-6等蛋白的缘故。Piperi 等研究也发现,恶性胶质细胞瘤由于瘤组织生长过快,血管生长速度相对减弱,致使瘤组织出现局部缺氧形象,缺氧促进恶性胶质细胞高表达CXCL-8,CXCL-8通过JAK-Akt-STAT3途径促进恶性胶质细胞膜分泌白细胞介素6 (IL-6)、血管内皮生长因子 (VEGF) 等因子而促进血管新生和肿瘤的转移[19]。此外还发现,IL-8也可以通过IL-8/CXCR1/2轴,STAT3通路影响血管内皮细胞的活性或调控血管、淋巴管生成[20],并发现IL-8尚能够激活MSC表面的CXCL-8受体 (CXCR1/2),通过Akt通路促进MSC归巢或促进MSC分泌VEGF等细胞因子,加速血管新生[21]。结合这些文献和我们的实验结果,共同佐证了IL-8能够激活Akt-Stat3等信号转导通路而促进MSC等细胞旁分泌VEGF、IL-6等细胞因子。
IL-8促进MSC分泌VEGF等细胞因子导致IL-8组的细胞增殖数目较高,TUNEL凋亡标记细胞降低,这是因为VEGF具有促进MSC等细胞的增殖,降低细胞凋亡等相关[22]。当然,细胞自噬的增多,也为细胞提供了较多代谢产物或能力,保证细胞在缺氧等环境中生存[23]。
MK2206是一种新型高特异性及非ATP竞争结合的Akt变构抑制剂,与Akt结合而发挥抑制Akt蛋白活化的效果[24]。Akt和Erk等信号通路之间具有广泛的联系,这些信号通路之间并不是彼此孤立的,而是互相影响、互相作用,共同调节细胞的生物活性[25]。因此,我们分析仅以MK2206影响Akt信号通路,导致Akt蛋白表达降低,进而IL-8会激活Erk等其他信号通路,当然具体的机制还需要深入研究。
在本实验中还发现,IL-8组MSC自噬能力提高。这可能是由于细胞在缺氧等条件下,细胞膜内折于细胞浆内,而形成类似“脂质体”样的膜性结构的“自噬体”。自噬体与溶酶体融合会降解内部的细胞器,而使周围细胞获得氨基酸、脂肪酸等小分子物质或ATP等能量,供细胞重新利用,进而保证细胞群体在高糖或缺氧等恶劣环境中的存活[26-27]。研究还发现,Akt-STAT3-mTOR信号通路在自噬发生的机制中具有重要作用[28]。我们发现在缺氧环境下,IL-8可以活化Akt-STAT3通路,也可能激活了下游的mTOR蛋白而促进MSC自噬的发生。提高细胞自噬行为,使MSC获得较多能量和营养物质,进一步提高了MSC增殖能力。虽然PI3K/Akt-Stat3信号转导通路在IL-8作用的血管内皮细胞中发挥了重要作用,但是我们也不排除IL-8对MSC的作用尚存在MAPK/Erk等其他分子作用机制[29],相关机制还有待深入研究。
在皮肤伤口愈合过程中,巨噬细胞会分泌大量IL-8,IL-8对皮肤缺损区域周围的成纤维细胞、血管内皮细胞、毛囊干细胞等细胞具有强大捕获作用,促使血管内皮细胞黏附,加速血管新生,增加细胞外基质沉积而促进伤口愈合,说明IL-8在伤口愈合中具有重要意义[6]。如果在抗缺氧性疾病中应用IL-8,将对保护移植细胞、促进宿主细胞归巢和参与修复组织损伤带来机遇。人体内含有成纤维细胞、血管内皮细胞等众多细胞[6],我们仅探讨了IL-8对MSC增殖和自噬的作用效果,关于IL-8对其他宿主细胞的作用,还需要深入研究。
综上所述,IL-8通过Atk/STAT3通路激活细胞自噬或旁分泌途径,提高MSC增殖,抑制缺氧性MSC损伤。目前利用间充质干细胞等细胞修复人体组织损伤具有非常广泛的应用价值,若从激活宿主细胞角度入手,发挥IL-8等趋化因子对细胞的保护性作用,并招募体内细胞归巢参与修复缺氧性疾病,将有利于提高抗缺氧的治疗效果。后续我们将会利用IL-8转染间充质干细胞,用于缺血性心脏病或糖尿病等动物模型的治疗,观察IL-8转染间充质干细胞对缺血性疾病的作用效果和机制,为拓展干细胞的临床应用奠定研究基础。
REFERENCES:
[1] Verges S, Chacaroun S, Godin-Ribuot D, et al. Hypoxic conditioning as a new therapeutic modality. Front Pediatr, 2015, 3: 58.
[2] Xiao HJ. The symbolic landmarks in the development of aviation oxygen supply equipment and protection physiology. Med J Chin PLA, 2004, 29(10): 833–835 (in Chinese). 肖华军. 航空供氧装备与防护生理学的发展历程. 解放军医学杂志, 2004, 29(10): 833–835.
[3] Jia SG, Liang H. Action and relationship of aerospace atmospheric environment medico-engineering. Acta Aeron Astronaut Sin, 2001, 22(5): 390–395 (in Chinese).贾司光, 梁宏. 航空与航天大气环境医学工程及其进展. 航空学报, 2001, 22(5): 390–395.
[4] Wang Y, Chen XD, Cao W, et al. Plasticity of mesenchymal stem cells in immunomodulation: pathological and therapeutic implications. Nat Immunol, 2014, 15(11): 1009–1016.
[5] Buravkova LB, Andreeva ER, Gogvadze V, et al. Mesenchymal stem cells and hypoxia: where are we? Mitochondrion, 2014, 19: 105–112.
[6] Sun BK, Siprashvili Z, Khavari PA. Advances in skin grafting and treatment of cutaneous wounds. Science, 2014, 346(6212): 941–945.
[7] Qin CS, Li XY, Jiang XJ, et al. Micro-inflammatory state and calcification. Chin J Tissue Eng Res, 2015, 19(29): 4721–4725 (in Chinese).秦超师, 李晓艳, 蒋学俊, 等. 微炎症反应状态与钙化. 中国组织工程研究, 2015, 19(29): 4721–4725.
[8] Russo RC, Garcia CC, Teixeira MM, et al. The CXCL8/IL-8 chemokine family and its receptors in inflammatory diseases. Expert Rev Clin Immunol, 2014, 10(5): 593–619.
[9] Chen W, Wu YX, Li L, et al. Adenosine accelerates the healing of diabetic ischemic ulcers by improving autophagy of endothelial progenitor cells grown on a biomaterial. Sci Rep, 2015, 5: 11594.
[10] Shafagh M, Rahmani F, Delirezh N. CuO nanoparticles induce cytotoxicity and apoptosis in human K562 cancer cell linemitochondrial pathway, through reactive oxygen species and P53. Iran J Basic Med Sci, 2015, 18(10): 993–1000.
[11] Shen L, Zeng W, Wu YX, et al. Neurotrophin-3 accelerates wound healing in diabetic mice by promoting a paracrine response in mesenchymal stem cells. Cell Transplant, 2013, 22(6): 1011–1021.
[12] Kim JY, Lee JS, Han YS, et al. Pretreatment with lycopene attenuates oxidative stress-induced apoptosis in human mesenchymal stem cells. Biomol Ther, 2015, 23(6): 517–524.
[13] Ma XW, Cui DP, Zhao DW. Vascular endothelial growth factor/bone morphogenetic protein-2 bone marrow combined modification of the mesenchymal stem cells to repair the avascular necrosis of the femoral head. Int J Clin Exp Med, 2015, 8(9): 15528–15534.
[14] Liu LB, Xie F, Chang KK, et al. Hypoxia promotes the proliferation of cervical carcinoma cells through stimulating the secretion of IL-8. Int J Clin Exp Pathol, 2014, 7(2): 575–583.
[15] Eming SA, Martin P, Tomic-Canic M. Wound repair and regeneration: mechanisms, signaling, and translation. Sci Transl Med, 2014, 6(265): 265sr6.
[16] Zhang P, Zhang XD, Jiang Y, et al. Effect of chemokine-8 factor on the migration ability of human adipose derived mesenchymal stem cell in high glucose environment. Acta Anat Sin, 2015, 46(6): 764–771 (in Chinese). 张鹏, 张晓东, 姜杨, 等. 趋化因子-8对高糖环境下脂肪间充质干细胞迁移能力的影响. 解剖学报, 2015, 46(6): 764–771.
[17] Liu JJ, Hao HJ, Huang H, et al. Hypoxia regulates the therapeutic potential of mesenchymal stem cells through enhanced autophagy. Int J Low Extrem Wounds, 2015, 14(1): 63–72.
[18] Bi LK, Zhou N, Liu C, et al. Kidney cancer cells secrete IL-8 to activate Akt and promote migration of mesenchymal stem cells. Urol Oncol, 2014, 32(5): 607–612.
[19] Piperi C, Samaras V, Levidou G, et al. Prognostic significance of IL-8-STAT-3 pathway in astrocytomas: correlation with IL-6, VEGF and microvessel morphometry. Cytokine, 2011, 55(3): 387–395.
[20] Levidou G, Sachanas S, Pangalis GA, et al. Immunohistochemical analysis of IL-6, IL-8/CXCR2 axis, Tyr p-STAT-3, and SOCS-3 in lymph nodes from patients with chronic lymphocytic leukemia: correlation between microvascular characteristics and prognostic significance. Biomed Res Int, 2014, 2014: 251479.
[21] Hou Y, Ryu CH, Jun JA, et al. IL-8 enhances the angiogenic potential of human bone marrow mesenchymal stem cells by increasing vascular endothelial growth factor. Cell Biol Int, 2014, 38(9): 1050–1059.
[22] Berendsen AD, Olsen BR. How vascular endothelial growth factor-A (VEGF) regulates differentiation of mesenchymal stem cells. J Histochem Cytochem, 2014, 62(2): 103–108.
[23] Kaur J, Debnath J. Autophagy at the crossroads of catabolism and anabolism. Nat Rev Mol Cell Biol, 2015, 16(8): 461–472.
[24] Sun DQ, Sawada A, Nakashima M, et al. MK2206 potentiates cisplatin-induced cytotoxicity and apoptosis through an interaction of inactivated Akt signaling pathway. Urol Oncol, 2015, 33(3): 111.e17–111.e26.
[25] McCubrey JA, Steelman LS, Chappell WH, et al. Ras/Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascade inhibitors: how mutations can result in therapy resistance and how to overcome resistance. Oncotarget, 2012, 3(10): 1068–1111.
[26] García-Prat L, Martínez-Vicente M, Perdiguero E, et al. Autophagy maintains stemness by preventing senescence. Nature, 2016, 529(7584): 37–42.
[27] Wu JF, Niu J, Li XP, et al. Hypoxia induces autophagy of bone marrow-derived mesenchymal stem cellsactivation of ERK1/2. Cell Physiol Biochem, 2014, 33(5): 1467–1474.
[28] Wu YS, Li Y, Zhang H, et al. Autophagy and mTORC1 regulate the stochastic phase of somatic cell reprogramming. Nat Cell Biol, 2015, 17(6): 715–725.
[29] Zhang Z, Chu G, Wu HX, et al. IL-8 reduces VCAM-1 secretion of smooth muscle cells by increasing p-ERK expression when 3-D co-cultured with vascular endothelial cells. Clin Invest Med, 2011, 34(3): E138–E146.
(本文责编 陈宏宇)
Enhancing the ability of autophagy and proliferation of bone marrow mesenchymal stem cells by interleukin-8 through Akt-STAT3 pathway in hypoxic environment
Lei Shen, Shanqiang Zhang, Xiaodong Zhang, Yuting Zhang, Liping Xie, Yang Jiang, Yong Ma, and Guofeng Li
,,161006,,
To study the effects and mechanisms of interleukin-8 (IL-8) on the proliferation and autophagy of human bone marrow mesenchymal stem cells (hBMSC) under hypoxic condition. In the hypoxia model, we set the non-stimulated hBMSC as the hypoxia control group; the hBMSC stimulated by 100 μmol/L human IL-8 as the IL-8 group; the hBMSC stimulated by 50 μmol/L MK2206 (Akt protein inhibitor) and 100μmol/L IL-8 as the Akt inhibitor group; and the normal cultured hBMSC as the normal control group. The experiments of EdU cell proliferation and TUNEL apoptosis were respectively used to detect the number of positive cells that were labeled by EdU and apoptosis in each group, and Western blotting and ELISA were used respectively to detect the expression of autophagy protein (LC-3), Akt/STAT3 and other proteins in each group. The results indicated that the proliferation and autophagy of hBMSC in IL-8 group was higher than that in hypoxia control group and Akt inhibitor group, and the apoptosis rate in IL-8 group decreased. These results and the high expression of Akt, STAT3 and VEGF protein of IL-8 group show that under the hypoxic condition, IL-8 played a protective role on MSC through the Akt-STAT3 pathway. It had important significance in the protection of MSC against the injury due to ischemia and hypoxia, and promoted the application of MSC in regenerative medicine.
hypoxia, interleukin-8, mesenchymal stem cell, autophagy, akt-STAT3 pathway
January 15, 2016; Accepted: March 4, 2016
Lei Shen. Tel: +86-452-2663205; Fax: +86-452-2663121; E-mail: shenleiby@126.com
时间:2016-03-28
http://www.cnki.net/kcms/detail/11.1998.Q.20160328.1517.001.html
Supported by:National Natural Science Foundation of China (No. 81541137).
国家自然科学基金(No. 81541137) 资助。
