家蚕bHLH转录因子Bmsage可溶性表达、纯化与结构分析
2016-11-14何华伟位曙光王叶菁刘莉娜李珍珍赵朋常怀普赵萍
何华伟,位曙光,王叶菁,刘莉娜,李珍珍,赵朋,常怀普,赵萍
家蚕bHLH转录因子Bmsage可溶性表达、纯化与结构分析
何华伟1,2,位曙光1,王叶菁1,2,刘莉娜1,李珍珍1,赵朋1,常怀普1,2,赵萍1
1 西南大学家蚕基因组生物学国家重点实验室,重庆 400715;2 西南大学生物技术学院重庆市蚕丝纤维新材料工程技术研究中心,重庆 400715
碱性螺旋-环-螺旋(Basic helix-loop-helix, bHLH) 转录因子在生命活动过程中发挥着重要的调控作用。Bmsage是家蚕丝腺中高量表达的一类bHLH转录因子,不仅参与了丝腺细胞在胚胎期的发育调控,而且对蚕丝蛋白的合成也有至关重要的调控作用,然而当前对其性质和结构了解不多。为研究其性质、结构和生物学功能,构建了NusA、MBP、SUMO、Trx和His融合标签的Bmsage重组原核表达载体,通过改变诱导温度和IPTG浓度,确定了Bmsage在大肠杆菌中可溶性表达的最佳载体和表达条件,进而通过镍柱亲和层析纯化获得了Bmsage,利用圆二色光谱研究了其二级结构。结果表明,NusA与MBP标签可显著增强Bmsage在大肠杆菌中的可溶性表达,但难以与Bmsage分离。SUMO标签有一定的助溶效果,并且能够与Bmsage有效分离。其他标签对Bmsage可溶性表达的效果不明显。圆二色光谱分析表明Bmsage含有α-helix结构,推测SUMO标签可能促进了Bmsage折叠形成类天然的结构。这些工作为深入研究Bmsage的性质、结构与功能建立了基础,同时也为其他类似蛋白的表达纯化提供了参考。
碱性螺旋-环-螺旋,Bmsage,MBP,NusA,SUMO,纯化
生命活动受多种转录因子的调控。碱性螺旋-环-螺旋(Basic helix-loop-helix,bHLH) 转录因子是一类重要的转录因子,它们在神经元发生、性别决定、肠组织发育、肌细胞及血细胞生成[1]等过程中发挥着重要的调控作用。研究者们根据bHLH类转录因子作用的DNA元件和结构特点将其分为6类,同时又根据其调控基因的功能将它们分成了45个亚家族[2-4]。
1989年,Murre等在小鼠中首次鉴定了bHLH转录因子E12和E47[5]。bHLH结构域大约由60个氨基酸残基组成,包含1个与DNA结合的碱性区域和1个可调节蛋白二聚化的HLH结构域[6-7]。1994年,MyoD的bHLH结构域与DNA结合的复合物结构被解析[8],促进了转录因子参与DNA识别和转录激活方面的研究。Imayoshi与Kageyama发现bHLH转录因子在调控端脑发育方面具有多样化的功能[9]。果蝇唾液腺特异因子sage属于bHLH转录因子家族,在果蝇唾液腺的发生和发育过程中发挥着重要的作用[10-11]。2007年,王勇等以黑腹果蝇bHLH氨基酸序列为查询模板,从家蚕基因组数据库中鉴定到了52个bHLH转录因子[12]。本实验室刘春等[13]在家蚕丝腺中鉴定了1个与果蝇sage同源高量表达的bHLH转录因子,将其命名为Bmsage。本实验室赵小明等在随后的研究中发现,Bmsage可以与丝腺因子1 (Silk gland factor-1,SGF-1) 相互作用,调控丝素重链基因的表达[14]。Xin等借助CRISPR/Cas9基因编辑技术敲除了家蚕基因,发现敲除突变体的家蚕丝腺发育不正 常[15],但是其具体的调控机制并不清楚。
尽管Bmsage在家蚕丝腺发育和蚕丝蛋白的合成方面发挥着重要的功能,然而,迄今为止,我们对该蛋白的性质和结构仍然了解不多。本文希望借助体外重组原核表达技术,利用溶解性高的多肽序列标签和Transetta (DE3) 表达菌株,通过改变诱导温度和IPTG浓度来表达并纯化获得可溶性Bmsage蛋白,从而为研究其性质、结构和功能建立基础。
1 材料与方法
1.1 材料和试剂
pET-50b(+)购自Novagen (默克,德国);pCold-SUMO和pET 32M.3C分别由华南农业大学樊惠英教授和中国科技大学周丛照教授惠赠;ppSUMO、pSKB2和pET-MBP来自美国西南医学中心张学武教授的馈赠。克隆菌株() DH5α和表达菌株Transetta (DE3) 购自北京全式金生物技术有限公司。限制性内切酶H Ⅰ、d Ⅲ购自TaKaRa宝生物工程 (大连) 有限公司;T4 DNA连接酶购自New England Biolabs公司;RNA提取试剂盒、DNA凝胶回收试剂盒购自OMEGA公司;质粒提取试剂盒购自Axygen公司;氨苄青霉素(Amp)、硫酸卡纳霉素(Kana)、氯霉素(Cam) 以及异丙基硫代半乳糖苷(IPTG) 购自生工生物工程 (上海) 股份有限公司;常规蛋白分子量Marker购自碧云天生物技术有限公司。
1.2 生物信息学分析
分别利用RACC (http://nihserver.mbi.ucla. edu/RACC/) 和Protparam (http://web.expasy.org/ protparam/)分析基因稀有密码子及其氨基酸特征。利用IBS 1.0软件构建其基因与蛋白结构模式图。以Bmsage氨基酸序列为模板,在Pubmed数据库(http://www.ncbi.nlm.nih.gov/pubmed/) 中进行Blast分析,选取果蝇、蚁、蝶、蚊等种属中相似的氨基酸序列,利用Clustal X[16]进行序列比对,并利用ESPript[17](http://espript.ibcp.fr/ ESPript/ESPript/index.php) 对bHLH结构域同源比对结果渲染,借助Mega 6.0[18]构建系统发育进化树。根据5龄3天家蚕各组织芯片基因表达谱(http://www.silkdb.org/microarray/),借助HemI[19]分析基因表达模式。
1.3 表达载体构建
取5龄3 天家蚕后部丝腺组织,利用Trizol RNA提取试剂盒提取总RNA,然后以其为模板反转录合成cDNA。根据家蚕基因组数据库中(ID: BGIBMGA005127) 的CDS序列,利用Primer Premier设计引物,Forward:5′-CGCATGTACAATCAAACATACGACGAT-3′ (下划线部分为H Ⅰ酶切位点);Reverse:5′-CCCTTAGTATCTCTGTTGACGCCTTC-3′ (下划线部分为d Ⅲ酶切位点)。通过PCR扩增目的基因,利用1.2%琼脂糖凝胶电泳分析PCR产物,并通过DNA凝胶回收试剂盒对目的DNA片段纯化回收。将质粒与目的DNA片段利用H Ⅰ和d Ⅲ在37 ℃同时双酶切4 h,然后利用T4 DNA连接酶在16 ℃连接过夜。将连接产物转化DH5α,挑取单克隆并提取质粒,通过双酶切与基因测序对构建的重组质粒进行验证。
1.4 蛋白可溶性表达条件探索
将测序验证正确的重组质粒转化Transetta (DE3) 细胞,挑取单克隆菌落在37 ℃过夜培养,然后按照1∶100的比例接种到含有抗生素的LB液体培养基中,37 ℃培养至600达到0.5–1.0,加入0.01–1 mmol/L IPTG,在12–37 ℃下诱导表达。160 r/min、37 ℃培养4 h,25 ℃培养10 h,12 ℃、14 ℃和16 ℃培养 20 h,对照为37 ℃下不加IPTG培养4 h的菌液,离心收集细胞。按培养物∶裂解液=10∶1比例加入预冷的裂解液 (20 mmol/L Tris-HCl,pH 8.0,500 mmol/L氯化钠,10%甘油),充分悬浮细胞。冰浴超声破碎。菌体裂解物于4 ℃、12 000 r/min离心20 min,上清和沉淀经15% SDS-PAGE电泳鉴定,比较不同标签融合蛋白在不同条件下的表达量,筛选较好的表达载体与表达条件。
1.5 目的蛋白纯化
根据筛选的表达载体和表达条件,大规模培养细菌。细胞破碎后离心收集上清,将上清通过0.45 μm滤膜过滤,在4 ℃下利用镍柱亲和层析对细胞裂解液中的融合蛋白进行分离提纯,利用15% SDS-PAGE电泳检测不同咪唑浓度的洗脱结果。将纯化的融合蛋白通过HiPrep 26/10 (GE Healthcare) 除去咪唑并同时置换为酶切缓冲液 (50 mmol/L Tris-HCl,150 mmol/L氯化钠,5%甘油),加入蛋白酶在4 ℃酶切16 h。将酶切产物再次通过镍柱除去融合标签,从而纯化获得不含标签的Bmsage。
1.6 蛋白二级结构分析
利用圆二色光谱仪MOS-500 (Bio-Logic,法国)对Bmsage的二级结构进行分析,蛋白样品溶于磷酸缓冲液PBS中,波谱扫描范围为190–250 nm,比色皿光程1 mm,蛋白浓度为 0.1 mg/mL。
2 结果与分析
2.1 生物信息学分析
基因位于家蚕第25号染色体,共有4个外显子和3个内含子 (图1A),cDNA全长705 bp,编码234个氨基酸残基。Bmsage分子量28.1 kDa,等电点5.97,带电荷氨基酸占整个蛋白的41%。Bmsage中152–205位氨基酸残基为bHLH结构域 (图1B),该区域等电点为10.1;N末端结构域(1–140) 富含酸性氨基酸残基,其等电点为4.77。N末端和bHLH结构域之间可能存在电荷-电荷相互作用,从而维持Bmsage构象的稳定。疏水性分析表明,Bmsage的亲水性指数为–1.223,表明该蛋白趋向于亲水。然而,我们发现,Bmsage容易形成包涵体表达。将Bmsage与可溶性标签融合表达,融合蛋白虽然以可溶性的形式表达,但是当去除标签之后,Bmsage容易发生聚沉,这可能是因为Bmsage分子之间可能通过电荷-电荷相互作用结合,从而导致蛋白聚集沉淀。
大肠杆菌对外源基因的表达具有密码子偏好性。分析发现,基因包含多个稀有密码子,可能会影响其在大肠杆菌中的表达。Transetta (DE3)细胞可以补充大肠杆菌缺乏的6种稀有密码子对应的tRNA,从而提高外源基因的表达水平。因此,在本实验中我们选择了Transetta (DE3)细胞作为表达菌株。
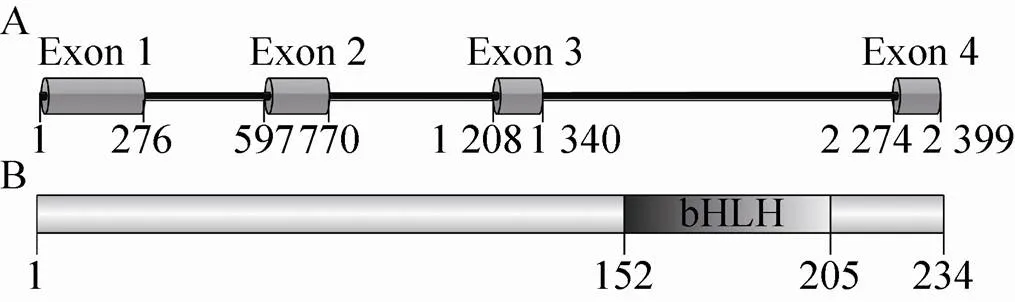
图1 Bmsage基因结构(A)及其蛋白结构域 (B) 分析
2.2 基因的组织表达谱分析
根据5龄3天家蚕各组织芯片基因表达谱,绘制在不同组织中表达的热图。结果显示,在家蚕丝腺中高量表达,而在头部等其他组织中表达量较低 (图2A)。定量分析 (图2B) 显示,无论在雄蚕前中部丝腺,还是后部丝腺中的表达量都比雌蚕在相同组织中的表达量高。一般来说,在相同的饲养条件下,同一品种雄蚕的产丝量要高于雌蚕。之前本实验室的赵小明等发现,在家蚕丝腺中高量表达,并且其在5龄期与丝素重链基因表达趋势一致。在后部丝腺,在高丝量品种872中的表达量要比低丝量品种大造的 高[14]。这些结果表明可能与家蚕丝腺合成蚕丝蛋白的主要功能相关。
2.3 蛋白序列比对和系统进化树构建
以Bmsage氨基酸序列为模板,通过Pubmed进行Blast分析。选取柑橘凤蝶等物种的bHLH序列与Bmsage的bHLH序列进行多序列比对 (图3)。结果表明,bHLH结构域的氨基酸序列在不同物种之间高度保守,暗示了bHLH类转录因子在不同的物种中可能具有重要的生物学功能。
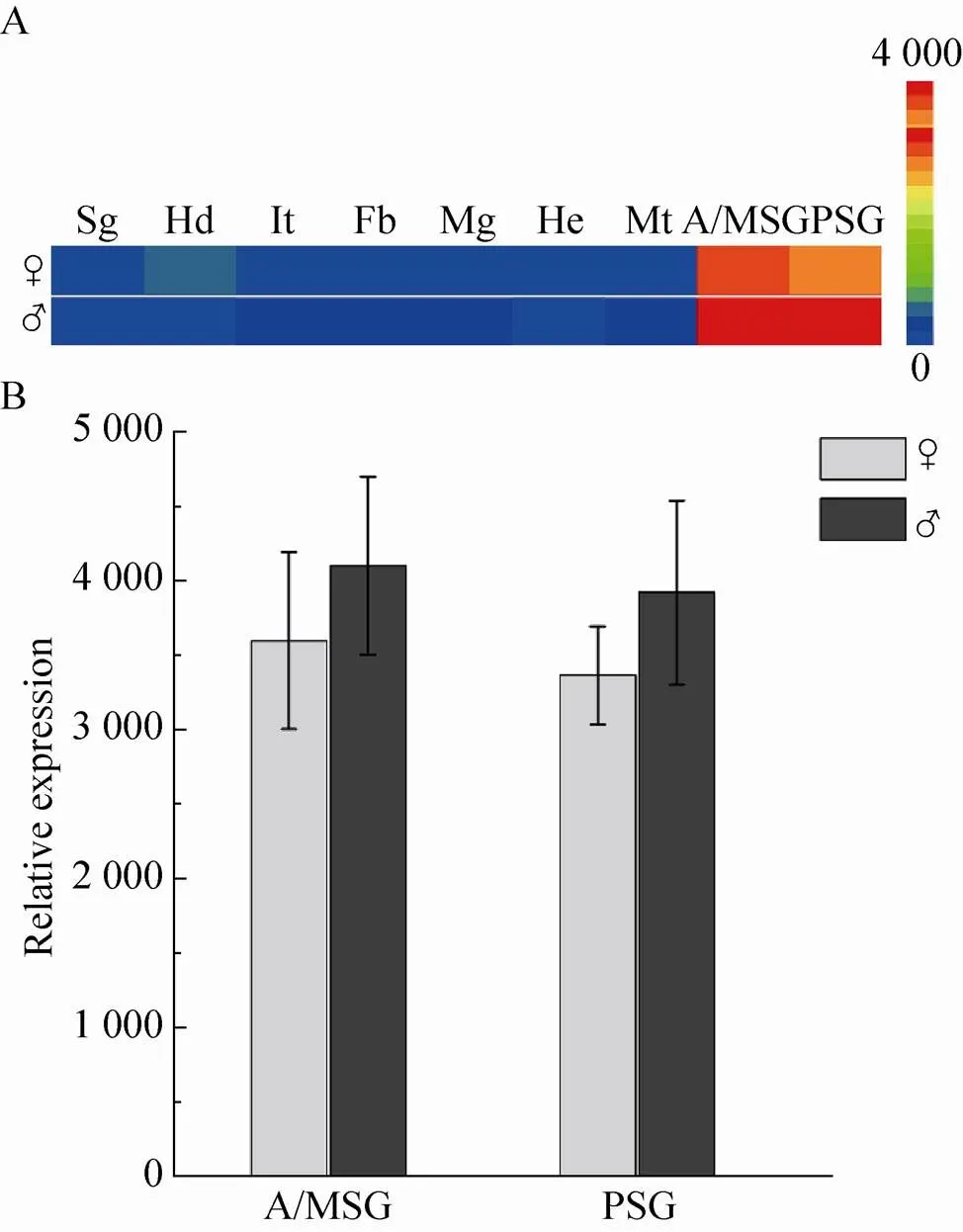
图2 5龄3天家蚕Bmsage基因表达分析(A:不同组织中的表达热图分析. ♀:雌性;♂:雄性;Sg:性腺;Hd:头;It:表皮;Fb:脂肪体;Mg:中肠;He:血细胞;Mt:马氏管;A/MSG:前中部丝腺;PSG:后部丝腺.B:Bmsage在雌蚕和雄蚕丝腺中的表达差异分析)
以Blast结果为基础,选取果蝇、蚁、蝶、蚊等物种中与Bmsage序列相似的蛋白构建发育进化树 (图4)。结果显示,家蚕与冬尺蠖蛾、柑橘凤蝶的亲缘关系最近,可以聚为一枝,其次是果蝇属的各物种,而与蚁、虱等物种亲缘关系较远。
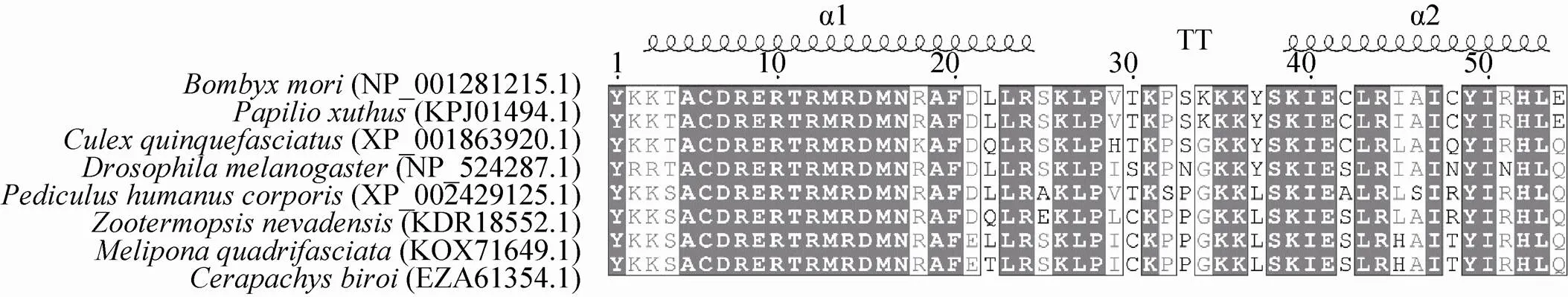
图3 不同物种bHLH结构域的多序列比对
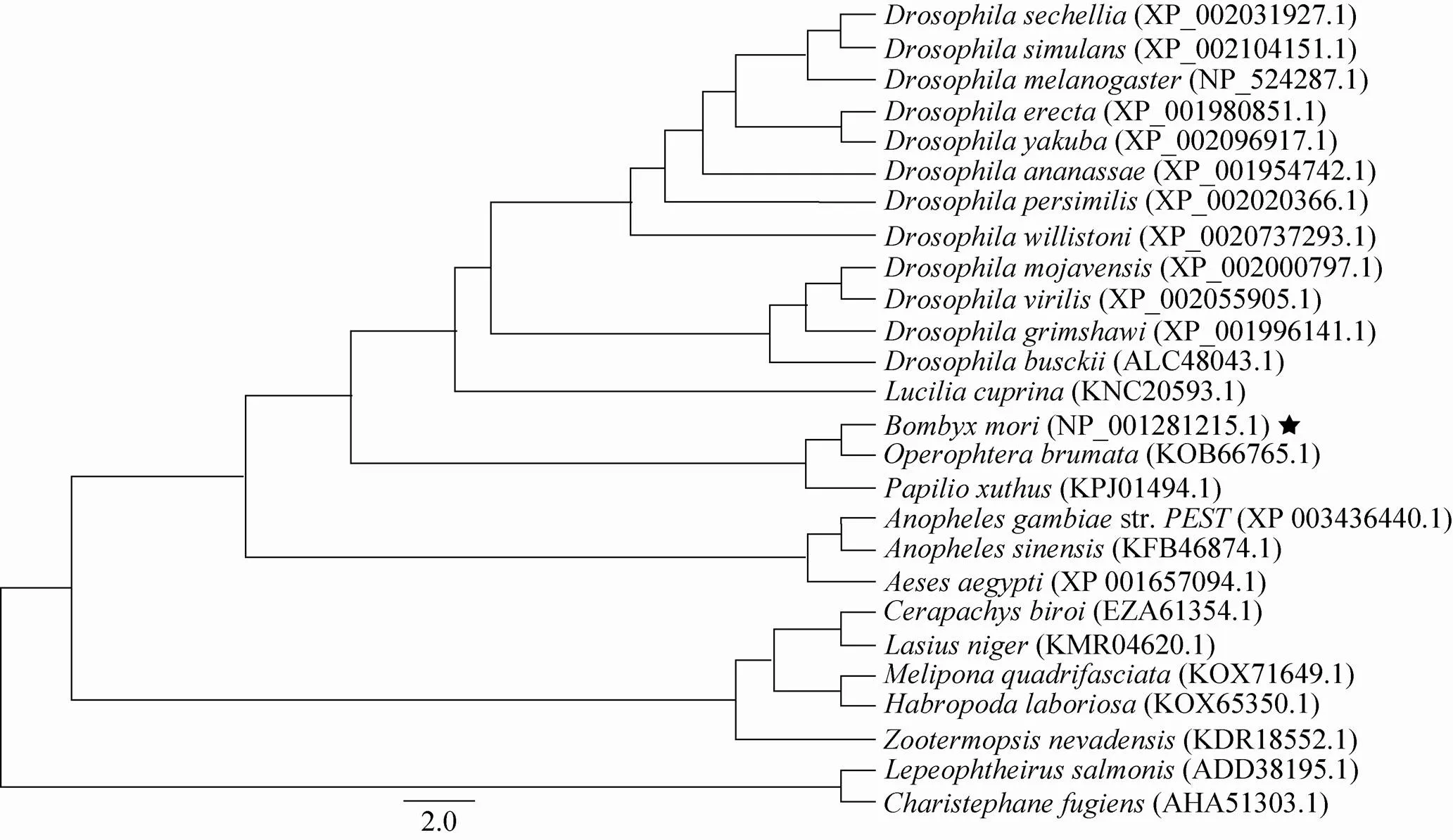
图4 家蚕Bmsage与其他物种同源蛋白的进化树分析
2.4 表达载体构建与可溶性表达分析
为研究Bmsage的性质和结构,利用PCR扩增获得了基因,然后通过双酶切将其构建到pSKB2等载体中进行表达,其中pSKB2、ppSUMO和pCold-SUMO是以pET-28a (+) 载体为基础改造而来,它们分别是将pET-28a (+) 中的Thrombin位点替换为PreScission和SUMO蛋白
酶切位点;pET 32M.3C中包含有6×His和Trx标签和PreScission酶切位点;pET-MBP基于pET-32a (+) 载体改造而来,包含6×His和MBP标签和烟草蚀纹病毒蛋白酶 (TEV) 酶切位点。
不同表达载体和表达条件下融合蛋白的表达效果如图5所示。结果显示,pSKB2-Bmsage (图5A)、ppSUMO-Bmsage (图5B)和pET 32M.3C-Bmsage (图5F) 在37 ℃下融合蛋白以包涵体形式表达,而在其他温度下可溶性蛋白的表达量较低,因此不适宜用这些载体表达可溶性的Bmsage。pCold-SUMO-Bmsage (图5C) 在所有条件下都有表达,在16 ℃、0.1 mmol/L IPTG下表达较好。pET-50b (+)-Bmsage (图5D) 在12 ℃和14 ℃下,融合蛋白主要以可溶性形式表达,在12 ℃、 0.1 mmol/L IPTG下表达较好。pET-MBP-Bmsage (图5E) 在16 ℃、0.1 mmol/L IPTG下表达较好。有研究表明,30 ℃有助于大肠杆菌产生可溶有活性的蛋白。我们对部分表达载体设置为30 ℃诱导表达,发现其对Bmsage的可溶性表达影响不大,因此设置了12–16 ℃来筛选Bmsage的可溶性表达条件。根据以上结果,本实验选择pCold-SUMO-Bmsage、pET-50b (+)-Bmsage和pET-MBP-Bmsage载体,并根据它们最优的表达条件来对Bmsage进行表达纯化。
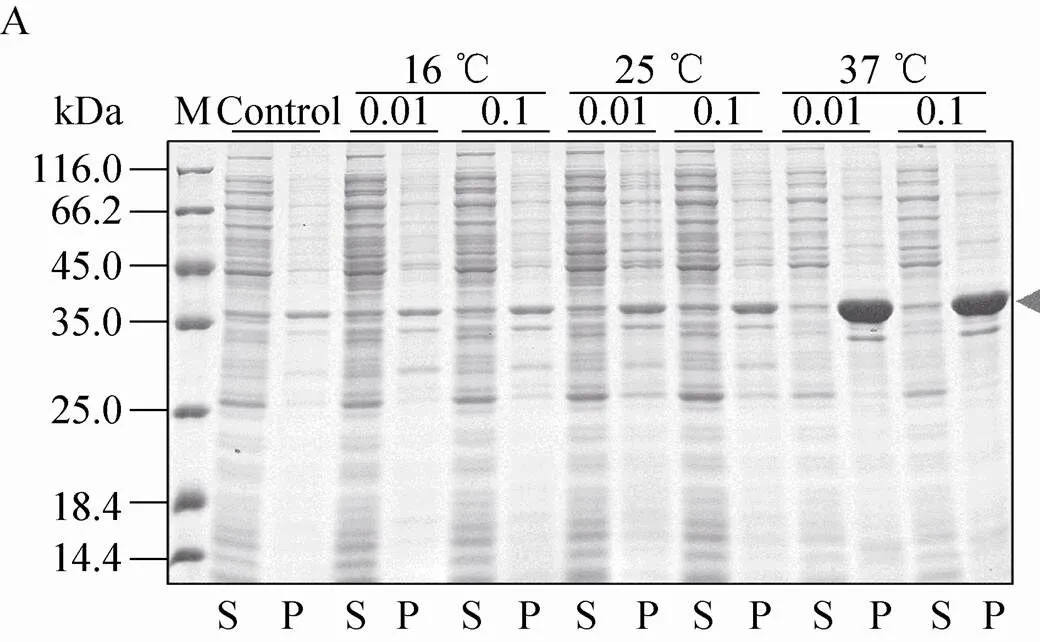
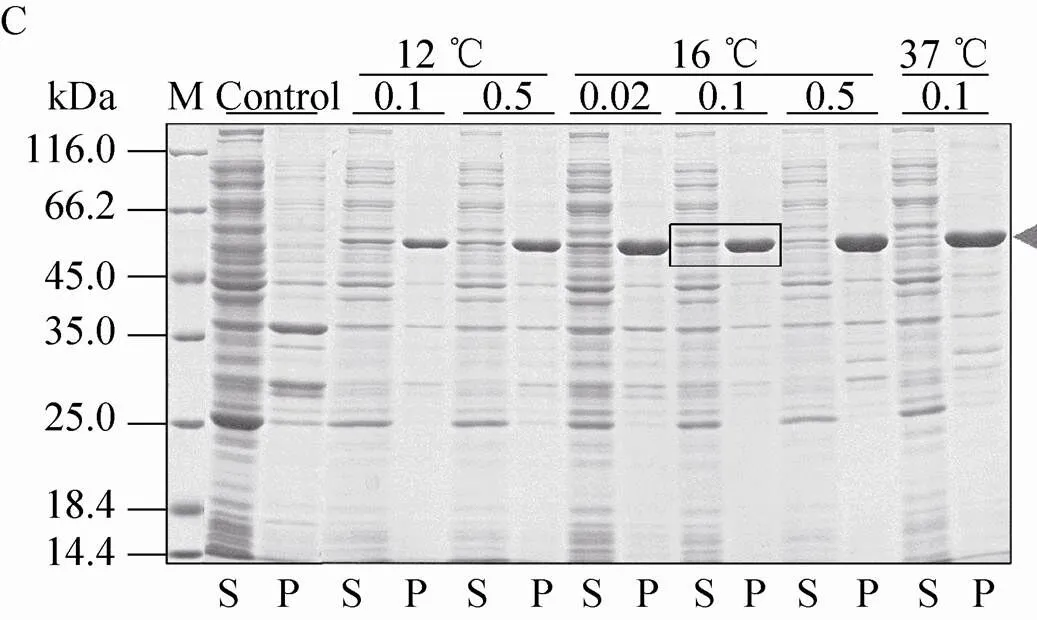
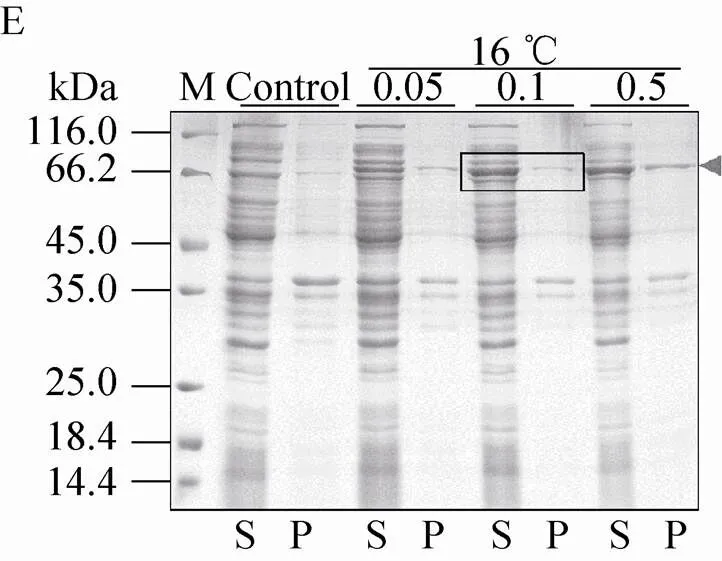
图5 诱导温度和IPTG浓度对不同重组表达载体表达Bmsage融合蛋白的影响(A:pSKB2-Bmsage;B:ppSUMO-Bmsage;C:pCold-SUMO-Bmsage;D:pET-50b(+)-Bmsage;E:pET-MBP-Bmsage;F:pET 32M.3C-Bmsage;M:分子量标准;Control、C:对照;S:上清;P:沉淀)
2.5 蛋白表达和纯化
2.5.1 利用pET-50b (+) 表达和纯化Bmsage
利用镍柱亲和层析对融合蛋白进行纯化 (图6A),上样缓冲液A为20 mmol/L Tris-HCl、 (pH 8.0)、500 mmol/L氯化钠、10%甘油、 20 mmol/L咪唑,利用包含不同咪唑浓度的缓冲溶液分步洗脱。结果显示,在300 mmol/L咪唑的洗脱条件下得到的融合蛋白 (约90 kDa) 较纯。将融合蛋白脱盐并置换为酶切缓冲液B (50 mmol/L Tris-HCl,pH 8.0,150 mmol/L氯化钠,10%甘油,5 mmol/L β-巯基乙醇),加入PreScission酶在4 ℃酶切16 h。酶切产物再次通过镍柱以除去NusA标签 (图6B)。结果显示,无论流穿,还是咪唑浓度梯度洗脱,Bmsage与NusA都不能被有效地分离。将图6B中第4–6泳道的样品收集除去咪唑后再次过镍柱,蛋白损失较多,且仍然不能将Bmsage与NusA标签完全分开。
2.5.2 利用pET-MBP表达和纯化Bmsage
收集细胞,破碎离心后将上清通过镍柱纯化,利用15% SDS-PAGE检测流穿和洗脱液(图7A)。结果显示,大部分His-MBP-Bmsage不与镍柱结合,即使降低流速上样,或者收集流穿二次上样,也无法让二者有效结合。利用包含不同咪唑浓度的缓冲溶液洗脱,在300 mmol/L咪唑的洗脱条件下得到的融合蛋白 (约70 kDa) 较纯。收集该融合蛋白并脱盐置换为酶切缓冲液B,加入TEV酶酶切,酶切产物通过镍柱以除去His-MBP标签(图7B)。结果显示,部分融合蛋白没有被TEV酶酶切,随Bmsage一起出现在流穿中 (图7B,泳道3)。利用不同浓度的咪唑分步洗脱,仍然不能将His-MBP标签与Bmsage有效地分离。
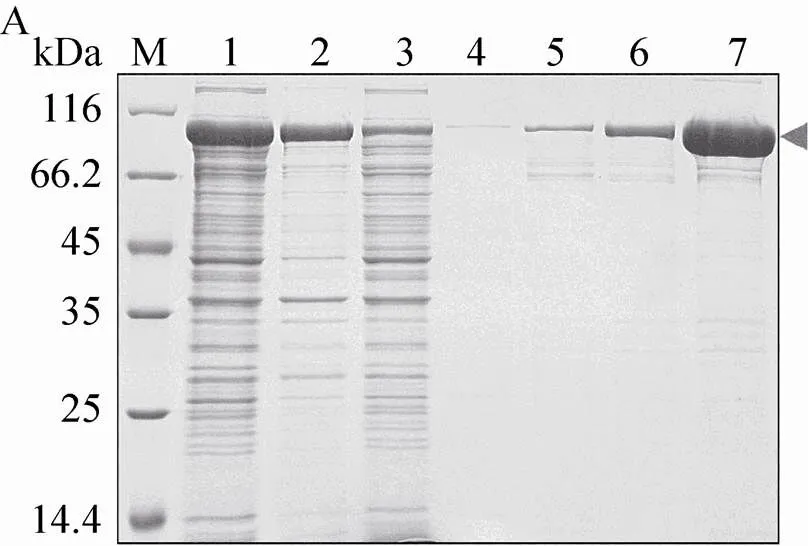
图6 借助pET-50b (+) 表达和纯化Bmsage. (A) 镍柱亲和层析纯化(1:上清;2:沉淀;3:流穿;4–7:60、80、100和300 mmol/L咪唑洗脱液);(B)酶切后通过镍柱纯化(1:重组蛋白;2:重组蛋白被PreScission蛋白酶酶切;3:流穿;4–8:20、40、50、60和500 mmol/L咪唑洗脱液. M:蛋白分子量标准)
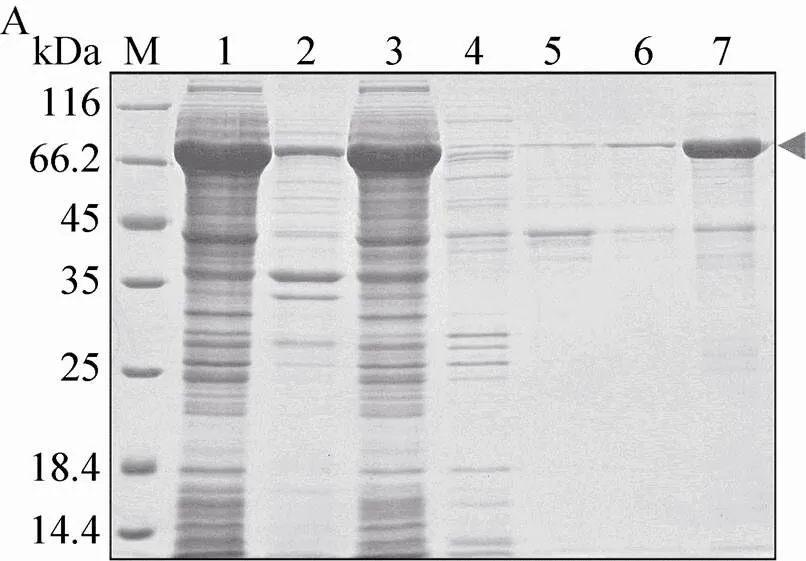
图7 借助pET-MBP表达和纯化Bmsage. (A)镍柱亲和层析纯化(1:上清;2:沉淀;3:流穿;4–7:40、60、80和300 mmol/L咪唑洗脱液);(B)酶切后通过镍柱纯化(1:重组蛋白;2:重组蛋白被TEV蛋白酶酶切;3:流穿;4–9:20、30、40、50、60和300 mmol/L咪唑洗脱液;M:蛋白分子量标准)
2.5.3 利用pCold-SUMO表达和纯化Bmsage
利用镍柱亲和层析纯化His-SUMO-Bmsage,收集流穿和洗脱液,进行SDS-PAGE检测(图8A),发现在300 mmol/L咪唑的洗脱条件下,获得的His-SUMO-Bmsage (约55 kDa) 较纯。将纯化的融合蛋白脱盐并置换为酶切缓冲液B,加入SUMO蛋白酶在4 ℃酶切16 h,再次通过镍柱去除SUMO标签 (图8B)。结果显示His-SUMO-Bmsage差不多被酶切完全,在流穿和40 mmol/L咪唑洗脱液中,可以检测到纯化的Bmsage,表明Bmsage与His-SUMO标签可以被有效地分开。
2.6 六种重组表达载体的表达纯化分析
本文利用6种表达载体对Bmsage在大肠杆菌中进行了表达,并选择了可溶性表达较好的载体和表达条件进行了纯化。现将所有的表达和纯化情况简要总结于表1,其中表达水平取该表达系统所有诱导条件下的最优值。结果显示,pSKB2-Bmsage、pET 32M.3C-Bmsage、ppSUMO- Bmsage主要以包涵体的形式表达,无法用于下一步纯化。pCold-SUMO-Bmsage、pET-50b(+)- Bmsage、pET-MBP-Bmsage部分以可溶性的形式在上清中表达,尤其是后两者,可溶性融合蛋白的表达量较高,但是难以将Bmsage与融合标签分离,而Bmsage与SUMO标签则可以被有效地分开。因此,pCold-SUMO是Bmsage表达纯化的最优系统。
2.7 蛋白二级结构分析
Bmsage属于bHLH转录因子家族,包含螺旋-环-螺旋结构域。为证实纯化的Bmsage是否包含有α-螺旋结构,利用远紫外圆二色光谱对其二级结构进行了分析 (图9)。结果显示,在圆二色光谱上208 nm与222 nm波长处有2个明显的负峰,193 nm波长处有1个明显的正峰,这些为α-螺旋结构的典型特征,表明纯化获得的Bmsage具有α-螺旋结构,推测其可能形成了类天然蛋白的空间构象。
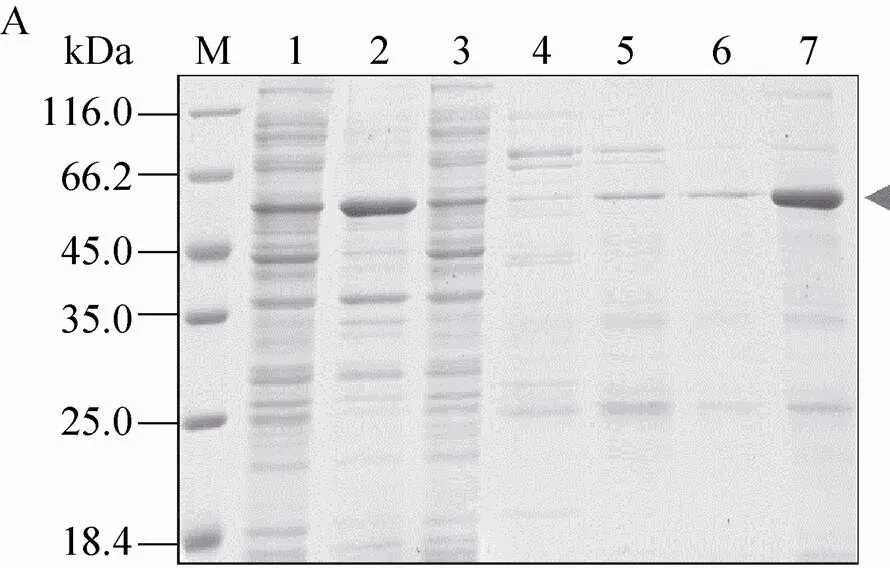
图8 借助pCold-SUMO表达和纯化Bmsage.(A) 镍柱亲和层析纯化 (1:上清;2:沉淀;3:流穿;4–7:40、60、80和300 mmol/L咪唑洗脱液);(B)酶切后通过镍柱纯化 (1:重组蛋白;2:重组蛋白被SUMO蛋白酶酶切;3:流穿;4–5:40和300 mmol/L咪唑洗脱液;M:蛋白分子量标准)

表1 6种重组表达系统的表达纯化情况比较
“+” indicates the level of expression and solubility, and the effect of purification, the more the better. 0 presents no observable solubility, and blank area represents this experiment is not conducted.
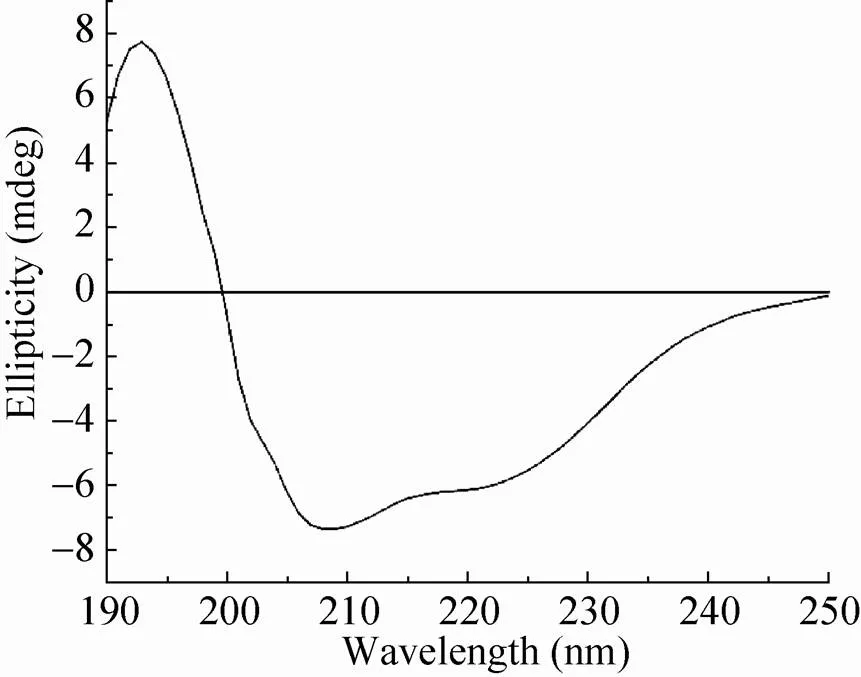
图9 Bmsage蛋白的远紫外圆二色光谱
3 讨论 蚕丝纤维因其优异的性能而被誉为“纤维皇后”。蚕丝蛋白主要由丝素和丝胶组成,其中主要成分是丝素。丝素由丝素重链、丝素轻链和P25按6∶6∶1的比例组成[20],其中丝素重链是丝素蛋白中最重要的成分,它赋予了蚕丝纤维主要的力学性能。丝素重链基因的表达在转录水平受多种转录因子 (SGF-1、SGF-2、SGF-3、SGF-4、FMBP-1、FBF-A1、Bmdimm等)[21-24]的调控。自本实验室刘春等[13]鉴定Bmsage以来, 研究表明Bmsage在丝蛋白合成[14]和丝腺器官发育[15]过程中发挥着重要的调控作用,然而迄今为止,对Bmsage的性质和结构了解不多。本研究拟通过大肠杆菌原核表达纯化Bmsage,从而为深入研究其结构和功能建立基础。 基因结构、基因表达速率和蛋白理化性质是影响外源基因在大肠杆菌中可溶性表达的主要因素。基因结构可以通过密码子优化或者利用携带稀有密码子tRNA的表达菌株来克服其表达问题;基因表达速率可以通过降低诱导温度和IPTG浓度来下调,从而使外源蛋白有充分的时间折叠形成正确的空间构象促进其溶解;外源蛋白可以通过与亲水的标签融合表达来提高其在大肠杆菌中表达的可溶性。20世纪末,融合标签技术快速发展起来,在辅助蛋白纯化、提高外源蛋白表达产量、溶解性和稳定性等方面显示出了巨大的应用价值。pET-50b(+)中的NusA[25]和pET-MBP中的MBP标签[26-27]具有较好的亲水性,可以帮助提高外源蛋白的可溶性;pCold-SUMO与ppSUMO中的SUMO标签[28]不仅有助于提高外源蛋白的溶解性,还可以促进其在体内的折叠;pET 32M.3C中的Trx标 签[29]不仅能够提高蛋白的溶解性,还能促进蛋白质中二硫键的正确配对。本研究将NusA、MBP、SUMO和Trx等标签分别与Bmsage融合表达,并利用Transetta (DE3)表达菌株,结合降低诱导温度和IPTG浓度的方式成功实现了Bmsage在大肠杆菌中的可溶性表达。高中生物课程是学生学习的重要科目,对学生的综合知识学习能力的提高有着积极作用,生物课堂教学过程中,注重教学方法的科学应用比较关键,这也是促进教学质量的重要举措。通过从理论层面深化生物课堂生活化教学发展研究,能为实际教学工作的开展提供相应参考。 我们的结果显示,NusA与MBP标签具有较好的助溶效果,能够显著地提高Bmsage的可溶性表达,这与其他的研究结果基本一致[30-31]。然而,当酶切之后,NusA标签与Bmsage无法有效地分离。NusA标签含有大量的酸性氨基酸残基,等电点约为4.62,推测其可能与Bmsage中碱性氨基酸残基之间存在非特异性电荷-电荷相互作用从而导致二者无法分开。His-MBP-Bmsage大部分不与镍柱结合,并且不能被酶切完全,即使加大蛋白酶用量、延长反应时间或者提高酶切反应温度也无法提高酶切产率,这可能是因为融合蛋白本身没有折叠形成良好的空间结构,从而导致组氨酸标签和蛋白酶切位点被包埋在蛋白质内部,组氨酸标签无法与镍亲和填料结合,同时TEV酶切位点两端的MBP与Bmsage也可能会对TEV酶产生空间位阻,导致融合蛋白无法被TEV酶识别和切割。Trx标签有助于富含二硫键蛋白的正确折叠,并且在一定程度上也能帮助提高外源蛋白的溶解性[30],但其对于Bmsage的可溶性表达并没有明显的帮助。SUMO标签可以帮助提高Bmsage的可溶性表达,其效果不如NusA与MBP标签明显,但经过SUMO蛋白酶酶切后,SUMO标签与Bmsage可以通过镍柱被有效地分离。圆二色光谱显示,利用SUMO标签表达纯化的Bmsage包含α-螺旋结构,推测其可能折叠形成了类天然的空间结构,这表明SUMO标签不仅具有一定的助溶效果,而且也有助于Bmsage的正确折叠。 bHLH转录因子在生命活动过程中具有多种重要的生物学功能,然而之前的研究很少涉及此类蛋白的性质和结构,这可能与其难以表达纯化相关。我们发现,Bmsage容易形成包涵体表达,并且易于聚沉,这可能与其氨基酸组成和性质相关。本研究利用SUMO标签和镍亲和层析的方法表达纯化了Bmsage蛋白,为深入研究其结构性质和功能建立了很好的基础,同时,我们的研究对其他类似蛋白的表达和纯化也有一定的借鉴意义。
REFERENCES:
[1] Massari ME, Murre C. Helix-loop-helix proteins: regulators of transcription in eucaryotic organisms. Mol Cell Biol, 2000, 20(2): 429–440.
[2] Ledent V, Paquet O, Vervoort M. Phylogenetic analysis of the human basic helix-loop-helix proteins. Genome Biol, 2002, 3(6): 1–18.
[3] Simionato E, Ledent V, Richards G, et al. Origin and diversification of the basic helix-loop-helix gene family in metazoans: insights from comparative genomics. BMC Evol Biol, 2007, 7: 33.
[4] Wang Y, Yao Q, Chen KP. Progress of studies on family members and functions of animal bHLH transcription factors. Hereditas (Beijing), 2010, 32(4): 307–330 (in Chinese). 王勇, 姚勤, 陈克平. 动物bHLH转录因子家族成员及其功能. 遗传, 2010, 32(4): 307–330.
[5] Murre C, McCaw PS, Baltimore D. A new DNA binding and dimerization motif in immunoglobulin enhancer binding, daughterless, myod, and myc proteins. Cell, 1989, 56(5): 777–783.
[6] Voronova A, Baltimore D. Mutations that disrupt DNA-binding and dimer formation in the E47 helix-loop-helix protein map to distinct domains. Proc Natl Acad Sci USA, 1990, 87(12): 4722–4726.
[7] Ferré-D'Amaré AR, Prendergast GC, Ziff EB, et al. Recognition by max of its cognate DNA through a dimeric b/HLH/Z domain. Nature, 1993, 363(6424): 38–45.
[8] Ma PC, Rould MA, Weintraub H, et al. Crystal-structure of MyoD bHLH domain-DNA complex-perspectives on DNA recognition and implications for transcriptional activation. Cell, 1994, 77(3): 451–459.
[9] Imayoshi I, Kageyama R. bHLH factors in self-renewal, multipotency, and fate choice of neural progenitor cells. Neuron, 2014, 82(1): 9-23.
[10] Abrams EW, Mihoulides WK, Andrew DJ. Fork head and sage maintain a uniform and patent salivary gland lumen through regulation of two downstream target genes,and. Development, 2006, 133(18): 3517–3527.
[11] Fox RM, Vaishnavi A, Maruyama R, et al. Organ-specific gene expression: the bHLH protein sage provides tissue specificity toFoxA. Development, 2013, 140(10): 2160–2171.
[12] Wang Y, Chen KP, Yao Q, et al. The basic helix-loop-helix transcription factor family in. Dev Genes Evol, 2007, 217(10): 715–723.
[13] Liu C. Expression profile of silk gland and transcriptional regulation of silk fibroin structural genes of[D]. Chongqing: Southwest University, 2006 (in Chinese). 刘春. 家蚕丝腺表达谱及丝素结构基因转录调控研究[D]. 重庆: 西南大学, 2006.
[14] Zhao XM, Liu C, Li QY, et al. Basic helix-loop-helix transcription factor Bmsage is involved in regulation ofgeneinteraction with SGF1 in. PLoS ONE, 2014, 9(4): e94091.
[15] Xin HH, Zhang DP, Chen RT, et al. Transcription factor Bmsage plays a crucial role in silk gland generation in silkworm,. Arch Insect Biochem Physiol, 2015, 90(2): 59–69.
[16] Larkin MA, Blackshields G, Brown NP, et al. Clustal W and Clustal X version 2.0. Bioinformatics, 2007, 23(21): 2947–2948.
[17] Robert X, Gouet P. Deciphering key features in protein structures with the new ENDscript server. Nucleic Acids Res, 2014, 42: W320-W324.
[18] Tamura K, Stecher G, Peterson D, et al. Mega6: molecular evolutionary genetics analysis version 6.0. Mol Biol Evol, 2013, 30(12): 2725–2729.
[19] Deng WK, Wang YB, Liu ZX, et al. Hemi: a toolkit for illustrating heatmaps. PLoS ONE, 2014, 9(11): e111988.
[20] Inoue S, Tanaka K, Arisaka F, et al. Silk fibroin ofis secreted, assembling a high molecular mass elementary unit consisting of H-chain, L-chain, and P25, with a 6: 6: 1 molar ratio. J Biol Chem, 2000, 275(51): 40517–40528.
[21] Hui CC, Suzuki Y. Enhancement of transcription from the Ad2 major late promoter by upstream elements of the fibroin-and sericin-1-encoding genes in silk gland extracts. Gene, 1989, 85(2): 403–411.
[22] Hui CC, Matsuno K, Suzuki Y. Fibroin gene promoter contains a cluster of homeodomain binding sites that interact with three silk gland factors. J Mol Biol, 1990, 213(4): 651–670.
[23] Takiya S, Kokubo H, Suzuki Y. Transcriptional regulatory elements in the upstream and intron of the fibroin gene bind three specific factors POU-M1, Bm Fkh and FMBP-1. Biochem J, 1997, 321(3): 645–653.
[24] Zhao XM, Liu C, Jiang LJ, et al. A juvenile hormone transcription factor Bmdimm-fibroin H chain pathway is involved in the synthesis of silk protein in silkworm,. J Biol Chem, 2015, 290(2): 972–986.
[25] De Marco V, Stier G, Blandin S, et al. The solubility and stability of recombinant proteins are increased by their fusion to NusA. Biochem Biophys Res Commun, 2004, 322(3): 766–771.
[26] di Guan, Chu PL, Riggsa PD, et al. Vectors that facilitate the expression and purification of foreign peptides inby fusion to maltose-binding protein. Gene, 1988, 67(1): 21–30.
[27] Lei RY, Qiao YH, Yan JD, et al. Soluble expression of recombinant human BMP6 inand its purification and bioassay. Chin J Biotech, 2008, 24(3): 452–459 (in Chinese). 雷荣悦, 乔玉欢, 闫继东, 等. 重组人BMP6在大肠杆菌中可溶表达、纯化及活性分析. 生物工程学报, 2008, 24(3): 452–459.
[28] Marblestone JG, Edavettal SC, Lim Y, et al. Comparison of SUMO fusion technology with traditional gene fusion systems: enhanced expression and solubility with SUMO. Protein Sci, 2006, 15(1): 182-189.
[29] Lavallie ER, Diblasio EA, Kovacic S, et al. A thioredoxin gene fusion expression system that circumvents inclusion body formation in thecytoplasm. Biotechnology (N Y), 1993, 11(2): 187–193.
[30] Dummler A, Lawrence AM, De Marco A. Simplified screening for the detection of soluble fusion constructs expressed inusing a modular set of vectors. Microb Cell Fact, 2005, 4: 1.
[31] Schrodel A, Volz J, De Marco A. Fusion tags and chaperone co-expression modulate both the solubility and the inclusion body features of the recombinant CLIPB14 serine protease. J Biotechnol, 2005, 120(1): 2–10.
(本文责编 郝丽芳)
Soluble expression, purification and structural analysis of the bHLH transcription factor Bmsage of
Huawei He1,2, Shuguang Wei1, Yejing Wang1,2, Lina Liu1, Zhenzhen Li1, Peng Zhao1, Huaipu Chang1,2, and Ping Zhao1
1,,400715,Chongqing Engineering and Technology Research Center for Novel Silk MaterialsCollege of BiotechnologySouthwest UniversityChongqingChina
Basic helix loop helix (bHLH) transcription factor plays an important role in biological processes. Bmsage is a class of bHLH transcription factor highly expressed in the silk gland of, which is not only involved in the developmental regulation of the silk gland cells at the embryonic period, but also plays a crucial regulatory role during the synthesis of silk protein. However, currently, much of the property and structure of Bmsage is still remained unknown. To study the property, structure and biological role of Bmsage, we constructed several prokaryotic expression vectors of Bmsage fused with NusA, MBP, SUMO, Trx and His tags, respectively, then screened and determined the best soluble expression vector and condition of Bmsage incombining with the induction temperature and IPTG concentration, and further purified the recombinant Bmsage by Ni-column affinity chromatography according to the established expression condition and characterized its secondary structure using circular dichroism spectra. The results showed that NusA and MBP could significantly enhance the soluble expression of Bmsage in, but it was difficult to separate Bmsage from these tags. SUMO could not only increase the soluble expression of Bmsage into a certain degree, but also be effectively separated from Bmsage. Other tags did not effectively promote the soluble expression of Bmsage in. Circular dichroism spectra showed that the purified Bmsage had well-defined α-helix structure in solution, indicating that SUMO may promote the correct folding of Bmsage into native-like structure. These work not only establish a foundation for further study of the property, structure and function of Bmsage, but also provide a reference for the expression and purification of other similar proteins.
basic helix-loop-helix, Bmsage, MBP, NusA, SUMO, purification
March 21, 2016; Accepted:May 12, 2016
Huawei He. Tel: +86-23-68251575; E-mail: hehuawei@swu.edu.cn
时间:2016-06-13
http://www.cnki.net/kcms/detail/11.1998.Q.20160613.0955.001.html
Supported by:National Basic Research Program of China (973 Program) (No. 2012CB114602), National Natural Science Foundation of China (Nos. 31402139, 31572465), Chongqing Research Program of Basic Research and Frontier Technology (Nos. cstc2015jcyjA00040, cstc2015jcyjBX0035), Fundamental Research Funds for the Central Universities (No. XDJK2013A019), Start-up Grant from Southwest University (No. SWU112111).
国家重点基础研究发展计划 (973计划) (No. 2012CB114602),国家自然科学基金(Nos. 31402139, 31572465),重庆市基础科学与前沿技术研究专项(Nos. cstc2015jcyjA00040, cstc2015jcyjBX0035),中央高校基本科研业务费(No. XDJK2013A019),西南大学博士基金(No. SWU112111) 资助。
