里氏木霉Cel5A基因优化及其在毕赤酵母中的高效表达
2016-11-14白仁惠张云博王春迪张斐洋张喆孙付保张震宇
白仁惠,张云博,王春迪,张斐洋,张喆,孙付保,张震宇
里氏木霉Cel5A基因优化及其在毕赤酵母中的高效表达
白仁惠1,2,张云博1,王春迪1,张斐洋3,张喆3,孙付保1,张震宇1
1 江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡 214122;2 南京林业大学江苏省生物质绿色燃料与化学品重点实验室,江苏南京 210037;3 河南天冠企业集团有限公司车用生物燃料技术国家重点实验室,河南南阳 473000
内切纤维素酶Cel5A缺乏是限制纤维素酶制剂高效酶解天然纤维素的关键因素。本文尝试构建高效表达里氏木霉Cel5A的毕赤酵母重组菌株以弥补目前Cel5A的天然分泌不足,通过基因密码子偏好性优化里氏木霉Cel5A基因和构建表达载体pPIC9K-,并将其电转入毕赤酵母GS115以构建重组子,利用浓度梯度平板和摇瓶发酵筛选获得一株高产毕赤酵母菌株GS115-EG Ⅱ。重组酶的酶学性质分析显示,该酶分子量50 kDa、最适pH (pH 4.5) 略有降低及最适反应温度为60 ℃,专一性地作用于非结晶纤维素,与天然里氏木霉Cel5A并无明显区别。通过摇瓶发酵的初步优化,该菌摇瓶培养条件:培养温度28 ℃、起始 pH 5.0、接种量2%、每24 h添加甲醇1.5% (/)、每24 h添加山梨醇4 g/L及吐温80添加4 g/L,发酵192 h重组酶酶活达到24.0 U/mL。进一步上罐(5 L) 发酵180 h,该重组酶Cel5A酶活高达270.9 U/mL,蛋白含量达到4.16 g/L。重组毕赤酵母GS115-EG Ⅱ是一株适合于外源表达Cel5A的工程菌,该重组酶可替代天然分泌Cel5A适用于当前酶基生物炼制模式下木质纤维素基质高效水解中。
毕赤酵母GS115-EG Ⅱ,里氏木霉Cel5A基因,AOX1启动子,密码子偏好性,发酵优化,CMC酶活
微生物酶法生物炼制工艺的关键步骤之一是如何经济高效地水解纤维素/半纤维素组分为可发酵性糖,纤维素酶成本过高仍然是阻碍该生物炼制商业化推进的关键因素[1]。目前商业纤维素酶主要来源于真菌里氏木霉及其变种,酶蛋白种类多达80余种[2],其中除了存在大量的不起作用的杂蛋白外,纤维素酶蛋白种类和比例相对较单一,难以满足不同来源 (种属和预处理) 基质特异性需求,酶蛋白间协同能力相对较低,从而导致酶载量增加,酶解效率降低[3]。针对该问题,国内外研究者们开展了外加酶蛋白 (复合酶) 和纤维素酶制剂重新定制的探索,取得了显著进展[4]。
纤维素酶核心酶组分Cel5A主要产自真菌里氏木霉,其含量占纤维素酶总蛋白比例不足10%[5]。Cel5A对纤维素长链内部β-1,4糖苷键进行有效水解从而促进纤维素糖化,所以可用于羊毛和棉织物等纤维素材料的表面处理,使其更为柔顺,用于牛仔布料能产生良好的脱色与石磨效应[6-8]。可见,如何获得充足的纤维素酶蛋白Cel5A具有重要的应用价值。国内外研究者们在微生物技术层面上进行了广泛研究,其中,异源表达效果引起了人们广泛关注。就细菌方面而言,Nakazawa等将里氏木霉Cel5A基因成功在大肠杆菌中实现了异源表达,摇瓶培养后得到胞内CMC比酶活3.7 U/mg[9]。但由于大肠杆菌所产蛋白为胞内蛋白,后续提纯工作繁杂,且Cel5A基因来源于真菌,许多研究者将其置于真菌表达系统中进行异源表达。Boonvitthya等将Cel5A基因成功在解脂耶氏酵母中实现异源表达,摇瓶培养后酶活为6 U/mL[10]。du Plessis等将Cel5A基因成功在酿酒酵母中实现异源表达,并利用培养基成分优化以及分别与Cel7A、Cel7B基因共表达用以提高Cel5A酶活,摇瓶培养后得到最终酶活22.3 U/mL[11]。然而,尽管研究人员在这些真菌中实现了异源表达,但由于宿主过度的翻译后修饰作用 (如糖基化) 导致异源表达酶活处于较低水平。于是,研究者们尝试以毕赤酵母作为宿主进行Cel5A表达。乔宇等将天然Cel5A基因导入毕赤酵母,摇瓶诱导培养后CMC酶活为8.7 U/mL[12]。郑海英等对含天然Cel5A基因的重组毕赤酵母进行摇瓶优化后CMC酶活达到23.1 U/mL[13]。Boonvitthya等进一步将天然Cel5A基因导入毕赤酵母,摇瓶诱导培养后CMC酶活最高可达 70 U/mL[10]。Samanta等将天然Cel5A基因在毕赤酵母中进行表达,摇瓶初步优化后CMC酶活可达130 U/mL[14]。这些研究表明,毕赤酵母是异源表达Cel5A的合适宿主,但目前这些研究大多是将Cel5A天然基因导入毕赤酵母中在摇瓶水平上开展工作,总体产酶水平仍不高,尤其国内这方面工作还很有限。
基于此,本文首先对里氏木霉内切葡聚糖酶Cel5A基因实现基因优化处理 (密码子偏好性优化,GC含量调整以及mRNA二级结构优化),然后将优化后的基因在AOX1启动子调控下在毕赤酵母中实现异源表达,通过多拷贝筛选获得目的菌株。检验其酶学性质后对其主要培养条件进行摇瓶优化以获得较高酶活,最后对重组菌株实现上罐发酵。
1 材料与方法
1.1 材料
毕赤酵母GS115 ()、大肠杆菌DH5α和大肠杆菌JM109等菌株为本实验室保存。质粒pPIC9K购自Invitrogen公司。限制性内切酶、连接酶和聚合酶购自TaKaRa-宝生物工程(大连) 有限公司。细菌/真菌培养基成分与遗传霉素G-418等抗生素购自生工生物工程上海 (股份) 有限公司。
1.2 菌株培养
大肠杆菌培养基为LB,配制平板时加入1.8%琼脂。毕赤酵母采用YPD培养,其重组菌筛选采用MD平板,摇瓶发酵采用BMMY (www.invitrogen.com/content/sfs/manuals/easyselecte man.pdf)。大肠杆菌平板培养时于37 ℃恒温培养箱中进行,摇瓶培养于旋转式摇床(37 ℃、220 r/min)上进行。
大肠杆菌培养:将大肠杆菌接入LB培养基中于37 ℃、220 r/min培养过夜,用于质粒提取。
毕赤酵母培养:将重组菌单菌落接入30 mL体积YPD中于30 ℃、250 r/min培养过夜至600=5,然后以1% (/) 接种量转接至50 mL (500 mL三角瓶) BMMY中发酵产酶,每24 h添加甲醇至终浓度为1.5% (/) 以诱导产酶。
1.3 目的基因优化
利用软件Gene Designer (DNA2.0,Menlo Park,CA,USA) 对来源于里氏木霉内切葡聚糖酶Ⅱ (Cel5A) 基因(GenBank Accession No. DQ178347.1) 进行密码子优化。然后用软件RNAstructure预测经密码子优化后目的基因二级结构,通过少数密码子同义替换将起始密码子端碱基呈现开环结构,并调整目的基因GC含量在40%–50%。最后在优化的目的基因5′端添加R Ⅰ酶切位点,在3′端添加Ⅰ酶切位点,送至上海旭冠生物技术发展有限公司进行全基因合成。
1.4 表达载体构建及其电转化
将合成的目的基因通过R Ⅰ与Ⅰ酶切位点克隆在穿梭质粒pPIC9K上,以Ⅰ作为线性化位点酶切后进行浓缩,用大约2 μg线性化质粒与毕赤酵母感受态细胞混合,在2 mm电击杯中冰浴15 min,电击参数设置为2.5 kV与5 ms。电击后将1 mL冰浴后的1 mol/L山梨醇加入电击杯混匀,涂MD平板筛选转化子。
1.5 高产菌株筛选
首先利用抗性浓度梯度筛选转化子,将含有重组质粒pPIC9K-转化子点在遗传霉素G-418抗性浓度分别为0、2和4 mg/mL的YPD平板上实现筛选。然后将能在高浓度抗性平板上正常生长转化子接入发酵培养基中实现产酶,用以进行高产菌株筛选。其中摇瓶培养做3个平行,标准差在图中以误差线标示。
1.6 分析测定
实验中按照先前报道方法对重组蛋白进行SDS-PAGE分析[15]。以羧甲基纤维素作为底物测定Cel5A酶活,方法如下:测定样为200 μL 1% (/) CMC底物(pH 4.8) 与100 μL发酵液上清混合,空白对照为200 μL柠檬酸缓冲液 (50 mmol/L,pH 4.8) 与100 μL发酵液上清混合。混合液在50 ℃反应30 min后加入300 μL 3,5-二硝基水杨酸溶液沸水浴5 min,加入 3.9 mL H2O,混合均匀后在540 nm测定吸光值。酶活单位(U) 定义:1个酶活力单位是指在50 ℃与pH 4.8的条件下,每分钟产生1微摩尔葡萄糖所对应的酶量。以微晶纤维素和水杨苷分别作为底物测定Cel5A相应酶活时,分别以微晶纤维素和水杨苷替代CMC,用上述相同步骤进行测定,其中微晶纤维素水解反应时间为 1 h。以滤纸(Whatman Filter Paper No. 1) 作底物测定Cel5A酶活时,将50 mg滤纸条置于 200 μL柠檬酸缓冲液(50 mmol/L,pH 4.8) 作为反应底物,除混合物反应时间为1 h外其他测定方法与CMC酶活测定方法相同。
蛋白含量测定方法采用考马斯亮蓝法(Bradford),测定管为0.8 mL NaCl溶液 (0.15 mol/L) 与0.2 mL酶液混合,混匀后加入5 mL考马斯亮蓝试剂,对照为1 mL NaCl溶液(0.15 mol/L) 与5 mL考马斯亮蓝混合物,测定混合液595值。
1.7 酶学性质分析
外源表达Cel5A最适反应pH:测定不同pH (pH 3.0–8.0) 柠檬酸缓冲液 (50 ℃、反应 30 min) 对应CMC酶活。考察最适反应温度:测定不同反应温度40–80 ℃下柠檬酸缓冲液 (pH 4.8、反应30 min) 对应CMC酶活。酶蛋白热稳定性:不同温度(40–80 ℃) 时每隔10 min取样测定CMC酶活。重组蛋白底物特异性:按CMC酶活测定方法,以不同底物 (Avicel,D-(-)-Salicin与Filter paper) 替代CMC测定相对应酶活。测定重组蛋白反应动力学时底物浓度为0.1%–2.5% (/),反应动力学参数m和max利用软件GraphPad Prism 5进行计算。所有实验数值均做3个平行,标准差在图中以误差线标示。
1.8 单因素摇瓶优化
基于上述毕赤酵母培养方法,保持其他条件不变,优化接种量时考察接种量为1%、2%、3%和4%时重组菌产酶能力;优化培养基pH时考察培养基pH 4、pH 5、pH 6和pH 7时重组菌产酶能力;优化培养温度时考察温度为24 ℃、26 ℃、28 ℃和30 ℃时重组菌产酶能力;优化甲醇添加量时考察每24 h添加甲醇至终浓度0.5%、1%、1.5%、2%和2.5%时重组菌产酶能力,它们分别培养144 h后对其菌浓度与酶活进行测定;优化碳源时,在每24 h添加甲醇至终浓度为1.5%时考察每24 h添加碳源 (山梨醇、甘露醇、葡萄糖及甘油) 至终浓度4 g/L,培养 72 h,测定其酶活与生物量;考察非离子表面活性剂时,在发酵培养基中分别添加4 g/L吐温20、4 g/L吐温80、0.5 g/L Triton X-100、2 g/L PEG2000、2 g/L PEG4000、2 g/L PEG6000、2 g/L PEG10000和2 g/L PEG20000,培养192 h,测定酶活。所有优化均采用单因素优化,均在 500 mL三角瓶内完成,装液量为50 mL。所有实验数值均做3个平行,标准差在图中以误差线标示。
1.9 上罐发酵
该培养在5 L发酵罐 (上海万木春生物工程有限公司,型号WMC-9005A/T) 里进行,采用无机盐培养基 (工作体积1.5 L),配方参考(http:// tools. thermofisher. com/content/ sfs/manuals/ pichiaferm_prot.pdf)。YPD培养基上种子培养24 h后,按7.5%接种量接入发酵罐。在生长阶段,控制发酵罐温度为30 ℃和转速180 r/min培养16 h (600=30左右),补加400 mL 50%甘油溶液 (含有12% PTM1) 作为碳源。继续培养 (大约在36 h) 至600=300时流加甲醇 (含12% PTM1) 进入诱导阶段,此时转速提升至500 r/min,温度降为28 ℃,此时起流速与DO相关联,维持DO在25%左右诱导培养144 h。期间每12 h取样测定600、发酵上清液酶活及蛋白含量。
2 结果与分析
2.1 目的基因优化
本实验以毕赤酵母作为宿主菌株进行研究,由于存在外源基因密码子偏好性,导致外源基因天然密码子在宿主细胞中转录和翻译效率常受到不利影响,所以目的基因异源表达前常要进行外源目的基因的优化处理[16]。本文通过优化密码子偏好性、优化mRNA二级结构及调整GC含量等对里氏木霉葡聚糖内切酶Ⅱ基因进行优化处理,以使目的基因更适合在毕赤酵母中异源表达。
在优化密码子偏好性时,利用软件Gene Designer对里氏木霉内切葡聚糖酶Ⅱ (Cel5A) 基因进行密码子优化。其中,目的基因含有自身信号肽,同样也实现了密码子偏好性优化,并在优化后基因5′端添加R Ⅰ酶切位点,在3′端添加Ⅰ酶切位点。优化后基因密码子与未优化的相比较,结果如表1所示。针对毕赤酵母偏好性表,天然Cel5A基因序列中使用频率低于20%的密码子均进行同义替换,以提高其异源表达效率。优化后目的基因密码子得到大幅度调整,其中284个碱基发生变化。
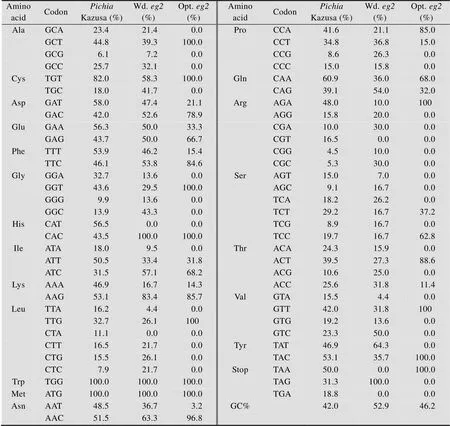
表1 Cel5A基因优化前后密码子使用频率表
Kazusa: cited online http://www.kazusa.or.jp/ codon; Opt.: optimized; Wd.: native.
在转录与翻译过程中基因在起始密码子端二级结构若呈现环状结构,将会对30S核糖体有排斥作用,导致转录和翻译效率降低[17]。因此,实验接着通过RNAstructure对目的基因mRNA二级结构进行了预测和优化。通过对起始密码子端碱基进行调整,并严格执行密码子同义替换,最终破坏基因起始密码子端环状结构,使优化后基因mRNA起始密码子端二级结构10个碱基呈开环结构,有助于提高宿主对目的基因的转录和翻译效率,结果如图1所示。
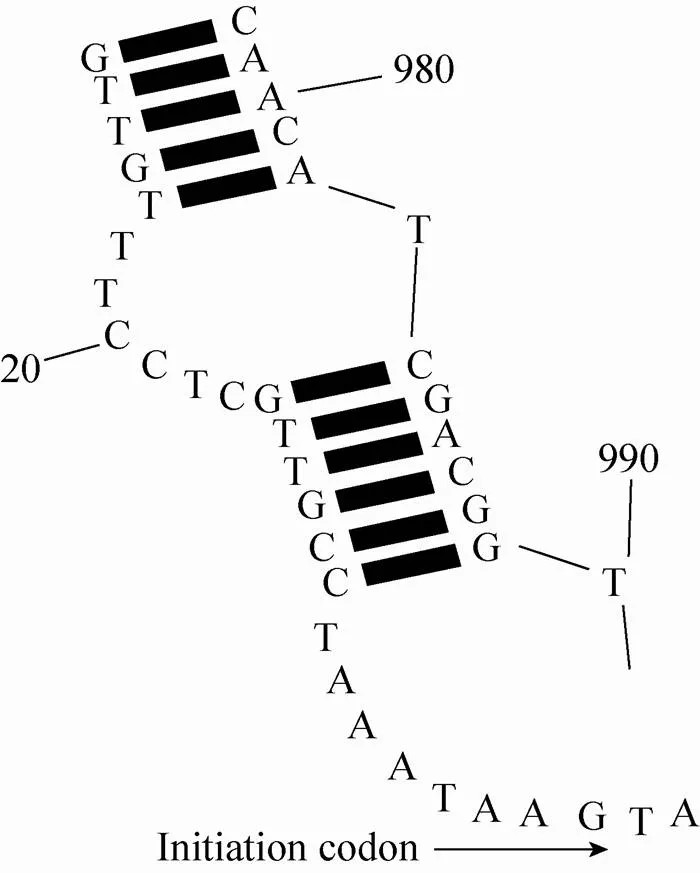
图1 Cel5A基因mRNA二级结构预测
本实验在优化密码子偏好性的同时,通过手动调整碱基对密码子也进行了同义替换,最终使目的基因GC含量从52.9%降至46.2%。一些研究认为,基因序列中GC含量同样影响基因转录和翻译,GC含量控制在40%–50%有助于提高外源基因在毕赤酵母中表达效率[16]。本实验中目的基因优化后GC含量为46.2%,与相关报道一致,这为提高后面的异源表达效率提供了可能。
2.2 含目的基因表达载体的构建
本实验中选择由甲醇严格调控的AOX1强启动子,为实现Cel5A基因在毕赤酵母中的异源表达,将目的基因插入穿梭质粒pPIC9K上,插入位点在酿酒酵母α-因子信号肽下游,酶切位点为R Ⅰ与Ⅰ,并置于AOX1启动子下游。将构建好的含目的基因的表达载体进行单双酶切验证,结果表明表达载体pPIC9K-构建成功。
2.3 电转化与平板筛选
为了将上述表达载体pPIC9K-导入毕赤酵母细胞以实现异源表达,本实验中以Ⅰ作为线性化位点进行酶切并浓缩,利用电转化手段导入毕赤酵母GS115感受态细胞,将优化后目的基因整合至毕赤酵母染色体上,以获得含目的基因的转化子。最后将电击后菌液涂布在不含组氨酸的筛选平板(MD) 上,在30 ℃下培养72 h共获得80株转化子。
平板筛选时将上述转化子点到不同浓度的遗传霉素G-418抗性梯度平板上,结果如图2所示。所有转化子在无遗传霉素G-418抗性的YPD平板上均能生长,当浓度升至2 mg/mL时绝大部分转化子可以生长,当浓度升至4 mg/mL时,仅剩12株具有生长优势。因此,以这12株菌株作为后续摇瓶筛选实验对象。
2.4 摇瓶筛选及产酶验证
为获得高产菌株,将上述平板筛选到的12株转化子接至摇瓶发酵培养基上,培养192 h后进行酶活与生物量测定 (图3)。这12株重组菌均能在发酵培养基中生长和产酶,其中66号菌株生长较好,发酵192 h时菌浓最高,达到600=30;而且发酵液中酶活相对较高,CMC酶活近20 U/mL。这样,本实验中选择66号重组菌株作为后续研究对象,暂命名为GS115-EG Ⅱ表示。

图2 高产Cel5A菌株的抗性平板筛选 (30 ℃培养48 h)
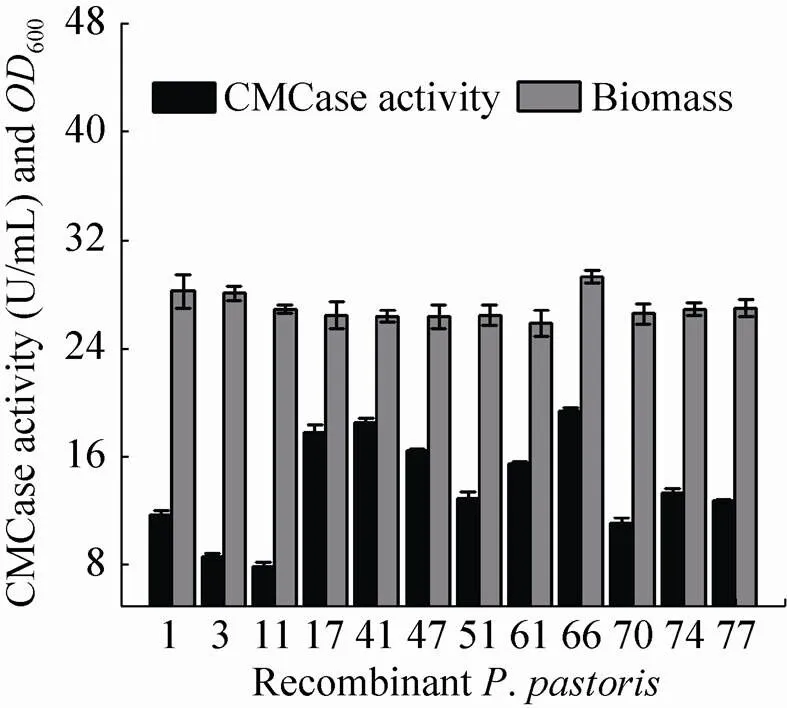
图3 转化子的摇瓶发酵筛选 (30 ℃培养192 h)
为了验证重组Cel5A已经实现异源表达并且分泌在胞外,实验接着利用SDS-PAGE对GS115-EG Ⅱ发酵上清液进行分析,结果表明转化子.GS115-EG Ⅱ在摇瓶培养168 h的不同阶段均分泌出一种蛋白,随着发酵时间延长,该蛋白浓度越大。该蛋白分子量约50 kDa,这与先前一些关于里氏木霉天然Cel5A蛋白的报道是一致的[18]。另外,一些研究的毕赤酵母中表达的重组Cel5A蛋白大小与本文结果一致[10,19]。因此,结合前面所测酶活,我们认为该蛋白是目标酶蛋白Cel5A。
另外,由SDS-PAGE分析可知该重组菌目前分泌的重组蛋白是接近电泳纯水平的,其发酵上清液可直接用于重组里氏木霉Cel5A酶酶学性质分析,不需要繁琐的蛋白纯化手段。这与先前相关报道相一致,毕赤酵母本身无内源性纤维素酶产生,产酶背景简单,可以直接获得较纯的目的蛋白酶液[20]。
2.5 重组蛋白酶学性质分析
本实验接着以摇瓶发酵上清液中重组里氏木霉Cel5A酶直接进行酶学性质分析,包括重组Cel5A酶水解底物的最适温度与pH、酶蛋白热稳定性、底物特异性以及酶学动力学参数等。结果如图4和表2所示,重组酶Cel5A最适反应pH值为4.5,最适反应温度为60 ℃,耐热性分析显示温度60 ℃时对该酶酶活无明显影响,但温度高于70 ℃时酶活下降非常明显。实验数据与其他天然Cel5A外源表达的相关报道基本一致[10,12,14]。酶学性质表明,本实验通过对里氏木霉Cel5A基因优化后在毕赤酵母中表达的Cel5A与天然酶蛋白非常接近,可适用于当前纤维素酶基生物炼制工业的天然纤维基质酶解。
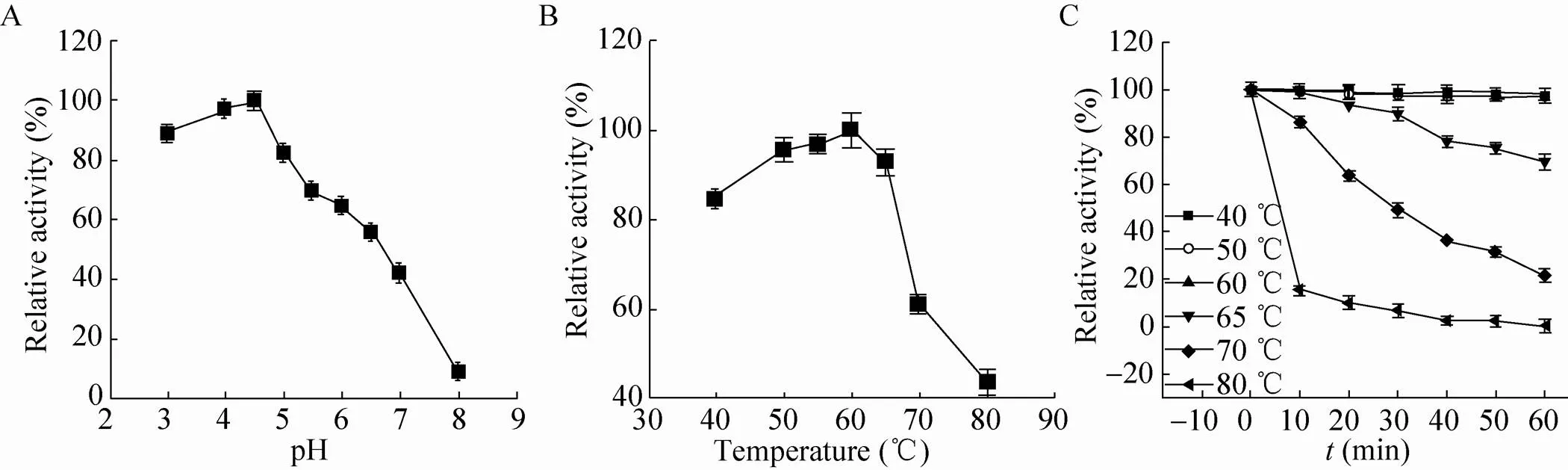
图4 重组Cel5A酶学性质
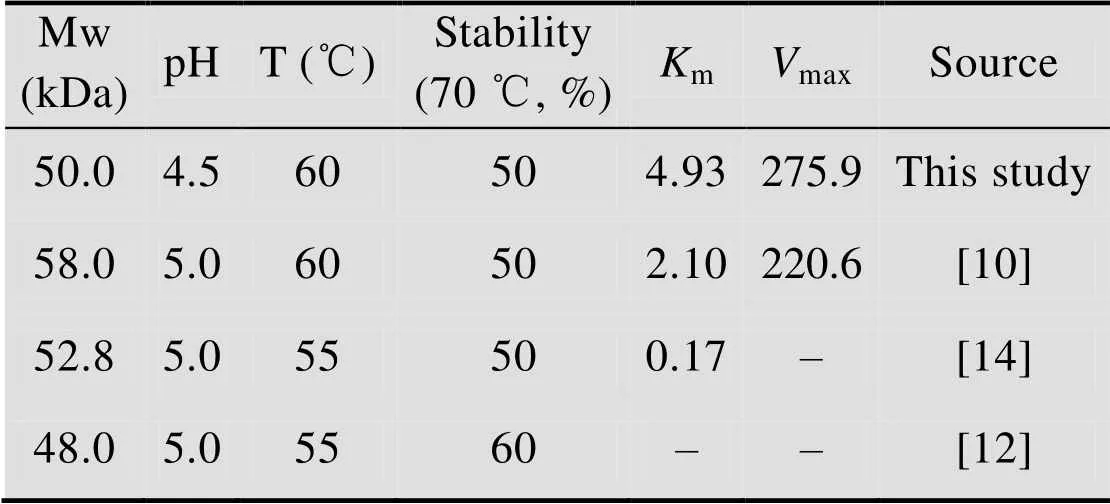
表2 重组Cel5A酶学性质分析
Mw: molecular weight; T: optimum reaction temperature; stability (%): residual activity (%) after the incubation at 70 ℃ for 30 min.
另外,对重组酶底物特异性进行分析可知重组酶对CMC有较强水解作用 (比酶活为58.82 U/mg),但对微晶纤维素 (比酶活为 0.02 U/mg)、水杨苷 (无法检测到酶活) 及滤纸水解力 (比酶活为0.05 U/mg) 较弱。可见,该重组酶蛋白与天然Cel5A相似,对无定型纤维素长链有较强的水解作用,但对纤维素短链以及纤维素结晶区作用较弱[14]。实验进一步以0.1%–2.5%浓度CMC为底物对重组Cel5A酶动力学关键参数进行测定,并利用曲线拟合软件GraphPad Prism 5进行计算,获得该重组酶的m值为4.93 mg/mL,max值为275.9 μmol/(min·mg)。与先前报道相比[10,14],本实验中所得Cel5A的最大反应速度max与相关报道基本一致,但m值明显大于相关报道的,初步推断可能是目的基因经过优化后表达的Cel5A酶蛋白结构发生了明显变化,具体信息有待深入研究。
2.6 重组毕赤酵母摇瓶优化
发酵条件优化是增加重组毕赤酵母菌产酶水平的重要手段[13]。本实验对毕赤酵母GS115-EG Ⅱ发酵的培养基 (碳源、甲醇诱导物和添加剂) 和培养条件 (接种量、初始pH和培养温度) 一些关键性参数进行初步考察 (图5)。如图5A所示,当接种量为2%时,该菌生物量最高(600=27.7),相应的CMC酶活也最高,达到19.8 U/mL。在培养基初始pH方面 (图5B),在pH 5时其生物量和酶活最高,分别为29.1及18.1 U/mL。培养温度如图5C所示,当培养温度为28 ℃时,其生物量600与酶活最高,分别为32.4与20.8 U/mL。
另外,诱导型系统中表达载体含有AOX1启动子,添加合适甲醇浓度能有效促进重组菌产酶能力[21]。实验接着对培养基关键成分进行考察。如图5D所示,重组毕赤酵母生物量与酶活随着甲醇浓度增加而增加,当甲醇添加量为1.5% (/) 时,生物量与酶活达到最高水平,分别为28和20 U/mL。对碳源考察如图5E所示,每24 h添加碳源均能促进菌株生长繁殖,其中葡萄糖效果最好,但添加葡萄糖未能提高酶活,而添加山梨醇和甘油在促进菌体生长繁殖同时也显著增加了重组毕赤酵母菌产酶能力,且山梨醇相对于甘油在促进酶活方面更有优势。该结果与早先的报道相符,Thorpe等[22]在比较混合碳源甘油/甲醇和山梨醇/甲醇对毕赤酵母外源表达重组蛋白影响时发现:相对于甘油,添加山梨醇导致毕赤酵母生物量稍低些,但其重组蛋白的产率提高明显。于是,本实验接着对山梨醇添加量进行考察,发现当山梨醇添加量为4 g/L时酶活提升最为明显,达到 11.4 U/mL,比对照提高了28%。
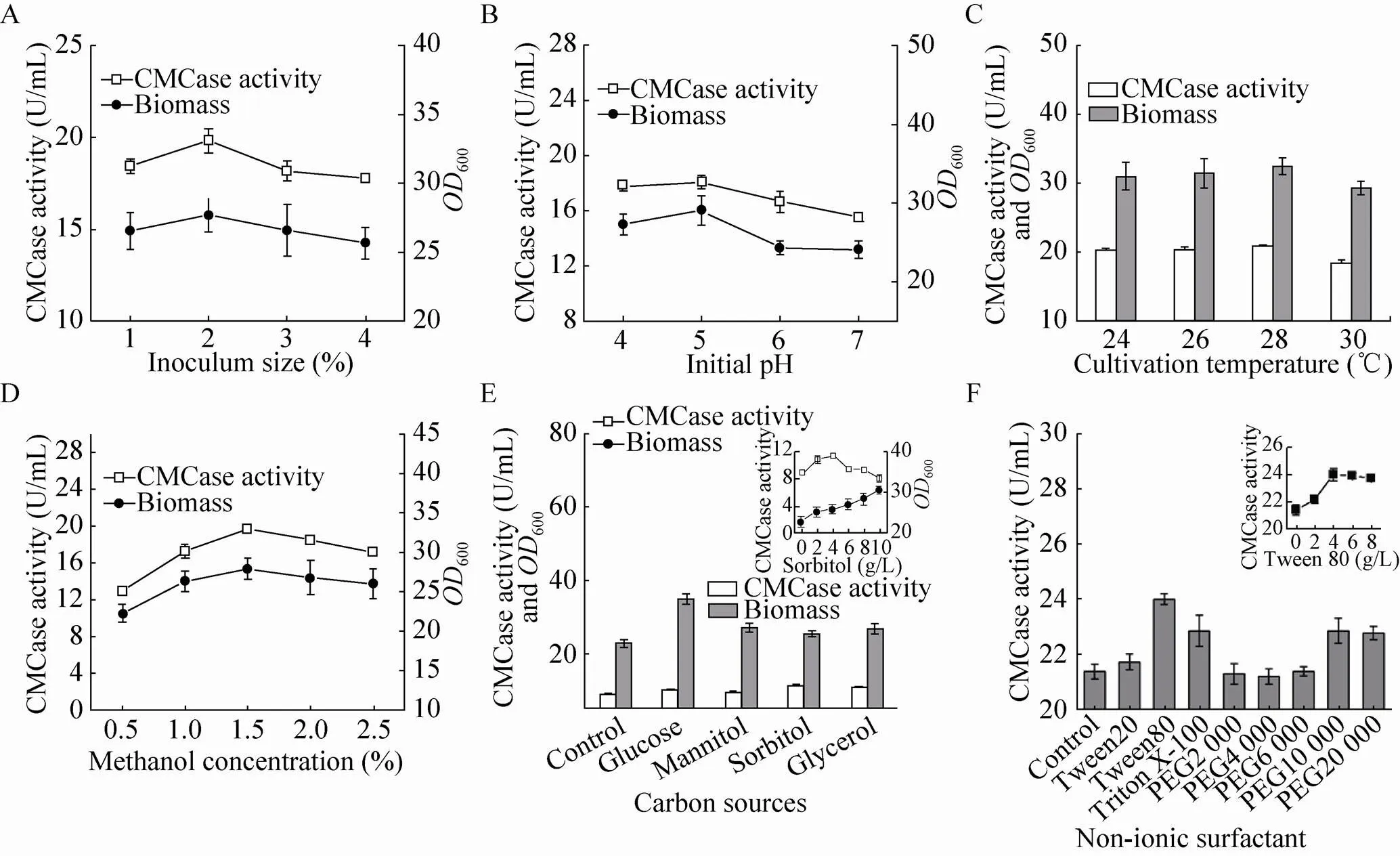
图5 重组毕赤酵母发酵产酶水平的初步摇瓶优化
此外,非离子表面活性剂能够提高真菌细胞壁渗透性,从而提高目的蛋白的表达量[23]。实验也考察非离子表面活性剂对菌株GS115-EG Ⅱ产重组酶的影响,如图5F所示。不同种类表面活性剂均对菌株发酵产酶有积极作用,其中吐温80作用效果最为明显,使所表达酶活增加10%以上。进一步对吐温80添加量进行选择,发现在吐温80添加量为4 g/L时重组菌株GS115-EG Ⅱ表达酶活最高,高达24.0 U/mL。
总之,本实验通过摇瓶优化,明显提高了重组菌GS115-EG Ⅱ产酶能力,使酶活提高10%以上,达到24.0 U/mL。然而,目前摇瓶发酵获得的CMC酶活不高。Samanta等将在毕赤酵母GS115中进行表达和诱导培养48 h时达到最高酶活(75 U/mL);进一步在BMMH中诱导培养72 h的CMC酶活可达130 U/mL[14]。最近,Akbarzadeh等优化Cel5A基因并在毕赤酵母GS115进行表达,以1%甲醇诱导培养72 h,其重组Cel5A蛋白CMC酶活高达 2 358.8 U/mL,这是迄今为止公开报道的最高酶活[24]。
2.7 上罐发酵
鉴于摇瓶发酵时溶氧局限性,实验接着尝试在发酵罐水平通过加强溶氧来提高重组菌GS115-EG Ⅱ的Cel5A表达水平,控制条件如图6A所示。在上罐发酵过程中溶氧(DO) 反映甲醇消耗量,当甲醇流加速率过高时DO值会过低,而甲醇添加速率过低时DO值会偏高[25]。本实验通过控制DO值来准确地控制甲醇添加量以高效诱导重组毕赤酵母产酶,同时又不至于对菌体产生毒害作用。本文在诱导过程中维持DO值在25%上下,发酵pH值与温度维持基本恒定。
如图6B所示,在5 L发酵罐中重组菌在甘油补料阶段(0–36 h) 生长速度最快,当甘油耗尽时(36 h) 生物量已达600=300;此时添加甲醇进行诱导培养,细胞生长繁殖放缓,但菌体量仍持续增加,直至发酵将近结束时生物量达到最高水平 (600接近700)。随着甲醇添加量增加,CMC酶活不断提升,180 h时酶活达到270.9 U/mL。同时,发酵上清液蛋白总量也在增加,在180 h达到4.16 g/L。另外,不同时间点的发酵上清液也进行了SDS-PAGE电泳 (图6B),各上清液在大约50 kDa处均有一条清晰条带,该条带随发酵进行更加浓重清晰。这也表明,在发酵过程中目的蛋白表达量的确随着发酵时间增加而显著提高,与酶活增长趋势相一致。总之,本实验通过对发酵罐参数的精确控制获得了较高的菌体浓度及良好的菌体活性,从而为重组Cel5A蛋白的高效表达提供了可能。
3 讨论
本文鉴于基因密码子偏向性,通过密码子偏向性优化、二级结构优化与GC含量调整等手段实现目的基因优化以期里氏木霉Cel5A在毕赤酵母中高效表达。既然国内外研究人员已开展了原始Cel5A基因直接在毕赤酵母里外源表达的研究,本文就将密码子优化基因在毕赤酵母里表达后与已报到结果进行比较。相对于天然基因直接表达,目的基因优化后外源表达存在着高效表达潜力;从本文结果和已报道文献看,目的基因优化后表达比天然基因直接表达的酶活相对高一些[12-13]。因此,目的基因序列的合理优化和转化子的有效筛选是获得高效表达重组菌的关键。
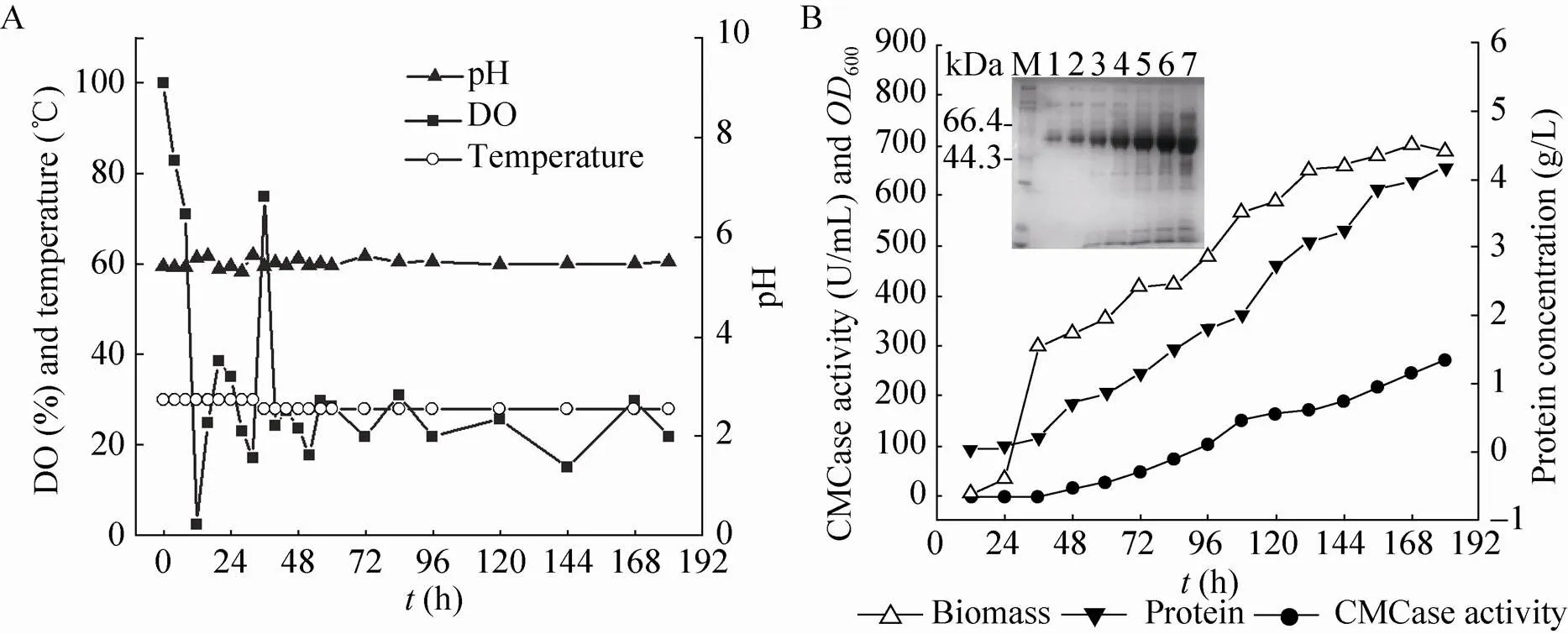
图6 毕赤酵母GS115-EG Ⅱ上罐发酵实验
毕赤酵母具有特殊的整合方式,通过电转化合成大量转化子的目的基因拷贝数是不同的,能在高浓度抗性平板上正常生长的转化子所含目的基因拷贝数通常较高[14]。文献[26]表明,重组毕赤酵母菌株中所含目的基因拷贝数能够影响其产酶能力,目的基因拷贝数增多时表达量能显著提升,但过多的拷贝数也无助于酶蛋白高效表达。本文中以Ⅰ作为线性化位点使线性化质粒载体中的AOX1基因与毕赤酵母染色体上AOX1基因进行替换与整合,有可能获得多拷贝转化子,进一步通过高浓度抗性平板筛选获得高产转化子可能性较大。本文在4 mg/mL抗性平板上完成重组毕赤酵母GS115-EG Ⅱ筛选,该菌株有可能是高拷贝重组菌。
重组毕赤酵母GS115-EG Ⅱ分泌表达的重组酶与天然里氏木霉分泌Cel5A酶蛋白在酶学性质上没有明显差异,表明重组毕赤酵母GS115-EG Ⅱ是适合外源表达Cel5A的工程菌,该重组酶适用于弥补里氏木霉菌株天然分泌Cel5A不足,可用于当前酶基生物炼制模式下的木质纤维素基质高效水解中。
重组毕赤酵母GS115-EG Ⅱ摇瓶发酵优化后Cel5A酶表达量增加并不理想(< 15%),通过上罐发酵实现了重组毕赤酵母菌株GS115-EG Ⅱ高效分泌,其CMC酶活达到270.9 U/mL,蛋白含量达到4.16 g/L。与天然里氏木霉发酵液相比,其酶活分别是Culbertson等[27]与Ahamed等[28]报道里氏木霉发酵液CMC酶活的150倍和64.5倍,表明毕赤酵母是异源表达里氏木霉内切酶基因Cel5A的合适宿主。李红等[29]在5 L罐水平里进行过含原始Cel5A基因重组毕赤酵母的外源表达,甲醇诱导48 h后CMC酶活为15.6 U/mL,远低于本文所获得的结果。然而国外新近报道(Akbarzadeh等[24]) Cel5A基因优化后导入毕赤酵母GS115构建的重组菌,以1%甲醇诱导培养72 h,其重组Cel5A蛋白CMC酶活高达2 358.8 U/mL,这是迄今为止公开报道的最高酶活。如若属实,将使毕赤酵母外源表达Cel5A商业化成为可能。
REFERENCES:
[1] Fang X, Qin YQ, Li XZ, et al. Progress on cellulase and enzymatic hydrolysis of lignocellulosic biomass. Chin J Biotech, 2010, 26(7): 864–869 (in Chinese). 方诩, 秦玉琪, 李雪芝, 等. 纤维素酶与木质纤维素生物降解转化的研究进展. 生物工程学报, 2010, 26(7): 864–869.
[2] Nagendran S, Hallen-Adams HE, Paper JM, et al. Reduced genomic potential for secreted plant cell-wall-degrading enzymes in the ectomycorrhizal fungus, based on the secretome of. Fungal Genet Biol, 2009, 46(5): 427–435.
[3] Meyer AS, Rosgaard L, Sørensen HR. The minimal enzyme cocktail concept for biomass processing. J Cereal Sci, 2009, 50(3): 337–344.
[4] Bussamra BC, Freitas S, da Costa AC. Improvement on sugar cane bagasse hydrolysis using enzymatic mixture designed cocktail. Bioresour Technol, 2015, 187: 173–181.
[5] Rosgaard L, Pedersen S, Langston J, et al. Evaluation of minimalcellulase mixtures on differently pretreated barley straw substrates. Biotechnol Progr, 2007, 23(6): 1270–1276.
[6] Heikinheimo L, Buchert J, Miettinen-Oinonen A, et al. Treating denim fabrics withcellulases. Text Res J, 2000, 70(11): 969–973.
[7] Miettinen-Oinonen A, Heikinheimo L, Buchert J, et al. The Role ofcellulases in cotton finishing.Aatcc Rev, 2001, 51(9): 7–12.
[8] Suominen PL, Mäntylä AL, Karhunen T, et al. High frequency one-step gene replacement in. Ⅱ. Effects of deletions of individual cellulase genes. Mol Gen Genet, 1993, 241(5/6): 523–530.
[9] Nakazawa H, Okada K, Kobayashi R, et al. Characterization of the catalytic domains ofendoglucanase Ⅰ, Ⅱ, and Ⅲ, expressed in. Appl Microbiol Biotechnol, 2008, 81(4): 681–689.
[10] Boonvitthya N, Bozonnet S, Burapatana V, et al. Comparison of the heterologous expression ofendoglucanase Ⅱ and cellobiohydrolase Ⅱ in the yeastsand. Mol Biotechnol, 2013, 54(2): 158–169.
[11] du Plessis L, Rose SH, van Zyl WH. Exploring improved endoglucanase expression instrains. Appl Microbiol Biotechnol, 2010, 86(5): 1503–1511.
[12] Qiao Y, Mao AJ, He YZ, et al. Secreted expression ofendo--glucanase Ⅱ gene inand anylysis of enzymic properties. Mycosystema, 2004, 23(3): 388–396 (in Chinese). 乔宇, 毛爱军, 何永志, 等. 里氏木霉内切-β-葡聚糖酶Ⅱ基因在毕赤酵母中的表达及酶学性质研究. 菌物学报, 2004, 23(3): 388–396.
[13] Zheng HY, Cai SL, Huang P, et al. Optimization of fermentation conditions for neutral endoglucanase EG Ⅱ.J Mirobiol, 2012, 32(1): 12–16 (in Chinese). 郑海英, 蔡少丽, 黄平, 等. 内切中性纤维素酶EG Ⅱ的发酵条件优化. 微生物学杂志, 2012, 32(1): 12–16.
[14] Samanta S, Basu A, Halder UC, et al. Characterization ofendoglucanase Ⅱ expressed heterologously infor better biofinishing and biostoning. J Microbiol, 2012, 50(3): 518–525.
[15] Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227(5259): 680–685.
[16] Akcapinar GB, Gul O, Sezerman U. Effect of codon optimization on the expression ofendoglucanase 1 in. Biotechnol Progr, 2011, 27(5): 1257–1263.
[17] Cruz-Vera LR, Magos-Castro MA, Zamora-Romo E, et al. Ribosome stalling and peptidyl-tRNA drop-off during translational delay at AGA codons. Nucl Acids Res, 2004, 32(15): 4462–4468.
[18] Miettinen-Oinonen A, Suominen P. Enhanced production ofendoglucanases and use of the new cellulase preparations in producing the stonewashed effect on denim fabric. Appl Environ Microbiol, 2002, 68(8): 3956–3964.
[19] Miettinen-Oinonen A, Paloheimo M, Lantto R, et al. Enhanced production of cellobiohydrolases inand evaluation of the new preparations in biofinishing of cotton. J Biotechnol, 2005, 116(3): 305–317.
[20] Cregg JM, Vedvick TS, Raschke WC. Recent advances in the expression of foreign genes in. Nat Biotechnol, 1993, 11(8): 905–910.
[21] Katakura Y, Zhang WH, Zhuang GQ, et al. Effect of methanol concentration on the production of human2-glycoprotein Ⅰ domain Ⅴ by a recombinant: a simple system for the control of methanol concentration using a semiconductor gas sensor. J Ferment Bioeng, 1998, 86(5): 482–487.
[22] Thorpe ED, d'Anjou MC, Daugulis AJ. Sorbitol as a non-repressing carbon source for fed-batch fermentation of recombinant. Biotechnol Lett, 1999, 21(8): 669–672.
[23] Liu YT, Xuan SX, Long CN, et al. Screening, identifying of cellulose-decomposing strain L-06 and its enzyme-producing conditions. Chin J Biotech, 2008, 24(6): 1112–1116 (in Chinese). 刘韫滔, 禤淑霞, 龙传南, 等. 纤维素降解菌L-06的筛选、鉴定及其产酶条件的分析. 生物工程学报, 2008, 24(6): 1112–1116.
[24] Akbarzadeh A, Siadat SOR, Motallebi M, et al. Characterization and high level expression of acidic endoglucanase in. Appl Biochem Biotechnol, 2014, 172(4): 2253–2265.
[25] Potvin G, Ahmad A, Zhang ZS. Bioprocess engineering aspects of heterologous protein production in: a review. Biochem Eng J, 2012, 64: 91–105.
[26] Mellitzer A, Weis R, Glieder A, et al. Expression of lignocellulolytic enzymes in. Microb Cell Fact, 2012, 11: 61.
[27] Culbertson A, Jin MJ, Sousa LDC, et al. In-house cellulase production from AFEXTMpretreated corn stover usingRUT C-30. RSC Adv, 2013, 3(48): 25960–25969.
[28] Ahamed A, Vermette P. Culture-based strategies to enhance cellulase enzyme production fromRUT-C30 in bioreactor culture conditions. Biochem Eng J, 2008, 40(3): 399–407.
[29] Li H. Gene clone and high-cell-density expression of endoglucanase Ⅱ in. Sun Yatsen Univ Forum, 2007, 27(11): 370–373 (in Chinese). 李红. 内切纤维素酶EG Ⅱ基因克隆及其在毕赤酵母中高密度发酵表达.中山大学学报论丛, 2007, 27(11): 370–373.
(本文责编 陈宏宇)
Gene optimization and efficient expression ofCel5A in
Renhui Bai1,2, Yunbo Zhang1, Chundi Wang1, Feiyang Zhang3, Zhe Zhang3, Fubao Sun1, and Zhenyu Zhang1
1 Laboratory of Industrial Biotechnology of Department of Education, Jiangnan University, Wuxi 214122, Jiangsu, China;2 Jiangsu Key Laboratory of Biomass-based Green Fuels and Chemicals, Nanjing Forestry University, Nanjing 210037, Jiangsu, China;3 State Key Laboratory of Motor Vehicle Biofuel Technology, Henan Tianguan Group Co., Ltd, Nanyang 473000, Henan, China
Deficient activity of endo-1,4-beta-glucanaseII (Cel5A) secreted byis one of the challenges involved in effective cellulase saccharification of cellulosic substrates. Therefore, we expressed Cel5A inby constructing a recombinant strain. With the gene optimization based on codon bias, and the construction of expression vector pPIC9K-, the optimized gene was electro-transformed intoGS115 to form transformants. Then, a high Cel5A activity producing recombinant, namelyGS115-EG Ⅱ, was selected on G-418 resistant plates, followed by shake-flask cultivation. Enzyme characterization showed that the recombinant Cel5A reacted optimally at pH 4.5 and 60 ℃, with 50 kDa of molecular weight, preferentially degrading amorphous cellulose. Recombinant Cel5A was not significantly different from the nativeCel5A. Moreover, a shake-flask fermentation of the recombinant strain was optimized as below: incubation temperature 28 ℃, initial pH 5.0, inoculum volume 2%, methanol addition (per 24 h) 1.5% (/), sorbitol addition (per 24 h) 4 g/L and Tween 80 4 g/L. Under above optimized condition, the recombinant produced 24.0 U/mL of the Cel5A after 192 h fermentation. When incubated in a 5 L fermentation, Cel5A enzyme activity reached 270.9 U/mL at 180 h, with 4.16 g/L of the total protein. The study indicates that the recombinant strainGS115-EG Ⅱ is extremely suitable for heterologous expression ofcellulase Cel5A. And the recombinant Cel5A can be used as an alternative to the nativeCel5A in development of a commercially relevant enzyme based biorefinery process.
GS115-EG Ⅱ,Cel5A gene, AOX1 promoters, codon bias, fermentation optimization, CMC enzyme activity
January 9, 2016; Accepted: March 4, 2016
Fubao Sun. Tel/Fax: +86-510-85327026; E-mail: fubaosun@jiangnan.edu.cn
Supported by:National Natural Science Foundation of China (No. 21176106), State Key Laboratory of Motor Vehicle Biofuel Technology (No. KFKT2013010), China Postdoctoral Science Foundation (No. 2015M571666), Jiangsu Key Lab of Biomass-based Green Fuels and Chemicals (No. JSBGFC14006).
国家自然科学基金(No. 21176106),车用生物燃料技术国家重点实验室开放基金(No. KFKT2013010),中国博士后科学基金(No. 2015M571666),江苏省生物质绿色燃料与化学品重点实验室课题(No. JSBGFC14006) 资助。
