不同大体肿瘤体积纵轴外扩长度在食管鳞癌根治性放化疗中的疗效比较
2016-11-14郑华周雨霏廖希一李夷民
郑华 周雨霏 廖希一 李夷民
·临床研究与应用·
不同大体肿瘤体积纵轴外扩长度在食管鳞癌根治性放化疗中的疗效比较
郑华 周雨霏 廖希一 李夷民
目的:比较食管癌选择性淋巴结区域照射(elective node irradiation,ENI)基础上原发病灶大体靶区纵向外扩不同长度的生存差异,探讨食管鳞癌(esophageal squamous cell cancer,ESCC)临床靶区的优化。方法:回顾性分析2009年5月至2012年11月厦门大学附属第一医院行放化疗初治的ENI的ESCC患者。根据大体靶区纵向外扩长度不同分为纵向外扩范围≤3 cm组及>3 cm组,依次命名为临床肿瘤体积1组(clinical tumor volume of group1,CTV1)及临床肿瘤体积2组(clinical tumor volume of group 2,CTV2),比较不同纵向外扩长度的临床肿瘤体积(clinical tumor volume,CTV)分组的生存率及不良反应差异。结果:142例患者纳入研究,其中CTV1组81例,CTV2组61例,两组生存差异及不良反应的发生率差异均无统计学意义。结论:基于ENI的ESCC原发病灶纵向外扩3 cm形成的CTV照射后的生存率不低于GTV纵向外扩>3 cm的CTV照射。建议选择性淋巴结区域照射时GTV纵轴外扩≤3 cm。
食管肿瘤靶区勾画选择性淋巴结照射生存分析不良反应
食管癌的发病率位于世界肿瘤发病率的第8位,死亡率居第6位,其中超过90%病理类型为食管鳞癌(esophageal squamous cell carcinoma,ESCC)[1]。放射治疗是进展期ESCC的主要治疗手段。现代精确放疗对肿瘤靶区(gross tumor volume,GTV)及临床靶区(clinical tumor volume,CTV)的勾画提出更高的要求。然而,在ESCC的放化疗中,CTV包括食管原发病灶的临床靶区(CTV-T)及淋巴结引流区的临床靶区(CTV-N)。目前对食管CTV-T的定义中需要GTV沿食管外扩多少尚无统一标准,不同国家、不同医疗机构甚至不同的医生之间观点存在差异。RTOG 85-01试验中CTV的范围包括从锁骨区到食管胃交界处的淋巴结引流区的范围[2]。RTOG 94-05试验则推荐食管远近端各外扩5 cm及大体肿瘤(GTV)侧边外扩2 cm作为CTV[3],RTOG 0113临床试验中的CTV远近端外扩只有4 cm[4]。因此,缩小靶区可以减少照射的体积从而减少放射性肺炎等不良反应。然而,靶区缩小是否会导致局部复发率或生存率的下降目前仍存在争议。
本研究回顾性分析厦门大学附属第一医院近年来以不同的GTV纵向外扩形成的CTV照射食管癌患者的疗效,从而对食管癌根治性放射治疗中CTV的优化提供帮助。
1 材料与方法
1.1临床资料
回顾性分析2009年5月至2012年11月厦门大学附属第一医院放射治疗初治的病理确诊为ESCC且完成根治性放化疗疗程的患者142例。入组条件:1)自愿参加并书面签署知情同意书;2)年龄18~75岁,性别不限;3)组织学确诊为ESCC,初治(未手术、放疗、化疗和靶向治疗);4)具有生育能力的男性或女性在试验中愿意采取避孕措施;5)无严重的造血功能、心、肺、肝、肾功能异常和免疫缺陷;6)白细胞≥3×109/L;血红蛋白≥9 g/dL;中性粒细胞≥1.5×109/L;血小板≥100×109/L;总胆红素<1.5倍正常值上限;AST(SGOT)/ALT(SGPT)≤2.5倍正常值上限;肌酐≤1.5倍正常值上限;7)体力状况评分ECOG为0~2级;8)预期生存期>3个月。
1.2放射治疗和综合治疗模式
1.2.1放射治疗GTV-T为食管原发病灶,根据增强CT及PETCT所示的食管高代谢区域结合食道钡餐、食管内镜超声结果确定;GTV-N包括CT上显示的纵隔直径>0.5 cm的淋巴结和体检触诊可确定的转移淋巴结;CTV-T包括GTV-T并沿食管上下外扩3 cm(CTV1组)或>3 cm(CTV2组)。CTV-N的勾画:淋巴引流区分区标准根据AJCC癌症分期手册(第6版)[5],包括GTV-N并根据肿瘤所在部位勾画淋巴结引流区,对颈段及胸上段肿瘤淋巴结引流区包括双侧锁上、2区、4区、5区、7区、下界为气管隆突下3 cm;胸中段肿瘤淋巴结引流区包括2区、4区、5区、7区,下界以CTV-T下界为准;胸下段肿瘤引流区包括4区、5区、7区、胃左与贲门周围淋巴结区。PTV在GTV-T、GTV-N、CTV-T、CTV-N基础上各外放0.5 cm形成。处方剂量:GTV-T-P、GTV-N-P 60 Gy/30~33次(1.8~2.0Gy/次),每周5d照射,CTV-T-P、CTV-N-P总剂量为50 Gy/25~28次(1.8~2.0 Gy/次),要求95%的PTV接受>95%的处方剂量。
1.2.2化疗方案Ⅱ期及以上的患者接受以顺铂为基础的同步化疗(开始时间为放疗前1 d),化疗方案首选顺铂75 mg/m2(分3 d)+紫杉醇135 mg/m2(d1),28 d为1个周期行2个周期;若出现紫杉醇过敏则紫杉醇更换为5-FU 500 mg/m2×5 d(d1~d5),28 d为1个周期行2个周期。年龄≥70岁的患者未行同步化疗。
1.3随访
随访起始时间以开始治疗时间至随访截止时间,死于食管癌者为完全数据,无瘤生存、带瘤生存、死于放疗并发症及死于其他疾病者归为截尾数据,生存时间为治疗初始之日至死亡或随访截止的时间。治疗后2年内每3个月随诊1次,第3~5年每6个月随诊1次,复查内容包括每次复查胸部CT、食管钡餐、食管镜、腹部彩超,有骨疼痛者查全身骨扫描。随访截止至2015年4月1日,142例患者100%随访,中位随访时间31(2~55)个月。
1.4生存获益分析
总生存期(overall survival,OS)是指从开始治疗至因任何原因引起死亡的时间。当记录至死亡之前的失访患者,截止到最后一次有记录的、与患者接触的时间。对于在最后分析的时间点上仍然生存的患者,将以其最后一次的联系时间作为生存时间。
局部无进展生存期(local recurrent free survival,LRFS):患者在无明显肿瘤复发的情况下存活的时间。以照射野内原发病灶的出现作为进展的标准,进展的标志时间点为首次观察到可测定的照射野内原发病灶的日期。在有记录到照射野内疾病进展前就因其他任何原因死亡的患者,LRFS将定义为治疗开始之日起至死亡的时间。分析时仍未出现局部疾病进展或死亡(即局部无进展生存)的患者,将以最后一次肿瘤评估的时间作为终点。从基线期后就未进行过肿瘤评价的无进展生存患者,将以治疗第1天作为LRFS终点。
1.5统计学分析
应用SPSS 20.0软件进行统计学分析,计量资料的平均值和标准差以x±s表示。以Kaplan-Meier进行生存分析及Log rank检验生存的差别。采用χ2检验中Fisher精确概率法比较不良反应的发生率。检验水准α=0.05。
2 结果
2.1患者特征
病例基本特征见表1。所有病例均为鳞癌,两组病例T3、T4分期者比例均>70%。
3.1.2 信号源内部必须有内置电源,将220Vac交流电整流为直流电提供给芯片等内部元件。信号源其他部分器件的发热也会使电源工作在更高的温度,降低了电源的可靠性,容易造成基站设备损坏。
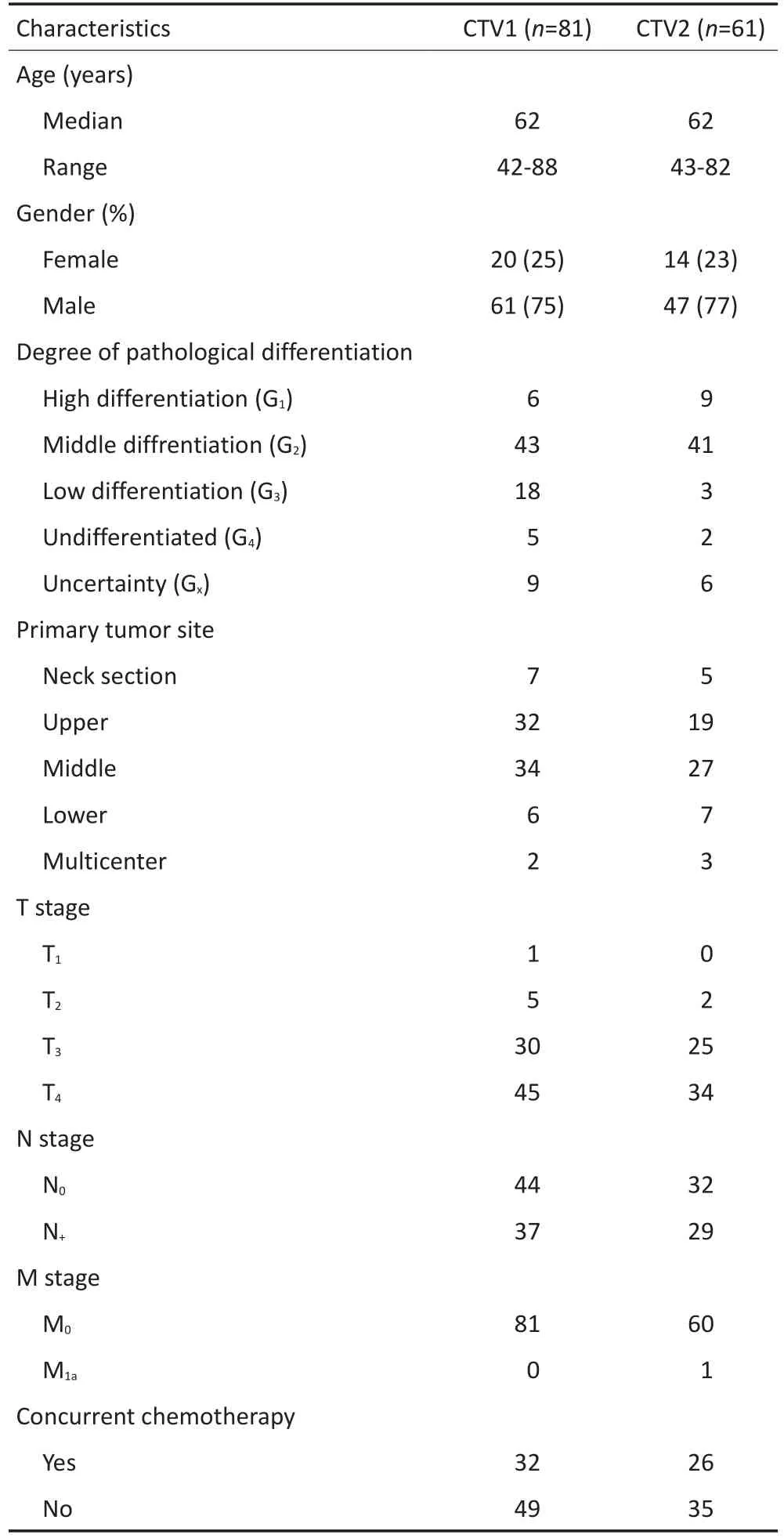
表1 根据不同CTV分组的患者基本特征Table 1Characteristics of patients in the two CTV groups
2.2生存分析
截止至随访时间,CTV1组81例中死亡50例,其1、3、5年OS分别为68%、41%、38%,CTV2组死亡37例,相应的OS分别为61%、43%、39%。对死亡病例中的死于局部复发的病例分析发现,CTV1组的1、3、5年LRFS分别为87.4%、24.4%、8.1%,CTV2组LRFS分别为88.8%、27.6%、7.9%。Kaplan-Meier生存分析和Log rank检验差异均无统计学意义(图1,2)。
2.3放化疗期间的不良反应情况
根据RTOG急性放射损伤分级标准及晚期放射损伤分级方案,≥3级的咽与食管、肺、血液学的放疗不良反应在两组中发生率均低于5%,两组中各发生1例食管瘘。Fisher概率比较差异无统计学意义(表2)。
2.4临床因素与疗效和预后的关系
采用Kaplan-Meier方法中的Log rank检验比较不同性别、年龄、原发病灶部位、病理分级、AJCC T分期等因素的总生存率的差异,发现除AJCC T分期外,差异均无统计学意义(表3)。
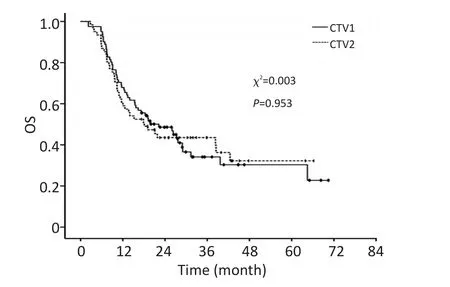
图1 CTV1与CTV2靶区分组的患者OS比较Figure 1The Kaplan-Meier survival probability analysis shows no significant statistical difference in the OS between CTV1 and CTV2 groups(log-rank test,P>0.05)
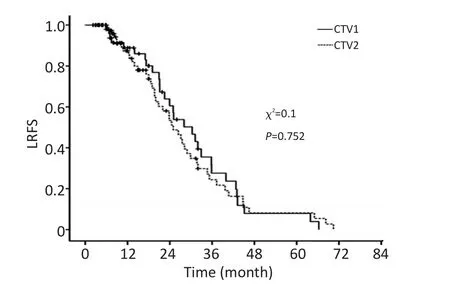
图2 CTV1与CTV2靶区分组的患者LRFS比较Figure 2The Kaplan-Meier survival probability analysis shows no significant statistical difference in LRFS between CTV1 and CTV2 groups(log-rank test,P>0.05)

表2 根据不同CTV分组的患者不良反应情况Table 2Incidence of radiotherapy side effects in the two CTV groups
2.5多因素分析
3 讨论
目前,食管癌的CTV的确定还远未获得共识。本研究结果显示,在根治性放化疗治疗食管癌时原发病灶沿GTV纵轴外扩3 cm与外扩>3 cm在总生存率、局部复发率的差异无统计学意义,>3 cm组的3级以上的放射不良反应略高,但差异无统计学意义。表明食管癌的放射治疗靶区中,原发病灶GTV沿食管纵轴外扩可以<3 cm,有利于进一步缩小食管癌的CTV并减少放疗的不良反应。
关于食管癌根治性放化疗中食管癌原发病灶GTV沿食管纵轴外扩多少现在仍无明确结论。根据术后病理学的研究结果,食管癌原发病灶的CTV由主瘤和次级肿瘤病灶构成,次级肿瘤病灶包括直接浸润、壁内转移、多中心起源病灶、脉管受侵、淋巴结微转移和孤立性瘤细胞等。Tsutsui等[7]对超过400例食管癌术后病理的研究数据显示,超过95%食管癌病变直接侵犯范围不超过30 mm。食管癌壁内转移、多中心起源等次级肿瘤病灶的发生率以及转移的距离目前仍难以明确并达成一致,有报道其最远可距原发肿瘤13 cm[8]。其中多中心起源的发生率可能与生活习惯、严重嗜烟酒、有上消化道肿瘤家族史等有关。此类患者应详细检查,必要时适当增加CTV的外扩。然而,根据既往的临床研究结果,大而全的照射野(包括全食管、全纵隔)并未提高食管癌的局部控制率和患者的生存率,反而会为患者带来不可耐受的毒性反应。临床上CTV外扩的范围必须要考虑到放疗的不良反应,在治疗肿瘤与治疗带来的不良反应之间做一个相对优化的选择。
由于扩大野照射未能获益,研究者开始考虑应用小野照射。Gao等[9]对ESCC亚临床病灶的病理对照研究似乎支持这一观点,94%ESCC亚临床病灶需要外放30 mm的距离。研究提示,较小外放范围是可以接受的,并不会提高局部失败的风险。Zhang等[10]回顾性分析80例行累及野照射(involved-field irradiation,IFI)照射的ESCC患者,中位随访56.2个月,野内复发、远处转移及野外复发率分别为53.75%、41.25%及30.00%。结果显示是否野内失败的中位OS差异(14.2 m vs.17.4 m,P=0.01)及是否发生远地转移的OS差异(13.2 m vs.15.9 m,P<0.000 1)差异具有统计学意义,但野外失败的OS差异无统计学意义,中位OS均为14.5 m P=0.665)。该研究结果表明,IFI照射后孤立的淋巴结失败是可以接受的,相对于ENI放射治疗来说,照射野内失败及远地转移仍然是影响生存的主要因素。Button等[11]回顾性分析接受根治性放化疗的食管癌患者145例,所有患者均行相同的亚临床病灶外放边界,即在腔内超声和(或)CT确定的原发病灶GTV上下方向外放2 cm,食管管周外放1 cm,不进行淋巴引流区预防性照射,照射剂量50 Gy/25次,5周内完成。结果显示,96%局部失败发生在照射野内。由此可见,食管癌放疗中沿食管病灶外扩3 cm形成的CTV放疗并不会降低患者的生存率。
食管癌的CTV除原发病灶的亚临床区(CTV-T)之外,还包括淋巴结预防的亚临床区(CTV-N)。食管的淋巴引流和淋巴结分布广,可位于颈部和上腹部之间的任何区域。然而这并不代表临床中需要进行全食管、全纵隔淋巴结引流区域照射。Huang等[12]对1 077例ESCC手术后淋巴结转移规律进行分析,结果显示胸上段食管癌下纵隔和腹腔淋巴结转移率均仅5.6%;胸中段及胸下段的淋巴结转移也主要发生在临近的淋巴结引流区。该研究建议在勾画淋巴结引流区时胸上段上界包括颈段食管旁和双侧锁骨上区淋巴结,向下包括气管隆突下淋巴结;胸下段上界包括气管隆突下淋巴结,下界包括胃左淋巴结和肝总动脉旁淋巴结;胸中段食管癌淋巴结预防照射区的确定应根据肿瘤位置,一般状况较好患者可以考虑较全面包括纵隔内淋巴引流区。然而,也有研究表明,仅包括受累淋巴结的IFI照射在部分ESCC患者的亚组中是可行的。Kawaguchi等[13]发现IFI在分期为Ⅰ期的胸段食管癌患者中,区域淋巴结的失败率并不高,对于接受根治性放疗的患者,研究采用三维适形放疗对食管癌不进行选择性淋巴结照射(elective node irradiation,ENI),结果发现单发的照射野外的淋巴结失败率仅2%~8%[13-15],并且发现在用ENI方式进行同步放化疗的病例中,至少50%以上的患者发生较严重的不良反应[3]。然而,董辉等[16]比较245例食管癌(鳞癌>93%)根治放疗中ENI与IFI后的失败模式中发现,接受ENI者126例,接受IFI者119例。分析放疗后的失败模式,结果全组患者出现放疗后失败163例,其中局部区域失败92例、单纯远处转移36例、区域失败伴远处转移35例。ENI与IFI放疗后1、3、5年总失败率不同,分别为35.4%、62.5%、69.0%与46.5%、71.5%、81.5%(P=0.036);1、3、5年局部区域失败率也不同,分别为29.9%、48.4%、50.0%与39.6%、62.1%、71.4%(P=0.003)。提示食管癌根治放疗时ENI可明显降低局部区域失败,进而改善长期生存。由于无Ⅲ期的临床试验结果支持IFI照射会改善生存并减少并发症,故本研究仍常规选择并推荐ENI作为淋巴结预防照射区域。
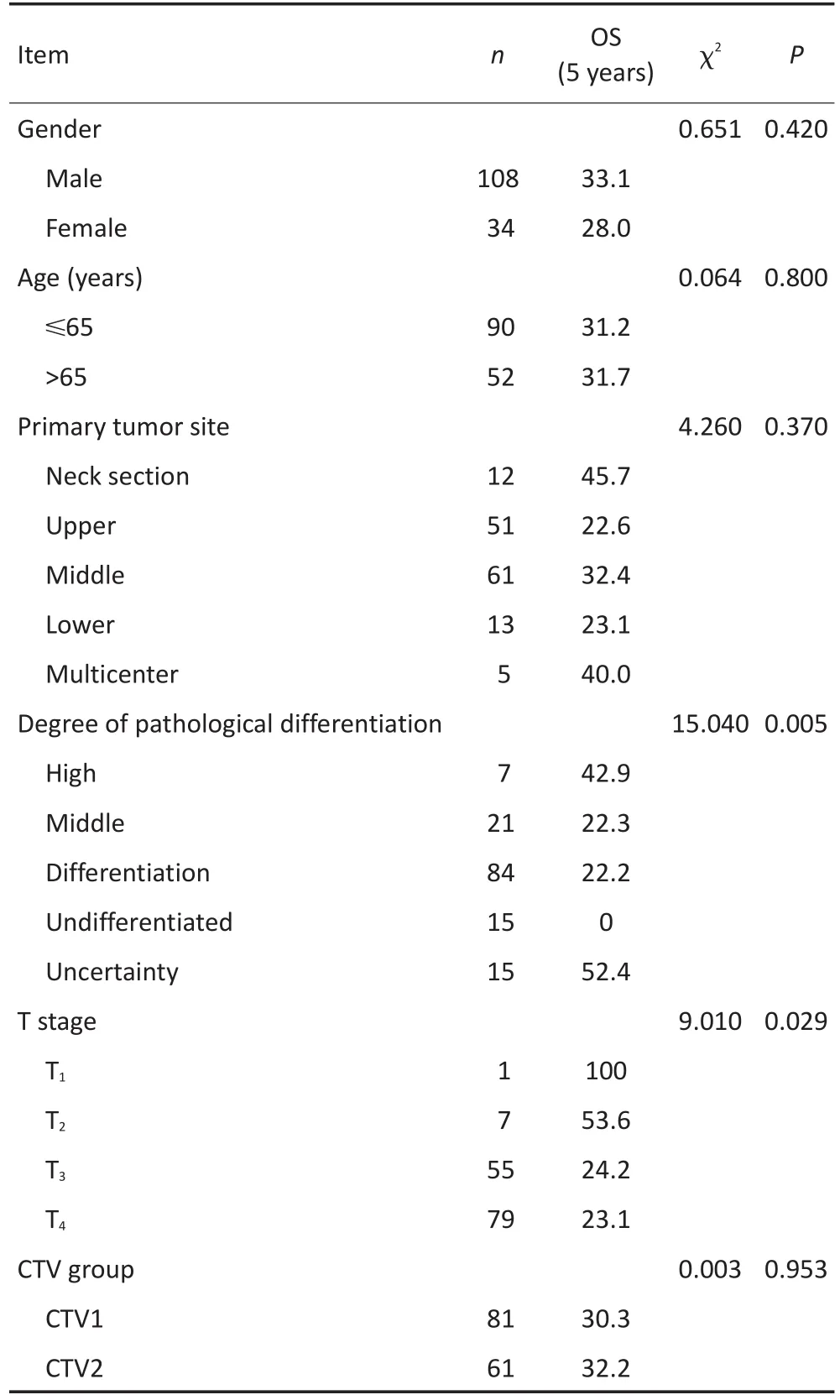
表3 Log rank检验部分临床资料对总生存的差异Table 3The difference between the clinical data on the overall survival by log-rank test
由于食管癌放疗后严重放射性肺炎等不良反应的发生率并不罕见,如果能进一步缩小靶区有可能减少这些并发症的发生概率。更精确的影像检查也缩小靶区,如PET-CT等新的影像技术在发现食管癌转移淋巴结方面可以比CT更早更敏感。Okada等[17]回顾性分析经过术后病理确诊的210例食管癌术后患者的淋巴结术前PET-CT的SUV值及静脉增强CT影像数据,发现PET-CT对淋巴结的阳性预测值高于静脉增强CT,Kato等[18]对167例行手术治疗的胸段ESCC的术前影像结果进行分析,发现PET-CT相对于单纯PET诊断颈部、上纵隔、腹腔淋巴结的敏感性较高。因此,本研究以PET-CT图像进行食管癌淋巴结转移病灶的判定可能是进行IFI照射进一步研究的方向。此外,由于新的化疗药物的不断问世,今后或许可以通过高效低毒的药物的发现,如奈达铂等达到对亚临床淋巴结引流区域进行预防治疗的目的从而减少放射治疗的靶区。
综上所述,本研究采用基于选择性淋巴结照射并沿食管纵轴外扩3 cm形成GTV-T构成的靶区在局部复发率及总生存率上并不高于GTV沿纵轴外扩>3 cm的靶区,且不良反应似乎有所减少。因此本研究认为GTV纵向外扩3 cm照射是可行的。由于食管癌淋巴结转移的规律性较弱,进行选择性淋巴结照射IFI时需慎重,应建立详细的对影像资料的分析并参考PET-CT影像的基础上个性化的实施。
[1]Kamangar F,Dores GM,Anderson WF.Patterns of cancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137-2150.
[2]Cooper JS,Guo MD,Herskovic A,et al.Chemoradiotherapy of locally advanced esophageal cancer:long-term follow-up of a prospective randomized trial(RTOG 85-01)[J].Radi Ther Oncol Group(JAMA),1999,281(17):1623-1627.
[3]Minsky BD,Pajak TF,Ginsberg RJ,et al.INT 0123(Radiation Therapy Oncology Group 94-05)phaseⅢtrial of combined-modality therapy for esophageal cancer:high-dose versus standard-dose radiation therapy[J].J Clin Oncol,2002,20(5):1167-1174.
[4]Ajani JA,Winter K.Komaki R,et al.PhaseⅡrandomized trial of two nonoperative regimens of induction chemotherapy followed by chemoradiation in patients with localized carcinoma of the esophagus:RTOG 0113[J].J Clin Oncol,2008,26(28):4551-4556.
[5]Greene FL,Sobin LH.The staging of cancer:a retrospective and prospective appraisal[J].CA Cancer J Clin,2008,58(3):180-190.
[6]Yin WB,Yu ZH,Xu GZ,et al.Radiation Ocology[M].4th,Beijing,Peking Union Medical College press,2008:558.[殷蔚伯,余子豪,徐国镇,等.主编.肿瘤放射治疗学[M].第4版,北京,中国协和医科大学出版社,2008:558.]
[7]Tsutsui S,Kuwano H,Watanabe M,et al.Resection margin for squamous cell carcinoma of the esophagus[J].Ann Surg,1995,222(2): 193-202.
[8]Nishimaki T,Suzuk T,Tanaka Y,et al.Intramural metastases from thoracic esophageal cancer:local indicators of advanced disease[J].World J Surg,1996,20(1):32-37.
[9]Gao X,Qiao X,Wu F,et al.Pathological analysis of clinical target volume margin for radiotherapy in patients with esophageal and gastroesophageal junction carcinoma[J].Int J Radiat Oncol Biol Phys,2007,67(2):389-396.
[10]Zhang X,M Li,Meng X,et al.Involved-field irradiation in definitive chemoradiotherapy for locally advanced esophageal squamous cell carcinoma[J].Radiat Oncol,2014,9:64.
[11]Button MR,Morgan CA,Croydon ES,et al.Study to determine adequate margins in radiotherapy planning for esophageal carcinoma by detailing patterns of recurrence after definitive chemoradiotherapy[J].Int J Radiat Oncol Biol Phys,2009,73(3):818-823.
[12]Huang W,Li B,Gong H,et al.Pattern of lymph node metastases and its implication in radiotherapeutic clinical target volume in patients with thoracic esophageal squamous cell carcinoma:A report of 1077 cases[J].Radio Oncol,2010,95(2):229-233.
[13]Kawaguchi Y,Nishiyama K,Miyagi K,et al.Patterns of failure associated with involved field radiotherapy in patients with clinical stageⅠthoracic esophageal cancer[J].Jpn J Clin Oncol,2011,41(8): 1007-1012.
[14]Welsh J,Settle SH,Amin Ai,et al.Failure patterns in patients with esophageal cancer treated with definitive chemoradiation[J].Cancer,2012,118(10):2632-2640.
[15]Zhao KL,Ma JB,Liu G,et al.Three-dimensional conformal radiation therapy for esophageal squamous cell carcinoma:is elective nodal irradiation necessary[J]?Int J Radiat Oncol Biol Phys,2010,76(2): 446-451.
[16]Dong H,Zhu SC,Su JW,et al.Failure modes of ENI and IFI in patients with esophageal carcinoma after radical radiotherapy[J]. Chin J Radia Oncol,2014,23(6):479-483.[董辉,祝淑钗,苏景伟,等.食管癌根治性放疗中ENI与IFI失败模式研究[J].中华放射肿瘤学杂志,2014,23(6):479-483.]
[17]Okada M,Murakami T,Kumano S,et al.Integrated FDG-PET/CT compared with intravenous contrast-enhanced CT for evaluation of metastatic regional lymph nodes in patients with resectable early stage esophageal cancer[J].Ann Nucl Med,2009,23(1):73-80.
[18]Kato H,Kimura H,Nakajima M,et al.The additional value of integrated PET/CT over PET in initial lymph node staging of esophageal cancer[J].Oncol Rep,2008,20(4):857-862.
(2016-06-27收稿)
(2016-09-13修回)
(编辑:周晓颖校对:孙喜佳)

郑华专业方向为恶性肿瘤的精确放疗。
E-mail:Zh600932@163.com
Efficacy comparison of different clinical target volume margins in the radical therapy of esophageal squamous cell carcinoma
Hua ZHENG,Yufei ZHOU,Xiyi LIAO,Yimin LI
Correspondence to:Yimin LI;E-mail:lym200528@126.com
Department of Radiotherapy,The First Affiliated Hospital of Xiamen University,Xiamen Cancer Hospital,The Quality Control Center of Radiotherapy in Xiamen City,Xiamen 316003,China
Objective:To compare the therapeutic effects by different longitude margins of the gross tumor volume(GTV)based on elective nodal irradiation(ENI)and to investigate the optimization of clinical tumor volume(CTV)in the radical chemoradiotherapy of esophageal squamous cell carcinoma(ESCC).Methods:ESCC patients treated with chemoradiotherapy for the first time in the First Affiliated Hospital of Xiamen University from May 2009 to November 2012 were retrospectively studied.All patients were treated with ENI for radical radiotherapy,and the patients were divided into two groups:CTV1 group(with longitudinal external expansion length of less than 3 cm)and CTV2 group(with longitudinal external expansion length of more than 3 cm).The survival time and occurrence of side effects in patients were compared.Results:Among the 142 cases of patients,82 and 61 cases were classified under CTV1 and CTV2,respectively.No significant difference in the overall survival(OS)and local recurrence-free survival(LRFS)rates was observed after 1,3,and 5 years of treatment between the two groups.The occurrence of side effects,such as bone marrow suppression,radiation pneumonitis,radiation esophagitis,and esophageal fistula,was less than 5%in both groups,and the data show that the side effect occurrence in CTV1 was significantly lower.Conclusion:In the radical chemoradiotherapy of esophageal cancer using ENI,the OS rate of patients with a delineated CTV according to a 3 cm GTV longitudinal external expansion length is not lower than that of patients with a delineated CTV according to a GTV longitudinal external expansion length of more than 3 cm.The results provide a reference for the optimization of CTV in the radical chemoradiotherapy of ESCC.
esophageal squamous cell carcinoma(ESCC),target delineation,elective nodal irradiation(ENI),survival analysis,side effects
10.3969/j.issn.1000-8179.2016.19.756
厦门大学附属第一医院,厦门市肿瘤医院放射治疗科,厦门市肿瘤放射治疗质控中心(福建省厦门市361003)
李夷民lym200528@126.com
