小分子免疫分析技术及其研究进展
2016-11-12邓省亮贺伟华江西省科学院微生物研究所江西南昌330096江西省农产品质量安全中心江西南昌330046
邓省亮,李 平,贺伟华(.江西省科学院微生物研究所,江西 南昌 330096;.江西省农产品质量安全中心,江西 南昌 330046)
小分子免疫分析技术及其研究进展
邓省亮1,李 平2,贺伟华1
(1.江西省科学院微生物研究所,江西 南昌 330096;2.江西省农产品质量安全中心,江西 南昌 330046)
小分子物质抗原表位单一,不能同时结合两个抗体,限制了夹心法在小分子残留检测中的应用,因此小分子免疫学分析方法主要采用竞争模式。近年来,随着生物合成全抗原、纳米抗体、抗独特型抗体等生物识别元件的成功应用,开拓了小分子免疫分析技术的新领域。本文从生物识别元件的角度综述了近几年小分子免疫学检测方法的研究进展,并对小分子免疫分析的发展趋势进行展望。
小分子物质;免疫分析;生物识别元件
近年来,小分子物质(诸如药物、激素、生物毒素、污染物等)残留所引发的一系列环境安全、食品安全事件已引起全社会的广泛关注,在小分子物质残留检测领域,免疫学检测技术以其操作简单、灵敏度高、能实现通量及现场检测等优点成为该领域的研究热点。免疫学检测方法可分为竞争和非竞争两种检测模式,非竞争检测模式中有足量抗体(一抗和酶标二抗)可供目标分析物结合,检测信号与分析物的含量成正相关。通常,较之竞争法,非竞争法具有更优的灵敏度、动力学参数、检测范围[1-2]。由于小分子物质分子质量小,仅有一个抗原决定簇,不能提供2 个或2 个以上表位与抗体结合,限制了传统夹心法在小分子物质免疫学检测中的应用。因此,小分子免疫检测主要以竞争法为主。由于基质中小分子目标分析物的残留量通常处于痕量级别,这对免疫分析方法的灵敏度及检测体系的稳定性提出了更高的要求。近年来,随着生物合成抗原、纳米抗体、抗独特型抗体等生物识别元件成功应用于小分子免疫检测,开拓了小分子免疫分析技术的新领域。本文综述了近年来国内外建立的小分子物质免疫分析的研究进展,并对其发展趋势进行初步展望。
1 生物合成抗原
小分子物质本身不具有免疫原性,因此建立小分子免疫学检测方法的关键是全抗原的合成。目前,小分子物质全抗原的合成主要通过化学合成的方法将活化的小分子与载体蛋白进行偶联,然而该方法存在合成步骤繁琐、副产物多、批次差异大等缺陷。
由于多肽分子具有蕴含信息丰富、分子构象特征明显及易被受体识别等特点,研究者们利用噬菌体展示肽库技术淘选可特异结合小分子单抗的多肽,并开展了将多肽作为小分子物质的替代物应用于免疫学检测的研究,但肽模拟物通常以噬菌体展示肽的形式作为竞争抗原[3-10],其作为固相生物识别元件的报道多集中于大分子物质检测领域(蛋白质、病毒、酶等)。此外,由于噬菌体本身作为生物有机体,稳定性不如普通生物试剂,因此不利于在实际检测中应用。最近,Liu Xing等[11]淘选随机环七肽库得到伏马毒素B1(fumonisin B1,FB1)的模拟表位,并进一步将合成后的多肽与牛血清白蛋白(bovine serum albumin,BSA)进行偶联作为包被原应用于间接竞争酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA),在玉米粉中的检测限为1.18 ng/mL。在此研究基础上,该课题组的Xu Yang等[12-13]将淘选肽库获取的抗原模拟表位的外源编码基因克隆至含有麦芽糖结合蛋白(maltose binding protein,MBP)的载体中,以模拟表位-融合蛋白的生物合成全抗原形式进行大量表达,构建了不以噬菌体为展示介质的新型模拟表位,并用于检测赭曲霉毒素A(ochratoxin A,OTA)和FB1,其中将OTA-MBP 作为包被原应用于化学发光ELISA和膜基质免疫分析法,其灵敏度与基于化学合成包被原(如OTA-偶联卵清蛋白)的检测方法灵敏度相似。而将FB1-MBP作为包被原应用于膜基质免疫分析法,阈值为2.5 ng/mL,相对于基于化学合成的包被原(如FB1-BSA)的检测方法,灵敏度提升了10 倍。生物合成抗原避免了化学合成途径所面临的多种缺陷,对于提升小分子物质免疫检测试剂的稳定性、可持续性生产及促进分析检测方法的标准化具有积极意义。此外,真菌毒素标准品价格昂贵,在一定程度上限制了免疫学检测的应用,生物合成抗原作为人工合成抗原的替代物可有效解决这一问题,并避免在免疫学检测过程中真菌毒素可能对检测人员和环境造成的毒害和污染。
2 纳米抗体
羊驼血液中存在天然缺失轻链的抗体,克隆其可变区得到只由一个重链可变区组成的单域抗体(variable domain of heavy chain of heavy-chain antibody,VHH),即为纳米抗体[14]。VHH由单一的基因编码,分子质量约15 kD,为普通抗体的十几分之一,其易通过酵母菌、大肠杆菌等原核表达系统进行大量制备,非常适于建立抗体库或通量筛选。VHH是自然存在的可与抗原结合的最小片段,这使它比普通的抗体分子更容易接近靶标表面的裂缝或者被隐藏的抗原表位,所以它可以识别很多普通抗体不能识别的抗原,尤为适于小分子物质的分子模拟[15]。此外,VHH还具有耐热、耐酸碱、耐有机试剂等特性[16]。
噬菌体展示肽库所具有的组成多样性、制备快捷、基因型与表型统一的特点非常适于作为生物识别元件应用于免疫学检测领域,通过构建VHH天然或免疫抗体库,再以相应小分子抗原为靶标进行亲和淘选,得到特异的噬菌体展示纳米抗体,通过DNA测序及翻译即可获得VHH抗体的氨基酸组成信息,经表达、纯化可以制备大量的特异VHH抗体。基于抗体库的VHH抗体已经应用于大量小分子间接竞争免疫学检测,包括药物、食品中的毒素、环境污染物等,如咖啡因[17]、三硝基甲苯[18]、3-羟基苯甲酸[19]、四溴化二苯醚[20]、15-乙酰脱氧雪腐镰刀菌烯醇[21]、赭曲霉毒素[22]、黄曲霉毒素[23]、四溴双酚A[24]。最近,Wang Jia等[25]将特异VHH抗体与碱性磷酸酶在大肠杆菌融合表达建立了一步竞争法用于检测四溴双酚A,提升灵敏度的同时减少了传统ELISA的反应步骤。Liu Xing等[26]在淘选VHH免疫抗体库得到特异噬菌体展示VHH抗体的基础上结合实时聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)用于检测赭曲霉毒素(图1),检测限达3.7×10-6ng/mL。在此研究基础上,Liu Xing等[27]将VHH抗体与碱性磷酸酶融合表达建立了直接竞争荧光免疫检测法,并应用于谷物检测,检测限达0.04 ng/mL。纳米抗体在小分子物质免疫检测领域的研究和应用较晚,但已成为新的研究热点,尤其是近年来涌现出的基于噬菌体展示肽库技术的研究和应用成果,显示出纳米抗体在该领域的巨大应用潜力。

图1 基于噬菌体纳米抗体的实时免疫PCR用于检测赭曲霉毒素A[26]Fig. 1 VHH-phage based real-time immuno-PCR for the detection of ochratoxin A[26]
3 抗独特型抗体

图2 2 α型、β型抗独特型抗体识别小分子抗体不同独特部位原理[34][34]Fig. 2 Schematic representation of how α-type and β-type antiidiotype antibodies (α-Ids and β-Ids) recognize their idiotopes on an anti-hapten antibody[34]
4 基于抗体片段的开放夹心式免疫检测法
开放夹心式免疫检测法(open sandwich immunoassay,OS-IA)是一种基于抗体可变区片段的非竞争免疫检测方法,其检测原理是游离的抗体可变区片段,即重链可变区片段(variable region of heavy chain,VH)和轻链可变区片段(variable region of light chain,VL)在加入相应的抗原后,VH与VL会提高它们间的相互结合的亲和力和稳定性。基于ELISA或phage-ELISA的检测原理见图3。OS-IA已经广泛应用于食品、环境等领域的多种小分子物质的残留检测[37-42],与竞争法相比,OS-IA在提升检测灵敏度的同时大大缩短了检测时间,既能应用于非均相又能应用于均相检测,具有非常广阔的应用前景。
Jerne[28]建立的“免疫网络学说”将抗体(antibody,Ab)分子可变区上的抗原决定簇称为独特型,独特型由若干表位组成,称为独特位。它可在异种、同种异体以及自身体内诱导产生相应的抗体,称为抗独特型抗体(anti-idiotype antibody,Id)。根据这一学说,机体在外界抗原的刺激下首先产生抗体Ab1,抗体Ab1上的独特位又刺激机体产生抗体Ab2,抗体Ab2上的独特位再刺激机体产生抗体Ab3,以此类推。因此,免疫网络也就可以被看成是由独特型和抗独特型形成的闭合型、多层次级联复杂网络。Ab1上不同的独特型决定位可刺激产生4 种不同类型的Ab2,即Ab2α、Ab2β、Ab2γ和Ab2ε。目前研究最多的是Ab2α和Ab2β,原理见图2。Ab2α是Abl中远离抗原结合部位的独特型决定簇产生的抗体,它能识别Abl上与骨架结构相关的独特位,Ab2α与Abl的结合不影响Abl再与产生Abl的抗原结合。Ab2β可识别Abl上与抗原互补的决定簇,能完全抑制抗原与Abl的结合,其可模拟抗原,产生与抗原相同的生物学效应,被称为外部抗原在机体免疫系统中的“内影像”。因此,Ab2β可作为小分子抗原的替代物(如剧毒毒素)应用于免疫学检测,既能有效保障实验操作人员安全,又能解决毒素标准品来源困难的问题,尤其噬菌体展示技术及纳米抗体在小分子免疫检测中的应用为抗独特型抗体的制备提供了新的选择[29]。Wang Yanru等[16]以抗黄曲霉毒素单抗免疫羊驼建立抗体库用于淘选特异的抗独特型VHH抗体,以其作为包被原替代化学合成的包被原建立间接竞争ELISA并应用于样品检测,检测结果与传统ELISA对照,相关性R2=0.89。Qiu Yulou等[30]应用相同的方法以抗独特型纳米抗体作为包被原建立异源性间接竞争ELISA检测脱氧雪腐镰刀菌烯醇,灵敏度是常规化学合成包被原检测方法的18 倍。Lei Jiawen等[31]将噬菌体展示抗独特型VHH抗体与RT-PCR相结合用于检测黄曲霉毒素,检测限达0.02 ng/mL。Xu Yang等[32]淘选天然VHH噬菌体抗体库获得抗独特型VHH抗体,并建立间接竞争噬菌体ELISA 检测桔霉素,灵敏度较传统ELISA提升了9 倍。Xu Yang等[33]进一步表达抗独特型VHH抗体,建立不依赖于噬菌体的间接竞争ELISA,灵敏度是传统ELISA的2 倍,并成功应用于谷物样品检测。
此外,当Ab2β与抗体结合形成复合物后,由于空间阻碍的存在,Ab2α不能结合Ab2β/Ab1复合物,基于此特性建立的非竞争免疫学检测方法已被应用于医疗诊断领域检测皮质醇[34]、11-脱氧皮质[35]、胆烷酸[36]等。然而,该方法的建立需同时制备3 种抗体(Ab1、Ab2α和Ab2β),其制备过程繁琐、成本高,需要进行大量筛选,且抗体分型鉴定、纯化难度很大,目前研究较少。

图3 基于ELISA或phage-ELISA的开放夹心免疫检测小分子物质原理[388--4422]]Fig. 3 ELISA or phage-ELISA based open-sandwich enzyme immunoassay for noncompetitive detection of hapten[38-42]
为了进一步提升检测方法的灵敏度,研究者们将OS-IA应用于多种检测体系。Ihara等[43]将OS-ELISA与微流控芯片系统相结合,建立了一种新快速的非竞争检测体系,称为micro OS-ELISA,用于检测骨钙素,检测限为1 ng/mL,分析时间只需要12 min。Minami等[44]将OS-ELISA与分子印迹技术结合,通过表面等离子共振传感器检测小分子的结合和解离过程。Dong Jinhua等[45]建立基于噬菌体的开放夹心式免疫PCR(open-sandwich immuno-PCR,OS-IPCR)检测骨钙素和17β-雌二醇,检测限分别达0.058 ng/mL和9.8 ng/mL。但DNA作为探针应用于immuno-PCR,加热提取噬菌体中DNA,方法的重现性一般,且噬菌体需新鲜制备,这些因素影响了OS-IPCR的实际应用。为了解决上述问题,Hasan等[46]建立了基于链霉亲和素(streptavidin,SA)的OS-IPCR用于检测骨钙素,包被MBP-VH,加入抗原、SA-VL及生物素化的DNA进行孵育,通过PCR以生物素化的DNA测定结合的SA-VL,实现对抗原的定量,检测限达1×10-4ng/mL。
OS-IA以其良好的检测性能成为小分子非竞争检测方法的热点,由于该方法的检测原理是基于抗原存在与否下的VH、VL强弱结合能力,因此其检测灵敏度主要取决于抗体的亲和力,即需要高亲和力的抗体。此外,需进一步减小方法的背景值,如通过定点突变技术减弱VH与塑性材料表面的非特异性结合、抗原不存在时VH和VL的非特异性结合来提升OS-IA的检测灵敏度[47]。
5 基于抗异型抗体的噬菌体抗免疫复合物检测法
抗异型抗体(anti-metatype antibody)是针对复合物中抗原与抗体之间形成的特定表位,即抗原与抗体结合而引起抗体活性位点发生构想改变而形成的位点而产生的[48]。抗异型抗体与小分子半抗原不会结合,与未结合小分子半抗原的抗体也基本不结合或结合力很差,基于这种特性若制备出此种抗体可建立小分子的非竞争免疫检测方法。但由于抗原和抗体结合后,大于85%的抗原表面积被包埋,只有极小部分与抗体形成异型表位,因此抗异型抗体的制备非常繁琐、困难[49]。而应用噬菌体展示肽库技术可有效解决上述难题,商业化肽库对于淘选抗异型抗体提供了非常便利的选择,淘选过程为:包被特异性单抗,加入目标小分子分析物与单抗结合,再加入肽库孵育,进行3~5 轮亲和淘选后得到基于噬菌体的抗免疫复合物多肽。基于此建立的噬菌体抗免疫复合物检测法(phage anti-immune complex assay,PHAIA)已经应用于多种小分子物质检测(检测基本原理见图4),如孔雀石绿[2]、异噁草松[50]、草达灭[49]、苯氧基苯甲酸[51]、溴联苯醚47[52]等,较之相应的竞争法,灵敏度均有较大提升。
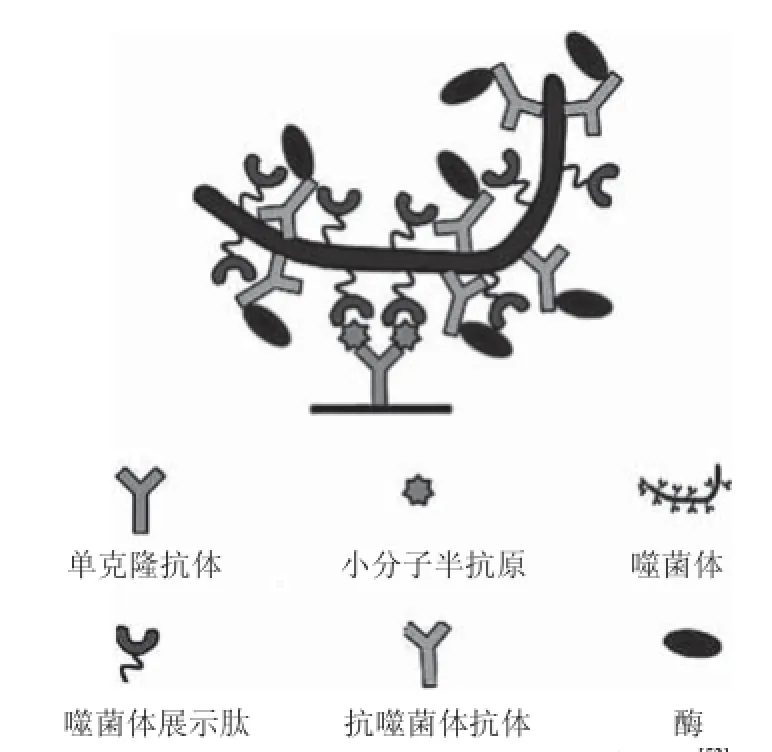
图4 噬菌体抗免疫复合物检测方法基本原理[[5522]]Fig. 4 Schematic diagram for phage anti-immune complex assay[52]
González-Techera等[53]将PHAIA与电化学免疫传感器相结合,建立一种新的噬菌体抗免疫复合物电化学免疫传感器检测方法用于检测莠去津,检测限达2×10-4ng/mL,灵敏度比相应的竞争ELISA提升了200倍。Kim等[51]将PHAIA与RT-PCR相结合用于检测3-苯氧基苯甲酸,检测限为6×10-2ng/mL,较之PHAIA,灵敏度提升了10 倍。为了进一步消除噬菌体作为生物有机体给实验带来的问题,Vanrell等[54]通过化学合成抗草达灭和广灭灵抗免疫复合物多肽(纳米肽适配子),建立了基于纳米肽适配子的非竞争检测法,用于检测草达灭和广灭灵,检测限分别达到1.2 ng/mL和3.2 ng/mL。Carlomagno等[55]合成抗异噁草松的纳米肽适配子,依据相同检测方法检测异噁草松,检测限为0.48 ng/mL。最近,Omi等[56]通过体外抗体制备体系(Autonomously Diversifying Library System)制备抗异型抗体,建立非竞争检测方法检测雌二醇和25-羟基维生素D,检测限分别达3.13×10-3ng/mL和2.1 ng/mL。噬菌体抗免疫复合物检测方法几乎能将所有的竞争ELISA转变为非竞争模式,并伴随了灵敏度的大幅提升。此外,与其他检测体系的联合应用,能有效提升小分子免疫分析方法的灵敏度。
6 展 望
小分子物质的免疫学快速检测技术在医学诊断、环境监测、食品安全控制等领域具有重大意义,亟须完善相应的检测技术手段来有效监控目标分析物的残留。然而,免疫学检测技术中仍有一些问题需要加以解决:如果目标小分子分析物是剧毒物,亟需找到相应的有效替代物来减少分析过程中对操作人员及环境的污染;化学合成全抗原(免疫抗原及检测抗原)带来的批间差异导致免疫分析法难以达到标准化;小分子物质非竞争免疫检测法的建立,我国还鲜有这方面的报道。针对以上问题,模拟表位肽及基于模拟表位肽的生物合成全抗原的应用能有效替代游离及偶联蛋白形式的小分子,而开放式夹心分析法及噬菌体抗免疫复合物分析法作为非竞争检测法开拓了小分子检测的新领域,是今后小分子免疫分析的主要发展方向,其中噬菌体抗体库技术因其能实现高通量筛选等优点被视为制备高亲和力抗体和抗免疫复合物抗体的有效途径,且基于分子改造技术进行抗体库的构建将使噬菌体展示技术不断用于优化特异性抗体的淘选。此外,除了从构建新型生物识别元件的角度来提高小分子免疫分析方法的灵敏度外,新型信号放大技术和多重信号放大技术的应用范围也越来越广泛,如纳米材料放大策略、酶标记放大策略、底物催化放大策略及底物循环放大策略,尤其是新型材料(量子点、荧光微球、纳米金、纳米磁珠、高分子材料等)与不同检测体系(如免疫传感器、免疫层析、免疫PCR等)之间的组合应用,从不同角度优化免疫学检测体系,实现高通量、高灵敏、多残留快速检测,将是今后小分子免疫分析方法发展的趋势。
[1] YAN Zhongdan, XIONG Ping, GAN Ning, et al. A novel sandwich-type noncompetitive immunoassay of diethylstilbestrol using β-cyclodextrin modified electrode and polymer-enzyme labels[J]. Journal of Electroanalytical Chemistry, 2015, 736: 30-37. DOI:10.1016/j.jelechem.2014.10.016.
[2] DONG Jiexiang, XU Chao, WANG Hong, et al. Enhanced sensitive immunoassay: noncompetitive phage anti-immune complex assay for the determination of malachite green and leucomalachite green[J]. Journal of Agricultural and Food Chemistry, 2014, 62(34): 8752-8758. DOI:10.1021/jf5019824.
[3] HUA Xiude, LIU Xiaofeng, SHI Haiyan, et al. Development of a heterologous enzyme-linked immunosorbent assay for organophosphorus pesticides with phage-borne peptide[J]. RSC Advances, 2014, 4(80): 42445-42453. DOI:10.1039/C4RA07059C.
[4] HE Zhenyun, HE Qinghua, XU Yang, et al. Ochratoxin A mimotope from second-generation peptide library and its application in immunoassay[J]. Analytical Chemistry, 2013, 85(21): 10304-10311. DOI:10.1021/ac402127t.
[5] WANG Yanru, WANG Hong, LI Peiwu, et al. Phage-displayed peptide that mimics aflatoxins and its application in immunoassay[J]. Journal of Agricultural and Food Chemistry, 2013, 61(10): 2426-2433. DOI:10.1021/jf4004048.
[6] WANG Jia, LIU Zhiping, LI G Q, et al. Simultaneous development of both competitive and noncompetitive immunoassays for 2,2’,4,4’-tetrabromodiphenyl ether using phage-displayed peptides[J]. Analytical and Bioanalytical Chemistry, 2013, 405(29): 9579-9583. DOI:10.1007/s00216-013-7364-5.
[7] HE Q H, XU Y, HUANG Y H, et al. Phage-displayed peptides that mimic zearalenone and its application in immunoassay[J]. Food Chemistry, 2011, 126(3): 1312-1315. DOI:10.1016/ j.foodchem.2010.11.085.
[8] LIU R R, YU Z, HE Q H, et al. An immunoassay for ochratoxin A without the mycotoxin[J]. Food Control, 2007, 18(7): 872-877. DOI:10.1016/j.foodcont.2006.05.002.
[9] SELLRIE F, SCHENK J A, BEHRSING O, et al. A competitive immunoassay to detect a hapten using an enzyme-labelled peptide mimotope as tracer[J]. Journal of Immunological Methods, 2002, 261(1/2): 141-144. DOI:10.1016/S0022-1759(01)00561-0.
[10] WANG Y, HU X F, PEI Y F, et al. Selection of phage-displayed minotopes of ochratoxin A and its detection in cereal by ELISA[J]. Analytical Methods, 2015, 7(5): 1849-1854. DOI:10.1039/ C4AY02290D.
[11] LIU X, XU Y, HE Q H, et al. Application of mimotope peptides of fumonisin B1in peptide ELISA[J]. Journal of Agricultural and Food Chemistry, 2013, 61(20): 4765-4770. DOI:10.1021/jf400056p.
[12] XU Y, HE Z Y, HE Q H, et al. Use of cloneable peptide-MBP fusion protein as a mimetic coating antigen in the standardized immunoassay for mycotoxin ochratoxin A[J]. Journal of Agricultural and Food Chemistry, 2014, 62(35): 8830-8836. DOI:10.1021/jf5028922.
[13] XU Y, CHEN B, HE Q H, et al. New approach for development of sensitive and environmentally friendly immunoassay for mycotoxin fumonisin B(1) based on using peptide-MBP fusion protein as substitute for coating antigen[J]. Analytical Chemistry, 2014, 86(16): 8433-8440. DOI:10.1021/ac502037w.
[14] HAMERS-CASTERMAN C, ATARHOUCH T, MUYLDERMANS S, et al. Naturally occurring antibodies devoid of light chains[J]. Nature, 1993, 363: 446-448. DOI:10.1038/363446a0.
[15] KOL S, KALLEHAUGE T B, ADEMA S, et al. Development of a VHH-based erythropoietin quantification assay[J]. Molecular Biotechnology, 2015, 57(8): 692-700. DOI:10.1007/s12033-015-9860-7.
[16] WANG Y R, LI P W, MAJKOVA Z, et al. Isolation of alpaca antiidiotypic heavy-chain single-domain antibody for the aflatoxin immunoassay[J]. Analytical Chemistry, 2013, 85(17): 8298-8303. DOI:10.1021/ac4015885.
[17] LADENSON R C, CRIMMINS D L, LANDT Y, et al. Isolation and characterization of a thermally stable recombinant anti-caffeine heavy-chain antibody fragment[J]. Analytical Chemistry, 2006, 78(13): 4501-4508. DOI:10.1021/ac058044j.
[18] ANDERSON G P, GOLDMAN E R. TNT detection using llama antibodies and a two-step competitive fluid array immunoassay[J]. Journal of Immunological Methods, 2008, 339(1): 47-54. DOI:10.1016/j.jim.2008.08.001.
[19] KIM H J, MCCOY M R, MAJKOVA Z, et al. Isolation of alpaca anti-hapten heavy chain single domain antibodies for development of sensitive immunoassay[J]. Analytical Chemistry, 2011, 84(2): 1165-1171. DOI:10.1021/ac2030255.
[20] BEVER C R, MAJKOVA Z, RADHAKRISHNAN R, et al. Development and utilization of camelid VHH antibodies from alpaca for 2,2’,4,4’-tetrabrominated diphenyl ether detection[J]. Analytical Chemistry, 2014, 86(15): 7875-7882. DOI:10.1021/ac501807j.
[21] DOYLE P J, ARBABI-GHAHROUDI M, GAUDETTE N, et al. Cloning, expression, and characterization of a single-domain antibody fragment with affinity for 15-acetyl-deoxynivalenol[J]. Molecular Immunology, 2008, 45(14): 3703-3713. DOI:10.1016/ j.molimm.2008.06.005.
[22] van HOUWELINGEN A, de SAEGER S, RUSANOVA T, et al. Generation of recombinant alpaca VHH antibody fragments for the detection of the mycotoxin ochratoxin A[J]. World Mycotoxin Journal, 2008, 1(4): 407-417. DOI:10.3920/WMJ2008.1070.
[23] HE T, WANG Y R, LI P W, et al. Nanobody-based enzyme immunoassay for aflatoxin in agro-products with high tolerance to cosolvent methanol[J]. Analytical Chemistry, 2014, 86(17): 8873-8880. DOI:10.1021/ac502390c.
[24] WANG J, BEVER C R, MAJKOVA Z, et al. Heterologous antigen selection of camelid heavy chain single domain antibodies against tetrabromobisphenol A[J]. Analytical Chemistry, 2014, 86(16): 8296-8302. DOI:10.1021/ac5017437.
[25] WANG J, MAJKOVA Z, BEVER C R, et al. One-step immunoassay for tetrabromobisphenol A using a camelid single domain antibodyalkaline phosphatase fusion protein[J]. Analytical Chemistry, 2015, 87(9): 4741-4748. DOI:10.1021/ac504735p.
[26] LIU X, XU Y, XIONG Y H, et al. VHH phage-based competitive realtime immuno-polymerase chain reaction for ultrasensitive detection of ochratoxin A in cereal[J]. Analytical Chemistry, 2014, 86(15): 7471-7477. DOI:10.1021/ac501202d.
[27] LIU X, XU Y, WANG D B, et al. Development of a nanobody-alkaline phosphatase fusion protein and its application in a highly sensitive direct competitive fluorescence enzyme immunoassay for detection of ochratoxin A in cereal[J]. Analytical Chemistry, 2015, 87(2): 1387-1394. DOI:10.1021/ac504305z.
[28] JERNE N K. Towards a network theory of the immune system[J]. Annales Dimmunologie, 1974, 125C(1/2): 373-389 .
[29] HE J, LIANG Y, FAN M T, et al. Preparation of anti-idiotype antibodies of O, O-dimethyl organophosphorus pesticides by phage display technology[J]. Chinese Journal of Analytical Chemistry, 2011, 39(2): 178-182. DOI:10.1016/S1872-2040(10)60415-X.
[30] QIU Y L, HE Q H, XU Y, et al. Deoxynivalenol-mimic nanobody isolated from a naïve phage display nanobody library and its application in immunoassay[J]. Analytica Chimica Acta, 2015, 887: 201-208. DOI:10.1016/j.aca.2015.06.033.
[31] LEI J W, LI P W, ZHANG Q, et al. Anti-idiotypic nanobody-phage based real-time immuno-PCR for detection of hepatocarcinogen aflatoxin in grains and feedstuffs[J]. Analytical Chemistry, 2014, 86(21): 10841-10846. DOI:10.1021/ac5029424.
[32] XU Y, XIONG L, LI Y P, et al. Citrinin detection using phagedisplayed anti-idiotypic single-domain antibody for antigen mimicry[J]. Food Chemistry, 2015, 177: 97-101. DOI:10.1016/ j.foodchem.2015.01.007.
[33] XU Y, XIONG L, LI Y P, et al. Anti-idiotypic nanobody as citrinin mimotope from a naive alpaca heavy chain single domain antibody library[J]. Analytical and Bioanalytical Chemistry, 2015, 407(18): 5333-5341. DOI:10.1007/s00216-015-8693-3.
[34] NIWA T, KOBAYASHI T, SUN P, et al. An enzyme-linked immunometric assay for cortisol based on idiotype-anti-idiotype reactions[J]. Analytica Chimica Acta, 2009, 638(1): 94-100. DOI:10.1016/j.aca.2009.02.010.
[35] KOBAYASHI N, IWAKAMI K, KOTOSHIBA S, et al. Immunoenzymometric assay for a small molecule, 11-deoxycortisol, with attomole-range sensitivity employing an scFv-enzyme fusion protein and anti-idiotype antibodies[J]. Analytical Chemistry, 2006, 78(7): 2244-2253. DOI:10.1021/ac051858f.
[36] KOBAYASHI N, KUBOTA K, OIWA H, et al. Idiotype-anti-idiotypebased noncompetitive enzyme-linked immunosorbent assay of ursodeoxycholic acid 7-N-acetylglucosaminides in human urine with subfemtomole range sensitivity[J]. Journal of Immunological Methods, 2003, 272(1): 1-10. DOI:10.1016/S0022-1759(02)00115-1.
[37] ISLAM K N, IHARA M, DONG J, et al. Direct construction of an open-sandwich enzyme immunoassay for one-step noncompetitive detection of thyroid hormone T4[J]. Analytical Chemistry, 2011, 83(3): 1008-1014. DOI:10.1021/ac102801r.
[38] HARA Y, DONG J, UEDA H. Open-sandwich immunoassay for sensitive and broad-range detection of a shellfish toxin gonyautoxin[J]. Analytica Chimica Acta, 2013, 793: 107-113. DOI:10.1016/ j.aca.2013.07.024.
[39] SHIRASU N, ONODERA T, NAGATOMO K, et al. Noncompetitive immunodetection of benzaldehyde by open sandwich ELISA[J]. Analytical Sciences, 2009, 25(9): 1095-1100. DOI:10.2116/ analsci.25.1095.
[40] IHARA M, SUZUKI T, KOBAYASHI N, et al. Open-sandwich enzyme immunoassay for one-step noncompetitive detection of corticosteroid 11-deoxycortisol[J]. Analytical Chemistry, 2009, 81(20): 8298-8304. DOI:10.1021/ac900700a.
[41] LIM S L, ICHINOSE H, SHINODA T, et al. Noncompetitive detection of low molecular weight peptides by open sandwich immunoassay[J]. Analytical Chemistry, 2007, 79(16): 6193-6200. DOI:10.1021/ ac070653z.
[42] LIU X B, EICHENBERGER M, FUJIOKA Y, et al. Improved detection sensitivity and selectivity attained by open-sandwich selection of an anti-estradiol antibody[J]. Analytical Sciences, 2012, 28(9): 861-867. DOI:10.2116/analsci.28.861.
[43] IHARA M, YOSHIKAWA A, WU Y, et al. Micro OS-ELISA: rapid noncompetitive detection of a small biomarker peptide by opensandwich enzyme-linked immunosorbent assay (OS-ELISA) integrated into microfluidic device[J]. Lab on a Chip, 2010, 10(1): 92-100. DOI:10.1039/B915516C.
[44] MINAMI K, IHARA M, KURODA S, et al. Open-sandwich molecular imprinting: making a recognition matrix with antigen-imprinted antibody fragments[J]. Bioconjugate Chemistry, 2012, 23(7): 1463-1469. DOI:10.1021/bc3000782.
[45] DONG J H, HASAN S, FUJIOKA Y, et al. Detection of small molecule diagnostic markers with phage-based open-sandwich immuno-PCR[J]. Journal of Immunological Methods, 2012, 377(1/2): 1-7. DOI:10.1016/j.jim.2012.01.005.
[46] HASAN S, DONG J, HARA Y, et al. Protein-based open sandwich immuno-PCR for sensitive detection of small biomarkers[J]. Analytical Sciences, 2013, 29(9): 871-876. DOI:10.2116/analsci.29.871.
[47] SAKATA T, IHARA M, MAKINO I, et al. Open sandwich-based immuno-transistor for label-free and noncompetitive detection of low molecular weight antigen[J]. Analytical Chemistry, 2009, 81(18): 7532-7537. DOI:10.1021/ac900457m.
[48] VOSS E W J, MIKLASZ S D, PETROSSIAN A, et al. Polyclonal antibodies specific for liganded active site (metatype) of a high affinity anti-hapten monoclonal antibody[J]. Molecular Immunology, 1988, 25(8): 751-759. DOI:10.1016/0161-5890(88)90111-3.
[49] GONZÁLEZ-TECHERA A, VANRELL L, LAST J A, et al. Phage anti-immune complex assay (PHAIA): a general strategy for noncompetitive immunodetection of small molecules[J]. Analytical Chemistry, 2007, 79(20): 7799-7806. DOI:10.1021/ac071323h.
[50] ROSSOTTI M, CARLOMAGNO M, GONZALEZ-TECHERA A, et al. Phage anti-immunocomplex assay for clomazone: two-site recognition increasing assay specificity and facilitating adaptation into an on-site format[J]. Analytical Chemistry, 2010, 82(21): 8838-8843. DOI:10.1021/ac101476f.
[51] KIM H J, McCOY M, GEE S J, et al. Noncompetitive phage antiimmunocomplex real-time polymerase chain reaction for sensitive detection of small molecules[J]. Analytical Chemistry, 2011, 83(1): 246-253. DOI:10.1021/ac102353z.
[52] KIM H J, ROSSOTTI M A, AHN K C, et al. Development of a noncompetitive phage anti-immunocomplex assay for brominated diphenyl ether 47[J]. Analytical Biochemistry, 2010, 401(1): 38-46. DOI:10.1016/j.ab.2010.01.040.
[53] GONZALEZ-TECHERA A, ZON M A, MOLINA P G, et al. Development of a highly sensitive noncompetitive electrochemical immunosensor for the detection of atrazine by phage antiimmunocomplex assay[J]. Biosensors & Bioelectronics, 2015, 64: 650-656. DOI:10.1016/j.bios.2014.09.046.
[54] VANRELL L, GONZALEZ-TECHERA A, HAMMOCK B D, et al. Nanopeptamers for the development of small-analyte lateral flow tests with a positive readout[J]. Analytical Chemistry, 2012, 85(2): 1177-1182. DOI:10.1021/ac3031114.
[55] CARLOMAGNO M, LASSABE G, ROSSOTTI M, et al. Recombinant streptavidin nanopeptamer anti-immunocomplex assay for noncompetitive detection of small analytes[J]. Analytical Chemistry, 2014, 86(20): 10467-10473. DOI:10.1021/ac503130v.
[56] OMI K, ANDO T, SAKYU T, et al. Noncompetitive immunoassay detection system for haptens on the basis of antimetatype antibodies[J]. Clinical Chemistry, 2015, 61(4): 627-635. DOI:10.1373/ clinchem.2014.232728.
Recent Advances in Immunoassays for Small Molecules
DENG Shengliang1, LI Ping2, HE Weihua1
(1. Institute of Microbiology, Jiangxi Academy of Sciences, Nanchang 330096, China; 2. Agricultural Products Quality and Safety Center of Jiangxi, Nanchang 330046, China)
The detection of small molecules mainly employs competitive immunoassay format due to their single epitopes that cannot be simultaneously recognized by two antibodies, which has limited the application of the sandwich immunoassay in the detection of small molecules. In recent years, the successful application of novel recognition receptors, such as biosynthetic antigen, nanobody, anti-idiotypic antibody, has opened up a new field of small molecule immunoassay technology. In this paper, an overview of the latest development and application of these approaches is presented from the perspective of recognition receptors. Furthermore, future development trend is also discussed.
small molecules; immunoassay; recognition receptor
10.7506/spkx1002-6630-201611048
TS207.3
A
1002-6630(2016)11-0277-06
邓省亮, 李平, 贺伟华. 小分子免疫分析技术及其研究进展[J]. 食品科学, 2016, 37(11): 277-282. DOI:10.7506/spkx1002-6630-201611048. http://www.spkx.net.cn
DENG Shengliang, LI Ping, HE Weihua. Recent advances in immunoassays for small molecules[J]. Food Science, 2016, 37(11): 277-282. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611048. http://www.spkx.net.cn
2015-08-27
江西省科技支撑计划项目(20141BBF60041;20121BBF60050);江西省科学院对外科技合作项目(H2014003);江西省科学院“省部共建国家重点实验室培育基地”计划项目(赣科院字[2013]19号-08);江西省科学院协同创新项目(2013-XTPH1-09)
邓省亮(1980—),男,副研究员,博士,研究方向为食品安全快速检测。E-mail:dslzdy@163.com
