荔枝蜜醋一步法发酵工艺
2016-11-12刘功良朱宝生陈华玲颜晓青白卫东仲恺农业工程学院轻工食品学院广东广州50225广州市广式传统食品加工与安全控制重点实验室广东广州50225
刘功良,朱宝生,陈华玲,颜晓青,白卫东(.仲恺农业工程学院轻工食品学院,广东 广州 50225;2.广州市广式传统食品加工与安全控制重点实验室,广东 广州 50225)
荔枝蜜醋一步法发酵工艺
刘功良1,2,朱宝生1,陈华玲1,颜晓青1,白卫东1,2
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.广州市广式传统食品加工与安全控制重点实验室,广东 广州 510225)
以荔枝蜜为原料,利用葡萄酒活性干酵母BV818和沪酿1.01醋酸菌发酵制备荔枝蜜醋,以总酸和总酯含量为考察指标,通过单因素和响应面试验设计,优化荔枝蜜醋的一步法发酵工艺。结果表明:最佳工艺条件为醋酸菌接种量8.0%、初始糖度310.0 g/L、初始酒精体积分数3.0%、荷花粉破壁上清液添加体积分数2.4%、初始pH4.0、葡萄酒高活性干酵母BV818的接种量0.3 g/L、培养温度29.5 ℃。经过14 d发酵,其总酸含量可以达到11.9 g/L,总酯含量可达2.9 g/L,酒精体积分数为2.0%,残糖含量172.1 g/L。在此最佳工艺条件生产的荔枝蜜醋醋味纯正,芳香清甜,风味柔和。
醋酸发酵;荔枝蜜醋;发酵工艺;响应面试验
荔枝蜜芳香清甜,含有人体所需的多种维生素和营养成分,是老少皆宜的天然保健食品。经现代医学研究证明,荔枝蜜所含的营养成分,具有美容养颜、补血、促进人体的消化吸收、增进食欲、镇静、安眠、提高人体免疫力等作用[1]。
荔枝蜜醋主要是以荔枝蜜或荔枝蜜酒为原料,通过微生物发酵酿制而成的,是现代生活不可缺少的保健品。荔枝蜜醋可抑制血糖升高、调节酸碱平衡、消除疲劳、防癌抗癌、降血脂、降胆固醇、美容护肤、延缓衰老等功能。传统荔枝蜜醋是荔枝蜜利用酵母菌进行酒精发酵,再用醋酸菌进行醋酸发酵[2]。但是这2 个生化过程需要各自不同的最佳发酵工艺条件,故导致传统酿醋方法具有周期长、工艺复杂等缺点。所以将酵母菌醋酸菌进行一步法发酵,使酒精和醋酸发酵混合进行,能够缩短发酵周期,节能省工,简化工艺设备,降低中间产物浓度过大等对生化反应产生的不良影响。
随着社会的发展,生活水平的提高,消费观念的改变,人们对保健醋的需求逐渐增加[3-7]。蜂蜜醋的发展也从分步发酵法转向一步发酵法,本研究利用荔枝蜜的特有风味酿造荔枝蜜醋,采用Design-Expert V8.0.5b响应面软件初步确立了荔枝蜜醋的生产工艺及其参数,以期为工业化生产荔枝蜜醋提供了技术支撑。
1 材料与方法
1.1 材料与菌种
荔枝蜜 广州蜂唛蜂业有限公司;荷花花粉 广州谭山蜂业有限公司。
葡萄酒高活性干酵母BV818 湖北安琪酵母有限公司;沪酿1.01醋酸菌 上海迪发酿造生物制品有限公司。
1.2 仪器与设备
JJ600精密电子天平 常熟双杰测试仪器厂;HWS12电子恒温水浴锅、DHP-9602恒温培养箱、DHG-9075A电热鼓风干燥箱 上海一恒科有限公司;PHS-25 pH测定仪 上海虹益仪器仪表有限公司;LX-C35L立式自动电热压力蒸汽灭菌锅 合肥华泰医疗设备有限公司;SW-CJ-IF超净工作台 上海博迅实业有限公司医疗设备厂;RHB32糖度计 石家庄泰斯特仪器设备有限公司;HZQ-C空气浴振荡器 哈尔滨市东明医疗仪器厂;0-40酒精比重计 余姚市方桥实验仪表厂;G716-3小型台式离心机 广州市正一有限公司;722-G可见光分光光度计 上海仪电分析仪器有限公司;JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 荔枝蜜醋生产工艺流程[8-10]
选取荔枝蜜于灭菌的器皿当中,经调配后,进行分装,于80 ℃灭菌25 min,待冷却至26~30 ℃,添加荷花粉破壁上清液和食用酒精,伴与已活化的酵母菌和醋酸菌进行发酵,发酵好的荔枝蜜再经75 ℃灭菌20 min,测定荔枝蜜发酵液的各项理化指标,再经过滤,制得成品。
1.4 操作要点
1.4.1 荔枝蜜的稀释
将荔枝蜜与水按照一定的比例配比,最终荔枝蜜液含糖量为250 g/L左右。
1.4.2 荷花粉破壁上清液制备
称取一定量的研磨后的荷花粉置于-18 ℃的冰箱中存放18~24 h,取出后迅速加入80 ℃的热水(料液比1∶7(m/V)),45 ℃水浴加热5 h,冷却至室温,超声波粉碎(20~25 kHz)处理10 min,3~4 mL的离心管分装,8 000 r/min离心5 min,取上清液于4 ℃冰箱中,保存备用。
1.4.3 酵母菌复水活化[11]
取葡萄酒高活性干酵母BV818,按1∶20(m/V)的比例投放于20 g/L的蔗糖水溶液中,并于35~40 ℃水浴条件下活化30 min,摇匀备用。
1.4.4 醋酸菌的活化及扩大培养[12-13]
醋酸菌的扩大培养为一级扩大培养和二级扩大培养。
一级扩大培养:挑取1~2 环新鲜的沪酿1.01醋酸菌斜面菌种接入到醋酸菌基础培养基中,29~30 ℃条件下振荡培养48 h。
二级扩大培养:将一级培养得到的菌种按10.0%的接种量接种到装有酒精体积分数为5.0%左右的基础培养基中,29~30 ℃条件下振荡培养48 h。
醋酸菌的基础培养基组成及配制方法如下:1%葡萄糖、1%酵母膏,用去离子水充分溶解,调整pH值至5.0,灭菌,冷却到60 ℃左右,加入4%无水乙醇。
1.4.5 酒精发酵及醋酸发酵
将荔枝蜜发酵液用8 层纱布紧塞封口后置于空气浴振荡器中,在转速150 r/min、培养温度29.5 ℃条件下进行酒精发酵及醋酸一步法发酵。在发酵期间,每隔2 d取下纱布,在超净工作台下换气,直到发酵结束[14]。
1.5 方法
1.5.1 发酵时间的确定[15-16]
将荔枝蜜液的酒精体积分数调整为5.0%,初始糖度调为250.0 g/L,按接种量10.0%接种沪酿1.01醋酸菌培养液,并使葡萄酒高活性干酵母BV818在发酵液中的质量浓度为0.3 g/L,添加荷花粉破壁上清液1.6%(V/V,下同),放置在29.5 ℃的恒温空气浴振荡器上进行醋酸发酵,每天测其总酸含量。
1.5.2 醋酸菌接种量对荔枝蜜醋发酵的影响[17]
用荔枝蜜调节发酵液的初始糖度为250.0 g/L,分别接种6.0%、8.0%、10.0%、12.0%、14.0%的沪酿1.01醋酸菌培养液,酵母菌添加量为0.3 g/L,荷花粉破壁上清液1.6%,初始酒精体积分数5.0%,8 层纱布封口,放置在29.5 ℃的恒温空气浴振荡器上培养14 d。发酵结束后,测其总酸含量及总酯含量。
1.5.3 初始糖度对荔枝蜜醋发酵的影响[18]
在最适醋酸菌接种量条件下,用荔枝蜜分别调节初始还原糖含量为220.0、250.0、280.0、310.0、340.0 g/L,酵母菌添加量为0.3 g/L,添加荷花粉破壁上清液1.6%,初始酒精体积分数调为5.0%(即接入5.0%的食用酒精),8 层纱布封口,放置在29.5 ℃的恒温空气浴振荡器上培养14 d。发酵结束后,测其总酸含量及总酯含量。
1.5.4 初始酒精体积分数对荔枝蜜醋发酵的影响
在最适初始糖度、接种量条件下,将荔枝蜜液的酒精体积分数分别调整为1.0%、3.0%、5.0%、7.0%、9.0%、11.0%,酵母菌添加量为0.3 g/L,添加荷花粉破壁上清液1.6%,8 层纱布封口,放置在29.5 ℃的恒温空气浴振荡器上培养14 d。发酵结束后,测其总酸含量及总酯含量。
1.5.5 荷花粉破壁上清液的添加量对荔枝蜜醋发酵的影响
在最适初始糖度、醋酸菌接种量、初始酒精体积分数条件下,酵母菌添加量为0.3 g/L,分别添加0.8%、1.2%、1.6%、2.0%、2.4%、2.8%的荷花粉破壁上清液,8 层纱布封口,放置在29.5 ℃的恒温空气浴振荡器上培养14 d。发酵结束后,测其总酸含量及总酯含量。
1.5.6 初始pH值对荔枝蜜醋发酵的影响[19-22]
在最适初始糖度、醋酸菌接种量、初始酒精体积分数、荷花粉破壁上清液的添加量条件下,酵母菌添加量为0.3 g/L,分别调节pH值为2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0,8 层纱布封口,放置在29.5 ℃的恒温空气浴振荡器上培养14 d。发酵结束后,测其总酸含量及总酯含量。
1.5.7 响应面试验设计及优化[23-24]
在单因素试验的基础上,选取醋酸菌接种量、荷花粉破壁上清液的添加量、初始酒精体积分数、初始糖度4 个因素的最优试验范围,进行响应面优化试验,以总酸和总酯含量为指标,研究最佳的荔枝蜜醋发酵工艺参数。
1.5.8 验证实验[25]
响应面试验的实际最优因素水平组合与理论最优因素水平组合之间存在差异。因此,将进行实际最优因素水平组合与理论最优因素水平组合之间的实验比较。
1.5.9 理化指标检测
pH值的测定:采用pH计法;酒精体积分数的测定:采用酒精比重计法;总酸测定:采用酸碱中和法;总糖测定:采用菲林法;总酯测定:采用电位滴定法[9]。
2 结果与分析
2.1 荔枝蜜醋发酵时间的确定
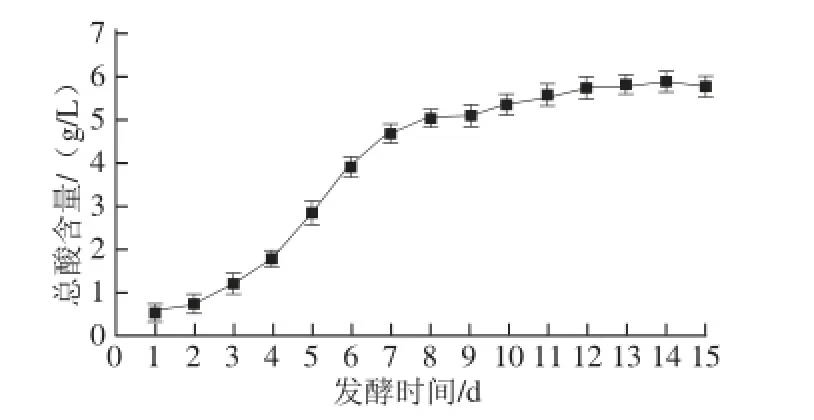
图1 发酵时间对荔枝蜜醋总酸含量的影响Fig. 1 Effect of fermentation time on total acid content in litchi honey vinegar
由图1可知,前4 d内总酸含量变化比较缓慢,为醋酸菌的繁殖和适应期。在4~11 d期间内,发酵液中的总酸含量上升迅速,在此阶段,酵母菌利用糖进行酒精发酵,产生大量酒精,而此时发酵液中的醋酸菌将酒精转换成醋酸,故总酸含量增加。11~14 d内总酸含量变化趋于平缓,为发酵后期,醋酸菌已将大部分酒精转换成了醋酸。15 d后,总酸含量有下降趋势。因此确定醋酸的发酵结束周期为14 d。
2.2 醋酸菌接种量对荔枝蜜醋发酵的影响

图2 不同醋酸菌接种量对荔枝蜜醋总酸和总酯含量的影响Fig. 2 Effect of inoculum amount on the content of total acids and total ester in litchi honey vinegar
由图2可知,接种量在8.0%时,荔枝蜜醋发酵生成的总酸含量最高,可达7.5 g/L,总酯含量却比较低,为0.9 g/L,分析其原因可能是这时候的接种量的醋酸菌消耗的酒精多,产酸高,酒精体积分数较低,此时,酸与醇的比例相差较大,所以产生的酯也就比较低。接种量在12.0%时,荔枝蜜醋发酵生成的总酸和总酯含量最低,可能是接种量过大时,基础营养物质消耗多,使营养物质不能满足菌体细胞的基本要求,引起细胞营养缺失,衰亡加快,且易发生自溶,消耗醋酸,从而导致总酸量和总酯量的下降,接种量过小时,荔枝蜜醋发酵速率慢,发酵不彻底,导致总酸量和总酯量的下降,生产成本高。由图可见,接种量在8.0%时,总酸最高,因此,确定荔枝蜜醋发酵的最适接种量为8.0%。
2.3 初始糖度对荔枝蜜醋发酵的影响
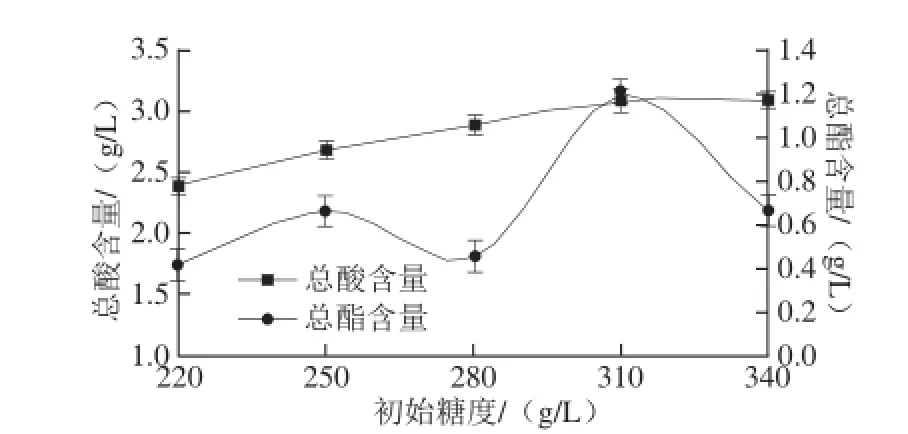
图3 初始糖度对荔枝蜜醋总酸和总酯含量的影响Fig. 3 Effect of initial sugar concentration on the contents of total acid and total ester in litchi honey vinegar
由图3可知,随着初始糖度的增加,荔枝蜜醋总酸含量也增加。当初始糖度在310.0 g/L时,总酸和总酯含量最高。超过310.0 g/L时,总酸及总酯含量均降低。分析其原因可能是,在一定的范围内,初始糖度越大,酵母菌利用糖进行发酵,转化成酒精,醋酸菌生长旺盛,将酒精转化成醋酸,总酸含量越大,而此时发酵液酒精体积分数较高,故生成的总酯含量较高。但超过一定的范围,可能会导致发酵液渗透压增大,使醋酸菌脱水,从而抑制了醋酸菌的生长繁殖。综合分析,初始糖度可调在310.0 g/L。
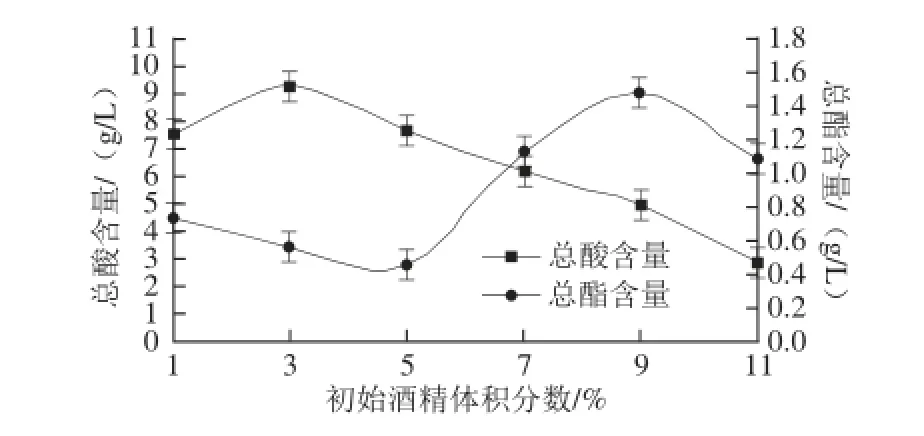
图4 不同酒精体积分数对荔枝蜜醋总酸和总酯含量的影响Fig. 4 Effect of alcohol concentration on the contents of total acids and total esters in litchi honey vinegar
2.4 初始酒精体积分数对荔枝蜜醋发酵的影响由图4可知,当初始酒精体积分数在3.0%时,产生的总酸含量最大,可达9.3 g/L,而总酯含量较低。当酒精体积分数小于3.0%时,随酒精体积分数的增加,产酸量增加,总酯含量较低;当酒精体积分数高于3.0%时,随着酒精体积分数的增加,总酸含量下降,总酯含量增加。分析其原因可能是当初始酒精体积分数在3.0%时,此时的发酵液酒精体积分数较低,产生的醋酸与酒精反应生成少量的酯,故总酯含量较低。而当初始酒精体积分数为9.0%时,总酸含量较低,但是此时测得发酵液的酒精体积分数高,造成总酯增加。综合以上分析结果,确定酒精体积分数3.0%为最佳初始酒精体积分数。
2.5 荷花粉破壁上清液的添加量对荔枝蜜醋发酵的影响
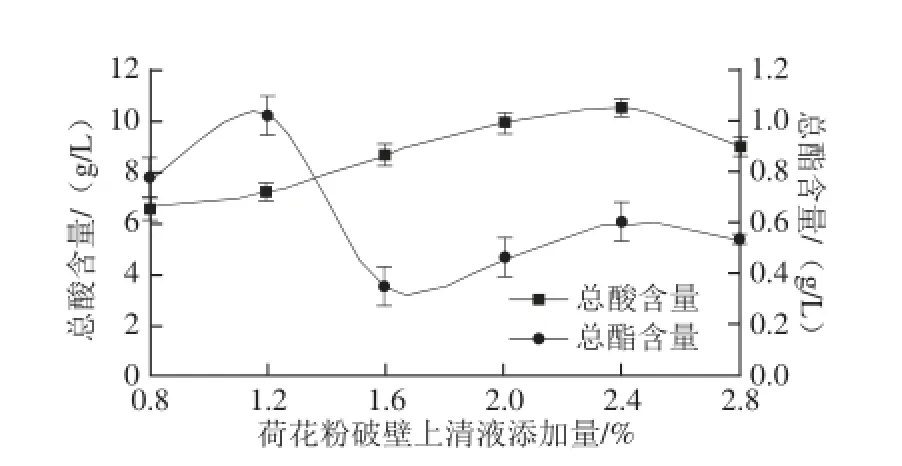
图5 不同荷花粉破壁上清液添加量对荔枝蜜醋总酸和总酯含量的影响Fig. 5 Effect of addition of supernatant from cell wall broken lotus pollen on the contents of total acid and total eater in litchi honey vinegar
由图5可知,随着荷花粉破壁上清液的添加量的增加,荔枝蜜醋中总酸含量也增加,而总酯含量先增加后减少。当荷花粉上清液添加量为2.4%时,荔枝蜜醋总酸含量达到最大,而总酯含量较低。分析其原因可能是这时候产酸高,酒精体积分数较低,此时,酸与醇的比例相差较大,所以产生的酯也就比较低。而荔枝蜜醋主要以总酸为衡量指标,综合考虑,选取2.4%荷花粉破壁上清液为最适添加量。
2.6 初始pH值对荔枝蜜醋发酵的影响

图6 不同初始pH值对荔枝蜜醋总酸和总酯含量的影响Fig. 6 Effect of initial pH on the contents of total acids and total eaters in litchi honey vinegar
由图6可知,初始pH值在4.0时,总酸含量最高,可达9.9 g/L,总酯含量最高,可达1.5 g/L。可见初始pH值对荔枝蜜醋发酵产生的酸和酯都有一定的影响。当pH值在4.0以下时,随着pH值的升高,总酸含量上升,总酯含量也有所上升,pH值在4.0以上时,总酸含量随着pH值的升高而下降,总酯含量也下降。偏酸或偏碱性时,醋酸菌细胞中某些酶的活性受到抑制,从而影响醋酸菌的生长繁殖和代谢,导致总酸量下降。综合以上分析,初始pH值可调在4.0。
2.7 响应面试验设计及优化
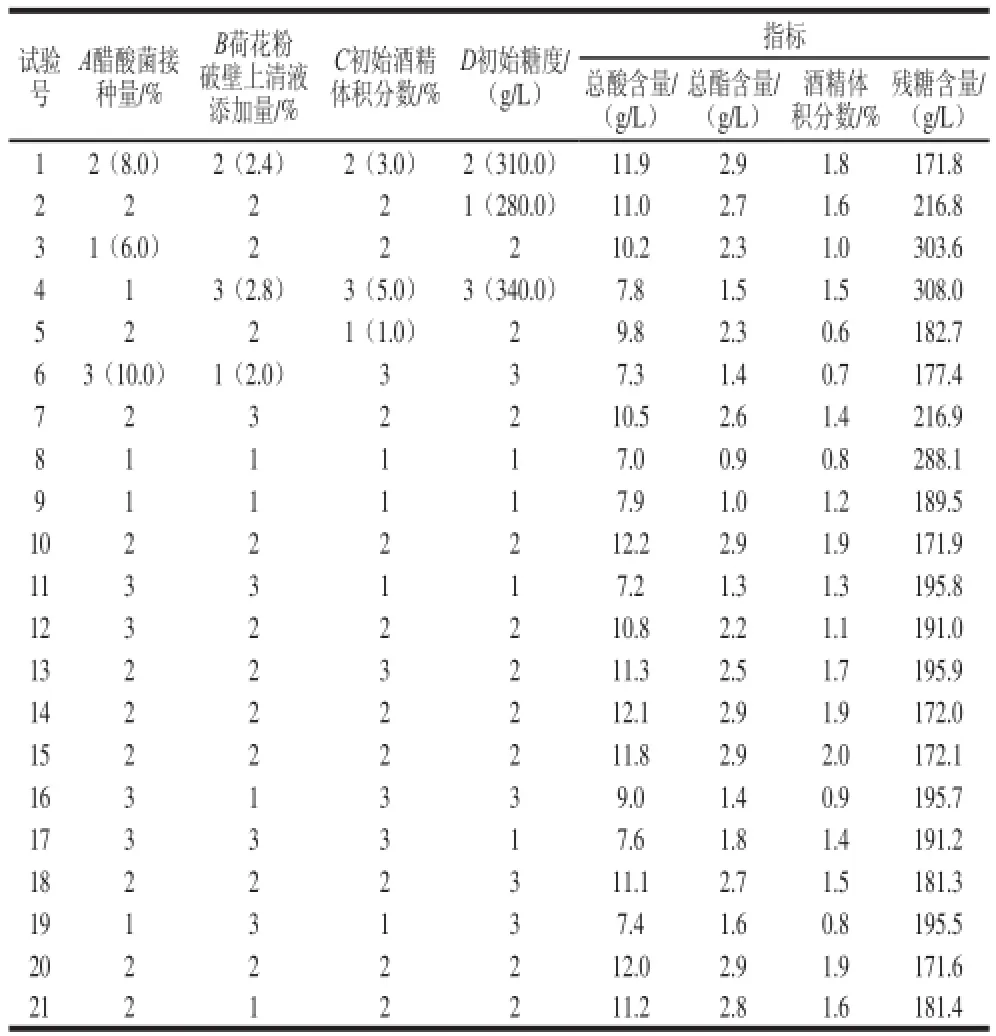
表1 响应面试验设计方案及结果Table 1 Experimental scheme and results for response surface analysis
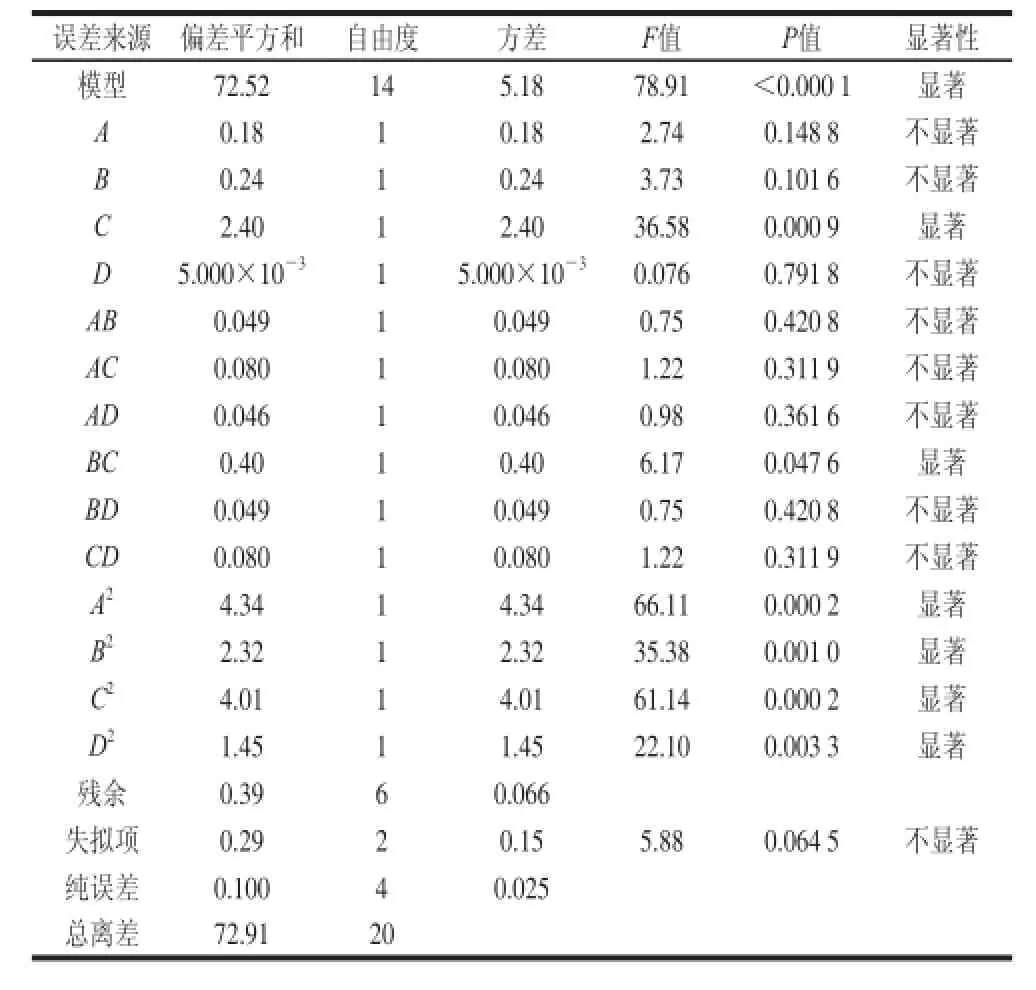
表2 总酸含量的方差分析Table 2 Analysis of variance for total acid content
响应面试验结果见表1。总酸含量的方差分析见表2,当P=“Prob>F”值小于0.05表明该项是显著的,据方差分析表分析得出,整体模型的显著性P<0.05,表明该二次方程高度显著,因此使用该方程模拟真实的四因素三水平的分析是可行的。失拟项不显著,说明在整个回归空间内拟合度较好。
对模型拟合度进行评价,拟合度为0.994 6,校正拟合度为0.982 0,预测拟合度为0.209 5,信噪比(RSN)为23.000。由结果可知,正决定系数R2=0.994 6>0.80和变异系数为0.21%,说明该模型只有0.54%的变异,能由该模型解释。进一步说明模型拟合优度较好,可用来对荔枝蜜醋工艺研究进行初步分析和预测。
通过Design-Expert软件进行二次响应面回归分析,得到多元二次响应面回归模型方程为:总酸含量/(g/L)=-128.461 57+6.848 62A+25.812 57B+2.084 07C+5.076 33D-0.218 75AB+0.025 00AC-0.033 33AD-0.281 25BC+0.145 83BD+0.016 67CD-0.325 96A2-5.961 39B2-0.313 46C2-0.083 75D2。
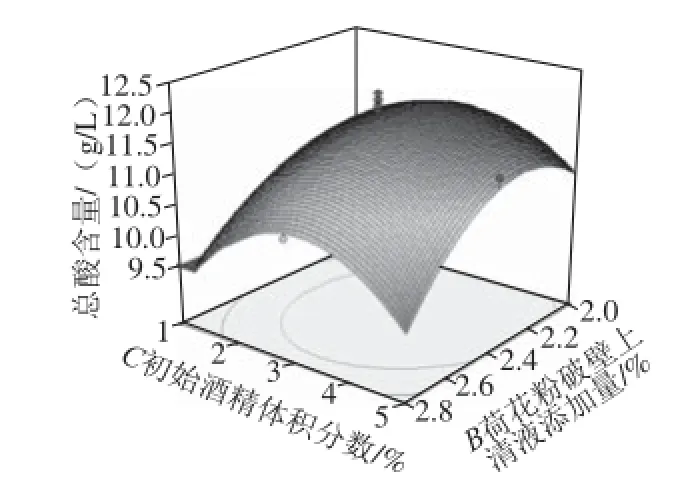
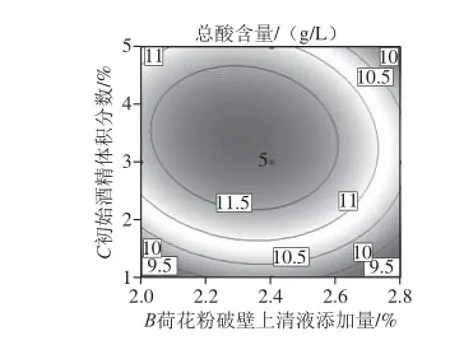
图7 荷花粉破壁上清液添加量及初始酒精体积分数对荔枝蜜醋总酸含量的影响Fig. 7 Effect of addition of supernatant from cell wall broken lotus pollen and initial alcohol concentration on total acid content of litchi honey vinegar
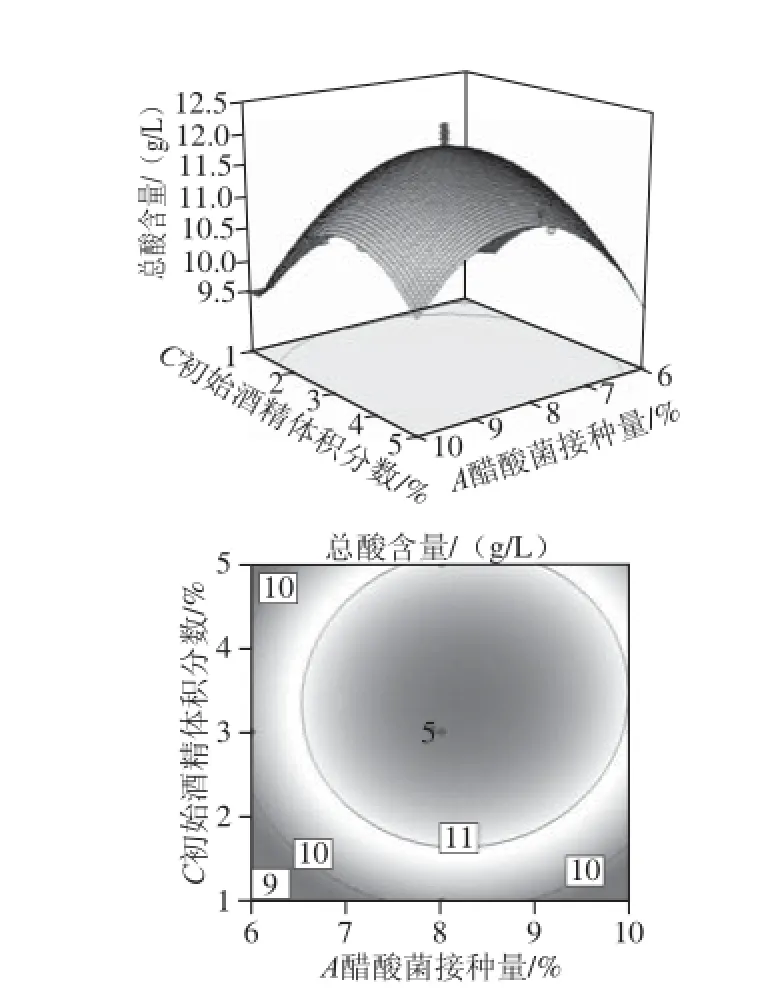
图8 醋酸菌接种量及初始酒精体积分数对荔枝蜜醋总酸含量的影响Fig. 8 Effect of inoculum amount and initial alcohol concentration on total acid content of litchi honey vinegar
响应面曲面图和等高线直观分析如图7、8所示,初始酒精体积分数和荷花粉上清液添加量的交互作用较大,而醋酸菌接种量与初始酒精体积分数的交互作用不大。因为等高线的形状反映交互效应的强弱大小,圆形表示两因素交互作用不显著,而椭圆形则相反。
采用响应面优化荔枝蜜醋的总酸含量,在单因素试验结果基础上,以醋酸菌接种量、荷花粉上清液添加量、初始酒精体积分数、初始糖度为试验因素,以总酸含量为响应值,得到总酸的三元二次数学回归模型。通过方差分析,4 个因素的影响的主次关系为初始酒精体积分数>荷花粉破壁上清液添加量>醋酸菌接种量>初始糖度。荔枝蜜醋的最优条件为:醋酸菌接种量8.0%、荷花粉上清液添加量2.4%、初始酒精体积分数3.0%、初始糖度310.0 g/L,在此条件下,总酸含量为11.9 g/L。
2.8 验证实验理论最佳因素与实际最佳因素的比较
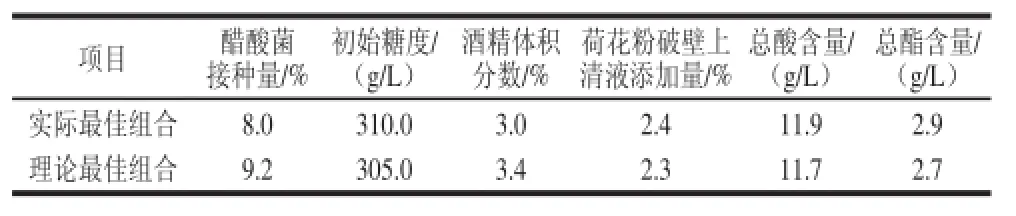
表3 理论最佳因素与实际最佳因素的比较Table 3 Comparison of actual and theoretical results under optimal fermentation conditions
由表3可知,在试验的进一步研究后得出实际最优因素水平组合的总酸含量和总酯含量较大,因此,以沪酿1.01醋酸菌接种量8.0%、初始糖度310.0 g/L、初始酒精体积分数3.0%、荷花粉破壁上清液添加量2.4%作为荔枝蜜醋一步法发酵的最优因素水平组合反应条件。并测得在此条件下的总酸含量为11.9 g/L,总酯含量为2.9 g/L。
3 结 论
以荔枝蜜为原料,酵母菌醋酸菌一步法发酵制备荔枝蜜醋,通过单因素和响应面试验设计,得出荔枝蜜醋的最佳发酵工艺条件为:以沪酿1.01作为发酵菌种,其接种量8.0%、初始糖度310.0 g/L、荷花粉破壁上清液添加量2.4%、初始酒精体积分数3.0%、初始pH 4.0、葡萄酒高活性干酵母BV818的接种量0.3 g/L、培养温度29.5 ℃。经过14 d的发酵,其总酸含量可以达到
11.9 g/L,总酯含量为2.9 g/L,酒精体积分数为2.0%,还原糖含量为172.1 g/L。以该工艺条件生产的荔枝蜜醋醋味纯正,芳香清甜,风味柔和。
[1] 林捷, 郑华, 周伟坚, 等. 超滤膜孔径对荔枝蜜加工特性的影响及营养分析[J]. 现代食品科技, 2009, 25(7): 741-744. DOI:10.3969/ j.issn.1673-9078.2009.07.007.
[2] 覃莉, 王志, 陈雄, 等. 酵母菌醋酸菌混菌发酵高产醋酸工艺研究[J]. 中国酿造, 2012, 31(1): 144-147. DOI:10.3969/ j.issn.0254-5071.2012.01.043.
[3] 张海涛, 刘新利. 苹果醋饮研制及氨基酸分析[J]. 山东轻工业学院学报(自然科学版), 2010, 24(1): 41-44. DOI:10.3969/ j.issn.1004-4280.2010.01.011.
[4] 李若彤. 蜂蜜醋酸饮料的研制[D]. 福建: 福建农林大学, 2011.
[5] MARTOS I, FERRERES F, YAO L, et al. Flavonoids in monospecifi c Eucalyptus honeys from Australia[J]. Journal of Agricultural and Food Chemistry, 2000, 48(10): 4744-4748.
[6] GHELDOF N, ENGESETH N J. Antioxidant capacity of honeys from various floral sources based on the determination of oxygen radical absorbance capacity and inhibition of in vitro lipoprotein oxidation inhuman serum samples[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 3050-3055.
[7] TAORMINA P J, NIEMIRA B A, BEUCHAT L R. Inhibition activity of honey against food-borne pathogens as infl uenced by the presence hydrogen peroxide and level of antioxident power[J]. International Journal of Food Microbiology, 2001, 69(3): 217-225. DOI:10.1016/ S0168-1605(01)00505-0.
[8] 王树林, 赵永华, 李宗文. 蜂蜜醋酸发酵饮料配方及工艺研究[J]. 食品科学, 2001, 22(2): 40-42. DOI:10.3321/ j.issn:1002-6630.2001.02.012.
[9] 徐龙江. 发酵工程原理与技术应用[M]. 北京: 化学工业出版社, 2012: 80-81.
[10] 高玉荣, 李大鹏, 陈丽红. 蜂蜜保健醋的研制[J]. 食品工业科技, 2001, 22(6): 52-53. DOI:10.3969/j.issn.1002-0306.2001.06.020.
[11] 马荣山, 郭丹. 蜂蜜果醋发酵工艺研究[J]. 中国调味品, 2009, 34(6): 54-55. DOI:10.3969/j.issn.1000-9953.2009.06.009.
[12] 赵春燕, 王鹏, 王淑琴, 等. 液态发酵食醋增香调色的研究[J]. 中国酿造, 2008, 27(19): 59-61. DOI:10.3969/ j.issn.0254-5071.2008.10.018.
[13] 周艳华, 李涛, 胡元斌. 富含γ-氨基丁酸苹果醋饮料的研制[J]. 粮食与饲料工业, 2013, 12(8): 25-28.
[14] 张丽珍. 山乌桕蜂蜜醋及其蜂蜜醋饮料的研制[J]. 中国食品学报, 2011, 11(4): 78-82. DOI:10.3969/j.issn.1009-7848.2011.04.011.
[15] GB/T 15038—2006 葡萄酒、果酒通用分析方法[S]. 北京: 中国标准出版社, 2006.
[16] MOLAN P C, BETTS J A. Clinical usage of honey as a wound dressing:an update[J]. Journal of Wound Care, 2004, 13(9): 353-356.
[17] 惠更平. 大麦芽红提姜果醋生产工艺研究[J]. 安徽农业科学, 2009, 36(44): 18151-18154. DOI:10.3969/j.issn.0517-6611.2009.36.118.
[18] 龚红菊, 党文新, 安秋. 甘蔗果醋加工工艺及最佳配方的研究[J]. 江西农业学报, 2011, 23(3): 140-142. DOI:10.3969/ j.issn.1001-8581.2011.03.043.
[19] 王玮. 海红果醋加工技术的研究[D]. 呼和浩特: 内蒙古农业大学, 2011.
[20] ILHA E C, SANT ANNA E, TORRE R C, et al. Utilization of bee(Apis mellifera) honey for vinegar production at laboratory seale[J]. Acta Cientifi ea Venezolana, 2001, 51(4): 231-235.
[21] 马超, 曾霞, 周天, 等. 荔枝酒发酵工艺的优化及风味成分的分析研究[J]. 食品研究与开发, 2013, 34(15): 43-46. DOI:10.3969/ j.issn.1005-6521.2013.15.012.
[22] 边金勇, 徐喜林, 杨国欣, 等. 荔枝发酵酒的研究[J]. 酿酒科技, 2006(5): 80-81. DOI:10.3969/j.issn.1001-9286.2006.05.021.
[23] 赵惠芳. 耐酸醋酸菌的选育及高酸度发酵果醋的研究[D]. 西安: 陕西科技大学, 2012.
[24] 朱林海, 胡启明, 胡利军, 等. 蜂蜜果醋发酵饮料生产工艺[J]. 饮料工业, 2003, 6(4): 39-40.
[25] 邹华. 一般最小低阶混杂准则下的正规2<’n-m>设计的造表和纯净效应搜索[D]. 天津: 南开大学, 2007.
One-Step Fermentation of Litchi Honey Vinegar
LIU Gongliang1,2, ZHU Baosheng1, CHEN Hualing1, YAN Xiaoqing1, BAI Weidong1,2
(1. College of Light Industry and Food, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China; 2. Key Laboratory of Traditional Cantonese Food Processing and Safety Control, Guangzhou 510225, China)
The optimization of fermentation conditions for the production of vinegar from litchi honey by one-step fermentation with active dry wine yeast (ADWY) and Acetobacter pasteurianus (Ap) CICC 20001 was implemented using one-factor-at-a-time method (OFAT) and response surface methodology (RSM). The contents of total acids and total esters were used as the responses. The optimal fermentation conditions were as follows: inoculum size of Ap, 8.0%; initial sugar concentration, 310.0 g/L; initial alcohol concentration, 3.0% (V/V); supernatant from cell wall broken lotus pollen, 2.4% (V/V); initial pH, 4.0; inoculum size of ADWY, 0.3 g/L; and culture temperature, 29.5 ℃. After fermentation for 14 days under these conditions, the vinegar obtained contained 11.9 g/L total acids, 2.9 g/L total esters and 2.0% (V/V) alcohol and 172.1 g/L the residual sugar, having a pure and soft vinegar fl avor, delicate fragrance and sweetness.
vinegar fermentation; litchi honey vinegar; fermentation process; response surface methodology (RSM)
10.7506/spkx1002-6630-201611024
TQ920.6
A
1002-6630(2016)11-0137-06
刘功良, 朱宝生, 陈华玲, 等. 荔枝蜜醋一步法发酵工艺[J]. 食品科学, 2016, 37(11): 137-142. DOI:10.7506/spkx1002-6630-201611024. http://www.spkx.net.cn
LIU Gongliang, ZHU Baosheng, CHEN Hualing, et al. One-step fermentation of litchi honey vinegar[J]. Food Science, 2016, 37(11): 137-142. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611024. http://www.spkx.net.cn
2015-10-26
广东省自然科学基金项目(2015A030313598);广东省高等学校优秀青年教师培养计划项目(YQ2015094);广东省省级科技计划项目(2013B020311019);广州市重大民生攻关专项(2012Y2-00015);广州市科技计划项目(201509010005);广东省普通高校特色创新项目(2015KTSCX068);国家级大学生创新创业训练计划项目(201311347001);广东省大学生创新创业训练计划项目(201411347056)
刘功良(1980—),男,副教授,博士,研究方向为发酵工程。E-mail:gongliangliu@126.com
