不同碱土金属氧化物掺杂对纳米二氧化铈催化性能的影响
2016-11-12李萍段慧娟
李萍,段慧娟
(1山西大学环境科学研究所,山西 太原 030006;2太原理工大学应用化学系,山西 太原 030024)
不同碱土金属氧化物掺杂对纳米二氧化铈催化性能的影响
李萍1,段慧娟2
(1山西大学环境科学研究所,山西 太原 030006;2太原理工大学应用化学系,山西 太原 030024)
通过水热法制备了平均粒径约为20nm的CeO2,并在纳米CeO2上引入不同浓度的3种碱土金属氧化物(MgO、CaO和BaO)。催化结果显示在用于催化二氧化碳和甲醇直接合成碳酸二甲酯(DMC)的反应中,此3种碱土金属氧化物均未对纳米CeO2的催化活性起到促进作用。此外通过透射电镜(TEM)、X射线衍射(XRD)、比表面积及孔分布测试(BET)、X射线光电子能谱(XPS)和程序升温吸附(TPD)对所制备的催化剂进行了表征。研究结果表明,少量的碱土金属氧化物的掺杂不会导致CeO2晶格变形,而是以无序的形式存在;且碱土金属氧化物的掺杂对纳米CeO2的形貌、尺寸和织构性质影响不大,对其表面的Ce(Ⅳ)/Ce(Ⅲ)和酸碱性位的数量以及强度有较大影响。此外,较高的Ce(Ⅳ)/Ce(Ⅲ)和较多的酸性位是影响纳米CeO2催化性能的重要因素。
纳米CeO2;碱土金属氧化物;掺杂;碳酸二甲酯
碳酸二甲酯(DMC)是一种重要的有机酸酯,是实现其他有机碳酸酯和聚碳酸酯非光气法绿色合成的基础原料[1],被誉为21世纪有机合成的“新基块”[2-3]。DMC可以代替光气作羰基化试剂,代替硫酸二甲酯(DMS)作甲基化试剂,还可以作清洁、安全的绿色无毒溶剂和无铅化及新配方汽油添加剂[3]。目前随着DMC应用领域的扩展,其需求量也日益增加。然而,由于目前合成DMC的方法存在着产量低、环境污染严重等问题,所以探索新的合成DMC的途径成为目前广大科学研究者的研究热点。
甲醇与CO2直接合成DMC的反应具有原子转化率高、反应物产物无毒的特点,且利用温室气体为原料、提高了煤化工下游产品的附加值,在环境保护和资源综合利用方面有着重大意义,因而备受瞩目[4]。利用CO2与甲醇直接合成DMC的关键是开发高活性的催化剂,促进CO2的活化,提高DMC的选择性和产率。目前已报道的催化剂主要有有机锡[5]、铜基催化剂[6]、金属氧化物[7-8]等。其中有机锡催化剂在催化过程中会形成低聚物进而降低催化活性[9];铜基催化剂的催化活性虽然高,但是易被氧化,储存不便,且铜基催化剂需要用氢还原,而还原后的催化剂含有毒性;金属氧化物则无需用氢还原,活性组分相对稳定,易贮存[10]。此外,金属氧化物如CeO2本身具有极好的储放氧功能和适当的酸碱性位,在COx、甲醇等分子的活化、吸附方面显示出较佳的效果,因而在很多氧化还原反应中被用于催化(助)剂。一些课题组[11-13]将铈锆固熔体用作催化剂催化甲醇和二氧化碳合成碳酸二甲酯,调整铈锆的比例,能够提高DMC的产率,且研究结果表明催化剂的酸碱性是影响催化活性的重要因素。LA等[14]以H3PW12O40/CexTi1-xO2为催化剂催化甲醇和二氧化碳合成碳酸二甲酯,认为其催化效果高于纯CeO2,这是因为H3PW12O40提供的Bronsted酸位和CexTi1-xO2提供的碱性位是其高催化活性的重要因素。ARESTA等[15-16]对比了反应前后发生失活的纳米二氧化铈,发现失活的催化剂中Ce(Ⅲ)明显增加,且在反应过程中甲醇转化成其他C1分子,因此在CeO2中引入杂原子,发现Al的引入可以改善CeO2的稳定性,提高CeO2的催化活性,对上述情况有所抑制。ABIMANYU等[17]将MgO-CeO2催化剂用于催化碳酸亚乙酯和甲醇酯交换合成碳酸二甲酯,研究结果显示,当Ce含量为25%时,DMC产率最高;表面碱度和碱分布是影响催化活性的重要因素。KANG等[18]将CeO2x-ZnO1-x用于催化甲醇和二氧化碳合成碳酸二甲酯,调整比例发现,由于CeO0.7-ZnO0.3含有大量的酸碱性位,其催化活性最好。
本文通过水热法制备了粒径约为20nm的CeO2,在CeO2上引入不同浓度的3种碱土金属氧化物(MgO、CaO和BaO),并且调整掺杂比例,将制得的催化剂用于催化甲醇和CO2合成DMC。
1 实验部分
1.1表征仪器
1.1.1透射电子显微镜(TEM)
采用JEM-2100F透射电镜,200kV下对铜网上的纳米CeO2(预先将纳米CeO2催化剂用玛瑙研钵研磨放进盛有无水乙醇的玻璃容器中,超声震荡40min,静置)进行形貌分析。条件:点分辨率≤0.23nm,线分辨率=0.14nm,HRTEM放大倍率为50万~150万倍。
1.1.2X射线衍射表征(XRD)
采用6000型X射线衍射仪(日本岛津)对催化剂的体相性质进行分析,检测条件:Cu靶,电压为40kV,电流为30.0mA,发散狭缝为1.0°,接收狭缝为0.3°,扫描范围2θ=20°~80°,扫描方式为连续扫描,扫描速度为8°/min,步宽为0.02°。
1.1.3比表面积及孔分布测试(BET)
在Tristar 3000自动吸附仪上使用低温液氮(77K)测定催化剂的比表面积、孔体积和孔径,催化剂在300℃下脱气预处理。
1.1.4X射线光电子能谱(XPS)
采用AXIS ULTRA DLD型X射线光电子能谱仪测定表面样品成分。X射线源是单色化Al靶,Kαhv=1486.6eV;样品分析区域为700µm×300µm;X射线工作功率为150W。
1.1.5程序升温化学吸附仪(TPD)
采用FINESORB-3010型全自动化学吸附仪(浙江泛泰仪器有限公司)进行 CO2/NH3的程序升温脱附实验。取样品量约0.1g,用20sccm氦气以20℃/min升温至200℃下吹扫样品50min进行预处理,然后降至0℃,化学吸附CO2/NH330min,再切换成氦气在50℃下吹扫15min,以除去催化剂表面的物理吸附;然后在20sccm 氦气气氛中以10℃/min的速率升温至550℃,用热导检测信号,最后降至室温。
1.2催化剂制备
(1)纯CeO2的制备 将6.5g的Ce(NO3)3·6H2O溶于少量蒸馏水中,在80℃不断搅拌的条件下滴加到适量的溶有少量CTAB的氨水中,继续搅拌30min,得到的悬浮液转移到水热釜中,在烘箱中373K保持24h。经洗涤,干燥后得到的Ce(OH)3前体。然后将以上前体在马弗炉中500℃焙烧2h,制得纯纳米CeO2催化剂。
(2)碱土金属氧化物掺杂的CeO2的制备 将上述方法制备的纳米CeO2分别与一定量的硝酸钙、硝酸镁和硝酸钡混合(调整混合比例为1∶0.05、1∶0.1、1∶0.2和1∶0.4),以乙醇为溶剂,超声8h后干燥,500℃焙烧2h。
1.3催化剂测试
称取0.50g催化剂放入反应釜(100mL)中,量取35mL甲醇置于釜内,盖上高压釜釜盖并拧紧。通入CO2吹扫,排净空气后一次性通入CO2到指定压力。最后在恒温磁力搅拌器上反应,反应温度140℃,搅拌速度600r/min,反应压力6.5MPa,反应时间3h。反应完毕后待反应釜体温度降至室温后,卸压打开釜盖。取上层清液10mL,量取40.0μL的异丁醇注入到上层清液中,超声震荡5min,静置,取上层清液进行气相色谱分析。色谱柱为PEG-20 M型毛细管柱(30m×0.32mm)。
2 结果与讨论
2.1催化活性
将纯CeO2和不同碱土金属氧化物在不同掺杂比例时的CeO2用于催化甲醇和CO2合成DMC,其产率如表1所示。

表1 不同种类催化剂的催化活性
如表1所示,以纯CeO2为催化剂催化甲醇和二氧化碳合成碳酸二甲酯时,产率达到0.8917 mmol/mmol。以MgO-CeO2为催化剂时,随着MgO含量的增加,DMC的产率逐步降低,当掺杂量为1∶0.05时,产率最高,达到0.6229 mmol/mmol,但是仍然低于纯CeO2的催化活性。以BaO-CeO2为催化剂时,随着BaO含量的增加,DMC产率逐步下降,当掺杂量为1∶0.05时,产率达到最高,为0.3620mmol/mmol,活性低于纯CeO2和MgO-CeO2。当以CaO-CeO2为催化剂时,随着CaO含量的增加,DMC产率先升高后下降,在掺杂比例为1∶0.1时,产率达到最高,为0.6321 mmol/mmol。可见,此3种掺杂型催化剂均未使得纳米CeO2催化活性得到提高。
2.2催化剂的结构表征
(1)TEM 图1为纯CeO2和不同碱土金属氧化物掺杂的CeO2(掺杂比例为1∶0.1)的TEM图片。通过软件分析测定发现粒径尺寸比较均匀,主要集中于15nm左右,形貌多为立方体,差别不大。
(2)XRD 纯CeO2和不同碱土金属氧化物掺杂的CeO2的XRD谱图如图2所示。可以看出,所有制备的催化剂均在(111)、(200)、(220)、(311)等晶面呈现较强衍射峰,该结构归属于立方萤石结构的CeO2。对比谱图发现并没有显著差别,没有额外的峰出现表明只有一种晶型。晶体结构表明只有Ce和O的位置,而没有其他碱土金属出现。然而如果碱土金属替代了Ce的位置,一定可以观察到严重的晶格变形,同时还伴随着电荷的不守恒[15-16]。因而认为碱土金属在CeO2晶格中无序存在。此外,通过谢乐公式计算得到CeO2、MgO-CeO2、CaO-CeO2和BaO-CeO2的粒径都是16nm;这就说明碱土金属氧化物的掺杂对纳米CeO2的粒径影响不大。

图1 CeO2和不同碱土金属氧化物掺杂的CeO2的TEM图片

图2 纯CeO2和不同碱土金属氧化物掺杂的CeO2的XRD图
(3)N2吸附 纯CeO2和不同碱土金属氧化物掺杂的CeO2的织构性质被表征(表2)。由表2可知,纯CeO2催化剂的比表面积(约为51m2/g)和孔体积(0.22cm3/g)略高于碱土金属掺杂的催化剂的比表面积(约为45m2/g)和孔体积(约为0.20cm3/g),而纯CeO2催化剂的平均孔径(约为16nm)则略微低于碱土金属氧化物掺杂催化剂的平均孔径(约为17nm),也就是碱土金属的加入导致了催化剂比表面积和孔体积的减小以及平均孔径的增加,且这种变化并不显著。这可能是因为少量碱土金属氧化物的掺杂堵塞了纳米CeO2的部分小孔,这与XRD结果中掺杂的碱土金属氧化物以无序形式存在相一致。对于一般的催化反应,较大的比表面积有助于反应物分子在其表面的高度分散,进而有利于催化反应的进行[19-20],所以纯CeO2的催化活性较高。
图3(a)为纯CeO2和不同碱土金属氧化物掺杂的CeO2的N2吸附平衡等温线。这4种样品均呈现Ⅳ型吸附平衡等温线,具有介孔特征。且氮气吸附量很少,表明制备的CeO2主要由纳米颗粒为主,大部分的孔主要是堆积孔。而图3(b)为相应的孔径分布图,孔径分布图相差不大,所有中孔都集中在20~30nm,且分布较窄。这就说明不同碱土金属掺杂对纳米二氧化铈的结构影响较小。
(4)XPS 图4为不同碱土金属掺杂的纳米CeO2的Ce3d谱图。
表2 纯CeO2和不同碱土金属氧化物掺杂的CeO2的结构性质

图3 纯CeO2和不同碱土金属掺杂的CeO2的N2吸脱附曲线和粒径分布
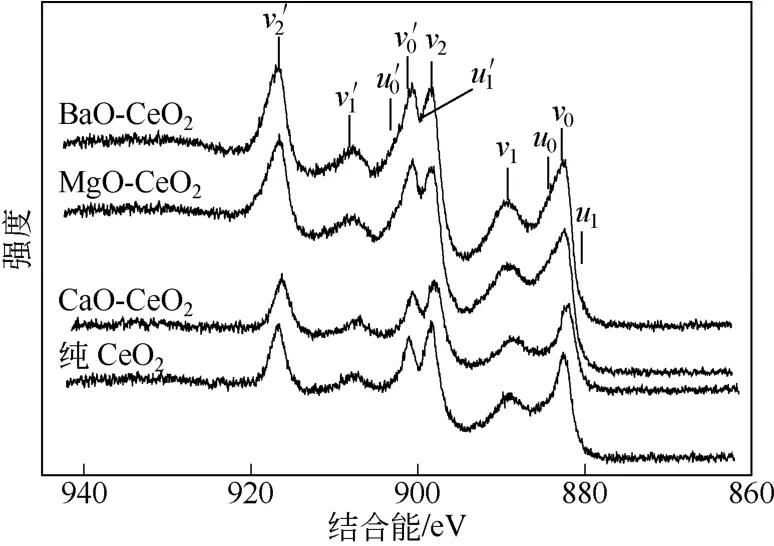
图4 不同碱土金属掺杂的纳米CeO2的Ce3d谱图
如图4所示,CeO2的Ce3d谱图中谱峰数量较多,这是由于CeO2极好的储放氧功能造成的[17]。由于Ce的3d3/2和3d5/2芯能级的自旋轨道分裂[17],图中3对峰(v2′,v2)、(v1′,v1)和(v0′,v0)分别对应Ce(IV)的不同终态:v2′(916.15eV)和v2(898eV)对应Ce 3d94f0O2p6,v1′(907.2eV)和v1(888.6eV)对应Ce3d94f1O2p5,v0′(900.7eV)和v0(882.3eV)对应3d94f2O2p4;另外两对峰(u0′,u0)和(u1′,u1)分别对应Ce(Ⅲ)的不同终态:u0′(903.9eV)和u0(885.2eV)对应于Ce 3d94f1O2p6,u1′(899.3eV)和u1(880.6eV)对应Ce 3d94f2O2p5。由于谱峰彼此重叠,因而很难区分图中Ce(Ⅳ)和Ce(Ⅲ)的峰。因此,根据文献[21]将谱峰曲线分别进行分峰拟合,进一步对制得的催化剂中Ce(Ⅳ)和Ce(Ⅲ)进行区分,分峰拟合图如图5所示。从图5中可以看出,钙掺杂的纳米CeO2和纯CeO2催化剂的谱峰强度相对较弱,而镁掺杂的纳米CeO2和钡掺杂的纳米CeO2则呈现较强的谱峰。Ce(Ⅳ)和Ce(Ⅲ)的比值列于表3中。由表3可知,不同碱土金属掺杂对纳米CeO2中Ce(Ⅳ)/Ce(Ⅲ)的比值有显著影响。金属镁和钡的掺杂会导致纳米CeO2中Ce(Ⅳ)/Ce(Ⅲ)的比值的下降,而钙的掺杂则可以使得四价铈的成分显著增加。此外,也计算了纳米CeO2与表面掺杂金属的比例,结果列于表3中。计算结果显示,在初始掺杂比相同的情况下,镁掺杂的纳米CeO2表面的掺杂金属含量极低,造成这种现象的原因应该是:硝酸镁的熔点是95℃,分解温度为330℃,本实验中分解温度为500℃,虽然使得硝酸镁完全分解,但同时也造成了硝酸镁升华损失,因而实际掺杂的结果远低于初始掺杂比例。钡掺杂的纳米CeO2表面的掺杂金属含量偏低的原因应该是:硝酸钡的熔点是592℃,在该温度之上硝酸钡才会发生分解,而本实验的焙烧温度仅有500℃,并没有达到硝酸钡的分解温度,因而催化剂为硝酸钡和纳米CeO2的混合物,这也可能是其催化活性过低的重要原因之一。相比而言,钙掺杂的纳米CeO2表面的掺杂金属含量较高,出现这种现象的原因则是:硝酸钙的熔点是561℃,分解温度为132℃,500℃的分解温度不会造成升华又能保证硝酸钙的完全溶解。

图5 不同碱土金属掺杂的纳米CeO2的Ce3d拟合图

表3 不同碱土金属掺杂的纳米CeO2的Ce(Ⅳ)/Ce(Ⅲ)和Ce/O
图6为不同碱土金属掺杂的纳米CeO2的O1s谱图。由图6可知,这4种样品的O1s谱图均由羟基氧和晶格氧组成。对比4种催化剂的O1s谱图,发现纯CeO2和CaO-CeO2的羟基氧的谱峰明显低于MgO-CeO2和BaO-CeO2。此外,不同的碱土金属也会导致CeO2的晶格氧的峰位发生偏移。对比显示,晶格氧的结合能由低到高依次是:CaO-CeO2、纯CeO2、MgO-CeO2和BaO-CeO2,这就表明不同的碱土金属掺杂会改变CeO2催化剂中晶格氧的化学环境,导致纳米CeO2催化剂中Ce(Ⅳ)成分依次减弱,进而验证了表3中由Ce3d谱图分峰拟合的Ce(Ⅳ)/Ce(Ⅲ)结果。此外,根据灵敏度因子和铈氧的峰面积,计算出来4种催化剂的Ce/O,计算结果列于表3中。如表3所示,Ce/O的比值升高的顺序与晶格氧的结合能升高的顺序正好相反。这与氧谱峰偏移和Ce(Ⅳ)/Ce(Ⅲ)的计算结果是一致的。
结合催化性能,发现在这4种催化剂中,随着四价铈成分的增加,催化活性增加,而钙掺杂和纯二氧化铈出现反常。其原因可由下面的TPD分析解释。此外,由于在本次实验中,3种硝酸盐的起始掺杂比虽然相同,但由于分解度和熔点的差异,实际催化剂中掺杂金属的含量有所区别,本文作者进而猜想当金属在纳米CeO2表面的掺杂量达到一定值时,其催化效果或许也有所提升。
(5)TPD 图7为纯CeO2和不同碱土金属氧化物掺杂的CeO2的TPD图。

图6 不同碱土金属掺杂的纳米CeO2的O1s谱图
由图7(a)可知,这4种催化剂的脱附峰主要出现在两个温度区间:350~450K和500~660K,这两个温度区间的碱性位分别对应弱碱性位和中强碱性位。对比弱碱性位发现,4种催化剂的峰面积基本相同,这也就表明其弱碱性位的数量变化不大;然而,也可以看出碱土金属掺杂的催化剂在389K处存在一个脱附峰,相比于纯CeO2,该脱附峰略微向低温处发生偏移,也就是说弱碱性位的强度略微减弱。对比中强碱性位发现,峰的位置和面积有明显变化。纯CeO2和CaO-CeO2均在614K处有一个脱附峰,而CeO2-MgO和BaO-CeO2在这一位置的脱附峰均向高温处偏移,表明其碱度变强。此外,CaO-CeO2和MgO-CeO2均在545K处存在一个脱附峰,纯CeO2不存在这个脱附峰,而BaO-CeO2在这一位置的脱附峰则向高温处偏移,表明其碱度变强。
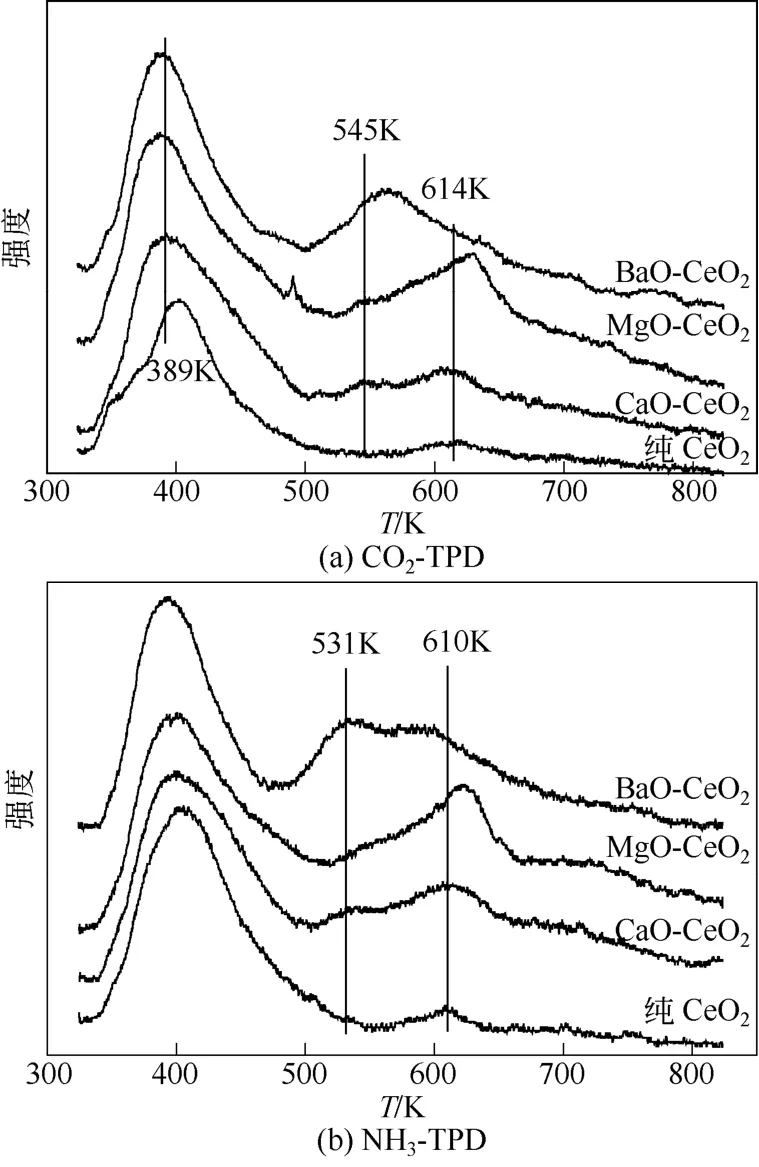
图7 纯CeO2和不同碱土金属掺杂的CeO2的CO2-TPD和NH3-TPD
由图7(b)可知,4种催化剂的脱附峰主要出现在两个温度区间,分别是350~500K和500~650K。这两个温度区间的酸性位分别对应弱酸性位和中强酸性位。对比弱酸性位发现,这4种催化剂的峰位置和峰面积变化不大,也就是说弱酸性位的强度和数量变化不大。对比中强酸性位发现,脱附峰的峰位置和峰面积都有明显区别。纯CeO2和CaO-CeO2均在610K处出现脱附峰,而MgO-CeO2在的脱附峰则明显向高温处偏移,表明其酸度增强,而BaO-CeO2则相反。CaO-CeO2和BaO-CeO2催化剂在531K处存在一个脱附峰,只是峰面积有所差别,而纯CeO2和MgO-CeO2则不存在这一脱附峰。
3 结 论
通过对比纯CeO2和碱土金属氧化物掺杂CeO2催化剂的催化活性发现,3种碱土金属氧化物(MgO、CaO和BaO)在以当前比例掺杂纳米CeO2制得的催化剂对纳米CeO2的催化活性并无促进作用。对催化剂的表征分析表明,少量的碱土金属氧化物的掺杂不会导致CeO2晶格变形,而是以无序形式存在。较高的Ce(Ⅳ)/Ce(Ⅲ)和较多的的碱性位是影响催化剂性能的重要因素。
[1] ONO Y. Dimethyl carbonate for environ mentally benign reactions[J]. Catal Today,1997,35(1/2):15-25.
[2] 赵艳敏,刘绍英,王公应,等. 尿素法合成碳酸二甲酯的研究进展[J]. 化工进展,2004,23(10):1049-1052.
[3] PACHECO M A,MARSHALL C L. Review of dimethyl carbonate(DMC) manufacture and its characteristics as a fuel additive[J]. Energy & Fuels,1997,11(1):2-29.
[4] 刘金聚,李凝,范细林,等. 掺杂物对负载型ZrO2/Al2O3的催化性能的影响[J]. 分子催化,2009,23(5):454-458.
[5] LAURENCZY G,PICQUET M,PLASSERAUD L. Di-n-butyltin(Ⅳ)-catalyzed dimethyl carbonate synthesis from carbon dioxide and methanol:an in situ high pressure119Sn{1H} NMR spectroscopic study[J]. Journal of Organometallic Chemistry,2011,696(9):1904-1909.
[6] NAM J K,CHOI M J,CHO D H,et al. The influence of support in the synthesis of dimethyl carbonate by Cu-based catalysts[J]. Journal of Molecular Catalysis A:Chemical,2013,370:7-13.
[7] WU X,KANG M,YIN Y,et al. Synthesis of dimethyl carbonate by urea alcoholysis over Zn/Al bi-functional catalysts[J]. Applied Catalysis A:General,2014,473:13-20.
[8] TOMISHIGE K,IKEDA Y,SAKAIHORI T,et al. Catalytic properties and structure of zirconia catalysts for direct synthesis of dimethyl carbonate from methanol and carbon dioxide[J]. Journal of Catalysis,2000,192(2):355-362.
[9] BALLIVET-TKATCHENKO D,CHAMBREY S,KEISKI R,et al. Direct synthesis of dimethyl carbonate with supercritical carbon dioxide:characterization of a key organotin oxide intermediate[J]. Catalysis Today,2006,115(1):80-87.
[10] ZHANG M,XIAO M,WANG S J,et al. Cerium oxide-based catalysts made by template-precipitation for the dimethyl carbonats synthesis from carbon dioxide and methanol[J]. Journal of Cleaner Production,2015,103:847-853.
[11] TOMISHIGE K,KUNIMORI K. Catalytic and direct synthesis of dimethyl carbonate starting from carbon dioxide using CeO2-ZrO2solid solution heterogeneous catalyst: effect of H2O removal from the reaction system[J]. Applied Catalysis A:General,2002,237(1):103-109.
[12] TOMISHIGE K,FURUSAWA Y,IKEDA Y,et al. CeO2-ZrO2solid solution catalyst for selective synthesis of dimethyl carbonate from methanol and carbon dioxide[J]. Catalysis Letters,2001,76(1/2):71-74.
[13] SEO E S,PARK N K,CHANG W C,et al. Direct synthesis ofdimethyl carbonate from methanol and carbon dioxide[J]. Journal-Korean Institue of Chemical Engineers,2002,40(1):9-15.
[14] LA K W,YOUN M H,CHUNG J S,et al. Synthesis of dimethyl carbonate from methanol and carbon dioxide by heteropolyacid/metal oxide catalysts[J]. Solid State Phenomena,2007,119:287-290.
[15] ARESTA M,DIBENEDETTO A,PASTORE C,et al. Cerium (Ⅳ)oxide modification by inclusion of a hetero-atom:a strategy for producing efficient and robust nano-catalysts for methanol carboxylation[J]. Catalysis Today,2008,137(1):125-131.
[16] ARESTA M,DIBENEDETTO A,PASTORE C,et al. Influence of Al2O3on the performance of CeO2used as catalyst in the direct carboxylation of methanol to dimethylcarbonate and the elucidation of the reaction mechanism[J]. Journal of Catalysis,2010,269(1):44-52.
[17] ABIMANYU H,KIM C S,AHN B S,et al. Synthesis of dimethyl carbonate by transesterification with various MgO-CeO2mixed oxide catalysts[J]. Catalysis Letters,2007,118(1/2):30-35.
[18] KANG K H,JOE W,LEE C H,et al. Direct synthesis of dimethyl carbonate from methanol and carbon dioxide over CeO2(x)-ZnO(1-x)nano-catalysts[J]. Journal of nanoscience and nanotechnology,2013,13(12):8116-8120.
[19] LI H F,ZHANG N,CHEN P,et al. High surface area Au/CeO2catalysts for low temperature formaldehyde oxidation[J]. Applied Catalysis B: Environmental,2011,110:279-285.
[20] ERDEM B,ERDEM S,ÖKSÜZOĞLU R M,et al. High-surface-area SBA-15-SO3H with enhanced catalytic activity by the addition of poly(ethylene glycol)[J]. Journal of Porous Materials,2013,20(5):1041-1049.
[21] PFAU A,SCHIERBAUM K D. The electronic structure of stoichiometric and reduced CeO2surfaces:an XPS,UPS and HREELS study[J]. Surface Science,1994,321:71-80.
·产品信息·
浙江丰利“超微粉碎设备”通过浙江名牌产品复评
国家高新技术企业浙江丰利粉碎设备有限公司的FLFS牌“超微粉碎设备”再次通过“浙江名牌产品”工业产品复评,连续四届获此殊荣,这在我国粉碎设备界仅此一家。浙江丰利的超微粉碎设备2002年首获浙江名牌产品称号,实现了我国粉体设备行业名牌零的突破。
享有“中国粉碎机专家”美誉的浙江丰利以科技为先导,立足粉体技术前沿,坚持自主创新与引进技术相结合的科研创新体系,依托引进的德国先进粉体技术,结合中国国情,创造出多项独有知识产权和国内领先并达到国际先进水平的技术和产品,成功推出了具有高技术含量的CWM超级涡流磨、CWJ超微粉碎机、CGM1000型超细辊压磨、HWV旋风磨和HTC涡轮分级机等系列超微粉碎设备,将粉碎细度提升到微米、亚微米级乃至纳米级,在粉体行业打出了响当当的“丰利”品牌;其中新一代超微粉碎设备——MTM冲击磨、GJF干燥超微粉碎机等十多项高新技术产品,被确认为国家重大产业技术开发专项、国家重点新产品和国家火炬项目,成为我国高端粉碎设备的代表。各类超微粉碎设备广泛适用于化工、农药、无机盐、染(颜)料、医药、食品、生物、非金属矿、有色金属、电子科技、新材料、塑料、烟草、饲料、陶瓷、建材、环保等各个行业的不同领域。
浙江丰利“超微粉碎设备”自获评浙江名牌产品十年来,凭着过硬的产品质量和高效的节能效果,热销全国各地,挺进国际市场,成为美国、德国等多家世界500强企业在中国采购粉体工程设备定点供应商。
目前,浙江丰利跻身中国科技名牌500强,成为我国粉体设备领域规模大、实力强、品种全、新品多的行业龙头企业,同时也是全国颗粒表征与分检及筛网标委会超微粉碎设备工作组秘书长单位,成为闻名海内外的成套超微粉体设备和绿色环保装备生产基地。
咨询热线:0575-83105888,83100888,83185888,83183618
网址:www.zjfengli.com
邮箱:fengli@zjfengli.cn
Effect of the doped alkaline-earth metals on the catalytic performance of CeO2
LI Ping1,DUAN Huijuan2
(1Institute of Environmental Science,Shanxi University,Taiyuan 030006,Shanxi,China;2Department of Applied Chemistry,Taiyuan University of Technology,Taiyuan 030024,Shanxi,China)
Nano-CeO2(20nm)was prepared by hydrothermal method,and then alkaline-earth metal oxides(MgO、CaO and BaO)of different concentrations were introduced into the nano-CeO2. The catalytic results showed that the doping of these three alkaline-earth metal oxides all had negative effects on the catalytic performance of nano-CeO2. In addition,the prepared nano-CeO2were characterized with TEM,XRD,BET,XPS and TPD. The results show that a small amount of doped alkaline-earth metal oxideswere in the form of disorder and they couldn't lead to the lattice deformation and showed little effects on the morphology,particle size and textural properties,but they had great effect on the ratio of Ce(Ⅳ)/Ce(Ⅲ) as well as the amount of the acid and base sites. In addition,high ratio of Ce(Ⅳ)/Ce(Ⅲ) and a large amount of acid and base sites are essential for the catalytic performance of nano-CeO2.
nano-CeO2;alkaline-earth metal oxides;dope;di-methyl carbonate(DMC)
TQ 225
A
1000-6613(2016)11-3529-07
10.16085/j.issn.1000-6613.2016.11.022
2016-03-01;修改稿日期:2016-05-04。
中国科学院煤炭转化重点实验室开放基金(J13-14-902)及国家自然科学基金(21373147,21573157)项目。
及联系人:李萍(1975—),女,博士,主要从事环境化学研究。E-mail liping0349@163.com。
