人脂肪源性间充质干细胞对乳腺癌转移的影响
2016-11-12车绪春天津医科大学总医院检验科天津30005天津医科大学基础医学院天津300070
王 凊 张 博 车绪春▲.天津医科大学总医院检验科,天津30005;.天津医科大学基础医学院,天津300070
人脂肪源性间充质干细胞对乳腺癌转移的影响
王凊1张博2车绪春2▲
1.天津医科大学总医院检验科,天津300052;2.天津医科大学基础医学院,天津300070
目的研究人脂肪源性间充质干细胞(hAD-MSC)的基本生物学特征及对乳腺癌转移的影响。方法贴壁法从人脂肪组织分离获得hAD-MSC,完成鉴定;分别用脂肪诱导培养基和成骨诱导培养基诱导其向脂肪和成骨细胞分化;hAD-MSC与人乳腺癌细胞MDA-MB-231共培养,Transwell小室法观察肿瘤细胞的形态和迁移、侵袭能力。结果从人脂肪组织中成功培养出间充质干细胞,其具有较强的体外增殖和自我更新能力。共培养之后的MDA-MB-231细胞迁移和侵袭能力增强。结论从人脂肪组织中可分离培养出具有多分化潜能的间充质干细胞,并可促进乳腺癌细胞的转移。
人脂肪源性间充质干细胞;乳腺癌;共培养;转移
乳腺癌是女性最常罹患的恶性肿瘤之一,肿瘤的远处转移亦是主要的致死因素。间充质干细胞(mes enchymal stem cells,MSC)对肿瘤的生长扮演着双重角色[1]。明确MSC与肿瘤细胞的相互作用是MSC在肿瘤进展及治疗研究中的关键[2]。人脂肪源性间充质干细胞(human adipose derived MSC,hAD-MSC)具有跟骨髓间充质干细胞(BM-MSC)类似的生物学特性,并且来源充足,易于分离,取材途径更易于供体接受[3]。本研究从人脂肪组织中培养获得hAD-MSC,对其生物学特性进行研究,并观察其对乳腺癌细胞转移的影响。
1 材料与方法
1.1材料
1.1.1人脂肪组织2015年1~12月收集2例天津医科大学总医院乳腺癌手术患者的乳腺癌脂肪组织。患者签署由医院伦理委员会批准的患者知情同意书,符合医学伦理学规定。
1.1.2乳腺癌MDA-MB-231细胞MDA-MB-231细胞购自中科院上海细胞库。
1.1.3主要仪器和试剂流式细胞仪(型号:FACSAriaⅡ,BD公司);Ⅰ型胶原酶(Gibco公司);Oricell人MSC成骨和脂肪分化培养基(广州赛业公司);FITC标记的抗人CD34、CD44、CD90、HLA-DR、CD105抗体,FITCmouse IgG1κ同型对照抗体(Biolegend公司)。
1.2hAD-MSC的分离培养
将脂肪组织用D-Hank液冲洗,剪碎后,0.1%的Ⅰ型胶原酶37℃下消化1 h,1000×g离心10 min,弃上清后将细胞重悬,尼龙网过滤。再次洗涤,离心获得单细胞悬液。计数细胞浓度为1×106/mL,培养基为10%FBSDMEM/F12,37℃5%CO2下进行贴壁培养。24 h后洗掉未黏附细胞,更换新鲜培基。之后传代培养,实验均选择3~15代的子代细胞,鉴定后备用[4-5]。
1.3hAD-MSC免疫表型鉴定
取对数生长期hAD-MSC细胞悬液100μL(浓度为5×106/mL),分别加入FITC-抗人CD34、CD44、CD90、HLA-DR、CD105抗体以及FITCmouse IgG1κ同型对照抗体20μL,避光4℃孵育30min。PBS洗涤,500×g离心5 min,重悬细胞后筛网过滤。流式细胞仪检测,CELLQUEST软件采集数据[6]。
1.4hAD-MSC的成骨和脂肪分化
1.4.1成骨分化调整hAD-MSC细胞浓度为5×104/mL,接种于培养板中,37℃5%CO2培养。24 h后,弃去原培养基,加入成骨诱导培养基(含谷氨酰胺、抗坏血酸、磷酸甘油、地塞米松),分化培养2周后,固定细胞,茜素红(Alizarin red)染色鉴定。
1.4.2脂肪分化细胞准备同上述步骤。弃去hAD-MSC原培养基后,加入脂肪诱导培基A(含IBMX、吲哚美辛、地塞米松);3 d后,换为脂肪诱导培基B(不含IBMX、吲哚美辛、地塞米松);24 h后,再换成培基A。如此进行培基A和B的轮换,3个循环后完成诱导。最后培基B培养1周。固定细胞,油红O进行染色鉴定[7]。
1.5hAD-MSC与肿瘤细胞系共培养
取对数生长期的MDA-MB-231(细胞浓度为2× 105/mL),加入到Transwell小室上层,每孔500μL。常规培养hAD-MSC后,调整细胞浓度为2×105/mL,1.5 mL/孔,加入到小室下方,以单纯hAD-MSC培养基作为对照。37℃、5%CO2孵育72 h。
1.6体外细胞迁移和侵袭实验
1.6.1迁移实验Transwell小室4℃预冷,25μL的趋化因子FN(0.2 mg/mL)涂在小室底部,风干。将共培养后的MDA-MB-231细胞,用0.1%BSA RPMI-1640调整细胞浓度至2×106/mL,100μL/室,加入到底部已涂有趋化因子FN的小室上层,以未与hAD-MSC共培养的MDA-MB-231细胞作为对照。小室下方加入10%FBS RPMI-1640 600μL/孔,37℃、5%CO2孵育24 h。用棉棒擦去微孔滤膜上未迁移的细胞,HE染色,中性树胶封片。100倍光学显微镜下计数膜上下左右中5个视野穿过滤膜的细胞数。
1.6.2侵袭实验25μL的Matrigel胶(0.2mg/mL)包被Transwell小室上层。其余实验步骤均同迁移实验[8]。
1.7统计学方法
采用SPSS 10.0进行分析,组间比较用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1hAD-MSC贴壁法分离结果
细胞贴壁后多为多边形,细胞核居中,多为单核;早期细胞生长缓慢,第3天数量明显增加。传至3代后,细胞形态基本一致,为成纤维细胞样,核清晰、胞质颗粒明显,生长速度稳定,分裂周期约为48 h,提示具有旺盛的体外增殖能力。传至第15代时,未见形态有异常改变,提示所得细胞具有较强的自我更新能力。见图1。
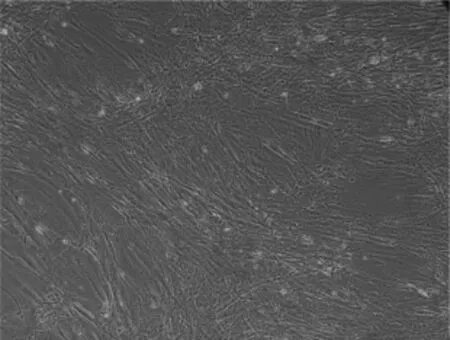
图1 贴壁法分离人脂肪源性间充质干细胞
2.2hAD-MSC免疫表型鉴定
流式分析结果显示,hAD-MSC具有较高的纯度。该细胞群高表达CD44、CD73、CD90、CD105,而CD34、CD45呈阴性。见图2。
2.3hAD-MSC的成骨和脂肪分化
hAD-MSC成骨诱导完成后采用茜素红染色,观察到细胞胞浆中有红色的钙结节,呈明显阳性;脂肪分化采用油红O染色,观察到细胞胞浆有红色的脂肪滴,呈明显阳性。结果显示,本研究分离获得的hAD-MSC具有多向分化潜能。见图3。
2.4MDA-MB-231细胞与hAD-MSC共培养后迁移和侵袭能力的变化
共培养72 h后,MDA-MB-231细胞的迁移和侵袭能力明显增强,迁移细胞数目为(100.2±13.0)个,与对照组[(58.6±12.5)个]比较,差异有统计学意义(P<0.05);侵袭细胞数目为(118.7±15.2)个,与对照组[(63.3±11.0)个]比较,差异有统计学意义(P<0.05)。见图4。
3 讨论
乳腺癌是严重威胁女性生命健康的恶性肿瘤,大部分乳腺癌患者死于癌症的复发和转移。明确MSC与肿瘤细胞之间的相互作用对于治疗研究至关重要[9]。有报道,与BM-MSC共培养能够诱导乳腺癌细胞发生形态学和表型的改变,MSC可被肿瘤细胞募集至原发肿瘤的基质表面,从而促进其侵袭和转移[10]。本研究采用hAD-MSC进行研究,其已知具有跟BM-MSC类似的生物学特性,包括多向分化潜能、自我更新、高度增殖能力,并且具有易于分离、取材途径更易于供体接受等特点,hAD-MSC已然成为MSC研究的新热点[11]。本研究对象取自于患者乳腺癌肿瘤脂肪组织,能更好地模拟乳腺癌肿瘤微环境中的MSC和癌细胞之间的相互作用,为研究肿瘤细胞的生长和转移过程以及临床上预防肿瘤提供极其重要的依据。

图2 人脂肪源性间充质干细胞的表面标记

图3 人脂肪源性间充质干细胞的成骨和脂肪分化

图4 MDA-MB-231细胞与hAD-MSC共培养后迁移和侵袭能力的变化
本研究采用贴壁法分离hAD-MSC。观察细胞形态一致,大部分为纺锤形或梭形细胞,与成纤维样细胞形态类似。细胞增殖稳定,传代至10~15代,并未见异常形态改变,说明本研究获得的hAD-MSC体外增殖及更新能力良好。对MSC进行鉴定的重要方面之一是其重要的表面分子标志。CD90、CD105、CD73和CD44分子是公认在间充质干细胞表面稳定表达的分子。CD90又称Thy-1,它是早期造血干细胞的标志,并已被确定在非淋巴组织的多种干细胞中均有不同程度的表达。CD105主要表达在血管内皮细胞、单核巨噬细胞,是骨髓间充质干细胞的特征性表型之一。CD73是目前公认的间充质干细胞表面标志物之一,它有可能通过抑制针对肿瘤细胞的保护性免疫反应或者干扰化疗药物诱导的肿瘤细胞凋亡的方式促进肿瘤的发生[12]。CD44是另外一个肿瘤干细胞常见标志物,主要参与细胞-细胞、细胞-基质之间的黏附。本研究对分离所得的hAD-MSC进行了CD105、CD90、CD13、CD44分子的流式鉴定。研究结果显示,这4种分子在hAD-MSC上都呈阳性表达,阳性率均在99%以上,而CD45、CD34在MSC表面呈阴性表达。CD45是在白细胞表面广泛表达的分子,CD34主要表达于原始的造血干细胞和内皮细胞,本研究中分离的细胞群,D45和CD34呈阴性表达,阳性率不超过2%,说明本研究获得的hAD-MSC纯度较高。
多向分化潜能是MSC的基本生物学特征之一[13],也是MSC鉴定的最重要指标。本研究采用间充质干细胞定向分化培养基对hAD-MSC进行诱导分化。茜素红和油红O分别进行染色,均表现出阳性,这提示hAD-MSC可完成向成骨和脂肪细胞的分化,证明本研究获得的hAD-MSC具有良好的定向分化能力。
MSC强大的分化和增殖能力促使其参与肿瘤组织的构建;通过多种趋化因子作用引起肿瘤细胞表型变化,促进肿瘤恶性行为;MSC具有类似“免疫豁免”效应,可对各主要类型的免疫细胞产生增殖和活化抑制作用,有助于肿瘤细胞逃逸;表达于MSC表面的多种生长因子和细胞因子可协同促进肿瘤血管和淋巴管生成,参与肿瘤侵袭、转移。MSC尚具有恶变潜能,在某些条件下可自发转化为致瘤干细胞[14]。为进一步研究肿瘤微环境中的MSC和肿瘤细胞之间的相互作用,本研究将人乳腺癌细胞系MDA-MB-231与hAD-MSC进行共培养,采用Transwell方法检测共培养后的乳腺癌细胞的迁移和侵袭能力。Karnoub等[15]于2007年首次证明骨髓来源的MSC能够促进乳腺癌细胞转移,MSC与乳腺癌细胞按一定比例混合后共同接种入裸鼠皮下,发现MSC能显著促进乳腺癌细胞的运动性、侵袭能力及体内转移能力。将绿色荧光蛋白标记的人乳腺癌细胞系(MCF/Ras、MDA-MB-231、MDA-MB-435、HMLER)与间充质干细胞以1∶3的比例共同移植到免疫缺陷的小鼠体内时,结果发现间充质干细胞可以促进四株人乳腺癌细胞系的转移。本研究发现与MSC能显著促进乳腺癌细胞MDA-MB-231的迁移和侵袭能力。
综上所述,本研究从人乳腺癌脂肪组织中分离出脂肪间充质干细胞,细胞一致性好,纯度高,对MSC进行进一步探讨,本研究观察了乳腺癌细胞与MSC共培养之后肿瘤特性的变化,发现MSC能显著促进乳腺癌细胞在体外的迁移、侵袭能力,初步探索了肿瘤微环境中MSC对乳腺癌细胞生长转移的影响及其作用机制,从而为肿瘤治疗提供新的靶点。
[1]Bidkhori HR,Ahmadiankia N,Matin MM,et al.Chemically primed bone-marrow derived mesenchymal stem cells show enhanced expression of chemokine receptors contributed to theirmigration capability[J].Iran JBasic Med Sci,2016,19(1):14-19.
[2]Khosrotehrani K.Mesenchymal stem cell therapy in skin:why and what for?[J].Exp Dermatol,2013,22(5):307-310.
[3]Liang X,Ding Y,Zhang Y,et al.Paracrinemechanisms of mesenchymal stem cell-based therapy:current status and perspectives[J].Cell Transplant,2014,23(9):1045-1059.
[4]Liu YS,Ou ME,Liu H,et al.The effect of simvastatin on chemotactic capability of SDF-1alpha and the promotion of bone regeneration[J].Biomaterials,2014,35(15):4489-4498.
[5]Moon HE,Yoon SH,Hur YS,et al.Mitochondrial dysfunction of immortalized human adipose tissue-derived mesenchymal stromal cells from patients with Parkinson's disease[J].Exp Neurobiol,2013,22(4):283-300.
[6]DelaRosa O,Sanchez-Correa B,Morgado S,et al.Human adipose-derived stem cells impair natural killer cell function and exhibit low susceptibility to natural killer-mediated lysis[J].Stem Cells Dev,2012,21(8):1333-1343.
[7]LibrizziM,Tobiasch E,Luparello C.The conditionedmedium from osteo-differentiating human mesenchymal stem cells affects the viability of triple negative MDA-MB231 breast cancer cells[J].Cell Biochem Funct,2016,34(1):7-15.
[8]Yang Y,Choi H,Seon M,et al.LL-37 stimulates the functions of adipose-derived stromal/stem cells via early growth response 1 and the MAPK pathway[J].Stem Cell Res Ther,2016,7(1):58.
[9]Razmkhah M,Abedi N,Hosseini A,et al.Induction of T regulatory subsets from naive CD4+T cells after exposure to breast cancer adipose derived stem cells[J].Iran J Immunol,2015,12(1):1-15.
[10]McAndrews KM,McGrail DJ,Ravikumar N,et al.Mesenchymal stem cells induce directional migration of invasive breast cancer cells through TGF-β[J].Sci Rep,2015,5:16941.
[11]BassiG,PacelliL,CarusoneR,etal.Adipose-derived stromal cells(ASCs)[J].Transfus Apher Sci,2012,47(2):193-198.
[12]Ayatollahi M,Talaei-Khozani T,Razmkhah M.Growth suppression effect of human mesenchymal stem cells from bone marrow,adipose tissue,and Wharton's jelly of umbilical cord on PBMCs[J].Iran J Basic Med Sci,2016,19(2):145-153.
[13]Khalaj Z,Lotfi AS,Kabir-Salmani M.Laminin matrix promotes hepatogenic terminal differentiation of human bone marrow mesenchymal stem cells[J].Iran J Basic Med Sci,2016,19(1):34-42.
[14]Niyaz M,Gurpinar OA,Oktar GL,et al.Effects of VEGF and MSCs on vascular regeneration in a traumamodel in rats[J].Wound Repair Regen,2015,23(2):262-267.
[15]Karnoub AE,Dash AB,Vo AP,et al.Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J].Nature,2007,449(7162):557-563.
Effect of hum an adipose derived m esenchymal stem cells on metastasis of breast cancer
WANG Qing1ZHANG Bo2CHE Xuchun2▲
1.Department of Clinical Laboratory,General Hospital,Tianjin Medical University,Tianjin 300052,China;2.School of Basic Medicine,Tianjin Medical University,Tianjin 300070,China
Ob jective To study the biological characteristics of human adipose derived mesenchymal stem cells(hADMSC),and its effectonmetastasis of breast cancer.M ethods hAD-MSCwere isolated from adipose tissue by adherence to plastic;hAD-MSC were induced into adipocytes and osteoblasts by adipose induced medium and osteogenesis induced medium;after breast cancer cells(MDA-MB-231)were co-cultured with hAD-MSC,the changes ofmorphology,migration and invasive capacity of tumor cellswere observed by Transwell system.Results hAD-MSCwas successfully obtained from human adipose tissue.They showed strong abilitiesof proliferation in vitro and self-renewal.Themigration and invasive capacity of MDA-MB-231 after co-cultured was significantly enhanced.Conclusion hAD-MSC with multipotent differentiation potential can be obtained from human adipose tissue,and it can promote themetastasis of breast cancer.
Human adipose derived mesenchymal stem cells;Breast cancer;Co-culture;Metastasis
R737.9
A
1673-7210(2016)06(c)-0025-04
天津医科大学科学基金面上项目(2015KYZM12)。
王凊(1978.5-),女,硕士;研究方向:抗肿瘤。
▲
(2016-02-26本文编辑:张瑜杰)
