NLRP3炎症小体在失血性休克大鼠肾脏损伤中的作用
2016-11-12李阿兴贺彦平西安一四一医院外一科陕西西安70089第四军医大学西京医院泌尿外科陕西西安70032
张 强 谭 超,2 李阿兴 贺彦平▲.西安一四一医院外一科,陕西西安70089;2.第四军医大学西京医院泌尿外科,陕西西安70032
NLRP3炎症小体在失血性休克大鼠肾脏损伤中的作用
张强1谭超1,2李阿兴1贺彦平1▲
1.西安一四一医院外一科,陕西西安710089;2.第四军医大学西京医院泌尿外科,陕西西安710032
目的探讨失血性休克大鼠早期肾脏组织内NLRP3炎症小体信号通路的表达及作用。方法将27只健康雄性SD大鼠按随机分为假手术组(对照组)、失血性休克组(实验组)、失血性休克优降糖干预组(干预组)。大鼠失血性休克模型完成后24 h监测血肌酐(Scr)和血尿素氮(BUN)水平,并分别采用Western blot和rt-PCR方法检测肾脏皮质中NLRP3炎症小体蛋白的表达和IL-1β、TNF-α的基因表达情况。结果①实验组大鼠血清Scr、BUN含量显著高于对照组(P<0.01);干预组大鼠血清Scr、BUN含量显著低于实验组(P<0.01)。②实验组大鼠肾脏皮质内NLRP3蛋白表达量显著高于对照组(P<0.01);与实验组比较,干预组大鼠肾脏皮质内NLRP3的蛋白含量明显降低(P<0.01)。③实验组大鼠肾脏皮质内IL-1β、TNF-α的mRNA表达量显著高于对照组(P<0.01);干预组大鼠肾脏皮质内IL-1β、TNF-α的mRNA表达量显著低于实验组(P<0.01)。结论失血性休克大鼠早期肾功能受损,肾脏皮质内NLRP3炎症小体活性增高,炎性反应明显,使用炎症小体抑制剂优降糖后,可显著抑制NLRP3的活化,降低肾脏炎性反应,改善肾功能。
失血性休克;肾脏;炎症小体;NLRP3;炎症
失血性休克是临床常见的急重症病症之一,常常由创伤、手术、交通事故和地震等引起,如治疗不当或不合理,常常引起重要脏器功能与代谢障碍,而肾脏是最易受累的器官之一[1]。失血性休克后主要引起机体急性循环功能障碍,导致肾脏微循环灌注不足以及细胞功能代谢障碍,机体免疫功能受到抑制,肾脏受到各种因素刺激,很容易产生炎性反应,导致肾损伤。休克后快速液体复苏是常用的治疗方法,但肾脏灌注急剧增加,缺血再灌注反而会进一步加重肾脏的损伤[2-4]。缺血再灌注损伤导致活性氧(ROS)大量产生,进而进一步扩大炎症反应,加重肾脏损伤[5-7]。据统计,在ICU病房,大约30%的失血性休克患者伴有肾脏功能损伤,因此阐明失血性休克早期肾脏损伤的机制成为研究重点。研究表明在失血性休克肺损伤的小鼠模型中发现血清中和肺组织中的IL-1β表达升高[8-10],而NLRP3炎症小体能够促进IL-1β的活化,因此推测在失血性休克诱导的肾脏损伤早期NLRP3炎症小体可能也参与介导了其发生发展过程。本研究采用经典的失血性休克模型,对失血性休克早期肾脏功能及肾脏皮质内NLRP3炎症小体的表达及肾皮质炎症水平进行研究。
1 材料与方法
1.1实验动物
采用雄性成年SD大鼠,8~9周,体重200~250 g,由第四军医大学实验动物中心提供,合格证号:SCXK(军2012-0007)。在SPF级的实验条件下,12 h昼夜循环,室温25℃左右,为其提供充足的饮水以及进食。
1.2动物分组及大鼠失血性休克模型的建立
实验前禁食12 h。将领取的动物按照随机数表法分为假手术组(对照组)、失血性休克组(实验组)、失血性休克优降糖干预组(干预组),每组各9只。三组试验用大鼠提前1 d于右侧腹股沟部位脱毛备皮,采用腹腔注射1%戊巴比妥钠(50mg/kg)的麻醉方式麻醉动物,检测大鼠角膜反射确定大鼠麻醉完好。失血性休克采用经典模型[11],大鼠仰卧放置于恒温(37±1)℃的工作台上,用碘酒进行消毒,经右侧腹股沟部切口,钝性分离皮下组织,暴露股动脉、股静脉和股神经,分离出股动脉和股静脉,用导管PE-50分别对股动脉和股静脉进行插管,此导管经传感器直接与数据采集系统连接(AD Instruments,Colorado Springs,CO,USA)。
对照组在完成上述手术后不做相关失血处理,观察1.5 h后,结扎股动脉和股静脉,拔出导管,缝合切口。
实验组大鼠在完成上述手术和检测后,进行失血处理:通过股静脉放血,股动脉读取平均动脉血压(MAP),从股静脉放血,放血量为全身的60%左右,10min内MAP降到40mmHg,并将血压控制在35~40mmHg(1 mmHg=0.133 kPa),维持1.5 h,然后进行复苏:股静脉输液(林格液),液体量为失血量的3倍,时间约为30min。然后结扎股动脉和股静脉,拔出导管,缝合切口,放回动物房正常饲养。
干预组大鼠在实验组大鼠失血的基础上,在补液过程中同时腹腔注射优降糖[格列苯脲(SigmaAldrich,MO,USA]30 mg/kg。
1.3肾静脉血和肾脏皮质的提取
三组试验大鼠正常饲养24 h后采用腹腔注射1%戊巴比妥钠(50 mg/kg),经侧腹部(距离腹正中线2 cm)切口,暴露双侧肾蒂,分离出肾静脉,取肾静脉血,后快速取下双侧肾脏皮质,冻存于-80℃冰箱。静脉血提取后离心,取上层血清,-80℃冰箱冻存。
1.4血清血肌酐(Scr)和血尿素氮(BUN)的检测
取静脉血后,3000 r/min,4℃环境下离心10min,分离血清。去各组冻存血清,采用干化学法测定血清中的血肌酐(Scr)和血尿素氮(BUN),操作按照血肌酐和血尿素氮试剂盒说明书进行。
1.5蛋白质免疫印迹(W estern blot)测定炎症小体NLRP3蛋白水平
取冻存肾脏组织50mg,加组织细胞裂解液500μL匀浆,提取蛋白,BCA法蛋白定量,SDS-PAGE电泳,湿转,1%BSA室温封闭1 h。4℃过夜孵育NLRP3(1∶400)抗兔一抗。洗膜后37℃孵育HRP标记山羊抗兔IgG二抗(1∶3000)1 h。再次洗膜后化学发光、显影,凝胶成像分析系统行灰度扫描分析,结果以目的蛋白条带灰度值与内参蛋白GAPDH灰度比值表示。
1.6RT-PCR测定肾脏皮质IL-1β、TNF-α的mRNA表达
取各组冻存标本,采用实时荧光定量PCR法检测各组肾脏皮质IL-1β、TNF-α的mRNA表达。大鼠IL-1β、TNF-α、GAPDH基因引物序列如表1。

表1 大鼠IL-1β、TNF-α、GAPDH基因引物序列
按照SYBR Green荧光定量试剂盒说明书进行PCR,反转录体系20μL:SYBR 10μL、上下游引物各1μL、cDNA 1μL、蒸馏水8μL。反应条件:初始变性95℃30 s;PCR反应变性95℃维持15 s;退火60℃维持30 s;重复40个循环。结果处理采用2-ΔΔCt相对量的方法。
1.7统计学方法
使用统计作图软件GraphPad Prism6进行分析及作图,正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2 结果
2.1血肌酐和血尿素氮含量变化
实验组大鼠血肌酐、血尿素氮含量显著高于对照组(P<0.01),干预组大鼠血肌酐、血尿素氮含量与实验组相比显著降低(P<0.01)。实验结果提示:缺血性休克对肾脏造成了损伤,而使用炎症小体抑制剂优降糖可以改善失血性休克后肾功能的降低。见表2、图1。
表2 三组大鼠肾脏功能检测结果比较(±s)

表2 三组大鼠肾脏功能检测结果比较(±s)
注:与对照组比较,*P<0.01;与实验组比较,#P<0.01;BUN:血尿素氮;Scr:血肌酐
组别动物只数BUN(mmol/L)Scr(μmol/L)对照组实验组干预组9 9 9 5.23±0.54 22.89±1.23*10.19±0.89#30.76±3.88 98.56±13.54*51.08±1.83#
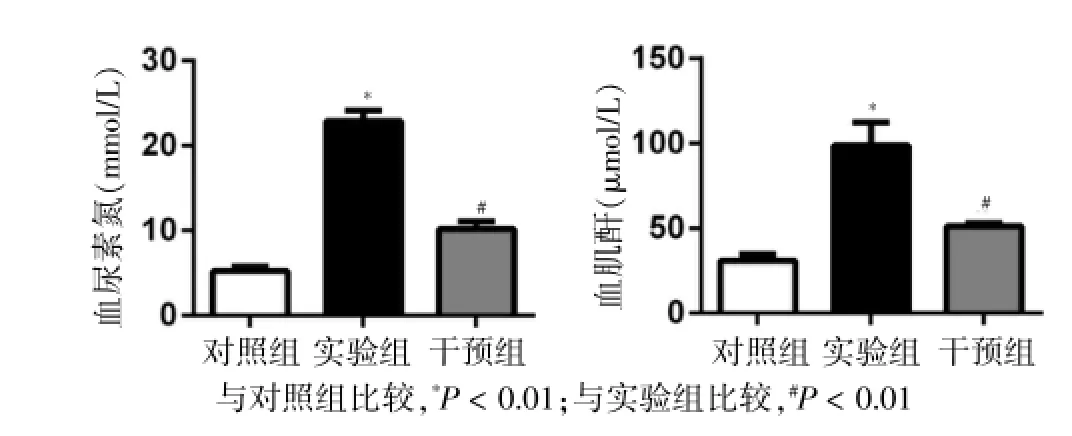
图1 三组大鼠肾脏功能检测结果
2.2失血性休克大鼠双侧肾皮质NLRP3的蛋白表达情况
失血性休克模型24 h后,取材肾脏皮质。采用Western blot方法对各组肾脏皮质的NLRP3的蛋白水平进行检测。结果表明,实验组肾皮质中NLRP3蛋白相对含量(0.43±0.12)显著高于对照组(0.09±0.04),差异有高度统计学意义(P<0.01),干预组肾脏皮质的NLRP3蛋白含量(0.19±0.02)明显低于实验组,差异有高度统计学意义(P<0.01)。结果提示炎症小体NLRP3可能参与了失血性休克造成的肾脏损伤,同时优降糖处理可以抑制失血性休克后炎症小体的活化。见图2。
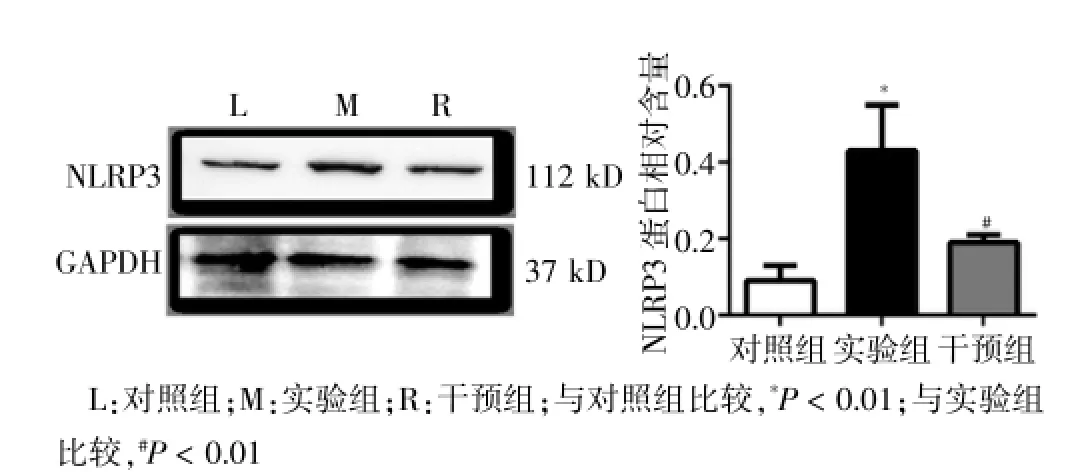
图2 三组大鼠失血性休克后24 h肾脏中NLRP3的蛋白表达
2.3失血性休克大鼠双侧肾皮质中IL-1β、TNF-α的mRNA表达
实验组大鼠肾皮质中IL-1β、TNF-α的mRNA表达量分别为(2.75±0.23)、(2.01±0.34),显著高于对照组的(1.00±0.09)、(1.00±0.10),差异有高度统计学意义(P<0.01),干预组大鼠肾脏皮质内IL-1β、TNF-α的mRNA表达量[(1.57±0.09)、(1.21±0.07)]明显低于实验组,差异有高度统计学意义(P<0.01)。说明NLRP3炎症小体可能是通过促进IL-1β的活化,促进炎性反应的发生,而参与失血性休克后肾损伤的。抑制NLRP3炎症小体活化对大鼠失血性休克后肾功能保护作用可能是通过降低肾皮质的炎症水平所介导的。
3 讨论
失血性休克是一种病情凶险、并发症多、易导致多器官功能衰竭的急性危重病症,其中肾脏是休克时最易受损害的器官之一,常发生急性肾损伤,甚至是肾功能衰竭。失血性休克后引起肾损伤的原因多种多样,但失血性休克早期因组织的缺血缺氧和炎性反应导致细胞因子和炎症介质的大量活化,是引起失血性休克早期肾损伤的重要原因[12]。NLRP3炎症小体是一种由多种蛋白构成的复合体,它能使半胱天冬肽酶-1(caspase-1)活化,促进IL-1β由其前体向活化状态转变。研究表明其还能够调节caspase-1依赖的细胞凋亡,诱导细胞在炎症和应激的病理条件下死亡[13]。在心肌组织,之前的研究表明,缺血再灌注损伤后,心肌组织的炎症小体NLRP3信号通路大量活化[14]。在肺组织,炎症小体NLRP3参与了失血性休克后的全身炎性反应综合征(SIRS)[8]。多种因素可以激活NLRP3炎症小体,如内源性危险信号,包括线粒体损伤[15]、溶酶体损伤、ATP等,以及病原相关分子模式[16-17]。与此同时,多种损伤如缺血再灌注损伤、脓毒症损伤诱导的肾损伤模型中,均发现NLRP3炎症小体在其中发挥重要作用[18-19]。因此笔者根据之前的研究进行推测炎症小体NLRP3信号通路有可能参与了失血性休克早期的肾脏损伤。本研究采用经典的失血性休克模型,对休克后24 h的大鼠进行研究,发现休克组大鼠血肌酐和血尿素氮的水平较对照组明显升高,表明失血性休克对肾脏的功能造成了损伤,而使用优降糖进行干预,则对失血性休克后肾损伤有保护作用。同时失血性休克组大鼠肾脏皮质内的NLRP3蛋白表达较对照组显著升高,使用优降糖进行干预的失血性休克大鼠的肾脏皮质内NLRP3的蛋白表达明显较未干预组降低,证明NLRP3可能参与了失血性休克早期肾损伤的过程。而利用优降糖进行干预,能够显著降低NLRP3炎症小体的活化,说明抑制NLRP3炎症小体的活化对失血性休克后肾损伤有保护作用。
在失血性休克早期,单核/巨噬细胞等炎症效应细胞迅速被激活,可促进多种前炎症细胞因子的释放,触发一系列的级联信号反应,进一步释放炎症介质,导致多个脏器的损害[20]。NLRP3是一种重要的炎症因子的启动子,可活化多种细胞因子前体使其激活,释放更多的炎症介质和细胞因子,使组织损伤加重,抑制NLRP3的活化可以改善失血性休克后的炎症。为了探究优降糖对失血性休克后肾功能的保护作用机制,我们进一步检测了失血性休克后肾皮质的炎症水平。
本研究结果表明,失血性休克后肾皮质NLRP3的表达显著升高,优降糖可明显降低NLRP3的信号通路活化,并逆转肾功能,NLRP3信号通路参与了失血性休克肾损伤的过程,抑制NLRP3信号通路可改善肾脏损伤。因此,本研究为临床上治疗失血性休克早期肾脏损伤提供了新的思路和实验依据。
[1]Chen S,Shi JS,Yibulayin X,et al.Cystatin C is amoderate predictor of acute kidney injury in the early stage of traumatic hemorrhagic shock[J].Experimental and Therapeutic Medicine,2015,10(1):237-240.
[2]Wang Y,Yan J,Xi L,et al.Protective effect of crocetin on hemorrhagic shock-induced acute renal failure in rats[J]. Shock(Augusta,Ga),2012,38(1):63-67.
[3]Patel NS,Kerr-Peterson HL,Brines M,et al.Delayed administration of pyroglutamate helix B surface peptide(pHBSP),a novel nonerythropoietic analog of erythropoietin,attenuates acute kidney injury[J].Molecularmedicine(Cambridge,Mass),2012,18:719-727.
[4]Hirano M,Ma BY,Kawasaki N,et al.Role of interaction ofmannan-binding protein with meprins at the initial step of complement activation in ischemia/reperfusion injury to mouse kidney[J].Glycobiology,2012,22(1):84-95.
[5]Flaherty JT Reperfusion injury[J].Free radical biology& medicine,1988,5(5/6):409-419.
[6]Wu CY,Chan KC,Cheng YJ,etal.Effects of different types of fluid resuscitation for hemorrhagic shock on splanchnic organ microcirculation and renal reactive oxygen species formation[J].Criticalcare(London,England),2015,19:434.
[7]WangH,Guan Y,Widlund AL,etal.Resveratrolameliorates mitochondrial dysfunction but increases the risk of hypoglycemia following hemorrhagic shock[J].The Journal of Trauma and Acute Care Surgery,2014,77(6):926-933.
[8]Xiang M,Shi X,Li Y,et al.Hemorrhagic shock activation of NLRP3 inflammasome in lung endothelial cells[J]. Journal of Immunology(Baltimore,Md:1950),2011,187(9):4809-4817.
[9]Liu GQ,Zuo XH,Jiang LN,et al.Inhibitory effect of posthemorrhagic shock mesenteric lymph drainage on the HMGB1 and RAGE inmouse kidney[J].Renal failure,2016,38(1):131-136.
[10]Sato H,Tanaka T,Kasai K,et al.A quantitative study of p38 mitogen-activated protein kinase on renal dysfunction after hemorrhagic shock in rats[J].The Journal of Trauma,2011,71(4):973-981.
[11]Xu Y,Dai X,Zhu D,et al.An exogenous hydrogen sulphide donor,NaHS,inhibits the apoptosis signaling pathway to exert cardio-protective effects in a rat hemorrhagic shock model[J].International Journal of Clinical and Experimental Pathology,2015,8(6):6245-6254.
[12]Xu P,Wen Z,Shi X,et al.Hemorrhagic shock augments Nlrp3 inflammasome activation in the lung through impaired pyrin induction[J].Journal of Immunology(Baltimore,Md:1950),2013,190(10):5247-5255.
[13]De Nardo D,Latz E.New insights into mechanisms controlling the NLRP3 inflammasome and its role in lung disease[J].The American Journal of Pathology,2014,184(1):42-54.
[14]Sahoo M,Ceballos-Olvera I,del Barrio L,et al.Role of the inflammasome,IL-1beta,and IL-18 in bacterial infections[J].The ScientificWorld Journal,2011,11:2037-2050.
[15]Wang H,Guan Y,Karamercan MA,et al.Resveratrol Rescues Kidney Mitochondrial Function Following Hemorrhagic Shock[J].Shock(Augusta,Ga),2015,44(2):173-180.
[16]Zhang LM,Jiang LJ,Zhao ZG,et al.Mesenteric lymph duct ligation after hemorrhagic shock enhances the ATP level and ATPase activity in rat kidneys[J].Renal failure,2014,36(4):593-597.
[17]O'Sullivan JC,Fu D,Alam HB,et al.Diazoxide increases liver and kidney HSP25 and HSP70 after shock and stroke[J].The Journalof SurgicalResearch,2008,149(1):120-130.
[18]Guo Z,Yu S,Chen X,et al.NLRP3 Is Involved in Ischemia/Reperfusion Injury[J].CNS&Neurological Disorders Drug Targets,2016.[Epub ahead of print]
[19]Wang P,Huang J,Li Y,etal.Exogenous Carbon Monoxide Decreases Sepsis-Induced Acute Kidney Injury and Inhibits NLRP3 Inflammasome Activation in Rats[J].International Journal of Molecular Sciences,2015,16(9):20595-20608.
[20]Peng Z,Ban K,LeBlanc A,et al.Intraluminal tranexamic acid inhibits intestinal sheddases and mitigates gut and lung injury and inflammation in a rodentmodel of hemorrhagic shock[J].The Journal of Trauma and Acute Care Surgery,2016.[Epub ahead of print]
Effect of NLRP3 inflamm asome in kidney injury of rats after hemorrhagic shock
ZHANG Qiang1TAN Chao1,2LIAxing1HE Yanping1
1.First Department of Surgery,Xi'an 141st Hospital,Shaanxi Province,Xi'an 710089,China;2.Department of Urology,Xijing Hospital,Fourth Military Medical University,Shaanxi Province,Xi'an 710032,China
Ob jective To study the expression and effect of NLRP3 inflammasome in hemorrhagic shock rats kidney. Methods 27 ratswere randomly divided into three groups:sham group(control group),hemorrhagic shock group(experiment group),glybenclamide treatment group(intervention group).Experimental rats were made into hemorrhagic shock model.Serum creatinine(Scr)and blood urea nitrogen(BUN)weremeasured after successfulmodeling 24 h.The protein expression of NLRP3 were examined byWestern blot and themRNA expression of IL-1βand TNF-αwere examined by RT-PCR in the cortex of kidney.Resu lts①The value of Scr and BUN in serum of experiment group were higher than those of control(P<0.01).The value of Scr and BUN in serum of intervention group were lower than those of experiment group(P<0.01).②The protein expression of NLRP3 in the cortex of kidney of experiment group were significantly higher than that of control group(P<0.01).The protein expression of NLRP3 in the cortex of kidney of intervention group were lower than those ofexperiment group(P<0.01)③ThemRNA expression of IL-1βand TNF-α in the kidney cortex of experiment group were significantly higher than those of control group(P<0.01);the IL-1β and TNF-αmRNA expression in the kidney cortex of intervention group was significantly lower than those of experiment group(P<0.01).Conclusion Rats with hemorrhagic shock have renal damage,with NLRP3 inflammasome activites and increases inflammatory reaction in the kidney cortex.The use of NLRP3 inflammasome inhibitor glibenclamide,significantly inhibites the activation NLRP3,reduces kidney inflammation,improves kidney features.
Hemorrhagic shock;Kidney;Inflammasome;NLRP3;Inflammation
R459.7
A
1673-7210(2016)06(c)-0029-04
贺彦平(1965.9-),男,主任医师;研究方向:腔镜泌尿外科学。
(2016-03-25本文编辑:苏畅)
