医用气源汲送装置复制呼吸衰竭犬模型的可行性研究
2016-11-12王合荣吴琦孙昕付莎莎
王合荣,吴琦,孙昕,付莎莎
医用气源汲送装置复制呼吸衰竭犬模型的可行性研究
王合荣,吴琦,孙昕△,付莎莎
目的探讨医用气源汲送装置复制呼吸衰竭犬模型的可行性及稳定性。方法以犬为研究对象,采用自行设计的气源汲送装置,通过调控吸入氧气(O2)、二氧化碳(CO2)和氮气(N2)的比例,降低吸入氧气浓度(FiO2)和(或)提高吸入CO2浓度(FiCO2),同时开放呼出气通路的方法,使犬动脉血氧分压[p(O2)]和动脉血二氧化碳分压[p(CO2)]达到并稳定在某一设定状态。分别在基础状态及造模后1 h和2 h时采集动脉血,检测相关血气指标。结果造模1 h后,实验动物p(O2)<60 mmHg(1 mmHg=0.133 kPa)、p(CO2)>50 mmHg,呼吸衰竭犬模型建立成功。造模1 h和2 h时酸碱度(pH)值、血氧含量、动脉血氧饱和度(SaO2)、碱剩余(BE)较基础状态降低,p(CO2)、二氧化碳总量(TCO2)、碳酸氢根(HCO3-)较基础状态升高(P<0.05)。造模2 h时p(O2)、血氧含量、SaO2较造模1 h降低(P<0.05),而pH值、p(CO2)、TCO2、HCO3-、BE较造模1 h差异无统计学意义(P>0.05)。结论在医用气源汲送装置调控下,成功建立了大型实验动物的呼吸衰竭模型。
医用气源汲送装置;呼吸衰竭;模型,动物;狗;可行性
呼吸衰竭是指呼吸功能严重障碍,以致不能进行有效的气体交换,导致缺氧伴或不伴二氧化碳(CO2)潴留而引起一系列生理功能和代谢障碍的临床综合征[1]。目前复制实验性呼吸衰竭模型的方法很多,引起呼吸衰竭的机制也各不相同,但多适用于小型实验动物,模型稳定性及可控性有待改善[2-4]。为建立更符合人类病理、生理状态的大型实验动物呼吸衰竭模型,便于体外生命支持(extracorporeal life support,ECLS)的研究,笔者设计制作了可调节式吸入气的气源汲送装置,以犬为研究对象,建立急性呼吸衰竭状态模型,并评价其可行性及稳定性。
1 材料与方法
1.1 实验动物及材料健康成年雄性杂种犬9只,体质量25~35 kg,由天津市津南区实验动物饲养站提供。呼吸机(瑞士夏美顿公司生产,型号:拉菲尔RAPHAEL),I.D.9.0#气管导管(德国鲁西公司生产),AVL-995Hb血气分析仪(瑞士),咪唑安定(力月西,江苏恩华,5 mg/mL)、氯胺酮(浙江九旭,10mg/mL)、氯化琥珀胆碱(上海旭东海普药业,50mg/mL)、维库溴铵(浙江仙琚制药,4 mg)等[5]。医用氧气(O2)、氮气(N2)、10%CO2-N2平衡气由天津市华北氧气厂提供。
1.2 可调节式吸入气的气源汲送装置设计实验装置示意图见图1。通过本实验模型装置,可实现O2、N2和CO2以任意混合浓度比输出,供呼吸实验使用。
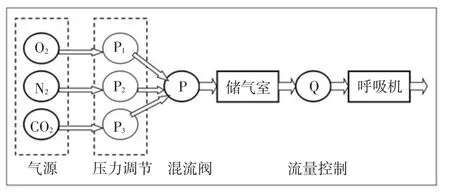
Fig.1Schematic diagram of test model device图1 实验模型装置示意图
1.3 气体混合比例计算3种气体性质稳定,常温条件下不会发生化学反应。为讨论问题方便,设3种气体含量均为100%。因为实验在正常大气压、室温条件下进行,气体在管路中的运动可视为设稳定流动,则有
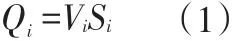
式中Qi为气体的体积流量,Vi为气体流速,Si为气流管道的横截面积,i=1、2、3,分别对应O2、N2和CO23种气体。考虑到气体的黏滞性,由流体的泊肃叶定律[6]可知
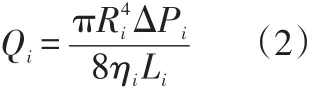
式中Ri为气流管道的半径,Li为气流管道的长度,ΔPi为气体混合前后压强差,ηi为气体的黏滞系数。取Ri、Li均为常数,则气体的流量仅是黏滞系数和压强差的函数,即

在温度一定时,ηi为实验常数,故只需调节ΔPi便可实现该气体的流量控制。由于是稳定流动,某种气体的浓度比决定于其体积流量之比,因此某种气体的体积浓度比(w)i为
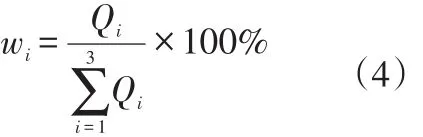
把(2)式和(3)式带入(4)式
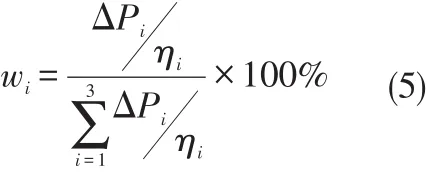
由(5)式便可以求出某种气体的浓度。考虑到在室温条件下,3种气体的黏滞系数差异不大,且实验中,气体在小范围内流动,可以认为ηi为常数,(5)式可简化为
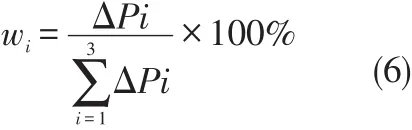
由上式可知,通过调节3种气体的压力,便可以实现气体混合浓度比的控制。通过逐步降低吸入氧气浓度(FiO2)和(或)提高吸入二氧化碳浓度(FiCO2)、呼出气开放,以控制实验动物体动脉血氧分压[p(O2)]和(或)动脉血二氧化碳分压[p(CO2)],当p(O2)<60 mmHg(1 mmHg=0.133 kPa)且p(CO2)>50 mmHg时,即形成实验动物的急性呼吸衰竭状态。
1.4 建立模型动物入室后,称质量、绑定。于前肢静脉推注力月西0.2 mg/kg、氯胺酮2 mg/kg、氯化琥珀胆碱50 mg全麻后,经口插入加长气管导管,逐次连接呼气末CO2探头、呼吸机管路,行机械通气。机械通气条件:呼吸机气源接口与可调式气源汲送装置送气端口连接,潮气量8~10 mL/kg,频率15次/min,吸呼比1∶1.5,呼气末压力2 cmH2O(1 cmH2O= 0.098 kPa)。实验中维持麻醉并阻断自主呼吸。100%空气持续20 min以上,依据动脉血气指标适当调节通气设置,以实验动物无低氧和CO2潴留作为基础状态,于2~4 h内,逐渐降低FiO2,提高FiCO2,同时监测动脉血气,保持实验犬
p(O2)<60 mmHg、p(CO2)>50 mmHg状态并维持送气参数设置。于建模后1 h、2 h,采集动脉血,进行动脉血气分析,记录酸碱度(pH)、p(CO2)、p(O2)、二氧化碳总量(TCO2)、碳酸氢根(HCO3-)、剩余碱(BE)、血氧含量、血红蛋白(Hb)、动脉血氧饱和度(SaO2)。
1.5 统计学方法应用SPSS 16.0统计软件做数据分析。所有资料均进行正态性检验,正态分布计量资料以均数±标准差表示,多组间均数比较采用方差分析,组间多重比较采用SNK-q法,以P<0.05为差异有统计学意义。
2 结果
2.1 设计完成医用气源汲送装置通过本试验模型装置,实现O2、N2和CO2以任意混合浓度比输出,见图2。
2.2 动脉血气指标变化造模1 h后p(O2)<60 mmHg、p(CO2)>50 mmHg,提示呼吸衰竭犬模型建立成功。造模1 h和2 h时pH值、血氧含量、SaO2、BE较基础状态降低,p(CO2)、TCO2、HCO3-较基础状态升高,差异有统计学意义(P<0.05)。造模2 h时p(O2)、血氧含量、SaO2较造模1 h降低(P<0.05),而pH值、p(CO2)、TCO2、HCO3-、BE较造模1 h差异无统计学意义(P>0.05)。实验过程当中,3个时点Hb水平差异无统计学意义(P>0.05),见表1。
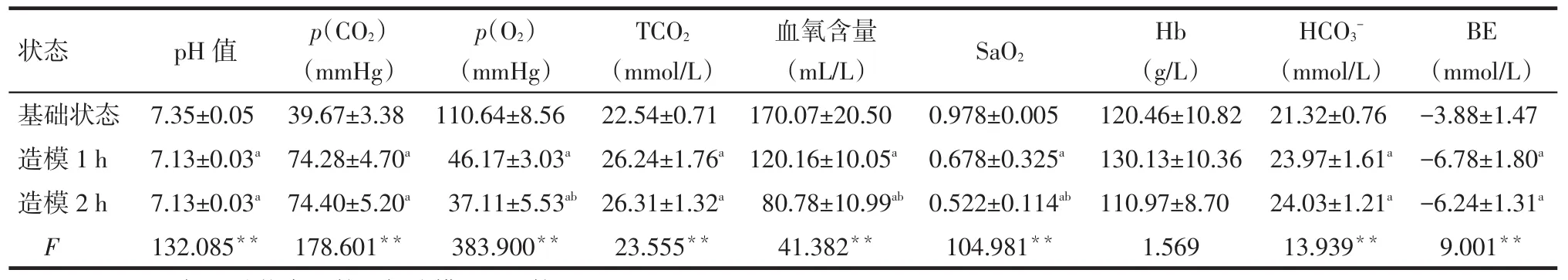
Tab.1Results of arterial blood gas analysis in animal models of respiratory failure表1 呼吸衰竭动物模型动脉血气分析统计结果(n=9)

Fig.2The medical gas suction feeding device图2 医用气源汲送装置
3 讨论
猪、羊、犬等大型实验动物从进化角度讲与人类更加相似,能够满足一定的采血量,更适用于ECLS研究[7]。其中犬类由于血液循环系统发达,器官功能一致性好,体温稳定,对实验环境的适应性、抗病能力较强,对手术的耐受性好,因而是理想的机械通气实验动物模型[8]。
目前复制成人呼吸衰竭的方法主要有以下几种:(1)通气限制结合重复呼吸。该方法通过降低通气供给,使实验动物出现缺氧,同时增加重复呼吸,造成CO2蓄积,使其表现为CO2潴留,形成急性呼吸衰竭状态。但此法制作的呼吸衰竭模型稳定性不够,难以解决实验动物进一步的低氧与CO2蓄积问题,而后者常常更为突出。(2)复制呼吸系疾病。报道较多的是采用复制急性肺损伤模型的方法[2]。引起急性肺损伤的危险因素分为直接肺损伤因素(肺内型肺损伤)和间接肺损伤因素(肺外型肺损伤)[9]。肺内型肺损伤实验造模方法包括生理盐水肺泡灌洗[10]、盐酸吸入[11]、机械通气相关肺损伤[12]、油酸[13-15]以及烟雾吸入[16]等。肺外型肺损伤动物模型包括创伤、内脏损伤诱发、内毒素型炎性因子或效应细胞诱发、二次打击等。严重的创伤可使机体免疫细胞处于被激活状态,引起机体全身炎症反应综合征,进而导致肺损伤[17]。复制呼吸系疾病的方法对疾病的复制是确切的,但是尚无方法能充分复制人类疾病的全部特点,因此选择该类动物模型应考虑每种模型的特点。另一方面,该类实验方法诱发的呼吸衰竭程度很难控制,且呼吸衰竭状态重复性差[3]。
此外,有报道在密闭舱内通入设定浓度的混合气,通过调节O2、CO2及N2送入浓度,成功复制了大鼠的高碳酸血症[18]和低氧血症模型[4]。但该方法只适合于小型动物,且需要定时检测舱内各气体浓度,存在着动物呼吸衰竭程度不便调控等不足。本研究通过医用气源汲送装置调节吸入气体的成分和比例,同时呼出气体开放(减少了重复呼吸),以控制实验动物体p(O2)和(或)p(CO2)、并稳定在p(O2)<60 mmHg,p(CO2)>50 mmHg,成功建立了急性呼吸衰竭模型。本试验中,实验犬造模1 h状态时血p(O2)、p(CO2)达到实验设计的呼吸衰竭标准,且较基础状态的各项血气指标差异同Zhu等[13]变化一致,且造模2 h后p(CO2)、TCO2、pH、BE、HCO3-较造模1 h状态无明显变化,表明此模型碳酸血症状态稳定。但造模2 h时p(O2)、血氧含量、SaO2水平较造模1 h降低,提示实验动物血氧指标稳定性不够,存在持续下降趋势。笔者考虑可能由于急性严重缺氧及高碳酸血症对肺血流动力学的影响[19]等方面的改变,氧耗增加所致。在今后的研究中,应降低FiO2下降的速度,同时监测血液动力学及氧耗等指标,并适时给予相应的干预,以期达到医用气源汲送装置复制呼吸衰竭的可控性及稳定性。
本研究中的医用气源汲送装置不仅可以应用于较大型动物呼吸辅助的ECLS实验研究,还可用于急性呼吸衰竭状态的病理、生理等领域的基础研究,此外,通过变更气源成分可作为一氧化碳(CO)中毒等动物模型的制作装置,也可通过变更气源成分实施一氧化氮(NO)等特殊吸入气体的治疗。
参考文献
[1]Wang JY.Medicine[M].2nd Edition.Beijing:People's Medical Publishing House,2010:159.[王吉耀.内科学[M].2版.北京:人民卫生出版社,2010:159].
[2]Wang HM,Bodenstein M,Markstaller K.Overview of the pathology of three widely used animal models of acute lung injury[J].Eur Surg Res,2008,40(4):305-316.doi:10.1159/000121471.
[3]López-Aguilar J,Quilez ME,Martí-Sistac O,et al.Early physiological and biological features in three animal models of induced acute lung injury[J].Intensive Care Med,2010,36(2): 347-355.doi:10.1007/s00134-009-1695-x.
[4]Guo SX,Niu SJ,Weng XZ,et al.A simple and practical normobaric system[J].ChineseJournalofTuberculosisandRespiratoryDiseases,1996,19(4):252.[郭胜祥,牛淑洁,翁心植,等.一种简易实用的常压低氧舱系统[J].中华结核和呼吸杂志,1996,19(4):252].
[5]Mei ZX.Basic study of respiratory failure treated with blood gas exchanger[D].Tianjin:Tianjin Medical University,2008.[梅早仙.小型体外膜氧合器治疗呼吸衰竭的基础研究[D].天津:天津医科大学,2008].
[6]Tang YN.A simple method of deriving the Poiseuille's law[J]. Journal of Changsha Medical College,2015,13(4):23-25.[唐燕妮.一种推导泊肃叶定律的简行方法[J].长沙医学院学报,2015,13(4):23-25].
[7]Ballard-Croft C,Wang D,Sumpter LR,et al.Large-animal models of acute respiratory distress syndrome[J].Ann Thorac Surg,2012,93(4):1331-1339.doi:10.1016/j.athoracsur.2011.06.107.
[8]Chen H,Li W,Zeng QS,et al.CT appearances of acute respiratory distress syndrome in a canine model with clinical and pathologic correlation[J].Chinese Journal of Radiology,2015,49(1):69-73.[陈淮,李雯,曾庆思,等.急性呼吸窘迫综合征犬模型的CT表现及临床病理对照[J].中华放射学杂志,2015,49(1):69-73]. doi:10.3760/cma.j.issn.1005-1201.2015.01.017.
[9]Gattinoni L,Pelosi P,Suter PM,et al.Acute respiratory distress syndrome caused by pulmonary and extrapulmonary disease. different syndromes?[J].Am J Respir Crit Care Med,1998,158(1):3-11.doi:10.1164/ajrccm.158.1.9708031.
[10]Fuchs JR,Kaviani A,Watson K,et al.Intratracheal pulmonary ventilation improves gas exchange during laparoscopy in a pediatric lung injury model[J].J Pediatric Surgery,2005,40(1):22-25.doi: 10.1016/j.jpedsurg.2004.09.006.
[11]Alien GB,Cloutier ME,Larrabee YC,et al.Neither fibrin nor plasminogen activator inhibitor-1 deficiency protects lung function in a mouse model of acute lung injury[J].Am J Physiol Lung Cell Mol Physiol,2009,296:L277-285.doi:10.1152/ajplung. 90475.2008.
[12]Pedreira PR,Garcia-Prieto E,Parra D,et al.Effects of melatonin in an experimental model of ventilator-induced lung injury[J].Am J Physiol Lung Cell Mol Physiol,2008,295:L820-827.doi:10.1152/ ajplung.90211.2008.
[13]Zhu YB,Ling F,Zhang YB,et al.A novel,stable and reproducible acute lung injury model induced by oleic acid in mature piglet[J]. Chin Med J(Engl),2011,124(24):4149-4154.doi:10.3760/cma.j. issn.0366-6999.2011.24.006.
[14]Prat NJ,Meyer AD,Langer T,et al.Low-dose heparin anticoagulationduringextracorporeallifesupportforacute respiratory distress syndrome in conscious sheep[J].Shock,2015,44(6):560-568.doi:10.1097/SHK.0000000000000459.
[15]Liu Q,Gao YH,Hua DM,et al.Functional residual capacity in beagle dogs with and without acute respiratory distress syndrome[J].J Thorac Dis,2015,7(8):1459-1466.doi:10.3978/j. issn.2072-1439.
[16]Alpard SK,Zwischenberger JB,Tao W,et al.New clinically relevant sheep model of severe respiratory failure secondary to combined smoke in halation/cutaneous flame burn injury[J].Crit Care Med,2000,28(5):1469-1476.doi:10.1097/00003246-200005000-00036.
[17]Basu RK,Donaworth E,Wheeler DS,et al.Antecedent acute kidneyinjuryworsenssubsequentendotoxininducedlung inflammation in a two-hit mouse model[J].Am J Physiol Renal Physiol,201l,301:F597-604.doi:10.1152/ajprenal.00194.
[18]Wang JX,Wang C,Pang BS,et al.Experimental study on setting up hypercapnic model and its pathophysiological changes in rats[J]. Chinese Journal of Pathophysiology,2001,17(7):635-638.[汪建新,王辰,庞宝森,等.大鼠高碳酸血症模型的复制及其病理生理变化的实验研究[J].中国病理生理杂志,2001,17(7):635-638].doi:10.3321/j.issn:1000-4718.2001.07.012.
[19]Morimont P,Guiot J,Desaive T,et al.Veno-venous extracorporeal CO2removal improves pulmonary hemodynamics in a porcine ARDS model[J].Acta Anaesthesiol Scand,2015,59(4):448-456. doi:10.1111/aas.12497.
(2016-01-22收稿2016-07-01修回)
(本文编辑胡小宁)
Study of the feasibility on medical gas suction feeding device for replicating model of respiratory failure in dogs
WANG Herong,WU Qi,SUN Xin△,FU Shasha
Tianjin Haihe Hospital,Tianjin Institute of Respiratory Diseases,Traditional Chinese Medicine(TCM)Key Research Laboratory for Infectious Disease Prevention for State Administration of TCM,Tianjin 300350,China△
ObjectiveTo investigate the feasibility and stability of medical gas suction feeding device for copying the model of respiratory failure in dogs.MethodsThe self-designed medical gas suction feeding device was used to establish the model of respiratory failure in dogs.After regulating the proportion of oxygen(O2),carbon dioxide(CO2)and nitrogen(N2),the fraction of inspiration O2(FiO2)was decreased,while the forced inspiratory carbon dioxide(FiCO2)was increased.At the same time,the breathing out pathway was open to make the arterial oxygen partial pressure p(O2)and arterial blood carbon dioxide partial pressure p(CO2)reached and stabilized in a stable condition.The arterial blood samples between default state and 1 hour,2 hour after modeling were collected to detect the blood gas index.Results One hour after the establishment of model,the p(O2)was≤60 mmHg(1 mmHg=0.133 kPa),and p(CO2)was≥50 mmHg(1 mmHg=0.133 kPa),which suggested that the dog model of respiratory failure was established successfully.Compared with the basic state,data of pH,oxygen content,oxygen saturation(SaO2)and residual alkali(BE)were decreased at 1 hour and 2 hour after modeling(P<0.05).The p(O2),oxygen content,SaO2were decreased in 2 hour after modeling compared with those of 1h after modeling(P<0.05).There were no significant differences in pH,p(CO2),TCO2,HCO3-and BE between 1 hour and 2 hour after modeling(P>0.05).ConclusionUnder the regulation of the medical gas suction feeding device,the respiratory failure state of large experimental animals is successfully established.
medical gas suction feeding device;respiratory failure;models,animal;dogs;feasibility
R332
A
10.11958/20160029
天津市卫生局重点攻关项目(11KG126)
天津市海河医院,天津市呼吸疾病研究所,国家中医药管理局中医药防治传染病重点研究室(邮编300350)
王合荣(1982),女,医师,硕士,主要从事呼吸系统疾病研究
